E
CHEMIA ORGANICZNA - REAKCJE
1.ALKANY
Otrzymywanie
Hydrogenacja alkenów:
![]()
redukcja halogenków alkilów - hydroliza odczynnika Grignarda:
![]()
Redukcja halogenków alkilu metalem w środowisku kwaśnym:
RX + Zn + H+ ==> RH + Zn2+ + X-
Np.:
reakcja halogenków alkilu ze związkami metaloorganicznymi:
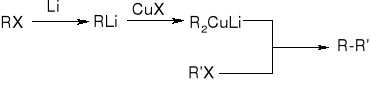
Reakcje alkanów:
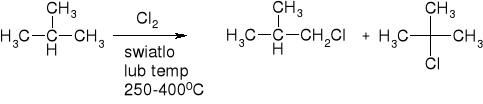
Halogenowanie
Reaktywność X2 Cl2>Br2
Reaktywność protonów: 30>20>10>H3C-H
Przykład:
alkany ulegają również spalaniu, a za pomocą pirolizy można skrócić ich łańcuchy, otrzymać wodór i alkeny.
2. Alkeny
Otrzymywanie:
Reaktywność alkoholi i halogenków w reakcji eliminacji: 30>20>10
Dehydrohalogenacja halogenków alkilu:
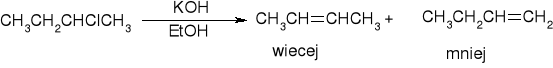
Dehydratacja alkoholi:
![]()
więcej mniej
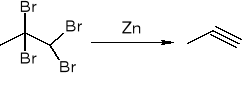
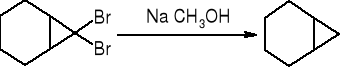
Dehalogenacja wicynalnych dihalogenopochodnych:
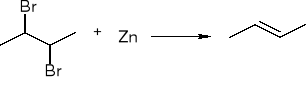
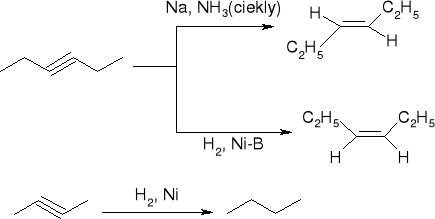
redukcja alkinów:
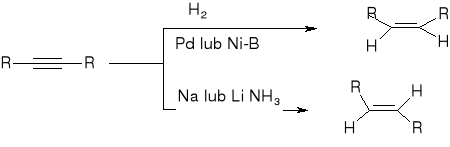
trwałość karbokationów:
30>20>10>CH3+
przegrupowują się w trwalsze
reakcje alkenów:
addycja wodoru:
![]()
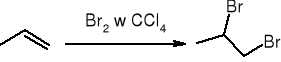
addycja halogenu:
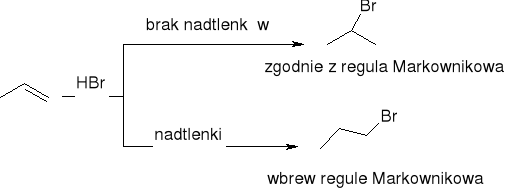
addycja halogenowodoru
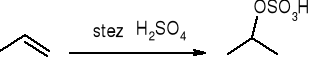
addycja kwasu siarkowego:
addycja wody:
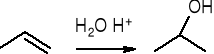
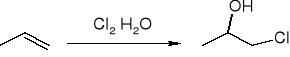
tworzenie halogenohydryn:
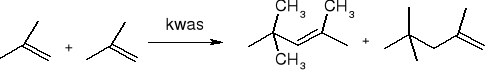
dimeryzacja:
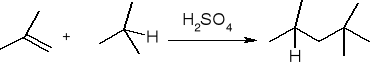
alkilowanie:
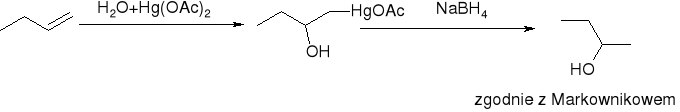
oksyrtęciowanie połączone z odrtęciowaniem:
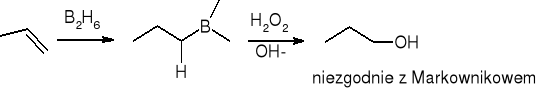
Borowodorowanie połączone z utlenianiem:
Addycja wolnych rodników:
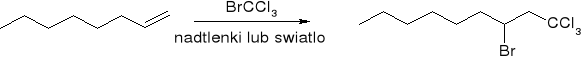
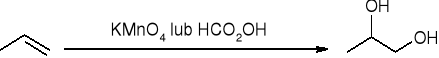
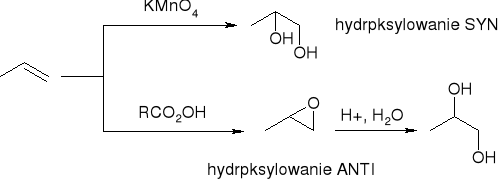
hydroksylowanie - tworzenie dioli wicynalnych:
reakcje podstawienia:
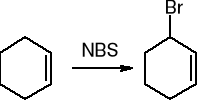
halogenowanie - substytucja w pozycji allilowej:
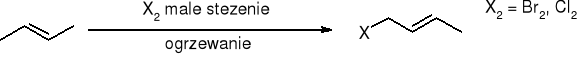
Ozonoliza:
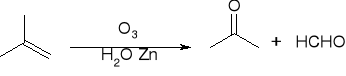
3. Alkiny
otrzymywanie:
dehydrohalogenacja dihalogenoalkanów:
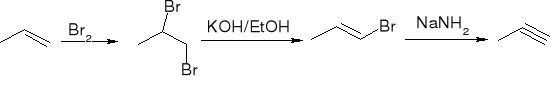
reakcje acetylenków sodowych z pierwszorzędowymi halogenkami alkilów:
![]()
dehalogenacja tetraholegnoalkanów:
reakcje:
Addycja wodoru:
Addycja halogenów:
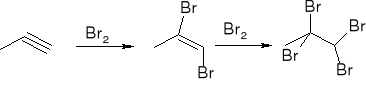
addycja halogenowodorów:
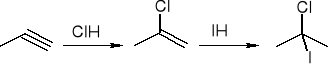
Addycja wody:
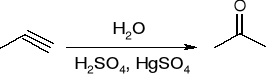
powstawanie acetylenków metali ciężkich:
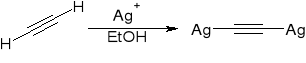
powstawanie acetylenków metali alkalicznych:
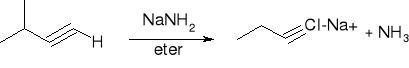
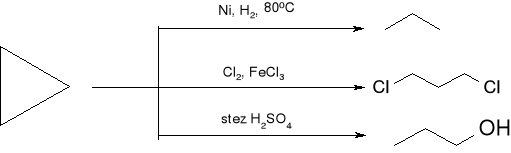
reakcje cyklopropanu:
Benzen
Nitrowanie:
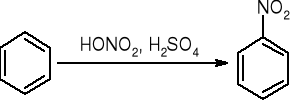
sulfonowanie:
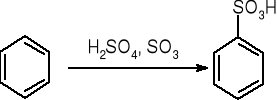
Halogenowanie:
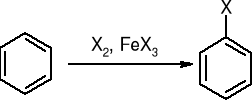
alkilowanie metodą Friedla - Craftsa:
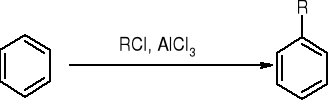
acylowanie metodą Friedla - Craftsa:
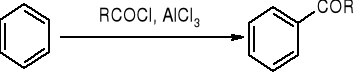
protonowanie:
a). Desulfonowanie:
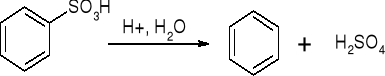
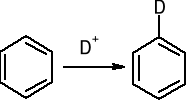
b). Wymiana protonu:
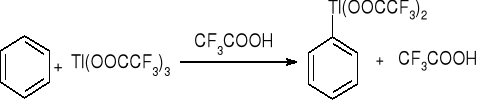
Talowanie:
Nitrozowanie:
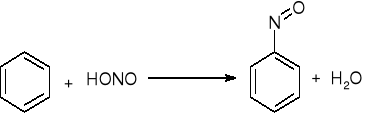
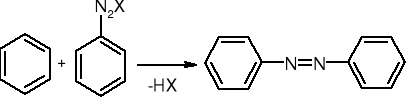
sprzęganie z solami diazoniowymi:
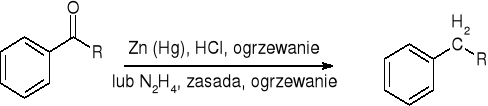
Redukcja Clemmensena lub Wolffa - Kiżnera:
wpływ skierowujący:
podstawniki aktywujące, kierujące w pozycje orto i para:
silnie aktywujące:
-NH2 (-NHR, -NR2), -OH
średnio aktywujące:
-OCH3 (-OC2H5 itd.), -NHCOCH3
słabo aktywujące:
-C6H5, -CH3 (-C2H5 itd.)
dezaktywujące, kierujące w pozycję meta:
-NO2, -N(CH3)+, -CN, -COOH (-COOR), -SO3H, -CHO, -COR,
dezaktywujące, kierujące w pozycję orto i para:
-F, -Cl, -Br, -I
ksyleny:
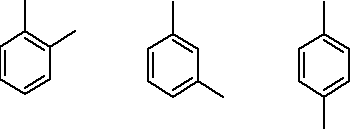
o - ksylen m - ksylen p - ksylen
Halogenki:
Otrzymywanie
Wymiana -OH na -X
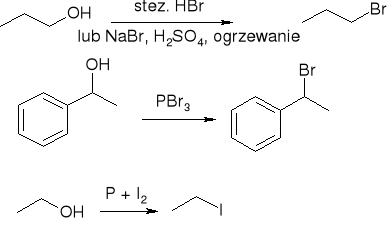
halogenowanie węglowodorów
addycja halogenowodorów do alkenów,
addycja halogenów do alkenów i alkinów
wymiana halogenu:
RX + I- RI + X-
Reakcje:
Substytucja nukleofilowa:
R:X + :Z R:Z + :X- |
Produkt |
R:X + OH- R:OH + :X- |
Alkohol |
R:X + H2O ROH |
Alkohol |
R:X + :OR'- => R:OR' |
Eter - synteza Williamsona |
R:X + -:C≡CR' => R:C≡CR' |
Alkin |
R:X + R'-M => R:R' |
ALKAN (SPRZĘGANIE) |
R:X + :I- => R:I |
Jodek alkilu |
R:X + :CN- => R:CN |
Nitryl |
R:X + R'COO:- => R'COOR |
Ester |
R:X + NH3 => R:NH2 |
Amina pierwszorzędowa |
R:X + :NH2R => R:NHR' |
Amina drugorzędowa |
R:X + NHR'R“ => R:NR'R“ |
Amina trzeciorzędowa |
R:X + :P(C6H5)3+X- => [R:P(C6H5)3]+X- |
Sól fosfoniowa |
R:X + SH- => R:SH |
Tiol (tioalkohol) |
R:X + :SR' => R:SR' |
Sulfid (tioeter) |
R:X + [CH3(COOC2H5)2]- => RCH3(COOC2H5)2 |
Synteza z estru malonowego |
|
|
Dehydrohalogenacja:
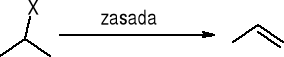
otrzymywanie odczynnika Grignarda:
RX + Mg (w bezwodnym eterze dietylowym) => RMgX
Redukcja:
SN1 - powstanie karbokation
SN2 - nukleofil atakuje cząsteczkę od tyłu
Alkohole:
Otrzymywanie:
Hydroksyrtęciowanie połączone z odrtęciowaniem:
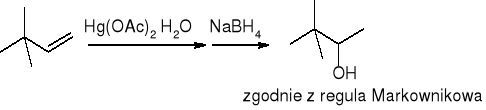
borowodorowanie połączone z utlenianiem:
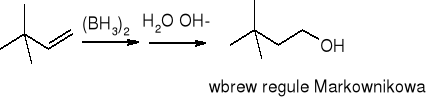
synteza Grignarda:
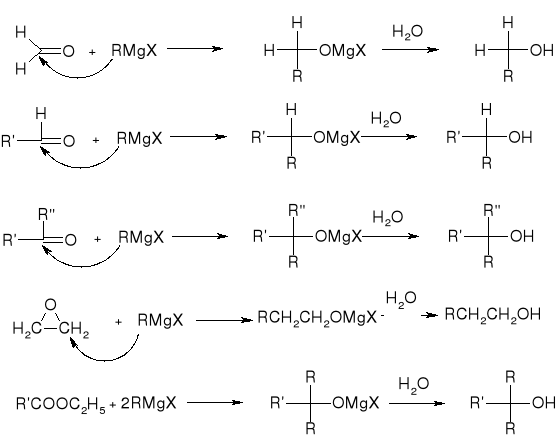
hydroliza halogenków alkilu:
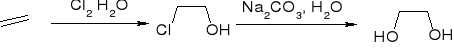
hydroksylowanie alkenów:
reakcje alkoholi:
ROZERWANIE WIĄZANIA R-OH
Reakcja z halogenowodorami:
R-OH + HX => RX + H2O
Gdzie R może ulec przegrupowaniu,
Reaktywność HX: HI>HBr>HCl
Reaktywność ROH: allilowy, benzylowy> 30> 20> 10
Reakcja z trójhalogenkami fosforu:
R-OH + PX3 => RX + H3PO3 (X = , Br, I)
Dehydratacja:
![]()
ROZERWANIE WIĄZANIA RO-H
Reakcje z metalami aktywnymi
CH3CH2OH + Na => CH3CH2Ona + ½ H2
Tworzenie estrów:
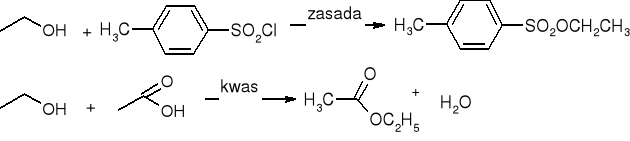
Utlanianie:
Alkohole 10:
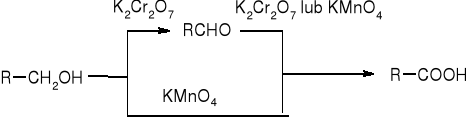
alkohole drugorzędowe:
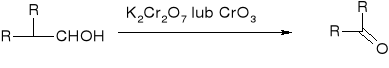
ETERY
Otrzymywanie:
Synteza Williamsona:
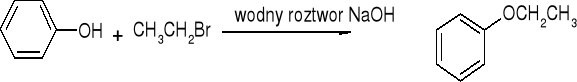
alkoksyrtęciowanie połączone z odrtęciowaniem:
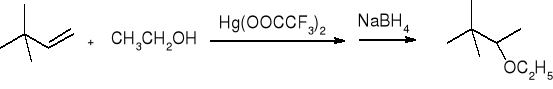
EPOKSYDY:
Otrzymywanie:
Z halogenohydryn:
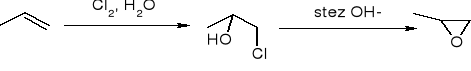
utlenianie C=C za pomocą nadtlenokwasów:

reakcje epoksydów:
rozszczepienie katalizowane przez kwas:
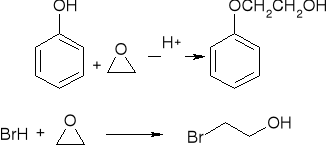
rozszczepienie katalizowane przez zasadę:
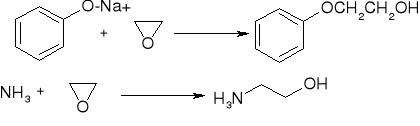
reakcja ze związkami Grignarda:
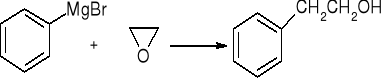
KWASY KARBOKSYLOWE
Otrzymywanie:
Utlenianie alkoholi pierwszorzędowych:
![]()
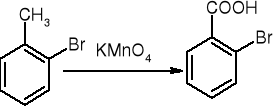
utlenianie alkilowych pochodnych beznenu:
reakcja związków Grignarda z CO2
![]()
Hydroliza nitryli:
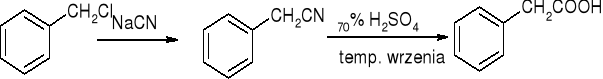
reakcje:
tworzenie soli
przekształcenie -OH na -Cl, -OR', -NH2
przekształcenie w chlorki kwasowe:

przekształcenie w estry - estryfikacja
przekształcenie w amidy:
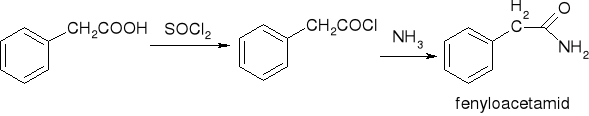
redukcja:
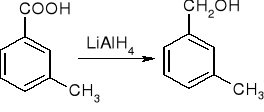
substytucja w grupie arylowej lub alkilowej:
reakcja Hella - Volharda - Zielińskiego:
![]()
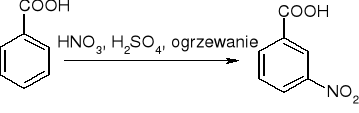
substytucja w pierścieniu -COOH dezaktywuje:
ALDEHYDY I KETONY:
Otrzymywanie aldehydów:
Utlenianie alkoholi pierwszorzędowych:
RCH2OH + K2Cr2O7 => RCHO
Utlenianie metylowych pochodnych benzenu:
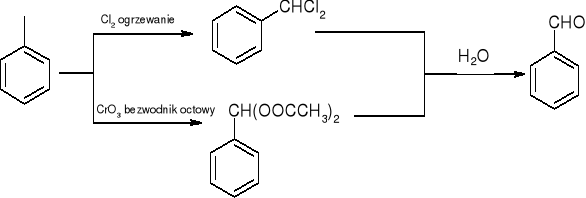
redukcja chlorków kwasowych:
RCOCl lub ArCOCl + LiAlH(OBu-t)3 => RCHO LUB ArCHO
Otrzymywanie ketonów:
Utlenianie alkoholi drugorzędowych:
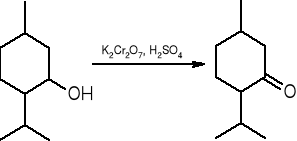
mentol menton
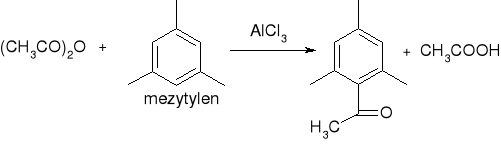
acylowanie metodą Friedla - Craftsa
reakcja chlorków kwasowych ze związkami kadmoorganicznymi:
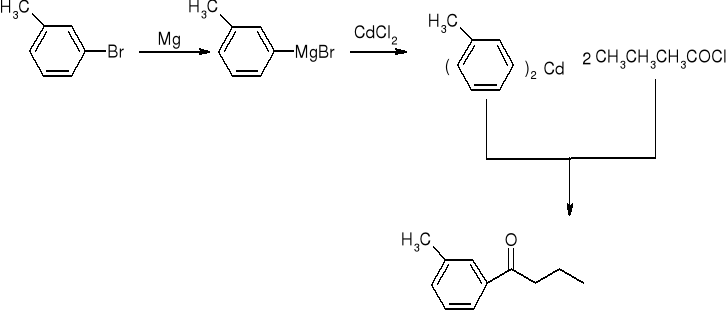
reakcje aldehydów i ketonów:
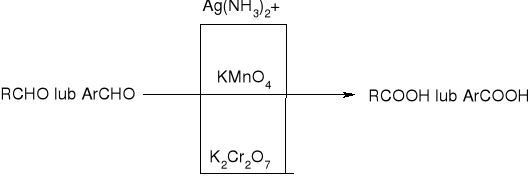
utlenianie aldehydów:
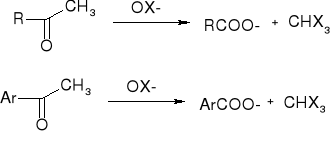
ketony metylowe - reakcja haloformowa
redukcja do alkoholi:
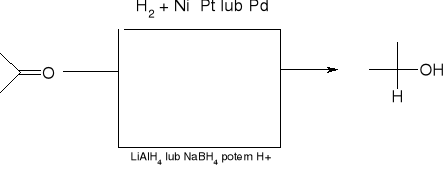
redukcja Clemmensena (dla związków wrażliwych na działanie zasad):
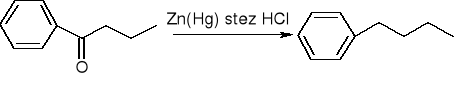
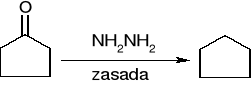
redukcja Wolffa - Kiżnera (dla związków wrażliwych na działanie zasad):
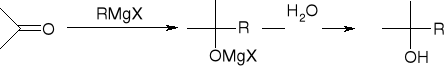
addycja związków Grignarda:
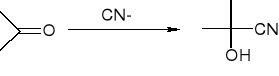
addycja cyjanowodoru - tworzenie cyjanohydryn
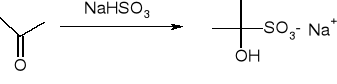
addycja wodorosiarczynu:
addycja pochodnych amoniaku:
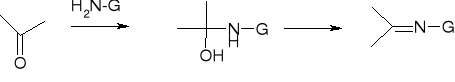
H2N-G |
produkt |
H2N-OH hydroksyloamina |
=C=NOH oksym |
H2N-NH2 hydrazyna |
=C=NNH2 hydrazon |
H2N-NHC6H5 fenylohydrazyna |
=C=NNHC6H5 fenylohydrazon |
H2N-NHCONH2 semikarbazyd |
=C=NNHCONH2 semikarbazon |
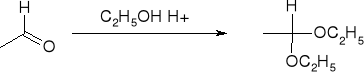
Addycja alkoholi - tworzenie acetali:
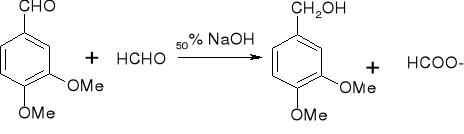
reakcja Cannizzaro:
ulegają jej aldehydy bez wodorów :
![]()
krzyżowa reakcja Cannizzaro:
-halogenowanie ketonów:

reakcje bezwodników kwasowych:
hydroliza - przemiana w kwasy
amonoliza - przemiana w amidy:
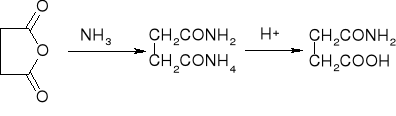
alkoholiza - przemiana w estry:
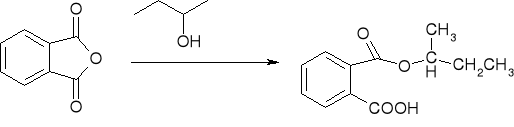
acylowanie metodą Friedla Craftsa:
reakcje amidów:
hydroliza (kwasowa lub zasadowa)
degradacja Hofmanna:
RCONH2 lub ArCONH2 + OBr- => RNH2 lub ArNH2 + CO32-
Estry - kondensacja Claisena:
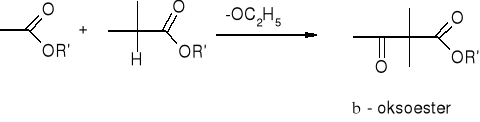
kondensacja aldolowa:

związek -hydroksykarbonylowy
Aminy
Otrzymywanie:
Redukcja związków nitrowych:
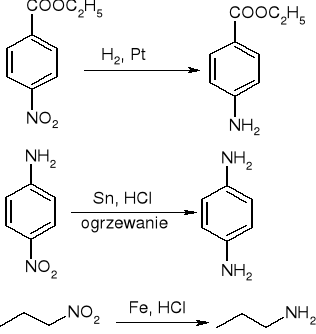
reakcja halogenków z amoniakiem lub aminami:
NH3 + RX => RNH2 + RX => R2NH + RX => R3N +RX => R4N+X-
Aminowanie redukcyjne
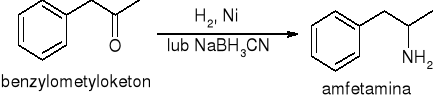
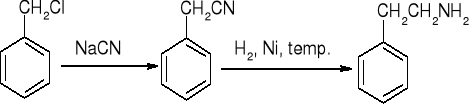
redukcja nitryli
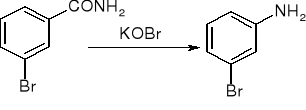
Degradacja amidów Hofmanna:
reakcje amin:
tworzenie soli
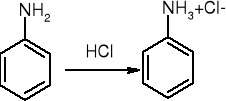
alkilowanie:
RNH2 + RX => R2NH + RX => R3N + RX => R4N+X-
Przemiana w amidy:
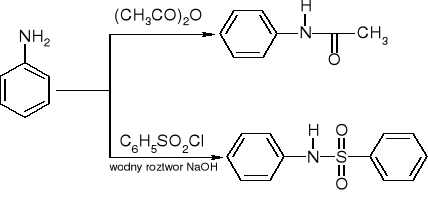
reakcje czwartorzędowych soli amoniowych - eliminacja Hofmanna:

reakcje z kwasem azotawym:
ArNH2 + HONO => Ar-N2+
RNH2 + HONO => R-N2+ +H2O => N2 + mieszanina alkoholi i alkenów
ArNHR lub R2NH + HONO => (ArR)N-N=O lub R2N-N=O N-nitrozoaminy
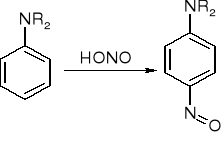
p - nitrozopochodna
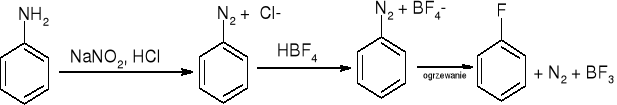
otrzymywanie soli diazoniowych:
ArNH2 + NaNO2 + 2HX => ArN2+X- + NaX + 2H2O
Sól diazoniowa
REAKCJE SOLI DIAZONIOWYCH:
Wymiana -N2 na -Cl, -Br lub -CN - reakcja Sandmeyera:
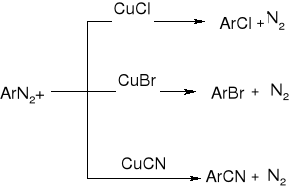
wymiana na -I
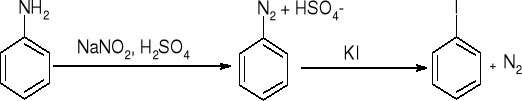
wymiana na -F
wymiana na -OH
ArN2+ + H2O (w H+)=> ArOH + N2
Sprzęganie soli diazoniowych:
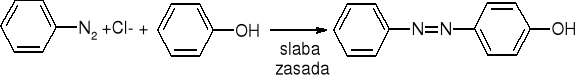
Fenole:
Otrzymywanie:
Hydroliza soli diazoniowych:
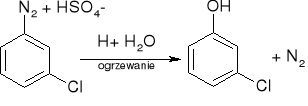
utlenianie związków arylotalowych:
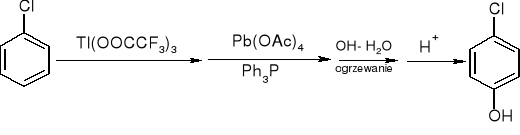
jedyny powstający izomer
reakcje:
tworzenie soli (jak kwasy)
tworzenie eterów - synteza Williamsona:
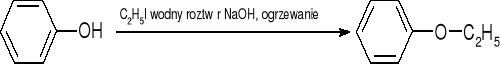
tworzenie estrów - fenole zachowują się jak alkohole
substytucja w pierścieniu - grupy -O- i -OH- są silnie aktywującymi i kierują w pozycje orto i para. Bromowanie fenolu prowadzi to 2,4,6 - tribromofenolu.
Alkilowanie Friedla - Craftsa
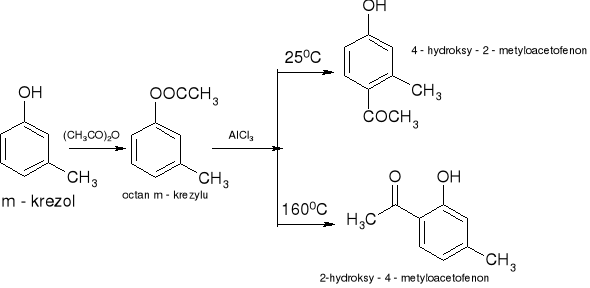
Acylowanie Freidla - Craftsa - przegrupowanie Firesa:
Nitrozowanie
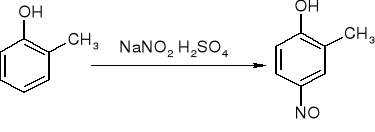
m - krezol 2 - metylo - 4 - nitrozofenol
karboksylowanie - reakcja Kolbego:
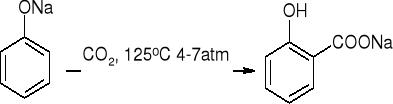
tworzenie aldehydów - reakcja Reimera - Teimanna:
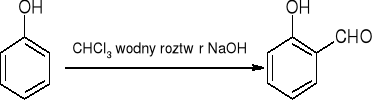
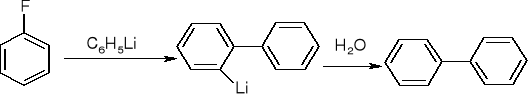
reakcje halogenków arylu:
tworzenie związków Grignarda:
ArBr + Mg w suchym eterze => ArMgBr
ArCl + Mg w tetrahydrofuranie (THF) => ArMgCl
Substytucja elektrofilowa - halogenek dezaktywuje pierścień i kieruje podstawnik w pozycje orto i para.
Substytucja nukleofilowa:
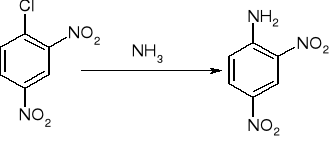
substytucja nukleofilowa - eliminacja połączona z addycją:
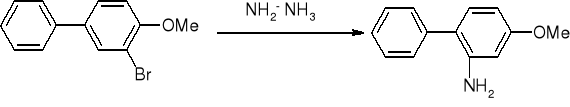
cykloaddycja 4+2 - reakcja Dielsa - Aldera”
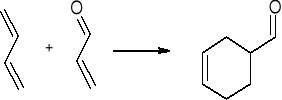
1,3 butadien
akroleina 1,2,3,6 - tetrahydrobenzaldehyd
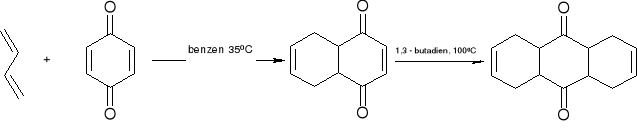
synteza Hawortha:
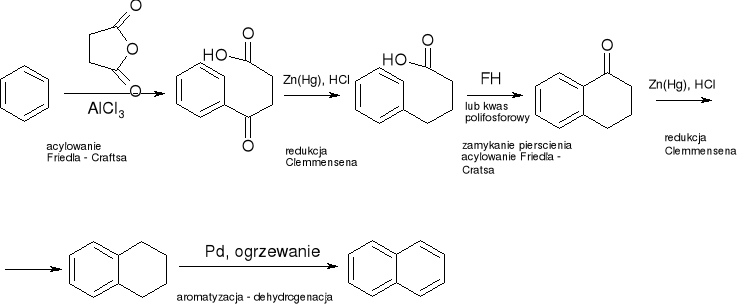
heterocykle:
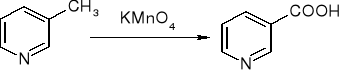
otrzymywanie kwasu nikotynowego:
synteza chinoliny - synteza Skraupa:
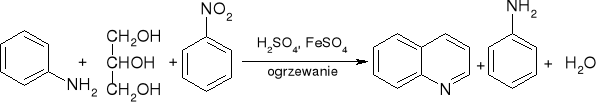
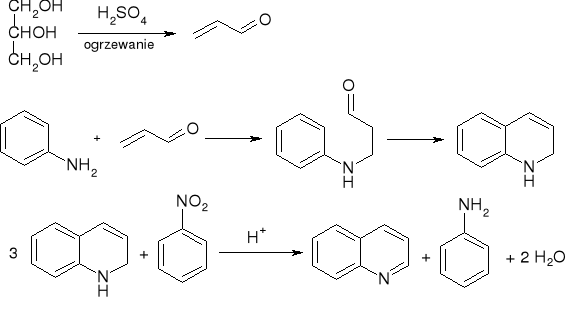
a właściwie:
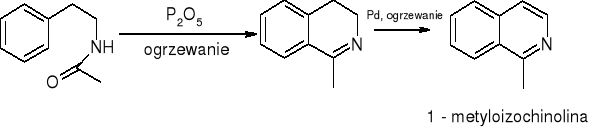
Izochinolina - synteza Bischlera - Napieralskiego
synteza kwasu barbiturowego:
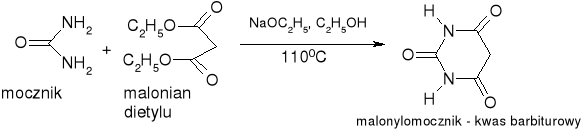
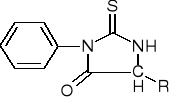
Aminokwasy:
Rozpoznawanie aminokwasów metodą Edmana:
Białko reagując z C6H5NCS (izotiocyjanianem fenylu) daje:
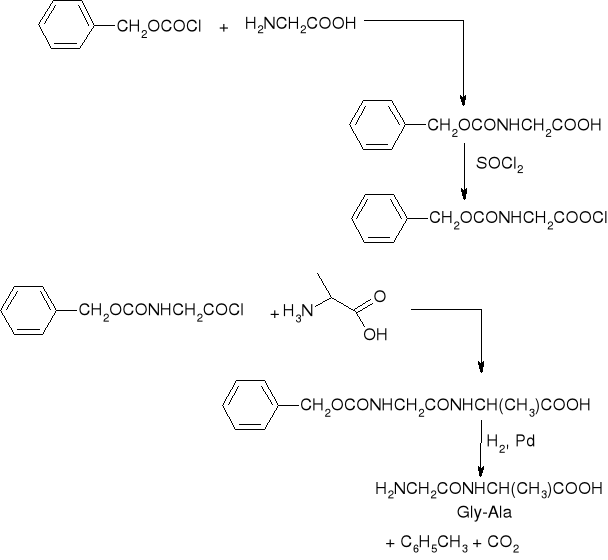
synteza dipeptydów metodą karbobenzoksylową:
synteza Glicynoalaniny (Gly-Ala)
Wyszukiwarka
Podobne podstrony:
Egz-pierwszy, Technologia chemiczna, 3 semestr, Chemia organiczna, egzaminy
sprawko z ćw 1, Uczelnia PWR Technologia Chemiczna, Semestr 3, Chemia techniczna organiczna
reakcje kompleksowania 111, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna n
Chemia Krzemianów-ściąga egzamin, Technologia Chemiczna, Rok II, Semestr II, Chemia Krzemianów, Egza
REAKCJA ALKILOWANIA IV-RZĘDOWYCH SOLI AMONIOWYCH, Uczelnia PWR Technologia Chemiczna, Semestr 5,
zagadnienia lab fiz, WIiTCh PK, Technologia Chemiczna, semestr 3, Chemia Fizyczna, laboratorium
REAKCJA SULFONOWANIA – OTRZYMYWANIE KWASU p-TOLUENOSULFONOWEGO, Uczelnia PWR Technologia Chemiczna,
REAKCJA ALKILOWANIA IV-RZĘDOWYCH SOLI AMONIOWYCH, Uczelnia PWR Technologia Chemiczna, Semestr 5,
StacjonarneBAT pytania egzamin2013-KW, Uczelnia PWR Technologia Chemiczna, Semestr 6, BAT-y egzamin
Technologia chemiczna org-zagadnienia, Uczelnia PWR Technologia Chemiczna, Semestr 5, Technologia ch
spr cw 11, Technologia chemiczna, semestr 2, Fizyka, Laboratorium, laboratoria fizyka bincia
wyplyw cieczy ze zbiornika, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu chemiczne
1(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Cw9, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
strona tytułowa projektu inżynierskiego pwr, Uczelnia PWR Technologia Chemiczna, Semestr 7, Różne pr
CWGC, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
więcej podobnych podstron