2. ANALIZA JAKOŚCIOWA KATIONÓW
Jakościowa analiza chemiczna ma na celu określenie jakościowego składu badanej substancji. Polega ona na tym że do badanej próbki dodaje się odpowiedniego odczynnika, pod wpływem którego zachodzi jakaś zauważalna, charakterystyczna reakcja, najczęściej roztwór się zabarwia, wytrąca lub rozpuszcza się osad (często barwny), wydziela się gaz lub powstaje charakterystyczny zapach. Takie reakcje, które pozwalają na wykrycie danego jonu w obecności innych jonów - nazywane są reakcjami charakterystycznymi.
Klasyczną analizę można przeprowadzić jako analizę wybiórczą lub analizę systematyczną. Analiza wybiórcza polega na wykrywaniu poszczególnych jonów z oddzielnych próbek badanego roztworu w dowolnej kolejności, bez oddzielania od siebie grup jonów za pomocą reakcji charakterystycznych. Analiza systematyczna polega na kolejnym oddzielaniu lub stwierdzeniu nieobecności grup jonów za pomocą tzw. odczynników grupowych. W ten sposób dzieli się analizowane jony na grupy, w których łatwiej jest wykryć poszczególne jony. W systematycznym toku analizy każdy jon jest wykrywany dopiero po wykryciu i usunięciu (oddzieleniu) wszystkich jonów przeszkadzających.
2.1. ANALIZA KATIONÓW
Podstawą systematycznej analizy kationów jest podział kationów na 5 grup analitycznych. Odczynnikami grupowymi są: rozcieńczony kwas solny (HCl), kwas siarkowy (H2SO4) lub węglan amonu (NH4)2CO3], siarkowodór (H2S) oraz siarczek amonu (NH4)2S. Wymienione odczynniki grupowe wytrącają z badanego roztworu kationy należące odpowiednio do grup I, II, III i IV. Podział najważniejszych kationów na grupy analityczne przedstawiono w tabeli 2.1( wg Z.S. Szmal, T. Lipiec).
Tabela 2.1
Podział kationów na grupy analityczne
Grupa |
Odczynnik grupowy |
Kationy |
Skład osadu |
Uwagi |
I |
HCl ( mol/dm3) |
Ag+ Pb2+ Hg2+ |
AgCl PbCl2 Hg2Cl2 |
Chlorki nierozpuszczalne w H2O i w rozcień- czonym HCl |
II |
H2SO4 |
Ba2+ Sr2+ Ca2+ (Pb2+ ) |
BaSO4 SrSO4 CaSO4 (PbSO4) |
Siarczany nierozpuszczalne w H2O i w rozcień-czonym H2SO4 |
III |
H2S lub AKT (amid kwasu tiooctowego CH3CSNH2) w rozc. H2SO4 (pH ≅ 0,5) |
Hg2+ Bi3+ Cu2+ Cd2+ Sn2+ Sn4+ |
HgS Bi2S3 CuS CdS SnS SnS2 |
Siarczki nierozp. w rozcieńcz. HCl i H2SO4 |
IV |
Na2S lub (NH4) 2S lub AKT (amid kwasu tiooctowego CH3CSNH2) wobec NH3⋅H2O + NH4Cl (pH ≈ 9) |
Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ |
Al.(OH)3 Cr(OH)3 FeS Fe2S3 NiS CoS MnS ZnS |
Siarczki Al(OH) 3 i Cr(OH)3 nierozp. w H2O i rozcień. kwasach |
V |
Brak odczynnika grupowego |
Mg2+ Na+, K+ NH4+ |
|
Nie wytrącają się z poprzednimi od-czynnikami grupowymi |
W tabeli zaznaczono te kationy które identyfikuje się na ćwiczeniach laboratoryjnych
REAKCJE CHARAKTERYSTCZNE WYBRANYCH KATIONÓW
2.1.1 Reakcje kationu ołowiu (II) - Pb2+
1. Kwas solny HCl i rozpuszczalne chlorki. Jony Cl− wytrącają z roztworów zawierających jony Pb2+ biały krystaliczny osad chlorku ołowiu (II) (PbCl2)
![]()
↓
Osad PbCl2 jest rozpuszczalny w gorącej wodzie, po oziębieniu z roztworu wytrąca się w postaci igieł.
2. Wodorotlenek sodu NaOH lub potasu KOH. Jony OH- wytrącają z roztworów zawierających jony Pb2+ biały osad amfoterycznego wodorotlenku ołowiu (II) Pb(OH)2 :
![]()
↓
Pb(OH)2 rozpuszcza się w nadmiarze odczynnika z utworzeniem anionu tetrahydroksoołowiu (II) [Pb(OH)4] 2- :
![]()
Osad Pb(OH)2 rozpuszczalny jest również w kwasach mineralnych.
3. Jodek potasu KI. Jony I- wytrącają z roztworów zawierających jony Pb2+ żółty osad jodku ołowiu(II) PbI2
![]()
↓
Osad PbI2 rozpuszcza się w gorącej wodzie, po oziębieniu wytrąca się ponownie w postaci złocistych blaszek. Osad PbI2 jest rozpuszczalny również w nadmiarze KI
![]()
4. Chromian(VI) potasu K2CrO4 i dichromian(VI) potasu K2Cr2O7. Jony chromianowe(VI) ![]()
i dichromianowe(VI) ![]()
wytrącają z roztworów zawierających jony Pb2+ - żółty osad chromianu (VI) ołowiu(II) PbCrO4:
![]()
PbCrO4
![]()
5. Kwas siarkowy(VI) H2SO4. Jony SO42- wytrącają z roztworów zawierających jony Pb2+ biały osad siarczanu(VI) ołowiu(II) PbSO4
![]()
PbSO4
2.1.2. Reakcje kationu wapnia(II) Ca2+
Szczawian amonu (NH4)2C2O4. Jony szczawianowe C2O42- wytrącają z roztworów zawierających jony Ca2+ biały osad szczawianu wapnia CaC2O4 .
![]()
↓
Osad szczawianu wapnia CaC2O4 jest rozpuszczalny w kwasach mineralnych (HCl, H2SO4, HNO3) lecz nie rozpuszcza się w kwasie octowym
2. Węglan sodu Na2CO3 i inne rozpuszczalne węglany. Jony węglanowe CO32- wytrącają z roztworów zawierających kationy Ca2+ biały bezpostaciowy osad węglanu wapnia CaCO3, rozpuszczalny w rozcieńczonych kwasach.
![]()
3. Wodorotlenek sodu NaOH lub potasu KOH. Jony OH− wytrącają z roztworów zawierających jony Ca2+ biały osad wodorotlenku wapnia -Ca(OH)2
![]()
↓
Ca(OH)2 nie rozpuszcza się w nadmiarze odczynnika.
4. Wodoroortofosforan (V) sodu Na2HPO4. Jony wodoroortofosforanowe (V) HPO42- wytrącają z roztworów zawierających jony Ca2+ biały kłaczkowaty osad wodoroortofosforanu (V) wapnia CaHPO4:
![]()
↓
5. Zabarwienie płomienia. Lotne sole sodu barwią płomień na kolor ceglasto-czerwony
2.1.3. Reakcje kationu miedzi(II) Cu2+
Wodorotlenek sodu lub potasu, NaOH lub KOH. Jony OH- wytrącają na zimno z roztworów zawierających jony Cu2+ niebieski osad wodorotlenku miedzi (II) Cu(OH)2:
![]()
↓
Osad Cu(OH)2 po ogrzaniu przechodzi w czarnobrunatny osad tlenku miedzi(II) CuO
2. Amoniak, NH4OH. Rozcieńczony roztwór amoniaku wytrąca z roztworów zawierających jony Cu2+ jasnoniebieski osad hydroksosoli, który łatwo rozpuszcza się w nadmiarze amoniaku, przy czym roztwór zabarwia się na ciemnoniebiesko, od powstającego jonu tetraamminomiedzi(II).Przebieg reakcji w obecności jonów siarczanowych(VI) ilustruje poniższe równanie:
![]()
![]()
![]()
3. Heksacyjanożelazian (II) potasu K4[Fe(CN)6]. Odczynnik ten wytrąca z roztworów zawierających jony Cu2+ (w środowisku obojętnym lub słabokwaśnym CH3COOH) czerwonobrunatny osad heksacyjanożelazianu(II) miedzi(II):
![]()
↓
Przy małym stężeniu jonów Cu2+ roztwór barwi się na różowobrunatno.
4. Zabarwienie płomienia. Lotne sole miedzi barwią płomień na kolor zielony
2.1.4. Reakcje kationu glinu(III) Al3+
1. Wodorotlenek sodu i potasu NaOH i KOH. Jony OH- wytrącają z roztworów zawierających jony Al3+ biały, galaretowaty, amfoteryczny wodorotlenek glinu Al(OH)3, rozpuszczalny w nadmiarze odczynnika z utworzeniem kompleksowego jonu tetrahydroksoglinianu(III) - [Al(OH)4]−
![]()
↓
![]()
Po zakwaszeniu wytrąca się ponownie osad Al(OH)3, który rozpuszcza się w nadmiarze kwasu:
![]()
![]()
2. Amoniak NH4OH. Roztwór amoniaku wytrąca z roztworów zawierających jony Al3+ biały, galaretowaty osad wodorotlenku glinu:
![]()
3. Wodoroortofosforan(V) sodu, Na2HPO4. Odczynnik ten wytrąca z roztworów zawierających jony Al3+ biały, galaretowaty osad ortofosforanu(V)glinu AlPO4:
![]()
4. Alizaryna. Odczynnik ten tworzy z jonami Al3+ czerwony osad lub czerwone zabarwienie.
Wykonanie: Do badanego roztworu (ok.1 cm3) należy dodać kilka kropli roztworu amoniaku, około 1 cm3 roztworu alizaryny oraz kilka kropli roztworu CH3COOH. W obecności jonów Al3+ powstaje czerwony osad lub czerwone zabarwienie.
2.1.5.. Reakcje kationu żelaza(II) Fe2+
1. Wodorotlenek sodu i potasu, NaOH i KOH. Jony OH- wytrącają z roztworów zawierających jony Fe2+ biały lub brudnozielony osad wodorotlenku żelaza(II) Fe(OH)2:
![]()
↓
Osad Fe(OH)2 na powietrzu łatwo utlenia się do czerwonobrunatnego wodorotlenku żelaza(III) Fe(OH)3:
![]()
↓
2. Amoniak NH4OH. Roztwór amoniaku wytrąca z roztworów zawierających jony Fe2+ biały lub brudnozielony osad wodorotlenku żelaza(II) Fe(OH)2
![]()
3. Heksacyjanożelazian(III) potasu, K3[Fe(CN)6]. Jony Fe(CN)62- wytrącają z roztworów zawierających jony Fe2+ w środowisku kwaśnym lub obojętnym ciemnobłękitny osad heksacyjanożelazianu(III) żelaza(II) Fe3[Fe(CN)6]2, tzw. błękit Turnbulla:
![]()
↓
4. Heksacyjanożelazian(II) potasu, K4[Fe(CN)6]2. Jony Fe(CN)64- wytrącają z roztworów zawierających jony Fe2+ w atmosferze pozbawionej tlenu biały osad heksacyjanożelazianu(II) żelaza(II) Fe2[Fe(CN)6].
![]()
↓
lub heksacyjanożelazianu(II) żelazowo(II) potasowego K2Fe[Fe(CN)6]:
![]()
↓
Powstający osad łatwo utlenia się na powietrzu nabierając niebieskiej barwy od powstającego heksacyjanożelazianu(II) żelaza(III) Fe4[Fe(CN)6]3 tzw. błękitu pruskiego.
2.1.6. Reakcje jonu żelaza(III) - Fe3+
1. Wodorotlenek sodu i potasu, NaOH i KOH. Jony OH- wytrącają z roztworów zawierających jony Fe3+ czerwonobrunatny osad wodorotlenku żelaza(III) Fe(OH)3:
![]()
↓
2. Amoniak NH4OH. Roztwór amoniaku wytrąca z roztworów zawierających jony Fe3+ czerwonobrunatny osad wodorotlenku żelaza(III) Fe(OH)3:
![]()
3. Heksacyjanożelazian(II) potasu K4[Fe(CN)6]. Jony Fe(CN)64- wytrącają z roztworów zawierających jony Fe3+ w środowisku słabo kwaśnym lub obojętnym ciemnoniebieski osad heksacyjanożelazianu(II) żelaza(III) Fe4[Fe(CN)6]2, tzw. błękit pruski:
![]()
↓
Przy małym stężeniu jonów Fe3+ powstaje niebieskie lub zielone zabarwienie
4. Heksacyjanożelazian(III) potasu, K3[Fe(CN)6]2. Jony Fe(CN)62- nie wytrącają z roztworów zawierających jony Fe2+( w odróżnieniu od jonó Fe2+) lecz tworzą rozpuszczalny w wodzie heksacyjanożelazian (III) żelaz (III) Fe[Fe(CN)6] o barwie ciemnobrunatnej:
![]()
↓
5. Tiocyjanian (rodanek) potasu KSCN lub amonu NH4SCN. Odczynniki te w słabokwaśnym roztworze zawierającym jony Fe3+, tworzą tiocyjanian żelaza(III) Fe(SCN)3, o intensywnym krwistoczerwonym zabarwieniu:
![]()
6. Octan sodu CH3COONa. Z jonami Fe3+ tworzy octan żelaza(III) o zabarwieniu czerwonobrunatnym:
![]()
Z rozcieńczonego roztworu i po ogrzaniu wytrąca się brunatny osad dihydroksyoctanu żelaza (III):
![]()
2.1.7. Reakcje kationu cynku (II) Zn2+
1. Wodorotlenek sodu i potasu NaOH i KOH. Jony OH- wytrącają z roztworów zawierających jony Zn2+ biały osad amfoterycznego wodorotlenku cynku Zn(OH)2:
![]()
↓
osad Zn(OH)2 rozpuszcza się w kwasach:
![]()
jak również w nadmiarze odczynnika, tworząc kompleksowy jon tetrahydroksocynkanu (II):
![]()
2. Amoniak NH4OH. Roztwór amoniaku wytrąca z roztworów zawierających jony Zn2+ biały osad wodorotlenku cynku Zn(OH)2:
![]()
Osad Zn(OH)2 rozpuszcza się w nadmiarze roztworu amoniaku z utworzeniem jonów kompleksowych: tetraamminocynku [Zn(NH3)4] 2+ lub heksaamminocynku - [Zn(NH3)6]2+
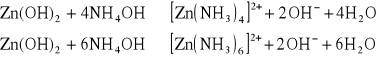
3. Wodorofosforan(V) sodu Na2HPO4. Odczynnik ten wytrąca z roztworów zawierających jony Zn2+ biały osad ortofosforanu(V) cynku Zn3(PO4)2
![]()
2.1.8. Reakcje kationu magnezu(II) Mg2+
1. Wodorotlenek sodu i potasu NaOH i KOH. Jony OH- wytrącają z roztworów zawierających jony Mg2+ biały galaretowaty osad wodorotlenku magnezu Mg(OH)2:
![]()
↓
Osad Mg(OH) 2 nie rozpuszcza się w nadmiarze wodorotlenku, natomiast rozpuszcza się w rozcieńczonych kwasach i w roztworach soli amonowych:
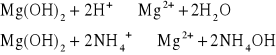
2. Amoniak NH4OH. Roztwór amoniaku częściowo wytrąca z roztworów zawierających jony Mg2+ biały galaretowaty osad wodorotlenku magnezu Mg(OH)2:
![]()
3. Wodoroortofosforan (V) sodu Na2HPO4. Odczynnik ten wytrąca z roztworów zawierających jony Mg2+ biały kłaczkowaty osad wodoroortofosforanu (V) magnezu MgHPO4:
![]()
↓
W obecności chlorku amonu (NH4Cl) i w środowisku amoniakalnym (NH4OH) wytrąca się biały krystaliczny osad ortofosforanu(V) magnezowo-amonowego MgNH4PO4:
![]()
Wykonanie :
Do badanego roztworu należy dodać tyle roztworu NH4Cl aby dodawany roztwór NH4OH nie powodował wytrącania się osadu Mg(OH)2. Po dodaniu roztworu Na2HPO4 wstrząsnąć probówką. W przypadku obecności jonów Mg2+ powstaje biały krystaliczny osad.
2.1 9. Reakcje kationu amonu NH4+
1. Wodorotlenek sodu i potasu NaOH i KOH. Jony OH- rozkładają sole amonowe z wydzieleniem amoniaku, który można rozpoznać po charakterystycznym zapachu:
![]()
2. Odczynnik Nesslera tetrajodortęcian(II) potasu K2[HgJ4]. Odczynnik ten wytrąca z zasadowych roztworów soli amonowych czerwonobrunatny osad jodku μ-amino-μ-oksortęci(II):
![]()
Wykonanie:
Do probówki nalewamy 1 cm3 roztworu soli amonowej, probówkę napełniamy do połowy wodą, po czy dodajemy 1 cm3 odczynnika Nesslera .Powstanie czerwonobrunatnego osadu świadczy o obecności jonu amonowego.
2.1.10. Reakcje kationu sodu Na+
1. Zabarwienie płomienia. Lotne sole sodu barwią płomień na kolor intensywnie żółty
2. Diwodoroantymonian(V) potasu KH2SbO4 wytrąca z roztworów soli sodowych, biały krystaliczny osad diwodoroantymonianu (V) sodu:
![]()
Wykonanie:
Do roztworu soli sodowej (o dość dużym stężeniu) dodajemy roztwór diwodoroantymonianu(V) potasu. Na skutek dużej rozpuszczalności NaH2SbO4 osad może pojawić się dopiero po pewnym czasie. Aby przyspieszyć wytrącanie się osadu z roztworu przesyconego pocieramy ścianki probówki bagietką szklaną. Odczyn roztworu powinien być obojętny albo słabo zasadowy. Reakcja powinna być przeprowadzona na zimno.
Wykonanie ćwiczenia
W otrzymanych do analizy próbkach należy zidentyfikować znajdujące się tam kationy.
Identyfikacje należy prowadzić w probówkach, używając 1-2 cm3 badanego roztworu i dodając taką samą objętość roztworu odczynnika. Przystępując do analizy należy zwrócić uwagą na barwę roztworu otrzymanego do analizy, ponieważ niektóre kationy i aniony wykazują w roztworach wodnych charakterystyczne zabarwienie.
W celu sprawdzenia poprawności identyfikowanych jonów wykonuje się tzw. ślepe próby, polegające na użyciu zamiast badanego roztworu roztworów zawierających odpowiednie jony.
Tabela 2
Przegląd reakcji chemicznych wybranych kationów
Odczynnik |
Pb2+ |
Ca2+ |
Cu2+ |
Al3+ |
Fe2+ |
Fe3+ |
Zn2+ |
Mg2+ |
Na+ |
NH4+ |
||||||||||
NaOH lub KOH |
Pb(OH)2 |
Ca(OH)2 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)2 brudnozielony |
Fe(OH)3 |
Zn(OH)2 |
Mg(OH)2 |
- |
- |
||||||||||
NH4OH |
Pb(OH)2 |
nie wytrąca po dłuższym staniu na
powietrzu CaCO3 |
[Cu(NH3)4]2+ |
Al(OH)3 |
Fe(OH)2 brudnozielony |
Fe(OH)3 |
Zn(OH)2 |
Mg(OH)2 |
- |
- |
||||||||||
K4[Fe(CN)6] |
- |
- |
Cu2[Fe(CN)6] |
- |
Fe2[Fe(CN)6] |
Fe4[Fe(CN)6]3 |
Zn2[Fe(CN)6] |
- |
- |
- |
||||||||||
Na2HPO4 |
- |
- |
- |
AlPO4 |
Fe3(PO4)2 |
FePO4 |
Zn3(PO4)2 |
MgHPO4 |
- |
- |
||||||||||
Barwa płomienia |
- |
ceglastoczerwona |
zielona |
- |
- |
- |
- |
- |
żółta |
- |
||||||||||
Barwa roztworu |
bezbarwny |
bezbarwny |
niebieski |
bezbarwny |
zielonkawy |
żółty |
bezbarwny |
bezbarwny |
bezbarwny |
bezbarwny |
||||||||||
Reakcja charakter. |
KJ |
Barwa płomienia |
NH4OH |
Alizaryna |
K3[Fe(CN)6] |
KSCN |
NaOH |
|
Barwa płomienia |
Odczynnik Nesslera |
||||||||||
|
PbJ2 żółty |
Ceglasto-czerwona |
Cu(NH3)4]2+ |
Czerwony osad lub czerwone zabarwienie tzw. lak |
F3[Fe(CN)6]2 Turnbulla |
Fe(SCN)3 |
Zn(OH)2 |
|
żółta |
Czerwonobrunatny osad |
||||||||||
45
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 2 Badanie właściwości i analiza jakościowa kationów, Politechika Białostocka, budownict
Analiza jakościowa kationów i anionów, Energetyka, I rok, chemia
Analiza jakościowa kationów i anionów, Technika Rolnicza i Leśna, Semestr 1, Chemia i Materiałoznaws
Analiza jakościowa kationów, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Laborki
Analiza jakościowa Kationów i anionów(1.0 pkt), Mechanika i Budowa Maszyn, Chemia sprawozdania
Analiza jakościowa kationów i anionów, Analiza jakościowa
analiza jakościowa kationów
4.Analiza jakościowa kationów. Reakcja kationu manganu (Mn2+). NaOH, NH4OH, MnSO4., Państwowa Wyższa
Elementy analizy jakosciowej kationy id 112043
Badanie właściwości i analiza jakościowa kationów(2), Badanie właściwości i analiza jakościowa katio
05-Analiza jakosciowa kationow
Analiza jakościowa kationów i anionów- płyny proste, Analiza jakościowa
ANALIZA JAKOŚCIOWA ANIONÓW, Chemia
4.Analiza jakościowa kationów. Reakcja kationu glinu ( Al3+ ). NaOH, NH4OH, CuSO4, Państwowa Wyższa
4. Analiza jakościowa kationów. Reakcja kationu miedź (Cu2+). NaOH, NH4OH, CuSO4, Państwowa Wyższa S
Analiza jakościowa kationów i anionów, Analiza jakościowa
sprawozdanie elementy analizy jakościowej kationów i anionów
Elementy analizy jakościowej kationy
więcej podobnych podstron