Wydział Metali Nieżelaznych
Metalurgia
Rok: II. Grupa: 9
Sprawozdanie
Adsorpcja na powierzchni fazy stałej
Chabetka Marek
Wstęp
Na powierzchni zetknięcia dwu faz, na przykład ciała stałego z gazem lub cieczą itp. występują zawsze pola nie wysyconych sił (wiązań atomowych, jonowych, van der Vaalsa). W wyniku oddziaływania tych sił substancja rozpuszczona w roztworze stykającym się z fazą stałą lub pozostająca w fazie gazowej może być gromadzona selektywnie na powierzchni fazowej. Stężenie tej substancji na powierzchni fazowej osiąga więc większą wartość niż w reszcie roztworu. Zjawisko to nazywa się adsorpcją. Oprócz opisanej adsorpcji dodatniej (wzrost stężenia na powierzchni fazowej) znane są przypadki adsorpcji ujemnej (spadek stężenia na powierzchni fazowej).
Zjawiska związane z adsorpcją są złożone. Oto niektóre z przyczyn:
rodzaje sił występujących na powierzchni faz stałych są różne,
rozkład tych sił na powierzchni adsorbenta jest zwykle niejednolity,
zaadsorbowane cząstki posiadają resztkowe siły przyciągające, za pomocą których mogą adsorbować dalszą warstwę cząsteczek, ta następną itd.; powstają w ten sposób wielocząsteczkowe warstwy zaadsorbowane.
Prawa adsorpcji są proste, jeżeli następuje tworzenie tylko jednocząsteczkowej warstwy adsorpcyjnej. W miarę wzrostu ciśnienia gazu lub stężenia ciała rozpuszczonego w roztworze, maleje wolna powierzchnia adsorbenta i wreszcie dochodzi do stanu nasycenia, odpowiadającego całkowitemu pokryciu powierzchni przez zaadsorbowane cząsteczki. Dalszy wzrost ciśnienia gazu czy stężenia też stężenia roztworu nie zmienia stanu rzeczy. W przypadku adsorpcji wielowarstwowej zależność ilości substancji zaadsorbowanej od ciśnienia lub stężenia ma jakościowo podobny przebieg, jednakże jej ilościowa interpretacja jest bardziej złożona.
Niekiedy podczas adsorpcji gazów na substancjach silnie porowatych obserwuje się zjawisko tak zwanej kondensacji kapilarnej. Wiąże się ono z tym, że prężność pary nasyconej nad silnie wklęsłym meniskiem (powstającym w kapilarach w przypadku zwilżenia ciała stałego przez ciecz) jest mniejsza niż nad płaską powierzchnią cieczy. Tak, więc, jeżeli w wyniku adsorpcji zostanie osiągnięte w kapilarach odpowiednie stężenie cząstek, wówczas może mieć tam miejsce kondensacja gazu.
Rys. 1. Izoterma adsorpcji
Na rys. 1. pokazano schematycznie przebieg zależności ilości zaadsorbowanego gazu od jego ciśnienia.
Freundlich stwierdził empirycznie, że zależność pomiędzy ilością substancji zaadsorbowanej x (na jednostkę powierzchni lub częściej na jednostkę masy adsorbenta m), a jej stężeniem p w układach gazowych, c w roztworach można przedstawić za pomocą równania paraboli:
![]()
(1)
K oraz n są to stałe (dla t0 = const), charakterystyczne dla danego rodzaju substancji adsorbowanej i adsorbującej, n jest mniejsze od jedności. Langmuir wyprowadził w przypadku adsorpcji jednowarstwowej równanie:
![]()
(2)
Z oznacza tu ułamek powierzchni zajętej przez cząstki zaadsorbowane; K jest to stała (dla t0 = const) charakterystyczne dla układu.
Istnieje również wyprowadzone przez Brunnauera, Emmetta i Tallera ogólne równanie (tzw. równanie BET) adsorpcji wielowarstwowej, posiadające bardziej złożoną postać.
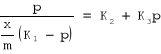
(3)
Zasadniczą różnicą pomiędzy równaniami Freundlicha i Langmuira jest to, że pierwsze z nich sugeruje ciągły wzrost ilości substancji zaadsorbowanej ze wzrostem jej stężenia w roztworze, drugie zaś wskazuje na istnienie granicy ![]()
Cel ćwiczenia
Celem ćwiczenia jest doświadczalne sprawdzenie, czy w badanym procesie (adsorpcja kwasu octowego na węglu) w zadanym zakresie stężeń stosuje się równania Freundlicha oraz Langmuria. W przypadku stwierdzenia stosowalności jednego z tych równań (lub obydwu) należy wyznaczyć, posługuje się metodą graficzną, współczynniki równań.
Opracowanie wyników
Nr kolbki |
1 |
2 |
3 |
4 |
5 |
6 |
Ilość ml pobranych do miareczkowania (przed adsorpcją) |
50 |
50 |
50 |
25 |
10 |
5 |
Ilość ml NaOH (0.1n) potrzebna dla zobojętnienia próbki |
6.5 |
12.7 |
25.3 |
22.1 |
21.3 |
20.0 |
Stężenie roztworu przed adsorpcją moli/litr c1 |
0.013 |
0.025 |
0.051 |
0.09 |
0.21 |
0.4 |
Ilość ml pobranych do miareczkowania (po adsorpcji) |
50 |
50 |
50 |
25 |
10 |
5 |
Ilość ml NaOH (0.1n) potrzebna dla zobojętnienia próbki |
0.8 |
1.4 |
5.9 |
10.1 |
14.9 |
16.1 |
Stężenie roztworu po adsorpcji moli/litr c2 |
0.002 |
0.003 |
0.012 |
0.04 |
0.15 |
0.32 |
|
7.3
|
14.7
|
25.3
|
25
|
21.7
|
26.7
|
|
|
|
|
|
|
|
![]()
Wyznaczenie współczynników równania Freundlicha:
log K = -1,1264
K = 0,074748
n = 1,480493
Wyznaczenie współczynników równanie Langmuira:
![]()
; K = ![]()
K = -0,00107
Wnioski
Z przeprowadzonego ćwiczenia adsorpcji kwasu octowego na powierzchni węgla aktywnego wynika, że zarówno równanie Freundlicha jak i Langmuira opisują to zjawisko. Można jednak zauważyć uchybienia dla obu tych metod.
Pierwszym wykres obrazuje krzywą adsorpcji. Przyjmując duży margines błędu możemy uznać iż charakterystyka ta jest liniowa. Możemy więc stwierdzić iż stosowalność równania Freundlicha jest spełniona, a parametry tego równania wynoszą odpowiednio K=0,074748 oraz n=.1,49691. Wykres ![]()
służy do sprawdzenia równania Langmuira. Tą charakterystykę również możemy uznać za liniową, a wiec stosowalność równania Langmuira jest spełniona. Dla drugiego równania K = -0,00107
P oraz c oznaczają stężenie w układzie będącym w równowadze z adsorbentem.
P (lub) c
adsorpcja
Kondensacja kapilarna (zjawisko występujące tylko w przypadku adsorpcji z fazy gazowej
Adsorpcja jedno- lub wielomolekularna
Wyszukiwarka
Podobne podstrony:
Sprawozdanie - Nr 11, Chemia fizyczna AGH laborki, lab 11
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
napiecie pow nr 2, Chemia fizyczna AGH laborki, lab 2
LABORKA UKASZ 3, Chemia fizyczna AGH laborki, lab 3,4
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
korozja dla justyny, Chemia fizyczna AGH laborki, lab 21
Wyniki pomiarów ciepła rozpuszczania, Chemia fizyczna AGH laborki, lab 3,4
SPRAWOZ6, Chemia fizyczna AGH laborki, lab 18
Chemia fizyczna (3, Chemia fizyczna AGH laborki, lab 3,4
lab. 05 - baron, Chemia fizyczna AGH laborki, lab 5
Wykresy do 3, Chemia fizyczna AGH laborki, lab 3,4
tekst 7, Chemia fizyczna AGH laborki, lab 6
Chem 1, Chemia fizyczna AGH laborki, lab 1
skoootaaa, Chemia fizyczna AGH laborki, lab 20
lepkość, Chemia fizyczna AGH laborki, lab 1
więcej podobnych podstron