Wstęp teoretyczny:
Temperaturą przejścia nazywamy taką temperaturę, w której pierwiastek lub związek chemiczny zmienia swój stan fazowy (stan skupienia lub budowę sieci krystalicznej). Przykładami temperatur przejścia są np. topnienie, wrzenie, przemiany alotropowe i polimor-ficzne. Przemiany te zachodzą przy stałym ciśnieniu, stałej temperaturze i są zależne tylko od rodzaju badanej substancji oraz rodzaju przemiany.
W danym ćwiczeniu określamy temperaturę przejścia przy pomocy analizy termicznej, która to jest bardzo często stosowaną metodą. W metodzie tej wykorzystuje się efekt cieplny towarzyszący z reguły przemianą fazowym.
W trakcie ogrzewania substancji możemy zaobserwować wzrost jej temperatury (gdy szybkość ogrzewania, czyli szybkość doprowadzania ciepła jest wielkością stała, wówczas temperatura jest liniową funkcją czasu) aż do rozpoczęcia przemiany fazowej. Wówczas na krzywej analizy termicznej, w temperaturze przemiany, pojawia się załamanie.
Gdy badany proces jest egzotermiczny, temperatura substancji zaczyna wzrastać szybciej, niż temperatura układu ogrzewającego, wskutek wydzielania ciepła przemiany. W większości przypadków mamy do czynienia z procesami endotermicznymi, w których po osiągnięciu temperatury przejścia obserwujemy przystanek na krzywej analizy termicznej, bowiem ciepło doprowadzone do układu jest zużywane wówczas na przemianę fazową. Czasami można zaobserwować zjawisko przegrzania i przechłodzenia.
Efekt przegrzania jesteśmy w stanie zaobserwować w przypadku cieczy, która mimo osiągnięcia temperatury wrzenia, nie wrze. Przyczyną tego zjawiska jest trudność utworzenia zarodków nowej fazy tzw. baniek gazowych. Jest to bardzo niebezpieczne zjawisko, bowiem w momencie, gdy ciecz przegrzana zaczyna wrzeć, powstanie zbyt duża ilość fazy gazowej (w naczyniu zamkniętym może to doprowadzić do eksplozji, a w naczyniu otwartym do wyrzucenia gorącej cieczy z naczynia). Zjawisku temu można przeciwdziałać wprowadzając do układu sztucznie zarodki nowej fazy.
Zjawisko przechłodzenia pary jest wykorzystywane w komorze Wilsona dla ujawniania torów przebiegu naładowanych elektrycznie elementarnych cząstek materii mogących spełniać rolę zarodków skraplania. Silne przechłodzenie cieczy może doprowadzić czasem do otrzymania ciała stałego o budowie bezpostaciowej, np. szkła.
Stromy lub płaski przebieg krzywej analizy termicznej zależy tylko od szybkości ogrzewania lub chłodzenia układu, natomiast długość odcinaka przystanku na krzywej analizy termicznej zależy od rodzaju substancji (im większe ciepło przemiany tym dłuższy odcinek), szybkości ogrzewania (chłodzenia) oraz masy próbki.
Cel ćwiczenia:
Wyznaczenie metodą analizy termicznej temperatury przejścia:
Na2SO4 ⋅ 10H2O Na2SO4 + 10H2O
Ustalenie związku między szybkością ogrzewania, szybkością wzrostu temperatury próbki i długością przystanku na krzywej analizy termicznej.
Ustalenie związku między masą próbki oraz długością przystanku na krzywej analizy termicznej.
Wyznaczenie metodą analizy termicznej temperatur przejścia:
ZnSO4 ⋅ 10H2O ZnSO4 ⋅ 6H2O + H2O ZnSO4 ⋅ H2O + 6H2O
Wyznaczenie temperatur przejścia przemian omawianych w powyższych punktach,
na podstawie danych tabelarycznych obrazujących zależność rozpuszczalności siarczanów sodu i cynku, od temperatury.
Metody pomiaru:
W danym ćwiczeniu do ogrzewania substratów stosuje się łaźnię wodną, bowiem temperatury przejścia badanych substratów są niższe niż 100°C, czyli są niższe od temperatury wrzenia wody.
Na wadze aptekarskiej należy odważyć 10 g próbki (w przypadku, gdy próbka jest grubo-krystaliczna, rozcieramy ją w moździerzu), następnie trzeba umieścić ją w próbówce, w łaźni wodnej oraz włączyć układ grzewczy, ustalając natężenie prądu na około 1,45 [A].
Temperatury wody i próbki należy odczytywać w stałych interwałach czasowych, co
15 sekund.
Tę czynność należy powtórzyć dla trzech różnych prędkości grzania i trzech różnych mas badanych substancji.
Jedną z próbek należy poddać chłodzeniu i odczytywać jej temperaturę w stałych interwałach czasowych, co 5 minut.
Wyniki analizy termicznej hydratów:
Badana substancja: Na2SO4 ⋅ 10 H2O
Naważka: m = 10 [g]
Prąd grzewczy: i = 1,45 [A]
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
0 |
22,0 |
20,3 |
195 |
33,0 |
25,1 |
390 |
43,0 |
31,0 |
15 |
23,0 |
20,5 |
210 |
34,0 |
26,0 |
405 |
44,0 |
31,2 |
30 |
24,0 |
20,6 |
225 |
34,0 |
26,9 |
420 |
44,5 |
31,3 |
45 |
24,5 |
20,7 |
240 |
35,0 |
27,1 |
435 |
45,0 |
32,0 |
60 |
25,0 |
20,8 |
255 |
36,0 |
28,0 |
450 |
46,0 |
32,2 |
75 |
26,0 |
21,8 |
270 |
37,0 |
29,0 |
465 |
46,5 |
32,5 |
90 |
27,0 |
22,0 |
285 |
38,0 |
29,1 |
480 |
47,0 |
32,6 |
105 |
28,0 |
22,2 |
300 |
38,0 |
30,0 |
495 |
48,0 |
33,1 |
120 |
29,0 |
22,7 |
315 |
39,0 |
30,1 |
510 |
49,0 |
33,2 |
135 |
29,5 |
23,0 |
330 |
40,0 |
30,2 |
525 |
49,5 |
34,3 |
150 |
30,5 |
23,3 |
345 |
41,0 |
30,3 |
540 |
50,0 |
35,3 |
165 |
31,0 |
23,8 |
360 |
42,0 |
30,9 |
555 |
51,0 |
36,5 |
180 |
32,0 |
24,2 |
375 |
42,0 |
31,0 |
570 |
52,0 |
37,5 |
|
585 |
52,0 |
40,0 |
|||||
Temperatura przejścia wynosi 31°C
Przy pomocy programu Microsoft Excel odczytujemy tangensy kątów nachylenia stycznych do wykresów:
dla pieca: tgα = 0,05, stąd wynika, że V0 = 3 [oC/min]
dla próbki: tgα = 0,03, stąd wynika, że V = 1,8 [oC/min]
czas przemiany próbki wynosi 30 s
Badana substancja: Na2SO4 ⋅ 10 H2O
Naważka: m = 10 [g]
Prąd grzewczy: i = 2,50 [A]
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
0 |
25,0 |
23,0 |
120 |
43,0 |
28,4 |
240 |
63,0 |
33,4 |
15 |
27,0 |
23,1 |
135 |
45,0 |
29,2 |
255 |
65,0 |
34,0 |
30 |
29,0 |
23,2 |
150 |
48,0 |
30,0 |
270 |
67,0 |
34,4 |
45 |
30,5 |
23,8 |
165 |
51,0 |
30,8 |
285 |
69,0 |
35,2 |
60 |
32,0 |
24,2 |
180 |
52,0 |
31,4 |
300 |
72,0 |
36,0 |
75 |
35,0 |
25,0 |
195 |
55,0 |
32,0 |
315 |
74,0 |
36,5 |
90 |
38,0 |
26,2 |
210 |
58,0 |
32,5 |
330 |
76,0 |
37,0 |
105 |
40,5 |
27,2 |
225 |
60,0 |
33,0 |
345 |
78,0 |
38,0 |
|
360 |
80,0 |
40,0 |
|||||
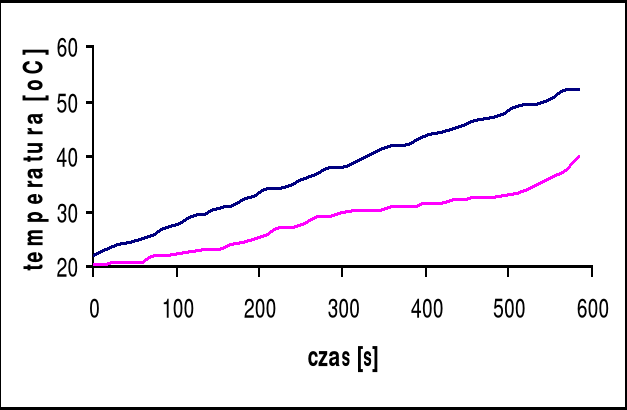
Temperatura przejścia wynosi 32°C
Przy pomocy programu Microsoft Excel odczytujemy tangensy kątów nachylenia stycznych do wykresów:
dla pieca: tgα = 0,16, stąd wynika, że V0 = 9,6 [oC/min]
dla próbki: tgα = 0,05, stąd wynika, że V = 3 [oC/min]
czas przemiany próbki wynosi 15 s
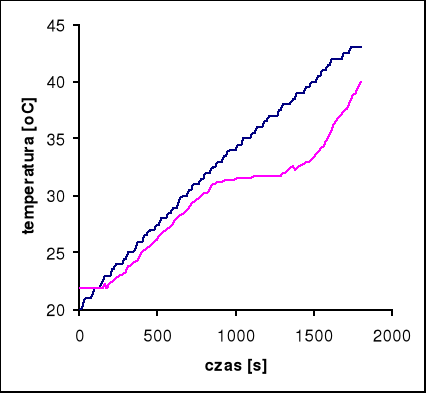
Badana substancja: Na2SO4 ⋅ 10 H2O
Naważka: m = 10 [g]
Prąd grzewczy: i = 0,73 [A]
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
Czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
0 |
20,0 |
22,0 |
600 |
29,0 |
27,6 |
1200 |
36,5 |
31,8 |
15 |
20,0 |
22,0 |
615 |
29,0 |
27,8 |
1215 |
37,0 |
31,8 |
30 |
20,5 |
22,0 |
630 |
29,0 |
28,0 |
1230 |
37,0 |
31,8 |
45 |
21,0 |
22,0 |
645 |
29,5 |
28,2 |
1245 |
37,0 |
31,8 |
60 |
21,0 |
22,0 |
660 |
30,0 |
28,4 |
1260 |
37,0 |
31,8 |
75 |
21,0 |
22,0 |
675 |
30,0 |
28,6 |
1275 |
37,5 |
31,8 |
90 |
21,5 |
22,0 |
690 |
30,0 |
28,8 |
1290 |
37,5 |
31,8 |
105 |
22,0 |
22,0 |
705 |
30,5 |
29,0 |
1305 |
38,0 |
32,0 |
120 |
22,0 |
22,0 |
720 |
30,5 |
29,2 |
1320 |
38,0 |
32,0 |
135 |
22,0 |
22,0 |
735 |
31,0 |
29,4 |
1335 |
38,0 |
32,2 |
150 |
22,5 |
22,0 |
750 |
31,0 |
29,6 |
1350 |
38,0 |
32,4 |
165 |
23,0 |
22,2 |
765 |
31,0 |
29,8 |
1365 |
38,5 |
32,6 |
180 |
23,0 |
22,2 |
780 |
31,5 |
30,0 |
1380 |
38,5 |
32,2 |
195 |
23,0 |
22,3 |
795 |
31,5 |
30,2 |
1395 |
39,0 |
32,4 |
210 |
23,5 |
22,4 |
810 |
32,0 |
30,3 |
1410 |
39,0 |
32,6 |
225 |
23,5 |
22,6 |
825 |
32,0 |
30,4 |
1425 |
39,0 |
32,7 |
240 |
24,0 |
22,8 |
840 |
32,0 |
30,6 |
1440 |
39,0 |
32,8 |
255 |
24,0 |
23,0 |
855 |
32,5 |
31,0 |
1455 |
39,5 |
33,0 |
270 |
24,0 |
23,1 |
870 |
32,5 |
31,0 |
1470 |
39,5 |
33,0 |
285 |
24,5 |
23,3 |
885 |
33,0 |
31,2 |
1485 |
40,0 |
33,2 |
300 |
24,5 |
23,4 |
900 |
33,0 |
31,2 |
1500 |
40,0 |
33,4 |
315 |
25,0 |
23,8 |
915 |
33,0 |
31,2 |
1515 |
40,0 |
33,6 |
330 |
25,0 |
23,8 |
930 |
33,5 |
31,3 |
1530 |
40,5 |
33,8 |
345 |
25,0 |
24,1 |
945 |
33,5 |
31,4 |
1545 |
40,5 |
34,0 |
360 |
25,5 |
24,3 |
960 |
34,0 |
31,4 |
1560 |
41,0 |
34,4 |
375 |
26,0 |
24,4 |
975 |
34,0 |
31,4 |
1575 |
41,0 |
34,8 |
390 |
26,0 |
24,8 |
990 |
34,0 |
31,4 |
1590 |
41,5 |
35,0 |
405 |
26,0 |
25,0 |
1005 |
34,0 |
31,5 |
1605 |
41,5 |
35,4 |
420 |
26,5 |
25,2 |
1020 |
34,5 |
31,6 |
1620 |
42,0 |
35,8 |
435 |
26,5 |
25,4 |
1035 |
34,5 |
31,6 |
1635 |
42,0 |
36,4 |
450 |
27,0 |
25,6 |
1050 |
35,0 |
31,6 |
1650 |
42,0 |
36,6 |
465 |
27,0 |
25,8 |
1065 |
35,0 |
31,6 |
1665 |
42,0 |
37,0 |
480 |
27,0 |
26,0 |
1080 |
35,0 |
31,6 |
1680 |
42,0 |
37,2 |
495 |
27,5 |
26,2 |
1095 |
35,0 |
31,6 |
1695 |
42,5 |
37,4 |
510 |
27,5 |
26,4 |
1110 |
35,5 |
31,7 |
1710 |
42,5 |
37,6 |
525 |
28,0 |
26,6 |
1125 |
35,5 |
31,8 |
1725 |
42,5 |
38,0 |
540 |
28,0 |
26,8 |
1140 |
36,0 |
31,8 |
1740 |
43,0 |
38,4 |
555 |
28,0 |
27,0 |
1155 |
36,0 |
31,8 |
1755 |
43,0 |
38,8 |
570 |
28,5 |
27,2 |
1170 |
36,0 |
31,8 |
1770 |
43,0 |
39,0 |
585 |
28,5 |
27,4 |
1185 |
36,5 |
31,8 |
1785 |
43,0 |
39,6 |
|
1800 |
43,0 |
40,0 |
|||||
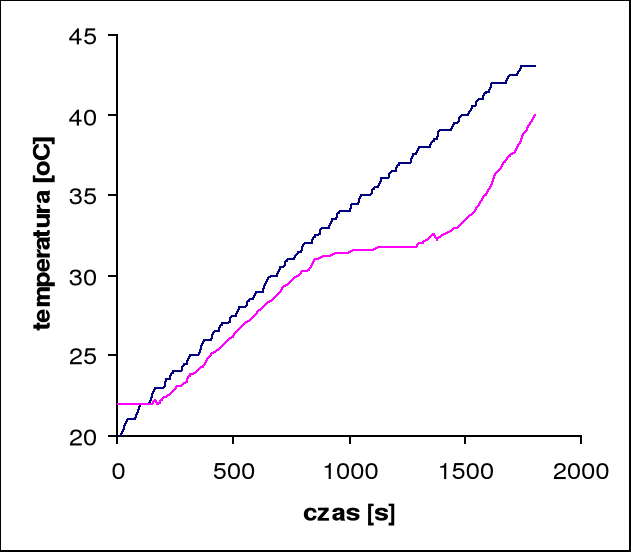
Temperatura przejścia wynosi 31,8°C
Przy pomocy programu Microsoft Excel odczytujemy tangensy kątów nachylenia stycznych do wykresów:
dla pieca: tgα = 0,01, stąd wynika, że V0 = 0,6 [oC/min]
dla próbki: tgα = 0,01, stąd wynika, że V = 0,6 [oC/min]
czas przemiany próbki wynosi 180 s
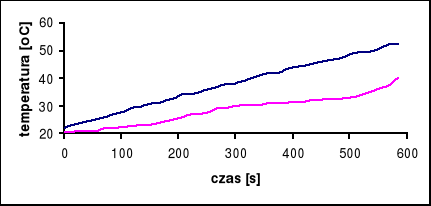
Badana substancja: Na2SO4 ⋅ 10 H2O
Naważka: m = 5 [g]
Prąd grzewczy: i = 1,45 [A]
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
0 |
22,0 |
22,0 |
165 |
32,0 |
26,2 |
345 |
43,0 |
32,0 |
15 |
23,0 |
22,2 |
180 |
33,0 |
27,0 |
360 |
43,5 |
32,0 |
30 |
24,0 |
22,4 |
195 |
34,0 |
27,8 |
375 |
44,5 |
32,2 |
45 |
25,0 |
22,7 |
210 |
35,0 |
28,4 |
390 |
45,0 |
32,4 |
60 |
26,0 |
23,0 |
225 |
35,5 |
29,4 |
405 |
45,5 |
33,4 |
75 |
27,0 |
23,3 |
240 |
36,5 |
30,0 |
420 |
46,0 |
34,0 |
90 |
27,5 |
23,6 |
255 |
37,5 |
30,6 |
435 |
47,0 |
34,8 |
105 |
28,0 |
23,9 |
270 |
38,0 |
31,0 |
450 |
48,0 |
35,4 |
120 |
29,0 |
24,2 |
285 |
39,0 |
31,4 |
465 |
49,0 |
36,4 |
135 |
30,0 |
24,8 |
300 |
40,0 |
31,6 |
480 |
49,5 |
37,2 |
150 |
31,0 |
25,4 |
315 |
41,0 |
31,8 |
495 |
50,5 |
39,0 |
|
330 |
42,0 |
31,8 |
510 |
51,0 |
40,4 |
||

Temperatura przejścia wynosi 32°C
Przy pomocy programu Microsoft Excel odczytujemy tangensy kątów nachylenia stycznych do wykresów:
dla pieca: tgα = 0,16, stąd wynika, że V0 = 9,6 [oC/min]
dla próbki: tgα = 0,05, stąd wynika, że V = 3 [oC/min]
czas przemiany próbki wynosi 30 s
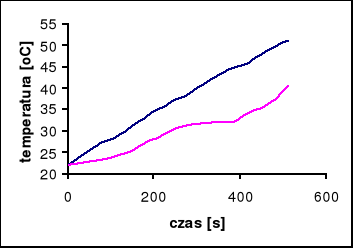
Badana substancja: Na2SO4 ⋅ 10 H2O
Naważka: m = 20 [g]
Prąd grzewczy: i = 1,45 [A]
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
Czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
0 |
22,0 |
21,8 |
210 |
34,0 |
26,2 |
420 |
44,0 |
32,0 |
15 |
23,0 |
22,0 |
225 |
34,5 |
27,0 |
435 |
45,0 |
32,0 |
30 |
24,0 |
22,0 |
240 |
35,5 |
27,6 |
450 |
46,0 |
32,0 |
45 |
25,0 |
22,0 |
255 |
36,0 |
28,0 |
465 |
46,0 |
32,2 |
60 |
26,0 |
22,2 |
270 |
37,0 |
28,8 |
480 |
47,0 |
32,4 |
75 |
27,0 |
22,4 |
285 |
38,0 |
29,2 |
495 |
48,0 |
32,8 |
90 |
27,5 |
22,8 |
300 |
38,5 |
29,6 |
510 |
48,5 |
33,2 |
105 |
28,0 |
23,0 |
315 |
39,0 |
30,0 |
525 |
49,0 |
33,4 |
120 |
29,0 |
23,4 |
330 |
40,0 |
30,4 |
540 |
49,5 |
34,0 |
135 |
30,0 |
23,6 |
345 |
40,0 |
30,8 |
555 |
50,0 |
34,8 |
150 |
31,0 |
24,2 |
360 |
41,5 |
31,0 |
570 |
51,0 |
35,6 |
165 |
31,5 |
24,8 |
375 |
42,0 |
31,4 |
585 |
52,0 |
37,2 |
180 |
32,0 |
25,2 |
390 |
43,0 |
31,8 |
600 |
52,5 |
38,0 |
195 |
33,0 |
25,8 |
405 |
43,5 |
32,0 |
615 |
53,0 |
39,0 |
|
630 |
53,5 |
40,0 |
|||||
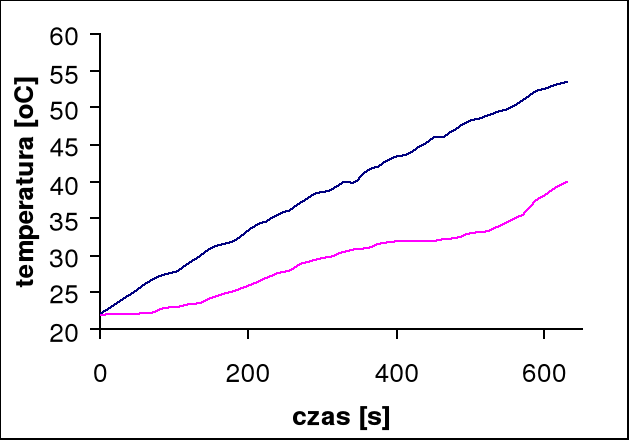
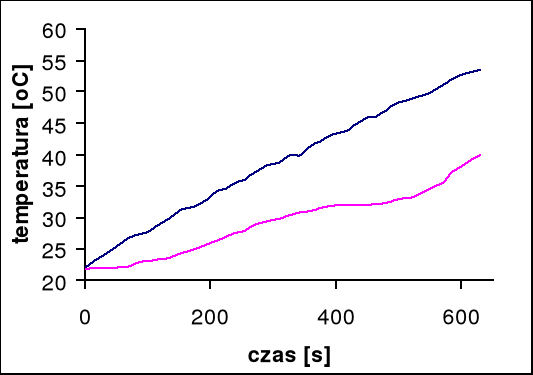
Temperatura przejścia wynosi 32°C
Przy pomocy programu Microsoft Excel odczytujemy tangensy kątów nachylenia stycznych do wykresów:
dla pieca: tgα = 0,05, stąd wynika, że V0 = 3 [oC/min]
dla próbki: tgα = 0,03, stąd wynika, że V = 1,8 [oC/min]
czas przemiany próbki wynosi 60 s
Badana substancja: ZnSO4 ⋅ 7 H2O
Naważka: m = 8,91 [g]
Prąd grzewczy: i = 1,45 [A]
czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
Czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
Czas pomiaru t[s] |
temp. wody t10 [°C] |
temp. próbki t20 [°C] |
0 |
22,0 |
22,0 |
390 |
44,0 |
35,8 |
780 |
63,0 |
50,6 |
15 |
23,0 |
22,4 |
405 |
44,5 |
36,4 |
795 |
63,5 |
51,7 |
30 |
24,0 |
22,4 |
420 |
45,0 |
37,0 |
810 |
64,5 |
53,0 |
45 |
24,5 |
22,6 |
435 |
46,0 |
38,0 |
825 |
65,0 |
54,0 |
60 |
25,5 |
22,6 |
450 |
47,0 |
38,4 |
840 |
66,0 |
55,0 |
75 |
26,0 |
22,8 |
465 |
48,0 |
38,9 |
855 |
66,5 |
56,1 |
90 |
27,0 |
23,2 |
480 |
49,0 |
39,2 |
870 |
67,0 |
57,0 |
105 |
28,0 |
23,4 |
495 |
49,5 |
39,6 |
885 |
68,0 |
58,0 |
120 |
29,0 |
23,8 |
510 |
50,0 |
40,0 |
900 |
68,5 |
59,0 |
135 |
29,5 |
24,2 |
525 |
51,0 |
40,4 |
915 |
69,0 |
59,5 |
150 |
30,5 |
24,8 |
540 |
51,5 |
41,0 |
930 |
70,0 |
60,0 |
165 |
31,5 |
25,2 |
555 |
52,5 |
41,2 |
945 |
71,0 |
61,2 |
180 |
32,5 |
25,8 |
570 |
53,0 |
41,6 |
960 |
71,5 |
61,8 |
195 |
33,0 |
26,4 |
585 |
54,0 |
42,0 |
975 |
72,0 |
62,2 |
210 |
34,0 |
27,0 |
600 |
54,5 |
42,6 |
990 |
72,5 |
62,2 |
225 |
35,0 |
27,4 |
615 |
55,0 |
43,4 |
1005 |
73,0 |
62,2 |
240 |
35,5 |
28,2 |
630 |
56,0 |
44,2 |
1020 |
73,5 |
61,6 |
255 |
36,5 |
29,0 |
645 |
56,5 |
45,0 |
1035 |
74,0 |
61,4 |
270 |
37,5 |
30,0 |
660 |
57,0 |
46,0 |
1050 |
74,5 |
61,0 |
285 |
38,0 |
30,6 |
675 |
58,0 |
47,0 |
1065 |
75,0 |
60,9 |
300 |
39,0 |
31,2 |
690 |
58,5 |
47,5 |
1080 |
76,0 |
61,0 |
315 |
40,0 |
32,0 |
705 |
59,0 |
48,0 |
1095 |
76,5 |
61,2 |
330 |
40,5 |
32,6 |
720 |
60,0 |
48,3 |
1110 |
77,0 |
61,4 |
345 |
41,5 |
33,8 |
735 |
61,0 |
48,5 |
1125 |
77,5 |
62,0 |
360 |
42,0 |
34,4 |
750 |
62,0 |
49,0 |
1140 |
78,0 |
62,5 |
375 |
43,0 |
35,0 |
765 |
62,5 |
49,5 |
1155 |
78,5 |
63,8 |
|
1170 |
79,0 |
65,0 |
|||||
Temperatura przejścia wynosi 41,2°C i 62,2°C
Przy pomocy programu Microsoft Excel odczytujemy tangensy kątów nachylenia stycznych do wykresów:
dla pieca: tgα = 0,05, stąd wynika, że V0 = 3 [oC/min]
dla próbki: tgα = 0,04, stąd wynika, że V = 2,4 [oC/min]
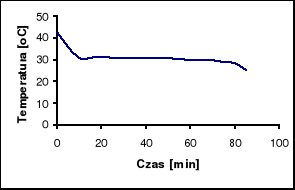
Badana substancja: Na2SO4 ⋅ 10 H2O
Naważka: m = 10 [g]
czas [min] |
temp.[OC] |
czas [min] |
temp.[OC] |
czas [min] |
temp.[OC] |
0 |
43,0 |
30 |
31,0 |
60 |
30,2 |
5 |
36,0 |
35 |
31,0 |
65 |
30,0 |
10 |
31,0 |
40 |
31,0 |
70 |
30,0 |
15 |
30,8 |
45 |
30,8 |
75 |
29,2 |
20 |
31,4 |
50 |
30,8 |
80 |
28,4 |
|
31,2 |
55 |
30,4 |
85 |
25,4 |
Dla próbki Na2SO4 ⋅ 10 H2O o stałej naważce m = 10 g i różnych natężeniach prądu:
1. i = 0,73 [A]
2. i = 1,45 [A]
3. i = 2,50 [A]
obliczamy stosunki poszczególnych wartości:
V01 : V02 : V03 = 0,6 : 3 : 9,6 = 1 : 5 : 16
V1 : V2 : V3 = 0,6 : 1,8 : 3 = 1 : 3 : 5
t1 : t2 : t3 = 180 : 30 : 15 = 12 : 2 : 1 = 1 : 1/6 : 1/12
Dla próbki Na2SO4 ⋅ 10 H2O o stałym natężeniu prądu i różnych naważkach:
1. m = 5 [g]
2. m = 10 [g]
3. m = 20 [g]
obliczamy przy pomocy wykresu stosunki wielkości naważek do długości odcinków poziomych na krzywych analizy termicznej:
1. stosunek wynosi: 5: 15 = 1/3
2. stosunek wynosi: 10: 30 = 1/3
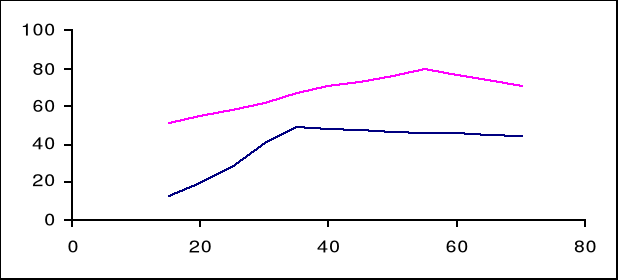
3. stosunek wynosi: 20: 60 = 1/3
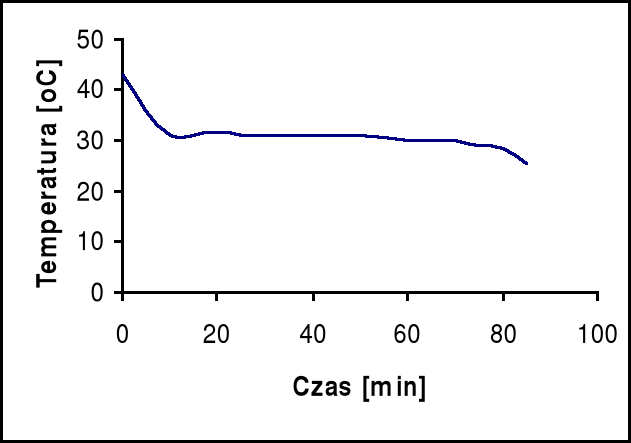
Przy pomocy powyższego wykresu odczytujemy temperatury przejścia dla badanych próbek:
Na2SO4 ⋅ 10 H2O = 35 oC
ZnSO4 ⋅ 7 H2O = 55 oC
Temperatury otrzymane w wyniku analizy termicznej odbiegają od temperatur odczytanych z powyższego wykresu o około 5oC.
Wnioski:
Temperatura przejścia określonej substancji jest wielkością stałą. Od szybkości dostarczania ciepła do układu zależy tylko stromość krzywej analizy termicznej. Na krzywej tej wielkość przystanku zależy od rodzaju substancji (im dłuższy przystanek tym większe ciepło przemiany), szybkości ogrzewania, a przede wszystkim od masy próki.
Stosunki wielkości naważek do długości odcinków poziomych na krzywych analizy termicznej są stałe dla danej substancji.

Wyszukiwarka
Podobne podstrony:
lab. 15 - baron, Chemia fizyczna AGH laborki, lab 15
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
napiecie pow nr 2, Chemia fizyczna AGH laborki, lab 2
LABORKA UKASZ 3, Chemia fizyczna AGH laborki, lab 3,4
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
korozja dla justyny, Chemia fizyczna AGH laborki, lab 21
Wyniki pomiarów ciepła rozpuszczania, Chemia fizyczna AGH laborki, lab 3,4
SPRAWOZ6, Chemia fizyczna AGH laborki, lab 18
Chemia fizyczna (3, Chemia fizyczna AGH laborki, lab 3,4
Wykresy do 3, Chemia fizyczna AGH laborki, lab 3,4
tekst 7, Chemia fizyczna AGH laborki, lab 6
Chem 1, Chemia fizyczna AGH laborki, lab 1
skoootaaa, Chemia fizyczna AGH laborki, lab 20
lepkość, Chemia fizyczna AGH laborki, lab 1
Potencjały równowagowe elektrod - siła elektromotoryczna ogniw. polaryzacja, Chemia fizyczna AGH la
więcej podobnych podstron