Wstęp teoretyczny:
Szczególny przypadkiem korozji jest korozja kontaktowa. Występuje ona w przypadku, gdy dwa metale (lub metal i elektronowy przewodnik niemetaliczny jak np. grafit, magnetyt) stykają się ze sobą i jednocześnie pozostają w kontakcie z elektrolitem. Kontakt dwóch metali z reguły zwalnia szybkość korozji jednego metalu, przyśpiesza zaś korozję drugiego.
Reakcje anodowe w tego typu reakcjach przedstawiają równania stechiometryczne:
MA → MAa+ + a⋅e-
MB → MBb+ + b⋅e-
Proces anodowy sprowadza się tu do roztwarzana metali, a szybkość tego procesu jest szybkością korozji.
Reakcję katodową w silnie kwasowych roztworach opisuje równanie:
H+ + e- → ½ H2 jest to tzw. depolaryzacja wodorowa
Korozję kontaktową metali A i B można opisać sumarycznymi równaniami stechometrycznmi:
MA + aH+ → MAa+ + a/2 H2
MB + bH+ → MBb+ + b/2 H2
Gdy korodujące metale są bardziej elektroujemne od wodoru (mniej szlachetne), wówczas będą korodować jednocześnie. Suma ilości przekorodowanych metali A i B musi być równa ilości wydzielonego na katodzie wodoru. Podobnie suma prądów anodowych jest równa sumie prądów katodowych. Proces anodowy jednak przebiega szybciej na metalu bardziej elektroujemnym , proces katodowy na metalu bardziej elektrododatnim.
Cel ćwiczenia:
Celem tego ćwiczenia jest ustalenie wpływu kontaktów: żelazo-cynk, żelazo-miedź oraz stosunku wielkości powierzchni pozostających w kontakcie metali na szybkość korozji
w 10% kwasie siarkowym.
Opracowanie wyników:
Wyniki pomiarów korozji kontaktowej w układach Fe - Zn, Fe - Cu
10% roztwór kwasu siarkowego t0 [oC]
1 |
2 |
3 |
4 |
7 |
8 |
9 |
10 |
11 |
12 |
|||||||
nr |
powierzchnia czynna Fe |
powierzchnia czynna Zn |
SFe / SZn |
czas trwania korozji |
masa próbki żelaznej |
masa próbki cynkowej (miedzianej) |
średnia szybkość korozji żelaza |
średnia szybkość korozji cynku (miedzi) |
sumaryczny średni prąd korozyjny w układzie |
|||||||
|
SFe [cm2] |
SZn [cm2] |
|
t [min] |
Przed |
po |
ubytek masy |
przed |
po |
ubytek masy |
IFe [A] |
na jedn. pow. |
IZn [A] |
na jedn. pow. |
I = IFe + IZn |
|
|
|
|
|
|
m1 Fe [g] |
m2 Fe [g] |
၄ၭၥ၆ ၝၧၛ |
m1 Zn [g] |
m2 Zn [g] |
၄ၭၮၚ ၝၧၛ |
|
iFe |
|
iZn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[A/cm2] |
|
[A/cm2] |
|
|
1 |
6,44 |
38,40 |
0,1 |
45 |
5,16780 |
5,16730 |
0,00050 |
5,22680 |
4,56370 |
0,66310 |
0,00064 |
0,00010 |
0,72510 |
0,01888 |
0,72574 |
|
2 |
40,18 |
38,40 |
1 |
45 |
16,48550 |
16,47110 |
0,01440 |
4,92740 |
3,55290 |
1,37450 |
0,01843 |
0,00046 |
1,50302 |
0,03914 |
1,52145 |
|
3 |
38,40 |
9,30 |
10 |
45 |
6,44620 |
6,44400 |
0,00220 |
4,43960 |
3,70560 |
0,73400 |
0,00282 |
0,00007 |
0,80263 |
0,08630 |
0,80545 |
|
|
|
SCu [cm2] |
SFe / SCu |
|
|
|
|
m1 Cu [g] |
m2 Cu [g] |
၄ၭၵ၃ ၝၧၛ |
|
|
ICu [A] |
iZn |
I = IFe + ICu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[A/cm2] |
|
|
4 |
5,80 |
42,00 |
0,1 |
45 |
4,4398 |
4,4305 |
0,0093 |
11,4676 |
11,4672 |
0,0004 |
0,0119 |
0,00205 |
0,00045 |
0,000011 |
0,01236 |
|
5 |
42,00 |
43,86 |
1 |
45 |
16,8638 |
16,8151 |
0,0487 |
10,9210 |
10,9209 |
0,0001 |
0,0623 |
0,00148 |
0,00011 |
0,000003 |
0,06245 |
|
6 |
44,72 |
6,24 |
10 |
45 |
16,6444 |
16,5872 |
0,0572 |
3,4786 |
3,4782 |
0,0004 |
0,0732 |
0,00164 |
0,00045 |
0,000072 |
0,07367 |
|
|
korozja bez kontaktów |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
7 |
Fe |
41,00 |
|
|
45 |
17,4210 |
17,3608 |
0,0602 |
|
|
|
0,0771 |
0,0019 |
|
|
|
8 |
Zn |
38,40 |
|
|
45 |
10,5342 |
4,9638 |
5,5708 |
|
|
|
6,09167 |
0,15864 |
|
|
|
9 |
Cu |
43,86 |
|
|
45 |
11,5728 |
11,5720 |
0,0008 |
|
|
|
0,00090 |
0,000021 |
|
|
|
Przykład obliczeń:
blaszka żelazna posiada wymiary 41 [mm] x 50 [mm]
S = 2 ⋅ 4,1 ⋅ 5,0 = 41,0 [cm2]
m1 Fe = 17,4210 [g]
m2 Fe = 17,3608 [g]
ΔmFe = m1 Fe - m2 Fe = 17,4210 - 17,3608 = 0,0602
czas korozji t = 45 [min] = 2700 [s]
Z pierwszego prawa Faradaya m = k⋅I⋅t obliczmy natężenie I = m / kt
F = 96500 [C] - stała Faradaya
MFe = 55,847 [g] - masa molowa
KFe = 55,847 / (2 ⋅ 96500) = 2,89 ⋅ 10-4
IFe = ΔmFe / (kFe⋅t) = 0,0602 / (2,89 ⋅ 10-4 ⋅ 2700) = 0,0771
iFe = IFe / SFe = 0,0771 / 41,0 = 0,0019
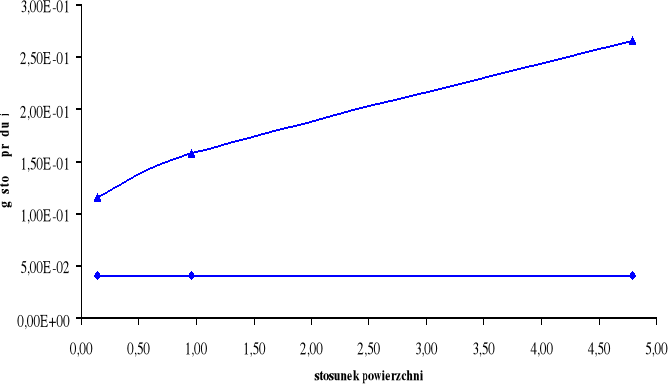
Wykresy:
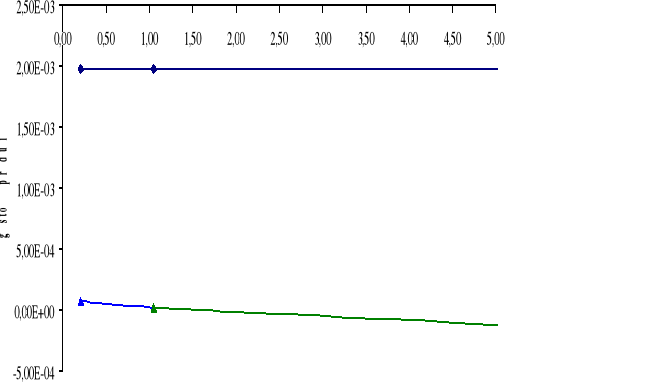
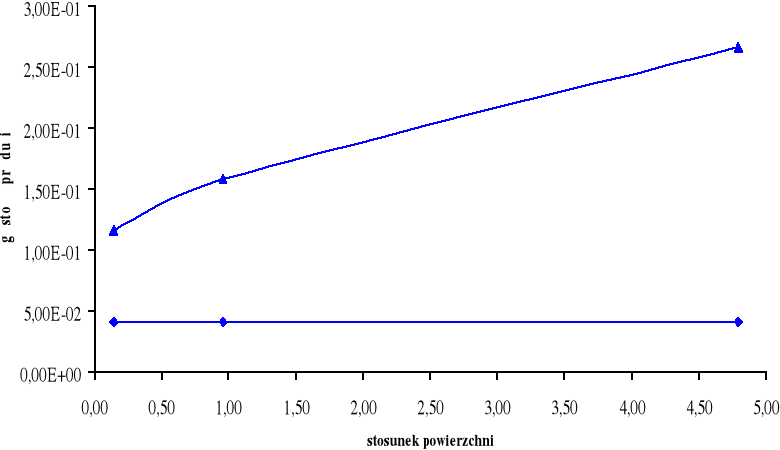
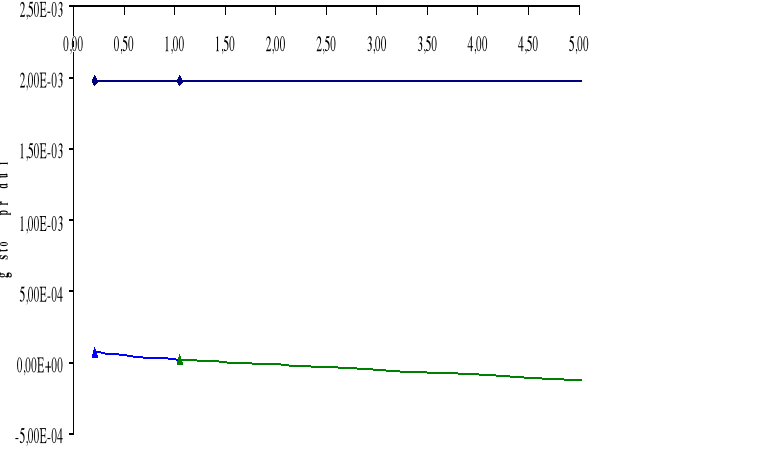
Górny wykres obrazuje zależność gęstości prądu i dla cynku Zn w zależności od stosunku powierzchni SFe / SZn.
Dolny wykres obrazuje zależność gęstości prądu i dla żelaza Fe w zależności od stosunku powierzchni SZn / SFe.
A: Zn → Zn2+ + 2e-
K: H+ + e- → ½ H2
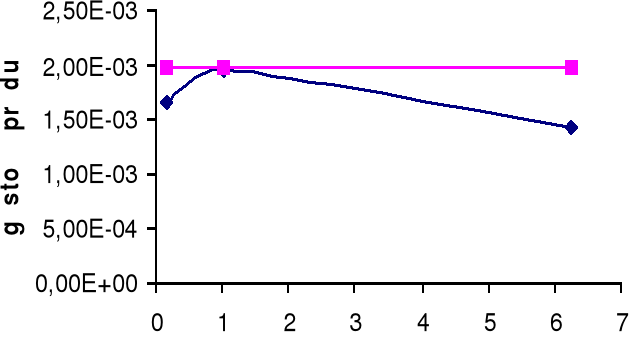
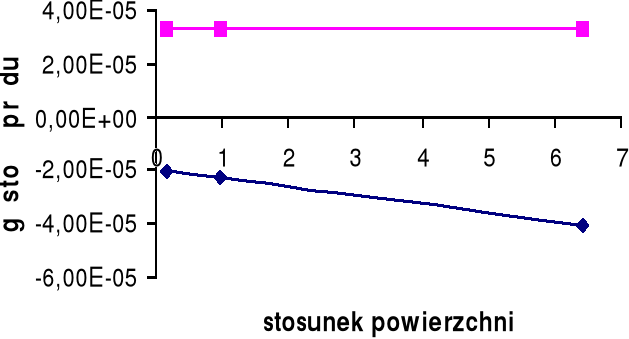
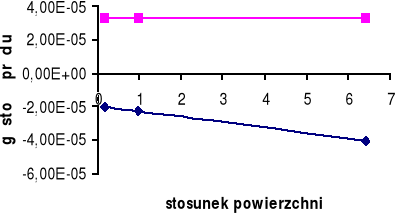
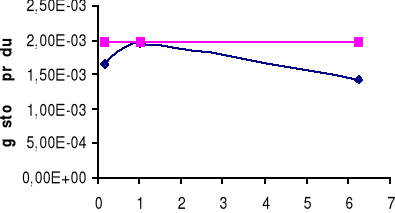
Górny wykres obrazuje zależność gęstości prądu i dla żelaza Fe w zależności od stosunku powierzchni SCu / SFe.
Dolny wykres obrazuje zależność gęstości prądu i dla miedzi Cu w zależności od stosunku powierzchni SFe / SCu.
A: Fe → Fe2+ + e-
K: H+ + e- → ½ H2
Wnioski:
W układzie Fe - Zn możemy zaobserwować zmniejszenie korozji żelaza, w wyniku kontaktu z cynkiem. Wynika to z tego, iż cynk jest bardziej elektroujemny od żelaza i przez chroni je przed korozją (cynk stanowi anodę, a żelazo katodę).
W układzie Fe - Cu możemy zaobserwować, iż w tym przypadku anodę stanowi blaszka żelazna, a katodę stanowi blszka miedziana (blaszka miedziana pokrywa się nalotem). Wynika to z teog, iż żelazo jest bardziej elektroujemne od miedzi.
Pod wpływem kontaktu żelaza z cynkiem lub miedzią można zaobserwować zmniejszenie korozji, bowiem w przypadku gdy żelazo pozostaje bez kontaktu z tymi metalami, wówczas koroduje ono bardziej (o 1-2 rzędy wielkości).
Pod wpływem kontaktu cynku z żelazem, można zaobserwować, iż cynk (stanowiący wówczas anodę) ulega korozji. Wynika to z tego, iż jest on bardziej elektroujemny od żelaza.
Pod wpływem kontaktu miedzi z cynkiem można zaobserwować, iż miedź (stanowiąca wówczas katodę) pokrywa się nalotem. Wynika to z tego, iż miedź jest bardziej elektrododatnia od żelaza.
W układzie Fe - Zn możemy zaobserwować, iż korozja żelaza zależy od stosunku powierzchni SFe / SZn. Im większy stosunek powierzchni SFe / SZn tym mniejsza korozja żelaza. Im większy stosunek SZn / SFe tym większa jest korozja cynku.
W układzie Fe - Cu możemy zaobserwować, iż korozja żelaza zależy od stosunku powierzchni SFe / SCu. Dla małych stosunku powierzchni można zaobserwować, iż korozja żelaza wzrasta, a dopiero po przekroczeniu pewnej wartości SFe / SCu korozja żelaza zmniejsza się.
Aby chronić żelazo przed korozją w silnie kwaśnym środowisku bardzo często blachę żelazną pokrywa się cienką warstwą cynku lub miedzi. Wynika to z tego, iż cynk zmniejsza korozyjność żelaza. Pokrywanie blachy żelaznej miedzią również chroni ją przed korozją, bowiem miedź ulega korozji wolniej niż żelazo.
Wyszukiwarka
Podobne podstrony:
trallalallabumcykcyk 20, Chemia fizyczna AGH laborki, lab 20
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
napiecie pow nr 2, Chemia fizyczna AGH laborki, lab 2
LABORKA UKASZ 3, Chemia fizyczna AGH laborki, lab 3,4
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
korozja dla justyny, Chemia fizyczna AGH laborki, lab 21
Wyniki pomiarów ciepła rozpuszczania, Chemia fizyczna AGH laborki, lab 3,4
SPRAWOZ6, Chemia fizyczna AGH laborki, lab 18
Chemia fizyczna (3, Chemia fizyczna AGH laborki, lab 3,4
lab. 05 - baron, Chemia fizyczna AGH laborki, lab 5
Wykresy do 3, Chemia fizyczna AGH laborki, lab 3,4
tekst 7, Chemia fizyczna AGH laborki, lab 6
Chem 1, Chemia fizyczna AGH laborki, lab 1
lepkość, Chemia fizyczna AGH laborki, lab 1
Potencjały równowagowe elektrod - siła elektromotoryczna ogniw. polaryzacja, Chemia fizyczna AGH la
więcej podobnych podstron