Państwowa Wyższa Szkoła Zawodowa
im. Prezydenta Stanisława Wojciechowskiego
w Kaliszu
Laboratorium z Analizy Chemicznej Wody i Ścieków
PEHAMETRIA
Miareczkowanie pehametryczne
Oznaczenie NaOH
Przygotowali:
Zarys teorii.
pH jest to ujemny dziesiętny logarytm stężenia jonów wodorowych w roztworze. Dla roztworów wodnych wartość pH mieści się w przedziale 0-14.
pH=-log[H+]
Miareczkowanie pehametryczne jest to instrumentalna metoda analityczna, wykorzystująca zależność pomiędzy potencjałem odpowiedniego półogniwa a aktywnością jonów lub cząsteczek w roztworze, w warunkach bezprądowych. Rolę takiego półogniwa spełniają najczęściej elektrody jonoselektywne.
Przy oznaczaniu stężenia kwasu lub zasady metodą miareczkową, podstawą uzyskania poprawnego wyniku jest uchwycenie momentu, w którym zobojętniony zostaje kwas lub zasada zawarte w miareczkowanej próbce roztworu. W trakcie tej reakcji powstaje sól i woda, zmienia się stężenie jonów wodorowych, czyli pH zobojętnionego roztworu.
Cel ćwiczenia.
Celem ćwiczenia jest oznaczenie zawartości NaOH w roztworach otrzymanych do analizy na podstawie wyników miareczkowania pehametrycznego.
Wykonanie ćwiczenia.
Mierząc pH miareczkowanego roztworu można dokładnie uchwycić punkt końcowy miareczkowania. Próbkę miareczkowanego roztworu umieszcza się w zlewce odpowiedniej wielkości i dodaje wody destylowanej, w takiej objętości, aby elektrody mogły się zanurzyć na dostateczną głębokość. Po uruchomieniu mieszadła z biurety dodaje się roztwór o znanym stężeniu, w porcjach objętości po 0,5cm3. Z uzyskanych wartości przygotowuje się wykres zależności pH od ilości cm3 dodanego roztworu.
Tabela.
Wykresy.
Obliczenia.
Wnioski.
Objętość dodawanego r-u miareczkującego V[ml] |
pH roztworu |
Kolejne przyrosty ΔpH |
Przyrosty objętości ΔV[ml] |
Pierwsze pochodne ΔpH ΔV |
0 |
9,48 |
0 |
0 |
0 |
0,5 |
9,40 |
0,08 |
0,5 |
0,16 |
1 |
9,25 |
0,15 |
0,5 |
0,3 |
1,5 |
9,05 |
0,2 |
0,5 |
0,4 |
2 |
8,44 |
0,61 |
0,5 |
1,22 |
2,5 |
7,61 |
0,83 |
0,5 |
1,66 |
3 |
5,55 |
2,06 |
0,5 |
4,12 |
3,5 |
3,74 |
1,81 |
0,5 |
3,62 |
4 |
1,96 |
1,78 |
0,5 |
3,56 |
4,5 |
1,65 |
0,31 |
0,5 |
0,62 |
5 |
1,68 |
0,03 |
0,5 |
0,06 |
5,5 |
1,48 |
0,2 |
0,5 |
0,4 |
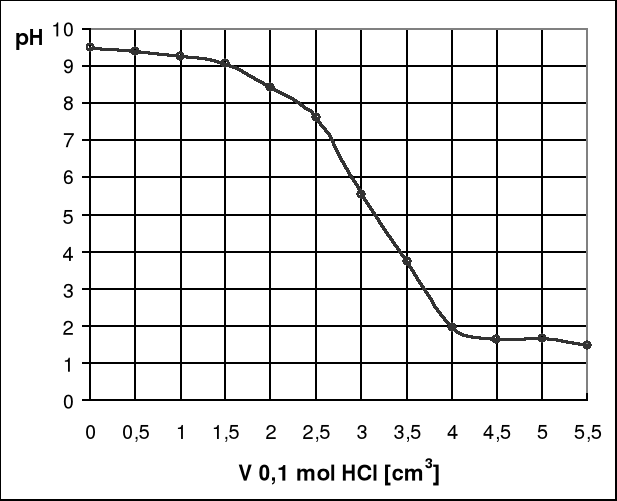
Wykres 1. Zależność pH roztworu od objętości dodanego titranta.
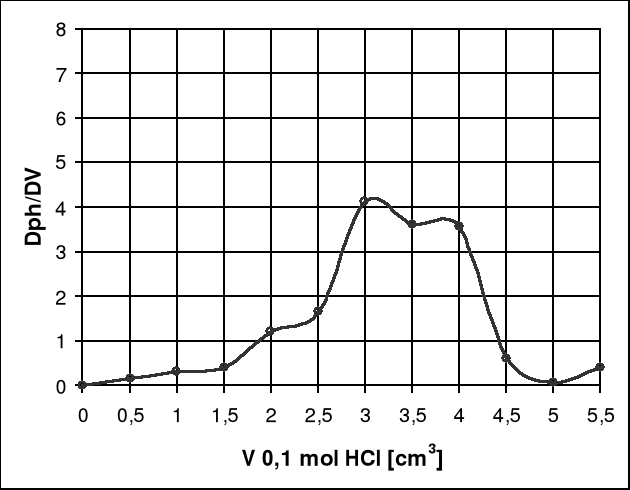
Wykres 2. Zależność pierwszej pochodnej od objętości dodanego titranta.
1. Obliczenie zawartości doświadczalnej NaOH.
ngRNaOH = VK × Cn
ngR - liczba gramorównoważników
VK - objętość titranta zużytego do miareczkowania w punkcie końcowym
Cn - stężenie normalne roztworu HCl (titranta)
VK = 3cm3 = 0,003dm3
Cn = 0,1gR/dm3
ngRNaOH = 0,0035dm3×0,1gR/dm3
ngRNaOH =0,00035gR
1 gRNaOH - 40g
0,00035 gRNaOH - xg
![]()
x =WD = 0,014g
2. Obliczenie wartości błędu względnego.
ΔB = |WT - WD|
WT - zawartość teoretyczna
WD - zawartość doświadczalna
WT = 0,014g
WD = 0,014g
ΔB = |0,014g - 0,014g|
ΔB = 0g
3. Obliczenie wartości błędu bezwzględnego.
![]()
ΔB - błąd względny
WT - zawartość teoretyczna
ΔB = 0g
WT = 0,014g
![]()
ΔW = 0%
Wykres zależności pH od objętości dodanego titranta rozpoczyna się przy pH = 9,48. Widzimy również, że w początkowej fazie miareczkowania krzywa prawie w ogóle się nie zmienia, następuje łagodny spadek pH. Następnie po dodaniu w sumie 2,5cm3 titranta, pH roztworu zaczyna gwałtownie spadać, aż do momentu przekroczenia punktu końcowego miareczkowania, czyli 3,5cm3, po przekroczeniu, którego znów następuje łagodny spadek pH roztworu, w okolicach pH = 1,64.
Odczytując punkt końcowy miareczkowania z wykresu zależności pH od objętości dodanego titranta, który wynosi 3cm3 i pH = 5,55. Wykres pierwszej pochodnej od objętości titranta osiągną maksimum przy objętości 3,5cm3, co odpowiada pH = 3,74.
Bardziej dokładny jest wykres zależności pierwszej pochodnej od objętości dodanego titranta gdyż tworzy się na nim maksimum w punkcie końcowym miareczkowania, natomiast na wykresie zależności pH od objętości dodanego titranta znalezienie punktu końcowego opiera się na przewidywaniach, dlatego jest on mniej dokładny.
Błąd względny i bezwzględny wynosi odpowiednio 0g i 0%. Świadczy to o dużej dokładności tej metody pomiarowej oraz dokonywanych pomiarów i czasów mieszania próbki z titrantem.
Miareczkowanie pehametryczne
2
7
2
pH/V
Wyszukiwarka
Podobne podstrony:
Oznaczenie twardości ogólnej metodą werenianową, inżynieria ochrony środowiska kalisz, Analiza Chemi
Spektrofotometria - oznaczenie miedzi, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody
Refraktometria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
ChZT-Mn, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Polarymetria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Spektrofotometria - oznaczenie manganu, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody
Konduktometria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Oznaczenie kwasowości, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Siarczany, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
pwsz ioś kalisz Analiza-Pehametria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
wersja do nauki, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, P
ogólne informacje o ściekach, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody
dekarbonizacja, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, Pl
Mikroskopowe badanie osadu czynnego, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technolog
Neutralizacja ścieków, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ście
wersja do nauki, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, P
więcej podobnych podstron