PAŃSTWOWA WYŻSZ SZKOŁA ZAWODOWA W KALISZU
INSTYTUT POLITECHNICZNY
INŻYNIERIA OCHRONY ŚRODOWISKA
LABORATORIA Z ANALIZY CHEMICZNEJ WODY I ŚCIEKÓW
SPRAWOZDANIE NR1
ĆWICZENIE NR 2
PEHAMETRIA
OZNACZANIE ZAWARTOŚCI WODOROTLENKU SODU NaOH W ROZTWORZE
WYKONALI:
Joanna Rybczyńska
Mateusz Sobkowiak
1)Cel ćwiczenia:
Oznaczanie wodorotlenku sodu NaOH w roztworze.
2)Zarys teoretyczny wykonywanego ćwiczenia:
Pehametria jest jedyną metodą analityczną, umożliwiajacą w sposób prosty i bardzo dokładny oznaczenie aktywności jonów wodorowych w roztworze. Roztwór podczas pomiaru pH nie ulega zniszczeniu i nie zmienia składu , co jest istotną zaleta metody.
Co to jest pH roztworu?
pH roztworu jest to ujemny logarytm dziesiętny stężenia jonów H+ w roztworze:
pH = - log [H+]
Roztwory wodne wszystkich substancji mogą mieć odczyn kwaśny, obojętny lub zasadowy. Jednak takie określanie charakteru roztworu jest mało miarodajne, ponieważ nie ma w nim zawartych informacji dotyczących dokładnego stężenia jonów H+ lub OH- w badanym roztworze, co często jest potrzebne.
Obok pH roztworu istnieje jeszcze jedna wielkość, która jest nazywana pOH roztworu. Analogicznie do pojęcia pH, pOH jest:
ujemnym logarytmem dziesiętnym stężenia molowego jonów OH- w roztworze:
pOH = -log[OH-]
Pomiędzy tymi wielkościami zachodzi ważna zależność:
pH + pOH = 14
Z teorii dysocjacji wynika, że iloczyn stężeń jonów wodorowych [H+] i wodorotlenowych [OH-] dla wody i wodnych roztworów jest wielkością stałą i wynosi w temp. 25o C :
![]()
Oznacza to, że skala pH mieści się w przedziale od 0 do 14 - skala Soerensena:
pH |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
[H+] |
10-0 |
10-1 |
10-2 |
10-3 |
10-4 |
10-5 |
10-6 |
10-7 |
10-8 |
10-9 |
10-10 |
10-11 |
10-12 |
10-13 |
10-14 |
[OH-] |
10-14 |
10-13 |
10-12 |
10-11 |
10-10 |
10-9 |
10-8 |
10-7 |
10-6 |
10-5 |
10-4 |
10-3 |
10-2 |
10-1 |
10-0 |
pOH |
14 |
13 |
12 |
11 |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
Odczyn pH od 0 - 6 to odczyn kwaśny, ponieważ [H+] > [OH-]
Odczyn pH równy 7 to odczyn obojętny, ponieważ [H+] = [OH-]
Odczyn pH od 8-14 to odczyn zasadowy, ponieważ [H+] < [OH-]
Pomiar pH wykonuje się metodami :
wskaźnikowymi,
kolorometrycznymi,
potencjometrycznymi.
Metody wskaźnikowe charakteryzują się najmniejszą dokładnością oparte są na wykorzystywaniu właściwości niektórych związków organicznych do zmiany barwy, w zależności od stężenia jonów wodorowych. Są najprostszym sposobem, lecz pokazującym jedynie czy roztwór jest kwaśny, zasadowy czy obojętny jest stosowanie tzw. wskaźników - indykatorów. Są to substancje organiczne o skomplikowanej budowie. Ogólnie można je przedstawić za pomocą wzorów ogólnych:
H-R - jeżeli wskaźnik jest słabym kwasem
R-OH - jeżeli wskaźnik jest słabą zasadą
Gdy wprowadzimy dany wskaźnik do roztworu, to nastąpi częściowa dysocjacja, prowadząca do stanu równowagi chemicznej, omówię to na przykładzie oranżu metylowego:
H-R
H+ + R-
Anion R- nadaje roztworowi barwę żółtą, a niezdysocjowane cząstki H-R barwę czerwoną. I gdy badany roztwór ma charakter kwasowy - będzie posiadał w nadmiarze jony H+, to równowaga zostanie przesunięta w lewo - czyli będzie widoczny tylko kolor czerwony. Natomiast gdy będziemy sprawdzali odczyn substancji o charakterze zasadowym, to nadmiar jonów OH-, spowoduje przesunięcie równowagi w prawo, a tym samym roztwór zabarwi się na żółto. W ten sposób działają wszystkie wskaźniki, w tabelce umieściłem najczęściej używane i ich zabarwienie w poszczególnych roztworach:
|
Kwaśny |
Obojętny |
Zasadowy |
Fenoloftaleina |
bezbarwny |
bezbarwny |
malinowy |
Oranż metylowy |
czerwony |
pomarańczowy |
żółty |
Lakmus |
czerwony |
fioletowy |
niebieski |
Błękit tymolowy |
czerwony |
żółty |
niebieski |
Papierki |
czerwony |
żółty |
niebieski |
W ostatnim wierszu umieszczono wskaźnik zwany papierkiem uniwersalnym. Jest to papierek, który na swoim końcu posiada bibułkę nasiąkniętą różnymi substancjami chemicznymi. Po włożeniu tego wskaźnika do badanego roztworu, bibułka zabarwia się na pewien kolor, który następnie sprawdza się ze skalą na opakowaniu. każdy kolor odpowiada każdemu stopniu w skali pH.
Metoda kalorymetryczna ma charakter orientacyjny i polega na porównaniu zabarwienia badanego roztworu, do którego dodano odpowiedni wskaźnik, z serią roztworów wzorcowych różniących się wartościami pH .
Metoda potencjometryczna może być stosowana do roztworów mętnych lub zabarwionych. Potencjometryczne pomiary pH można wykonać metodą bezpośrednią przez wyznaczenie siły elektromotorycznej SEM ogniwa pomiarowego bez użycia roztworu buforowego lub metodą porównawczą stosując roztwór buforowy.
Miareczkowanie pehametryczne:
Przy oznaczaniu stężenia kwasu lub zasady metodą miareczkowania, podstawą uzyskania poprawnego wyniku jest uchwycenie momentu, w którym zobojętniony zostaje kwas lub zasada zawarte w miareczkowanej próbce roztworu.
Mierząc pH miareczkowanego roztworu można dokładnie uchwycić punkt końcowy miareczkowania. Przygotowuje się wykres zależności pH od ilości cm3 dodanego roztworu. Na podstawie krzywej wzorcowej pH = f(v) sporządza się wykres
![]()
i odczytuje się objętość Vr odpowiadającą punktowi równoważnemu.
Elektroda kombinowana:
jest to zestaw dwoch elektrod w jednej oprawce, co upraszcza przeprowadzenie pomiaru, wykonywanego bez dodatkowej elektrody porównawczej.
3)Odczynniki, sprzęt laboratoryjny i aparatura :
Roztwór HCl - 0,1 n
Roztwór NaOH - 0,1 n
Elektroda kombinowana
Zlewka 100 ml, pipeta 25 ml
Biureta 25 ml, statyw, mieszadło magnetyczne
Pehametr
4)Wykonanie ćwiczenia :
Celem ćwiczenia było oznaczenie zawartości NaOH w roztworze otrzymanym do analizy na podstawie wyników miareczkowania pehametrycznego
Zasada oznaczania:
Podstawą tej metody jest reakcja przebiegająca między zasadą a dodawanym roztworem kwasu solnego
Na+ + OH- + H+ + Cl- → H2O + Cl- + Na+
Zasadą tego miareczkowania jest pomiar pH roztworu badanego zależnym od stężenia jonów wodorotlenowych.
5)Przebieg doświadczenia:
Otrzymany roztwór w zlewce 100ml uzupełniamy wodą destylowaną do objętości 60ml. Zlewkę z roztworem umieszczamy na mieszadle magnetycznym. Po wymieszaniu zanurzamy w roztworze elektrodę i badamy pH roztworu.
Miareczkujemy pehametrycznie roztwór bazowy dodając roztworu o,1 molowego HCl (titranta) z biurety porcjami po 0,5 ml (cm3). Każdorazowy po dodaniu titranta mieszamy otrzymywany roztwór i badamy jego pH.
Wyniki pomiarów pH oraz sumaryczną liczbę dodawanych mililitrów titranta zapisujemy w tabeli.
Obliczmy kolejne zmiany pH i przyrosty dodawanej objętości titranta (HCl)
Wykonujemy wykresy krzywej miareczkowania w układzie pH = f(V) oraz wykres stosunku pochodnych pH i V do dodawanego titranta :
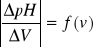
.Z krzywych miareczkowania określamy punkt końcowy miareczkowania, którym jony wodorowe [H+] pochodzące z kwasu - titranta (HCl) zobojętniają jony wodorotlenowe [OH-] z roztworu badanego zasady (NaOH). Na podstawie wartości objętości równoważnikowej obliczmy pomiarowa masę NaOH w badanej próbce.
Obliczamy błędy pomiarowe : bezwzględny i względny, porównując otrzymany wynik z wartością rzeczywistą masy NaOH.
6) Opracowanie wyników/tabela pomiarowa:
L.P. |
OBJĘTOŚĆ DODANEGO R-U MIARECZKOWANEGO V [ml] |
pH ROZTWORU
|
KOLEJNE PRZYROSTY ΔpH |
PRZYROST OBJĘTOŚCI ΔV [ml] |
PIERWSZE POCHODNE
|
1 |
0 |
9,43 |
|
|
|
2 |
1 |
9,03 |
0,4 |
1 |
0,4 |
3 |
2 |
8,00 |
1,03 |
1 |
1,03 |
4 |
3 |
7,13 |
0,87 |
1 |
0,87 |
5 |
4 |
6,60 |
0,53 |
1 |
0,53 |
6 |
5 |
6.49 |
0,11 |
1 |
0,11 |
7 |
6 |
6,40 |
0,09 |
1 |
0,09 |
8 |
7 |
|
|
|
|
9 |
8 |
5,74 |
0,66 |
2 |
0,33 |
10 |
9 |
4,48 |
1,26 |
1 |
1,26 |
11 |
10 |
2,54 |
1,94 |
1 |
1,94 |
7)Wykresy:
Krzywa miareczkowania pH=f(V)
Pierwsza pochodna:
8)Obliczenia:
obliczam liczbę gramorównoważników NaOH zawatrą w próbce:
ngR=Vk⋅Cn
Vk - objętość titranta zużyta do miareczkowania w punkcie końcowym
Cn - stężenie normalne roztworu HCl (titranta)
Dane:
Vk =2,5 cm3=2,5⋅10-3 dm3 [wartość odczytana z wykresu]
Cn=0,1 mol/dm3
1gR NaOH = 40g
ngR=2,5⋅10-3⋅0,1=2,5⋅10-4 mola
obliczam wartość doświadczaną WD (masa wodorotlenku sodu NaOH w próbce):
1 mol NaOH _ 40g
2,5⋅10-4 _ WD
WD=2,5⋅10-4⋅40=0,01g
obliczam wartość błędu bezwzględnego:
WD=0,01g
WT=0,012g
gdzie : WT - wartość teoretyczna WD - wartość doświadczalna
BB=WT-WD=0,012-0,01=0,002g
obliczam wartość błędu względnego:
BW= ![]()
=![]()
9)Wnioski:
Z przeprowadzonych pomiarów widać iż krzywa miareczkowania nie jest taka sama jak krzywa wzorcowa. Przypuszczamy iż takie wyniki przeprowadzonych pomiarów wynikają ze zbyt krótkiego czasu mieszania roztworu oraz z tego, że w wyniku pomyłki w pewnym momencie wykonywania doświadczenia zostało dodane 1 ml roztworu za dużo.
Z wykresu pierwszej pochodnej odczytaliśmy objętość titranta zużytą do miareczkowania w punkcie końcowym tj. 2,5 ml HCl , natomiast z obliczeń masa NaOH zawarta w próbce wynosi 0,01g a wartość podana przez prowadzącego wynosiła 0,012g. Tak więc błąd pomiarowy wynosił 0,2%.
10
Wyszukiwarka