STRUKTURA ELEKTRONOWA ATOMU, WIĄZANIA
Wskaż poprawne określenie liczby masowej:
A) masa atomowa pierwiastka wyrażona w atomowych jednostkach masy;
B) liczbę neutronów zawartych w jądrze atomu;
C) suma liczby protonów i liczby neutronów w jądrze danego atomu;
D).liczbę protonów w jądrze danego atomu.Liczba atomowa określa:
A) sumę protonów i elektronów;
B) liczbę protonów zawartych w jądrze;
C) sumę protonów i neutronów zawartych w jądrze;
D) liczbę neutronów zawartych w jądrze atomu.Liczba atomowa pewnego pierwiastka jest równa 33, natomiast liczba masowa 75. Liczba cząstek składowych atomu tego pierwiastka wynosi:
………………………………………………………………………………………………Ładunek jądra pierwiastka wynosi +25, a suma protonów, neutronów i elektronów wynosi 80. Liczba poszczególnych cząstek składowych tego pierwiastka jest równa:
………………………………………………………………………………………………Podaj, które z podanych informacji dotyczą izotopów:
I. mają różną liczbę masową, ale taką samą liczbę elektronów
II. mają różną liczbę masową, ale taką samą liczbę neutronów
III. mają taką samą liczbę masową, ale różną liczbę neutronów
IV. mają taką samą liczbę masową, ale różną liczbę protonów.
A) tylko I; B) I i II; C) tylko III; D) III i IV.Liczba protonów w atomie X jest równa liczbie neutronów w atomie Y. Spośród opisanych atomów wybierz parę, która spełnia podane warunki:
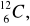
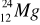
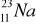
atom X………….., atom Y…………..Ułóż równania elektronowe wyjaśniające, w jaki sposób z atomów powstają jony:
Ca→Ca2+, Cl→Cl--
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………Wskaż poprawnie określone położenie w układzie okresowym pierwiastka, którego atom zawiera 12 protonów w jądrze:
A) okres 2, grupa 3; C) okres 3, grupa 12;
B) okres 3, grupa 2; D) okres 4, grupa 3.Masa atomowa węgla mC= 12u, a wyrażona w gramach to:
A) 1,09.10-24g; B) 1,09.10-23g C) 1,99.10-24g D) 1,99.10-23gOblicz masę cząsteczkową:
H3PO4 ………………………………………………………………………………………
………………………………………………………………………………………………
Ca(NO2)2 …………………………………………………………………….…………….
………………………………………………………………………………………..……
Na2CO3………………………………………………………………………………….…Podaj rozmieszczenie elektronów na powłokach następujących atomów:
8O ………………………………………………………………………………………
17Cl …………………………………………………………………………………………
30Zn ………………………………………………………………………………………..Pokreśl atomy, które są izotopami:
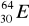
,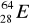
,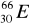
,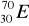
,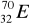
Wiązanie chemiczne, będące wynikiem uwspólnienia elektronów, występuje w cząsteczce opisanej wzorem:
A) KF; B) HBr; C) LiCl D) NaCl.Przyporządkuj podanym określeniom 1, 2, 3, 4, 5 symbole następujących pierwiastków:, sód, gal, wapń, chlor, beryl, jod.
1) znajduje się w piątym okresie …………………………………..
2) zawiera 3 elektrony walencyjne………………………………….
3) zawiera 4 protony ………………………………………………..
4) znajduje się w drugiej grupie ……………………………………
5) zawiera 7 elektronów walencyjnych……………………………...Narysuj wzory elektronowe następujących cząsteczek i określ rodzaje wiązań w nich występujących: K2O, HCl, Br2 MgS
Wskaż szereg zawierający tylko związki o wiązaniach kowalencyjnych:
A) Cl2 ,O2, HCl; C) MgCl2, HCl, CO2 ;
B) HCl, NaCl, O2 ; D), KF CO2, O2.Wskaż szereg, w którym wszystkie podane związki posiadają wiązanie jonowe:
A), F2 , NaF, MgCl2, C) KI, HI, NaF
B) NaF, MgCl2, KI, D) I2 , NH3 , MgCl2.Jakie są zastosowania pierwiastków promieniotwórczych?
………………………………………………………………………………………..……
………………………………………………………………………………………………
………………………………………………………………………………………..……
………………………………………………………………………………………………
………………………………………………………………………………………..……
………………………………………………………………………………………………
………………………………………………………………………………………..……
………………………………………………………………………………………………
………………………………………………………………………………………..……
………………………………………………………………………………………………
Wyszukiwarka
Podobne podstrony:
Rolnictwo gr A SPRAWDZIAN, do wykorzystania w szkole
Reakcje w roztworachgr A i B SPRAWDZIAN, do wykorzystania w szkole
Pochodne weglowodorow POWTÓRZENIE, do wykorzystania w szkole
Sprawdzian roczny kl 1, do wykorzystania w szkole
Litowce i fluorowce SPRAWDZIAN, do wykorzystania w szkole
Rolnictwo SPRAWDZIAN, do wykorzystania w szkole
Budowa atomów i prawa chemiczne SPRAWDZIAN, do wykorzystania w szkole
Jednofunnkcyjne pochodne weglowodorow SPRAWDZIAN, do wykorzystania w szkole
ZADANIA mole nie są trudne, do wykorzystania w szkole
Tajemnica krzyża - Misterium Wielkopostne do wykorzystania w szkole podstawowej i gimnazjum, Narrato
Oto przykłady zabaw logopedycznych do wykorzystania w domu(1), Logopedia
Wzór - Informacja o gotowości do nauki w szkole, Zespół pomocy psychologiczno-pedagogicznej
struktura w s.v. werder bremen, Materiały Szkoleniowe Łukasz, uefa b kurs 2013
53 242403 specjalista do spraw szkolen
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
WYKŁAD 5. Elektronowa struktura atomu, chomikowe, WYKŁADY z Chemii
ELEKTROUJEMNOŚĆ to dążność atomu do przyciągania do siebie elektronów
ocena opisowa kl. 3 do wykorzystania na świadectwo, Oligofrenopedagogika
ocena opisowa kl.3 do wykorzystania na świadectwa, OCENA OPISOWA, ocena opisowa
więcej podobnych podstron