WYKRYWANIE KATIONÓW I GRUPY
Ag+, Pb2+, Hg22+
Chlorki kationów nie rozpuszczają się w wodzie, i w rozcieńczonych kwasach.
Siarczki nie rozpuszczają się w rozcieńczonych kwasach.
Srebro Ag+
HCl i Cl- - kwas solny i rozpuszczalne chlorki (jony Cl-)(S - reakcja selektywna) wytrącają z obojętnych lub kwasowych roztworów zawierających jony Ag+ biały serowaty osad chlorku srebra AgCl
Ag+ + Cl- → AgCl↓
AgNO3 + NaCl → AgCl↓ + NaNO3
Osad AgCl jest nierozpuszczalny w wodzie i w rozcieńczonych kwasach, rozpuszcza się w stęż. HCl oraz w stęż. r-rach chlorków metali alkalicznych na gorąco
AgCl + Cl- → AgCl2-
AgCl2- + Cl- → AgCl3- …… AgCl4-
Osad AgCl rozpuszcza się w rozcieńczonym amoniaku, tworząc kompleksowy jon diamosrebrowy Ag(NH3)2+ (S)
AgCl↓ + 2(NH3·H2O) ↔ [Ag(NH3)2]Cl + 2H2O
Z tego r-ru po dodaniu HNO3 wytrąca się ponownie osad AgCl (S)
[Ag(NH3)2]Cl + 2HNO3 → AgCl↓ + 2NH4+ + 2NO3-
AgCl rozpuszcza się w KCN i Na2S2O3
AgCl↓ + 2CN- ↔ Ag(CN)2- + Cl-
AgCl↓ + 2S2O32- ↔ Ag(S2O3)23- + Cl-
KBr i KI bromek potasowy i jodek potasowy
Ag+ + Br- → AgBr↓ - słomkowy osad słabo rozp. w NH3+
AgNO3 + NaBr → AgBr↓ + NaNO3
Ag+ + l- → Agl↓ - żółtawy osad, bieleje ale nie rozp. się w NH3+
AgNO3 + Nal → Agl↓ + NaNO3
Osady AgBr i AgI rozp. się w KCN i Na2S2O3
AgBr↓ + 2CN- ↔ Ag(CN)2- + Br-
AgBr↓ + 2S2O32- ↔ Ag(S2O3)23- + Br-
K2CrO4 chromian potasowy wytrąca z r-rów zawierających jony Ag+ czerwonobrunatny osad chromianu srebra rozp. w rozc. CH3COOH i r-rze NH4OH
2Ag+ + CrO42- → Ag2CrO4↓
2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3
H2S i S2- siarkowodór i inne rozpuszczalne siarczki wytrącają z r-rów zawierających jony Ag+ czarny osad Ag2S
2Ag+ + S2- → Ag2S↓
2AgNO3 + Na2S → Ag2S↓ + 2Na2NO3
rozpuszczalny w rozc. HNO3 na gorąco i stęż. r-rze KCN
3 Ag2S↓ + 8HNO3 → 6AgNO3 + 2NO↑ + 3S↓ + 4H2O
3x Ag2S → 2Ag+ + S + 2e
2x NO3- + 4H+ + 3e → NO↑ + 2H2O
3 Ag2S↓ + 2NO3- + 8H+ → 6Ag+ + 2NO↑ + 3S↓ + 4H2O
Ag2S↓ + 4CN- → 2Ag(CN)2- + S2-
Ag2S jest jedynym siarczkiem wytrącającym się pod wpływem AKT na zimno; b. słabo rozpuszczającym się w wodzie.
NaOH lub KOH Jony OH- wytrącają brunatny osad tlenku srebra AgO nierozpuszczalny w nadmiarze odczynnika.
2 Ag+ + 2OH- → Ag2O↓ + H2O
Osad rozpuszcza się w NH4OH i w HNO3
Ag2O↓ + 4 NH4OH ↔ 2Ag(NH3)2+ + 2OH- + 3H2O
NH4OH amoniak wytrąca z roztworów zawierających jony Ag+ biały brunatniejący osad AgO, rozpuszczalny w nadmiarze odczynnika, z utworzeniem jonu kompleksowego.
2 Ag+ + 2OH- → Ag2O↓ + H2O
Ag2O↓ + 4 NH4OH ↔ 2Ag(NH3)2+ + 2OH- + 3H2O
Na2CO3 węglan sodowy - jony CO32- wytrącają z Ag+ biały osad węglanu srebra przechodzący w żółtawy od powstającego Ag2O
2 Ag+ + CO32- → Ag2CO3
Ag2CO3 → Ag2O↓ + CO2↑
Metale Zn0, Cu0 redukują jony srebrowe Ag+. Srebro wypada z osadu w postaci czarnego osadu srebra metalicznego Ag0. Metale przechodzą jednocześnie do roztworu.
2Ag+ + Zn0 → 2Ag0↓ + Zn2+
2Ag+ + Cu0 → 2Ag0↓ + Cu2+
Rtęć Hg22+
HCl i Cl- - kwas solny i rozpuszczalne chlorki (jony Cl-) wytrącają z roztworów zawierających jony Hg22+ biały osad chlorku rtęciawego Hg2Cl2 - kalomel
Hg22+ + 2Cl- → Hg2Cl2↓
Osad Hg2Cl2 jest nierozpuszczalny w gorącej wodzie i zimnych rozcieńczonych kwasach. Rozpuszcza się w wodzie królewskiej (1 obj. stęż HNO3 i 3 obj. stęż. HCl) i w stężonych roztworach chlorków metali alkalicznych (np. NaCl) z wytworzeniem jonu kompleksowego HgCl42-
Hg2Cl2 + 2Cl- → 2 HgCl42-
Pod wpływem działania amoniaku na Hg2Cl2 powstaje HgNH2Cl biały aminochlorek rtęciawy i rtęć metaliczna (dlatego osad czernieje). Jest to charakterystyczne dla jonów rtęciawych (S) a nie dotyczy rtęciowych.
Hg2Cl2↓ + 2(NH3·H2O) ↔ HgNH2Cl↓ + Hg0↓ + NH4+ + Cl- + 2H2O
W tej reakcji jeden atom rtęci z +1 stopnia utlenienia w Hg2Cl2 redukuje się do Hg0, drugi atom rtęci z +1 stopnia utlenia się do +2 stopnia utlenienia w HgNH2Cl. Zachodzi jednocześnie reakcja utleniania i redukcji mimo że dodawany odczynnik - amoniak nie jest w tej reakcji ani utleniaczem ani reduktorem. W/wym. reakcja to przykład samoredukcji i samoulteniania = dysproporcjonowania.
2HgNH2Cl↓ + 6Cl- → 2HgCl42- + N2↑ + 4H+ + 6e
2x NO3- + 4H+ + 3e → NO↑ +2H2O
2 HgNH2Cl↓ + 6Cl- + 2NO3- + 4H+ → 2HgCl42- N2↑ + 2NO↑ + 4H2O
3x Hg0 + 4Cl- ↔ HgCl42- + 2e
2x NO3- + 4H+ + 3e → NO↑ + 2H2O
3Hg0 + 2NO3- + 8H+ + 12Cl- → 3HgCl42- + 2NO↑ + 4H2O
KI jodek potasowy Jony I- wytrącają z roztworów zawierających jony Hg22+ żółtawozielony osad jodku rtęciawego Hg2I2
Hg22+ + 2I- → Hg2I2↓
rozpuszczalny w nadmiarze odczynnika z wydzieleniem metalicznej rtęci i wytworzeniem bezbarwnego jonu kompleksowego - jodortęcianowego HgI42-
Hg2I2↓ + 2I- → HgI42- + Hg0
Jest to przykład samoutlenienia i samoredukcji.
K2CrO4 chromian potasowy wytrąca na zimno z r-rów zawierających jony Hg22+ brunatny osad chromianu rtęciawego Hg2CrO4 przechodzący w krystaliczny czerwony osad w czasie ogrzewania i gotowania
Hg22+ + CrO42- → Hg2CrO4↓
H2S i S2- siarkowodór i inne rozpuszczalne siarczki wytrącają z r-rów zawierających jony Hg22+ czarny osad siarczku rtęciowego HgS z wydzieleniem metalicznej rtęci.
Hg22+ + S2- → Hg2S↓ → HgS↓ + Hg0↓
Siarczek rtęciowy b.słabo rozpuszcza się w wodzie i w rozcieńczonych kwasach. Rozpuszcza się w wodzie królewskiej.
3x HgS↓ + 4Cl- → HgCl42- + S↓ + 2e
2x NO3- + 4H+ + 3e → NO↑ + 2H2O
3 HgS↓ + 12Cl- + 2NO3- + 8H+ → 3HgCl42- + 2NO↑ + 3S↓ + 4H2O
NaOH lub KOH Jony OH- wytrącają czarny osad tlenku rtęciawego Hg2O nierozp. w nadmiarze odczynnika.
Hg22+ + 2OH- → Hg2O↓ + H2O → HgO + Hg0 + H2O
NH4OH amoniak wytrąca czarny osad (biała aminortęciowa sól OHg2NH2NO3 i rtęć metaliczna - dlatego osad czernieje).
2Hg2(NO3)2 + 4NH4OH → 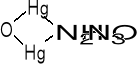
+ 2Hg↓ + 3NH4NO3 + 3H2O
SnCl2 chlorek cynawy powoduje szybkie czernienie białego kalomelu a wskutek redukcji do metalicznej rtęci.
Hg2Cl2↓ + Sn2+ + 4Cl- → 2Hg↓ + SnCl62-
Ołów Pb2+
HCl i Cl- - kwas solny i rozpuszczalne chlorki (jony Cl-)
wytrącają z roztworów zawierających jony Pb2+ biały krystaliczny osad chlorku ołowiawego PbCl2 - który tworzy się w zimnym i niezbyt rozcieńczonym roztworze.
Pb2+ + 2Cl- → PbCl2↓
Osad jest rozpuszczalny w gorącej wodzie. Po oziębieniu wytrąca się w postaci igieł. Jest rozpuszczalny w stężonym HCl z wytworzeniem jonów kompleksowych
PbCl2↓ + Cl- → PbCl3-
PbCl2↓ + 2Cl- → PbCl42-
Rozcieńczając roztwór jonów kompleksowych ponownie wytrąca się osad PbCl2
KI jodek potasowy Jony I- wytrącają z roztworów zawierających jony Pb2+ żółty osad jodku ołowiowego
Pb2+ + 2I- → PbI2↓
rozpuszczalny w nadmiarze odczynnika. W czasie ogrzewania PbI2 rozpuszcza się, a po ochłodzeniu wypada osad w postaci błyszczących blaszek.
PbI2↓ + 2I- ↔ PbI42-
K2CrO4 chromian potasowy wytrąca na zimno z roztworów zawierających jony Pb2+ brunatny osad chromianu ołowiowego nierozpuszczalny w kwasie octowym CH3COOH i w roztworze amoniaku NH4OH, rozpuszczalny w wodorotlenkach z utworzeniem ołowinu oraz w kwasie azotowym.
Pb2+ + CrO42- → PbCrO4↓
PbCrO4↓ + 4OH- → Pb(OH)42- + CrO42-
Z dwuchromianem potasowym wydziela się jednocześnie wolny kwas, który częściowo rozpuszcza osad
2Pb2+ + Cr2O72- + H2O → 2PbCrO4↓ + 2H+
Dlatego też reakcja z chromianem potasowym jest czulsza.
H2S i S2- siarkowodór i inne rozpuszczalne siarczki wytrącają z r-rów zawierających jony Pb2+ czarny osad siarczku ołowiowego PbS. Z roztworów o dużym stężeniu kwasu solnego siarkowodór albo nie wytrąca osadu PbS, albo tworzy czerwony osad siarkochlorku ołowiowego Pb2SCl2, który stopniowo przy rozcieńczaniu roztworu i przepuszczaniu H2S przechodzi w PbS.
Pb2+ + S2- → PbS↓
Siarczek ołowiowy jest rozpuszczalny w rozcieńczonym HNO3 z wydzieleniem siarki.
3x PbS → Pb2+ + S↓ + 2e
2x NO3- + 4H+ + 3e → NO↑ + 2H2O
3 PbS + 2NO3- + 8H+ → 3Pb2+ + 2NO↑ + 3S↓ + 4H2O
NaOH lub KOH Jony OH- wytrącają z roztworów zawierających jony Pb2+ biały osad amfoterycznego wodorotlenku ołowiowego Pb(OH)2 rozp. w nadmiarze odczynnika.
Pb2+ + 2OH- → Pb(OH)2↓
Pb(OH)2 + 2OH- → Pb(OH)42-
NH4OH amoniak wytrąca biały osad mieszaniny wodorotlenku i zasadowej soli nierozpuszczalnej w nadmiarze odczynnika. W obecności kwasów organicznych (kwas octowy, winowy) i wobec dużego stężenia soli amonowych osad nie wypada.
H2SO4 Kwas siarkowy i rozpuszczalne siarczany Jony SO42- wytrącają z roztworów zawierających jony Pb2+ biały osad siarczanu ołowiowego PbSO4 nierozpuszczalny w wodzie, rozpuszczalny w stężonym kwasie siarkowym, w stężonym roztworze octanu amonowego i winianu amonowego.
Pb2+ + SO42- → PbSO4↓
PbSO4↓ + CH3COO- → Pb(CH3COO)+ + SO42-
Jon Pb(CH3COO)+ jest trwały w obecności nadmiaru jonów CH3COO-.
Siarczan ołowiowy jest rozpuszczalny w stężonych zasadach przy podgrzaniu tworząc ołowin.
PbSO4↓ + 4OH- → Pb(OH)42- + SO42-
Przy zakwaszeniu osad wytrąca się ponownie.
Na2SO3 Siarczyn sodowy Wytrąca biały trudno rozpuszczalny osad PbSO3. Reakcję tą zaproponowano do badania wody na obecność jonów ołowiu Pb2+. Dodana taka sama objętość 2% świeżo przygotowanego odczynnika Na2SO3 powoduje powstanie białego zmętnienia PbSO3. Obecne w roztworze jony Cu2+, Fe2+, Fe3+, Al3+, Mg2+ i Ca2+ w tych warunkach nie dają osadu ani zmętnienia.
Pb2+ + SO32- → PbSO3
Wyszukiwarka
Podobne podstrony:
WYKRYWANIE KATIONÓW II GRUPY, OGRODNICTWO UP LUBLIN, CHEMIA
Podział materiału glebowego na frakcje i grupy granulo metryczne, OGRODNICTWO UP LUBLIN, GLEBOZNAWST
Gerbera nakolosanotatki 13-01-2014, OGRODNICTWO UP LUBLIN, ROŚLINY OZDOBNE, ozdobne II semestr
przech-sciagi, OGRODNICTWO UP LUBLIN, PRZECHOWALNICTWO
eko4, OGRODNICTWO UP LUBLIN, EKOLOGIA
Zielarstwo - wyk-ad 6 - 16.11.2010, OGRODNICTWO UP LUBLIN (buka), Semestr III, ZIELARSTWO
Ekonomia- wszystkie wykłady i ćwiczenia- ściaga, OGRODNICTWO UP LUBLIN, EKONOMIA
Sciagi warzywa, OGRODNICTWO UP LUBLIN (buka), Semestr III, WARZYWNICTWO OGÓLNE
Doniczki test, OGRODNICTWO UP LUBLIN, ROŚLINY OZDOBNE, ozdobne II semestr
zestaw 6 biochemia, OGRODNICTWO UP LUBLIN, BIOCHEMIA, zestawy
botanika pytania, OGRODNICTWO UP LUBLIN, BOTANIKA
GLEBOZNAWSTWO - wykład 7 - 23.11.2009r, OGRODNICTWO UP LUBLIN, GLEBOZNAWSTWO, wykłady
szkółkarstwo 3 kolokwium, OGRODNICTWO UP LUBLIN (buka), Semestr III, SZKÓŁKARSTWO
Palmy, OGRODNICTWO UP LUBLIN, ROŚLINY OZDOBNE, ozdobne II semestr
BOTANIKA - wyklad 4 - 27.10.2009, OGRODNICTWO UP LUBLIN, BOTANIKA, wykłady
Szkodniki jabłoni. Ł.Krzywicki P.Koralewski., OGRODNICTWO UP LUBLIN, FITOFAGI DRZEW I KRZEWÓW
GLEBOZNAWSTWO - wykład 5 - 09.11.2009, OGRODNICTWO UP LUBLIN, GLEBOZNAWSTWO, wykłady
Zestawy z biochemie co były na egzamnie, OGRODNICTWO UP LUBLIN, BIOCHEMIA
więcej podobnych podstron