Nr i tytuł ćwiczenia:
Wyznaczanie współczynnika podziału kwasu octowego w układzie dwóch niemieszających się cieczy
|
|||||
Imię i nazwisko osoby prowadzącej ćwiczenia: dr inż. Bożena Parczewska-Plesnar |
|||||
Data wykonania ćwiczenia |
Godz. |
Nr grupy studenckiej |
Zespół |
Nazwiska osób wykonujących ćw. |
Pkt za spr |
11.05.2010 |
8:00 |
8 |
J |
Aleksandra Puszcz Agnieszka Różańska Małgorzata Zioło |
|
Uwagi prowadzącego: |
|
||||
WSTĘP TEORETYCZNY
Prawo podziału Nernsta.
Treść tego prawa brzmi: „Jeżeli do układu złożonego z dwóch praktycznie niemieszających się cieczy wprowadzimy trzeci składnik, rozpuszczający się w obu cieczach, to w wyniku ustalenia się stanu równowagi stosunek stężeń wprowadzonej substancji w tych rozpuszczalnikach jest wielkością stałą w danej temperaturze, niezależną od ilości substancji wprowadzonej.”
![]()
Modyfikacje prawa w przypadku substancji ulegających asocjacji lub dysocjacji w jednej z faz.
Jeżeli substancja rozpuszczona, np. kwas benzoesowy, ulega w rozpuszczalniku organicznym (np. w benzenie) częściowo asocjacji, to współczynnik podziału jest miarą efektu sumarycznego: podziału między obie fazy cząsteczek niezasocjowanych i zasocjowanych.
Kwas benzoesowy tworzy w benzenie w znacznej części cząsteczki podwójne (dimery) - ustala się równowaga:
![]()
2 C6H5COOH (C6H5COOH)2
Stała równowagi procesu dimeryzacji jest wyrażona następującym wzorem:
![]()
gdzie:
c2 - stężenie dimerów kwasu benzoesowego
c1 - stężenie monomerów (cząsteczek pojedynczych) kwasu benzoesowego
K2 - stała dimeryzacji
Jeżeli przyjmiemy, że co = c1 + 2c2, gdzie co - stężenie ogólne kwasu w benzenie, to:
![]()
gdzie: k - stężeniowy współczynnik podziału.
Jeżeli przyjmiemy, że c1/cw = k1, gdzie k1 jest współczynnikiem podziału monomerów, równanie sprowadza się do postaci:
k = k1 + 2K2k12cw.
O wiele prostsze jest uwzględnienie we wzorze na współczynnik podziału procesu dysocjacji cząsteczek substancji na jony w fazie wodnej. Współczynnik podziału jest wtedy stosunkiem stężenia substancji w fazie organicznej do stężenia niezdysocjowanych cząsteczek w fazie wodnej.
Jeżeli do układu dwóch niemieszających się cieczy (np. benzen-woda) wprowadzimy kwas ulegający w wodzie częściowo dysocjacji, to ustala się równowaga opisywana za pomocą stałej dysocjacji:
![]()
którą możemy zapisać również:
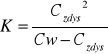
Po przekształceniach otrzymujemy wzór na stężenie cząsteczek zdysocjowanych:
![]()
i wzór na stężenie cząsteczek niezdysocjowanych:
![]()
.
Zastosowanie prawa podziału Nernsta:
Badanie wielu złożonych równowag chemicznych w roztworach, często trudno dostępnych dla badań innymi metodami.
Znalezienie najlepszych warunków ekstrakcji różnych substancji za pomocą odpowiednio dobranych rozpuszczalników.
Wykorzystanie w ekstrakcji frakcjonowanej, chromatografii cienkowarstwowej i chromatografii gazowej.
CEL ĆWICZENIA
Poznanie metody wyznaczania współczynnika podziału substancji między dwie niemieszające się ciecze.
WYKONANIE ĆWICZENIA
1. Oznaczenie dokładnego stężenia kwasu octowego w roztworach wodnych.
Do pięciu ponumerowanych kolb stożkowych odmierzyć kolejno pipetą po 2 cm3 roztworów kwasu octowego o podanych stężeniach. Miareczkować mianowanym roztworem wodorotlenku sodu wobec fenoloftaleiny. Odmierzyć stężenia roztworów kwasu octowego według wzoru:
C kwasu = c zasady V zasady/ V kwasu
2. Wyznaczenie współczynników podziału kwasu octowego miedzy rozpuszczalnik
organiczny i wodę.
a. Do pięciu kolb stożkowych z korkami szlifowymi odmierzyć kolejno pipetą po 20 cm3 roztworów kwasu octowego, których stężenia zostały wcześniej obliczone. Do każdej kolby dodać pipetą po 20 cm3 rozpuszczalnika organicznego. Zamknąć kolby, wytrząsać przez około 20 minut. Po upływie tego czasu i po rozdzieleniu się mieszaniny pobrać z każdej kolby po 2cm3 warstwy wodnej (dolna) i miareczkować tym samym co poprzednio roztworem wodorotlenku sodu.
b. Obliczyć, według wzoru, stężenia kwasu octowego w fazie wodnej po ekstrakcji rozpuszczalnikiem organicznym. Objętości rozpuszczalnika organicznego i roztworów kwasu octowego użyte do ekstrakcji były jednakowe (podobnie jak objętości roztworów miareczkowanych przed ekstrakcją i po ekstrakcji) i w związku z tym stężenie kwasu octowego w roztworach wodnych przed ekstrakcją i po ekstrakcji.
Następnie obliczyć wartości współczynników podziału kwasu octowego między rozpuszczalnik organiczny i wodę według wzoru Nernsta. Wyniki zestawić w tabeli.
Narysować wykres zależności współczynnika podziału kwasu octowego k między rozpuszczalnik organiczny i wodę od stężenia kwasu octowego w fazie wodnej cw po ekstrakcji. Zinterpretować przebieg otrzymanej izotermy podziału. Ekstrapolując prostą do wartości cw = 0, odczytać wartość k1. Po znalezieniu wartości współczynnika kierunkowego prostej obliczyć wartość stałej dimeryzacji K2. Wyciągnąć wnioski.
Zestawienie wyników.
Numer roztworu |
ckwasu w roztworze wodnym przed ekstrakcją [mol * dm-3] |
ckwasu w roztworze wodnym po ekstrakcji [mol * dm-3] |
ckwasu w fazie organicznej [mol * dm-3] |
k |
1 |
0,2457 |
0,1906 |
0,0551 |
0,3069 |
2 |
0,4915 |
0,3761 |
0,1154 |
0,3487 |
3 |
0,7222 |
0,5517 |
0,1705 |
0,3680 |
4 |
0,9529 |
0,7272 |
0,2257 |
0,3888 |
5 |
1,2287 |
0,8977 |
0,3310 |
0,4655 |
Wartości współczynników podziału kwasu octowego między rozpuszczalnik organiczny i wodę według wzoru Nernsta:
k1 = c0/cw = 0,0551/0,1906 = 0,2891
k2 = 0,1154/0,3761 = 0,3086
k3 = 0,1705/0,5517 = 0,3090
k4 = 0,2257/0,7272 = 0,3104
k5 = 0,3310/0,8977 = 0,3687
k= k1 + 2 K2*k12*cw
y= ax + b
y = k
b = k1
a =(y2-y1)/(x2-x1)=(0,3561-0,2765)/(0,8977 mol*dm-3 - 0,1906 mol*dm-3) = 0,1126 mol*dm-3
K2 = a/2*k12 = 0,1126 mol*dm-3/0,2012 = 0,5596 mol*dm-3
Wnioski:
Zauważamy, że wykres zależności współczynnika podziału kwasu octowego k między rozpuszczalnik organiczny i wodę od stężenia kwasu octowego w fazie wodnej cw, po ekstrakcji w przypadku naszych pomiarów jest rosnący. Kolejne pomiary stężeń kwasu octowego w fazie wodnej, pokazują, że są one rosnące, co za tym idzie stała k która jest od tych stężeń zależna również jest dla kolejnych roztworów większa. Po znalezieniu wartości współczynnika kierunkowego a, który wyniósł: 0,1126 mol*dm-3 obliczyliśmy wartość stałej dimeryzacji K2, która wyniosła: 0,5596 mol*dm-3.
Wyszukiwarka
Podobne podstrony:
puszcz, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od oli, technologia, ch
WRL2474ch.fizyzcna 3poprawka 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II ro
fiz 62 poprawione, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawo
Obliczenia91, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kaski
sprawozdanienr41, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kaski
Wzór tabelki do sprawozdania, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, o
Opracowanie wynikow91, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kaski
sprawozdanie fizyczna71, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kas
Obliczenia91, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kaski
wyklady opakowania, Technologia Żywności, II ROK, Opakowania, magazynowanie i transport żywności
egzamin pytania, Technologia Żywności, II ROK, Maszynoznawstwo
ustny i pytania, Technologia Żywności, II ROK, Opakowania, magazynowanie i transport żywności
Podstawy zywienia, Technologia Żywności, II ROK, Podstawy żywienia
raport chem fiz 4, II rok od 4 piętro;), CHEMIA FIZYCZNA
więcej podobnych podstron