Imię i nazwisko |
Data |
Temat ćwiczenia |
Technologia chemiczna |
Magdalena Kazimierska Angelika Sobisiak |
14.03.2010r. |
Reakcje w układzie kwas-zasada |
Niestacjonarne I-go stopnia, semestr II |
Teoria Brønsteda - sformułowana przez Johannesa Brønsteda w 1923 teoria, w myśl której kwasem jest substancja mogąca odłączać ze swojej cząsteczki jony wodoru (protony), natomiast zasadą substancja, która protony przyłącza. Stąd kwas jest donorem protonu (protonodonorem), a zasada akceptorem protonu (protonoakceptorem). Kwas po odłączeniu protonu przechodzi w sprzężoną zasadę, tak samo zasada pobierając proton przechodzi w sprzężony kwas:
Ogólny zapis równowagi kwasowo-zasadowej wg teorii Brønsteda można przedstawić następująco:
kwas + zasada ⇌ sprzężona zasada + sprzężony kwas
HA + B ⇌ A- + HB+
Ponadto zgodnie z teorią Brønsteda podczas reakcji dwóch cząsteczek wody każda z nich może być zarówno donorem, jak i akceptorem protonu:
H2O + H2O ⇌ H3O+ + OH- - woda zachowuje się zarówno jak kwas, jak i zasada, czyli jest związkiem amfoterycznym (dokładniej - amfiprotycznym).
Iloczyn jonowy wody, iloczyn równowagowych stężeń jonów oksoniowych (H3O+) i hydroksylowych (OH-). W temperaturze 25oC iloczyn jonowy wody wynosi 10-14 mol/dm3, Stężenia obu rodzajów jonów w czystej wodzie są sobie równe i wynoszą 10-7mol/dm3. Ponieważ wartość iloczynu jonowego wody pozostaje stała w stałej temperaturze, wprowadzeniu do roztworu jonów oksoniowych towarzyszy zmniejszenie stężenia jonów hydroksylowych. Analogicznie - wzrost stężenia jonów hydroksylowych odbywa się kosztem zmniejszenia stężenia jonów oksoniowych. Wartość iloczynu jonowego wody można wyznaczyć za pomocą pomiaru przewodnictwa (pH).
[H+] ∙ [OH-] = const
10-7 ∙10-7 = 10-14 (mol/l)
Skala pH - ilościowa skala kwasowości i zasadowości roztworów wodnych związków chemicznych. Skala ta jest oparta na aktywności jonów hydroniowych [H3O+] w roztworach wodnych.
Tradycyjnie pH definiuje się jako:
pH = -log10[H3O+]
Współcześnie jednak nie jest to ścisła definicja tej wielkości.
Reakcja mocnego kwasu z mocną zasadą
H3O+ + OH- ---> 2H2O
Po zmieszaniu stechiometrycznych ilości mocnego kwasu i mocnej zasady otrzyma się formalnie roztwór soli oraz wodę. Sól która powstała w reakcji mocnego kwasu i mocnej zasady nie ulega hydrolizie. Odczyn roztworu jest obojętny (pH = 7)
Ogólne równanie reakcji słabego kwasu z mocną zasadą jest następujące;
HA + OH- ---> H2O + A-
Reakcja mocnego kwasu ze słabą zasadą Dla reakcji chemicznej w której uczestniczy stechiometryczne ilości reagentów, odczyn roztworu jest kwasowy (pH < 7) . Ogólne równanie reakcji chemicznej dla tego przypadku opisane jest równaniem.
H+ + MeOH ---> Me+ + 2H2O
gdzie MeOH oznacza słabą zasadę. Mało jest słabych zasad typu MeOH. Z znanych zasad należy tutaj wymienić zasady typu NH3. Równanie zobojętnienia dla tego typu zasady jest następujące; H+ + NH3 --->NH4+
Reakcja słabego kwasu ze słabą zasadą Równanie ogólne dla reakcji słabego kwasu i słabej zasady jest następujące.
HA + MeOH ---> Me+ + A- + H2O
Bufor - przeciwdziała zmianom stężenia jonów wodorowych w roztworze (stabilizuje pH) Do najważniejszych buforów należą:
bufor octanowy: CH3COOH, CH3COONa w zakresie pH = 3,5 - 6
bufor amonowy: NH3* H2O, NH4Cl w zakresie pH = 8 - 11
bufor fosforanowy: NaH2PO4, Na2HPO4 w zakresie pH = 5,5 - 8
bufor boranowy: H3BO3, Na2B4O7 w zakresie pH = 7 - 9
Wskaźniki kwasowo-zasadowe . Przebieg zobojętnienia kwasu przez zasadę lub odwrotnie obserwuje się wizualnie przez zastosowanie odpowiednio dobranego wskaźnika (indykatora), którego zmiana barwy wskazuje na zakończenie reakcji. .
Wskaźnikami są substancje ulegające przemianom lub modyfikacjom strukturalnym w pewnym obszarze stężenia jonów H+ (H3O+). Z przemianami tymi związana jest zmiana barwy wskaźnika. .
Aby dana substancja mogła być dobrym wskaźnikiem, musi spełniać następujące warunki;
zmiana barwy musi zachodzić ostro i zmieniona barwa musi kontrastować z pierwotną
zmiana barwy musi występować w wąskim zakresie zmian wartości pH, przy czym zakres ten musi obejmować stan kiedy reagenty występują w ilościach stechiometrycznych.
Na rysunku podano obszary pH odpowiadające przejściom barwnym kilku najczęściej używanych wskaźników.
Wskaźnik |
Zakres zmian barwy |
Barwa wskaźnika pH
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
|
Błękit tymolowy |
1,2 - 2,8 |
|
|
|
Oranż metylowy |
3,0 - 4,4 |
|
|
Błękit bromofenylowy |
3,0 - 4,6 |
|
|
Czerwień metylowa |
4,4 - 6,2 |
|
|
Lakmus |
5,0 - 8,0 |
|
|
Błękit bromotymolowy |
6,0 - 7,6 |
|
|
Błękit tymolowy |
8,0 - 9,6 |
|
|
|
Fenoloftaleina |
8,4 - 10,0 |
|
|
Krzywe miareczkowania:
punkt A podaje wartość pH na starcie miareczkowania
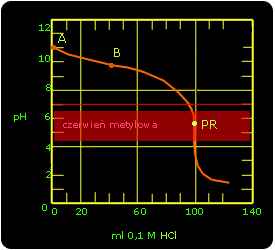
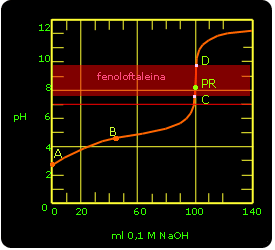
punkt B odpowiada połowicznemu zobojętnieniu
punkt PR (punkt równoważnikowy)
punkty C i D określają zakres zmian zabarwienia wskaźnika . kwasowo-zasadowego
Punkt równoważnikowy PR reakcji jest to moment, w którym doprowadzona ilość odczynnika miareczkującego jest równoważna chemicznie ilości składnika oznaczanego. Punkt końcowy miareczkowania (PK) - punkt, w którym za pomocą metod
instrumentalnych lub zmiany barwy wskaźnika można zaobserwować punkt
równoważnikowy (koniec miareczkowania). Punkt końcowy powinien pokrywać się z punktem równoważnikowym.
Wyniki ćwiczenia nr2:
przykład 1.4 - miareczkowanie słabego kwasu (0,1M CH
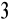
COOH) mocną zasadą (0,1M NaOH); użyty wskaźnik - fenoloftaleina
cm^3 |
pH |
barwa |
0 |
2,63 |
brak |
1 |
3,08 |
brak |
2 |
3,46 |
brak |
3 |
3,69 |
brak |
4 |
3,84 |
brak |
5 |
3,99 |
brak |
5,5 |
4,04 |
brak |
6 |
4,08 |
brak |
7 |
4,18 |
brak |
8 |
4,29 |
brak |
8,5 |
4,33 |
brak |
9 |
4,37 |
brak |
9,5 |
4,43 |
brak |
10 |
4,47 |
brak |
10,5 |
4,52 |
brak |
11 |
4,55 |
brak |
11,5 |
4,6 |
brak |
12 |
4,64 |
brak |
12,5 |
4,7 |
brak |
13 |
4,74 |
brak |
13,5 |
4,78 |
brak |
14,5 |
4,88 |
brak |
15,5 |
4,99 |
brak |
16,5 |
5,11 |
brak |
17,5 |
5,22 |
brak |
18,5 |
5,35 |
brak |
19,5 |
5,53 |
brak |
20,5 |
5,75 |
brak |
21,5 |
6,1 |
brak |
22 |
6,3 |
brak |
22,5 |
6,9 |
brak |
23 |
9,52 |
jasny malinowy |
23,5 |
11,1 |
malinowy |
25 |
12,25 |
malinowy |
26 |
12,54 |
malinowy |
28 |
12,82 |
malinowy |
30 |
12,97 |
malinowy |
32 |
13,08 |
malinowy |
34 |
13,16 |
malinowy |
36 |
13,21 |
malinowy |
38 |
13,25 |
malinowy |
40 |
13,29 |
malinowy |
42 |
13,32 |
malinowy |
44 |
13,34 |
malinowy |
46 |
13,36 |
malinowy |
48 |
13,39 |
malinowy |
50 |
13,42 |
malinowy |
A -punkt zobojętnienia
B -punkt nasycenia równoważnikowego
C -bufor
Miareczkowanie kwasu octowego zasadą NaOH
Na starcie miareczkowania i dla 0,1 molowego roztworu kwasu octowego pH = 2,63.
Do roztworu wprowadzamy 0,1 molowy roztwór NaOH, w roztworze zachodzi reakcja chemiczna zgodnie z równaniem.
CH3COOH + OH- ---> CH3COO- + H2O
Po wprowadzeniu do roztworu pewnej ilości zasady tworzy się sól i pozostaje nadmiar słabego kwasu. Tworzy się roztwór buforowy. Podczas dodawania kolejnych porcji roztworu NaOH pH zmienia się nieznacznie, aż do momentu w którym reagenty występują w ilościach stechiometrycznych a sól (pochodzi od słabego kwasu i mocnej zasady) która powstawała podczas miareczkowania nadaje roztworowi odczyn zasadowy. Wtedy zauważamy gwałtowną zmianę pH, jest to moment osiągnięcia punktu równoważnikowego (PR). Dalsze dodawanie nadmiaru zasady wywołuje już tylko nieznaczne zmiany pH.
W punkcie równoważnikowym (ilość dodanego wodorotlenku równoważy ilość kwasu octowego) otrzymamy roztwór będzie taki sam, jaki uzyskałoby się przez rozpuszczenie odpowiedniej ilości octanu sodowego (CH3COONa). Roztwór tej soli nie jest jednak obojętny (pH > 7), lecz alkaliczny, ponieważ jest to sól pochodząca od słabego kwasu i mocnej zasady. Dla tego przypadku najodpowiedniejszym wskaźnikiem jest fenoloftaleina, gdyż zmiana jej barwy zachodzi dokładnie w granicach skoku miareczkowania (pH =8,4-10).
przykład 1.5 - miareczkowanie słabej zasady (0,1M NH
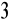
) mocnym kwasem
(0,1M HCl); użyty wskaźnik - oranż metylowy
cm³ |
pH |
barwa |
0 |
10,33 |
żółta |
1 |
10,2 |
żółta |
2 |
10,05 |
żółta |
3 |
9,88 |
żółta |
4 |
9,68 |
żółta |
5 |
9,51 |
żółta |
6 |
9,31 |
żółta |
6,5 |
9,17 |
żółta |
7 |
9,08 |
żółta |
7,5 |
8,87 |
żółta |
8 |
8,7 |
żółta |
8,5 |
8,41 |
żółta |
9 |
7,54 |
żółta |
9,5 |
6,97 |
żółta |
10 |
6,69 |
żółta |
10,5 |
6,39 |
żółta |
11 |
6,31 |
żółta |
11,5 |
6,07 |
żółta |
12 |
5,7 |
żółta |
12,5 |
4,88 |
żółta |
13 |
2,63 |
jasno różowa |
13,5 |
2,36 |
różowa |
14 |
2,18 |
różowa |
14,5 |
2,07 |
różowa |
15,5 |
1,89 |
różowa |
16,5 |
1,79 |
różowa |
18,5 |
1,67 |
różowa |
20,5 |
1,57 |
różowa |
22,5 |
1,52 |
różowa |
24,5 |
1,48 |
różowa |
26,5 |
1,44 |
różowa |
28,5 |
1,42 |
różowa |
30,5 |
1,4 |
różowa |
A- punkt zobojętnienia
B- punkt nasycenia równoważnikowego
C- bufor
Miareczkowanie słabej zasady amonowej mocnym kwasem solnym.
Na starcie miareczkowania i dla 0,1M roztworu NH![]()
pH=10,33. Do roztworu wprowadzamy 0,1M HCl, w roztworze zachodzi reakcja chemiczna zgodnie z równaniem:
NH![]()
OH + 2H![]()
---> NH![]()
+ H![]()
O
Po wprowadzeniu do roztworu pewnej ilości kwasu tworzy się sól i pozostaje nadmiar słabej zasady. Tworzy się roztwór buforowy. Podczas dodawania kolejnych porcji roztworu HCl pH zmienia się nieznacznie, aż do momentu w którym reagenty występują w ilościach stechiometrycznych, a sól (pochodzi od mocnego kwasu i słabej zasady) która powstała podczas miareczkowania nadaje roztworowi odczyn kwaśny. Wtedy zauważamy gwałtowną zmianę pH, jest to moment osiągnięcia punktu równoważnikowego (PR). Dalsze dodawanie nadmiaru kwasu wywołuje już tylko nieznaczne zmiany pH.
Osiągnięcie punktu równowagi miareczkowania jest określone przez punkt równoważnikowy dla pH < 7. Użyty w doświadczeniu oranż metylowy zmienia barwę w zakresie pH=3-4,4 W przedziale tym nie znajduje się granica skoku miareczkowania, dlatego też bardziej odpowiedni byłby czerwień metylowy pH=4,4-6,2.
B
A
B
A
C
C
Wyszukiwarka
Podobne podstrony:
teoria sportu, Trening ukierunkowany jest na forme sportowca
Definicja organizacji administracji publicznej sformułowan a przez prof, Ustrój administracji rządow
Teoria literatury, CO TO JEST TEORIA, J
Teoria literatury, CO TO JEST LIT., J
Kredyt jest stosunkiem ekonomicznym wynikającym ze świadczenia przez jedną ze stron
jezyk polski, Idziesz przez świat i życiu nadajesz kształt... -rozwiń myśl, „IDZIESZ PRZEZ ŚWI
Szósta i Siódma Księga Mojżesza Mojżesza sztuka magiczna i duchowa ze staroż hebr tłum przez Johann
Zagadnienia do egzaminu - TO AiR NS 2011-2012, Wykłady Teoria Obwodów
Zestaw zadań do ćwiczeń z Ekonomii matematycznej TEORIA KONSUMENTA NS
Zgodnie z teorią Brönsteda kation NH4, Towaroznawstwo SGGW, Rok I, Semestr I, Chemia nieorganiczna
Technikacieplnateoria pytania2015, pwsz ns - teoria sterowania, pwsz ns semestr IV
Zestaw zadań do ćwiczeń z Ekonomii matematycznej TEORIA KONSUMENTA NS
T2 teoria Gr1 NS
budownictwo - teoria, Współczynnik przenikania dla przegrody, Obliczenie współczynnika przenikania c
Poetyka sformułowana i immanentna jako przedmiot historii literatury, edukacja, teoria dzieła litera
Cecha podzielności -teoria, ćw, Cecha podzielności przez ………
więcej podobnych podstron