Model atomu wodoru Bohr’a
Fizyka sem II - ćwiczenia
Model atomu wodoru Bohr’a

Widmo promieniowania atomów i jonów (w przeciwieństwie do ciągłego widma
promieniowania ogrzanych ciał stałych) jest zawsze widmem liniowym składającym się z
promieniowania o dyskretnych długościach fal (częstości).
Ernest Rutherford (18711 - 1937) zaproponował jądrowy model atomu, który jest
podstawą teorii nam współczesnych. W modelu tym ładunek dodatni i prawie cała masa
atomu są uwięzione w jądrze (bardzo małej kulce o promieniu rzędu 10
-14
[m]). Elektrony
krążą
wokół
jądra
w
objętości
o
promieniu
rzędu
10
-10
[m].
Niels Bohr (1913) uniknął tej trudności zakładając, że atom wodoru, podobnie jak
oscylatory Plancka, może znajdować się jedynie w pewnych ściśle określonych stanach
stacjonarnych, w których nie wypromieniowuje energii. Wypromieniowanie następuje
tylko wtedy, gdy atom przechodzi z jednego stanu o energii E
w
, do innego stanu o niższej
energii E
n
. Można to zapisać w postaci:
n
w
E
E
h
−
=
ν
(1)
gdzie
ν
h
oznacza kwant energii uniesiony przez foton, który jest w czasie przejścia
wypromieniowany z atomu.

Powtórzmy jego rozważania. Załóżmy, że elektron w atomie wodoru porusza się po
kołowych orbitach o promieniu r ze środkiem w miejscu gdzie znajduje się jądro. Zakładamy,
ż
e jądro (które jest pojedynczym protonem) jest tak ciężkie, że środek masy układu pokrywa
się ze środkiem protonu. Obliczmy energię takiego atomu. Korzystając z II zasady Newtona
dla ruchu elektronu, gdzie siłę działającą na elektron wyznaczamy z prawa Coulomba, mamy
kolejno:
a
m
F
e
=
albo
v
Ze
2
2
r
v
m
r
Ze
e
o
2
2
2
4
=
πε
(2)
gdzie: e - ładunek elektronu (protonu), m - masa elektronu, v - jego prędkość liniowa w
jednostajnym ruchu po orbicie , a - przyspieszenie dośrodkowe, F - siła jaką jądro przyciąga
elektron,
ε
ο
- przenikalność elektryczna próżni:
[
]
o
o
k
C
m
N
=
=
2
2
9
/
*
10
*
0
,
9
4
1
πε
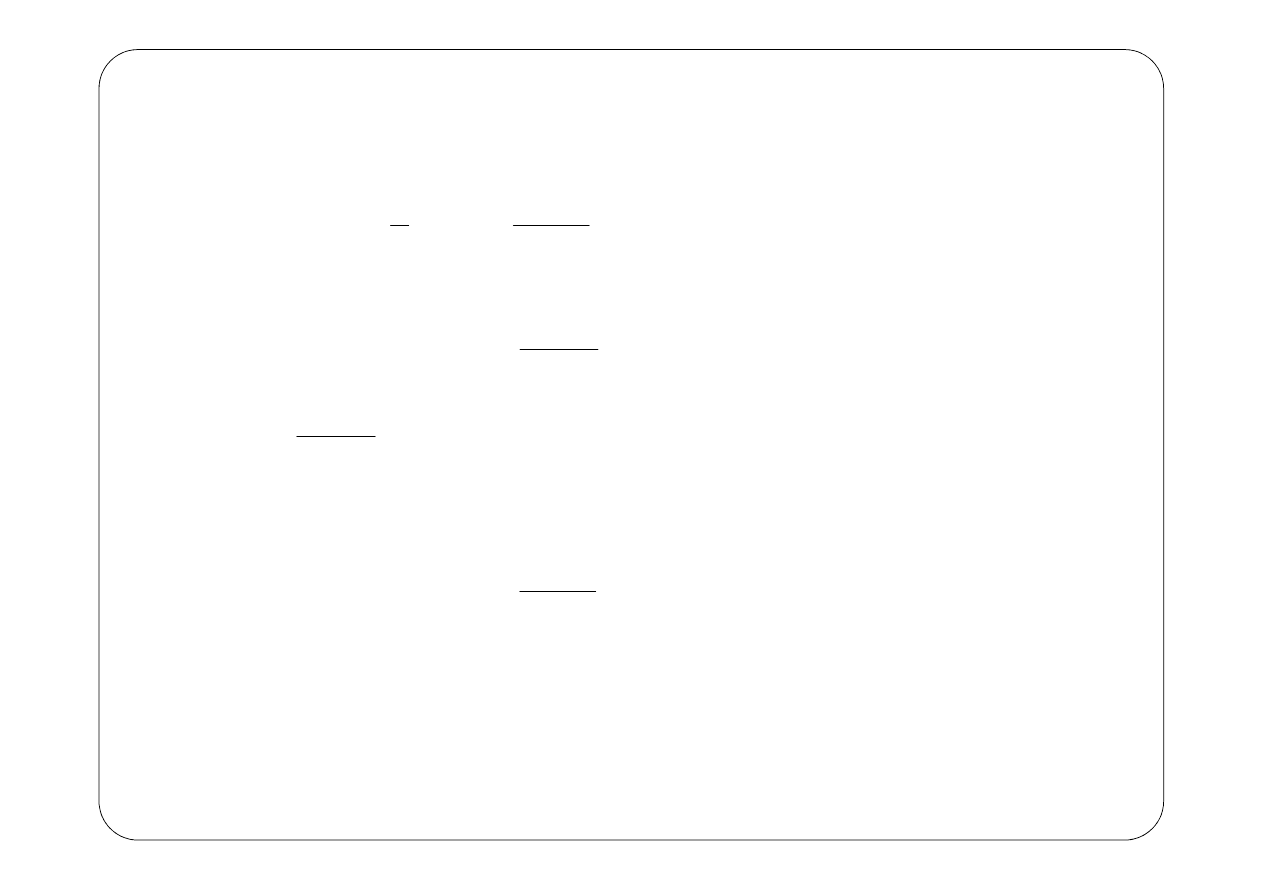
Na podstawie wyrażenia (2) łatwo wyliczyć energię kinetyczną elektronu
r
Ze
v
m
K
o
e
πε
8
2
1
2
2
=
=
(3)
Energia potencjalna układu proton - elektron dane jest równaniem
( )
r
Ze
e
V
U
o
πε
4
2
−
=
−
=
(4)
gdzie
r
Ze
V
πε
4
=
- oznacza potencjał pola elektrycznego wytworzonego przez proton
gdzie
r
V
o
πε
4
=
- oznacza potencjał pola elektrycznego wytworzonego przez proton
(ładunek punktowy) w odległości równej promieniowi orbity elektronu.
Całkowita energia elektronu jest równa:
r
Ze
U
K
E
o
πε
8
2
−
=
+
=
(5)
Stwierdzamy przede wszystkim, że całkowita energia elektronu związanego w
atomie przyjmuje wartości ujemne. Widać też, że energia jest funkcją promienia orbity.
Dlatego problem kwantowania energii sprowadza się do problemu kwantowania
promienia r.
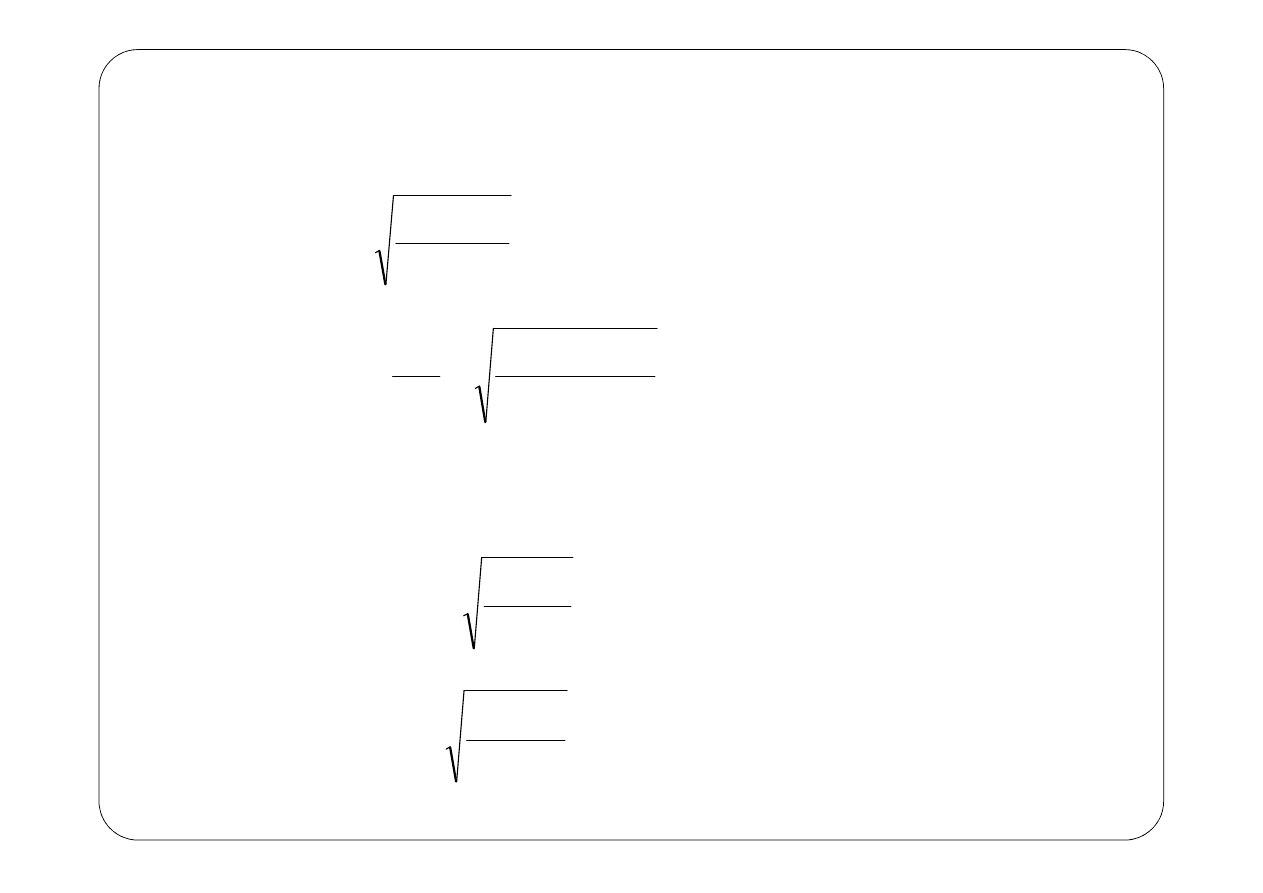
Znając promień można wyznaczyć wszystkie własności orbity:
-
prędkość liniowa elektronu:
r
m
Ze
v
e
o
πε
4
2
=
(6)
-
częstość obrotów
3
3
2
16
2
r
m
Ze
r
v
e
o
o
ε
π
π
ν
=
=
(7)
-
pęd elektronu
r
e
Zm
v
m
p
o
e
e
πε
4
2
=
=
(8)
-
moment pędu
o
e
r
e
Zm
pr
L
πε
4
2
=
=
(9)

Bohr wysunął hipotezę, że kwantyzacja parametrów orbitali jest najprostsza, jeżeli
zastosować ją do momentu pędu i założyć, że ta może przyjmować jedynie wartości
określone równaniem:
π
2
h
n
L
=
, n = 1, 2, 3, . . .
(10)
gdzie h oznacza stałą Plancka, n - liczbę kwantową.
Dla promienia otrzymuje się teraz wyrażenie
.
.
.
.
3,
2,
1,
,
*
2
2
2
=
=
n
h
n
r
o
π
ε
(11)
.
.
.
.
3,
2,
1,
,
*
2
=
=
n
e
m
n
r
e
π
(11)
a dla energii całkowitej elektronu w atomie wodoru
.
.
.
3,
2,
1,
,
8
2
2
4
2
=
−
=
n
n
h
e
m
Z
E
o
e
ε
(12)
Ostatni wzór dostarcza bezpośrednio wartości energii dozwolonych stanów
stacjonarnych.

Ze wzorów (1) i (12) otrzymujemy teoretyczny wzór dla częstości widmowych
wodoru
−
=
2
2
3
2
2
4
1
1
8
w
n
o
e
n
n
h
Z
e
m
ε
ν
(13)
Odpowiednie długości fali można łatwo znaleźć ze wzoru:
ν
λ
c
=
Można teraz sformułować wniosek:
Można teraz sformułować wniosek:
Energia elektronu związanego w atomie jest skwantowana
i przyjmuje ujemne wartości.
Poszczególne wartości liczby n w równaniu (12) określają poziomy lub inaczej
stany energetyczne elektronu w atomie. Na rysunku 1 przedstawiono wykres
poziomów energetycznych dla atomu wodoru:
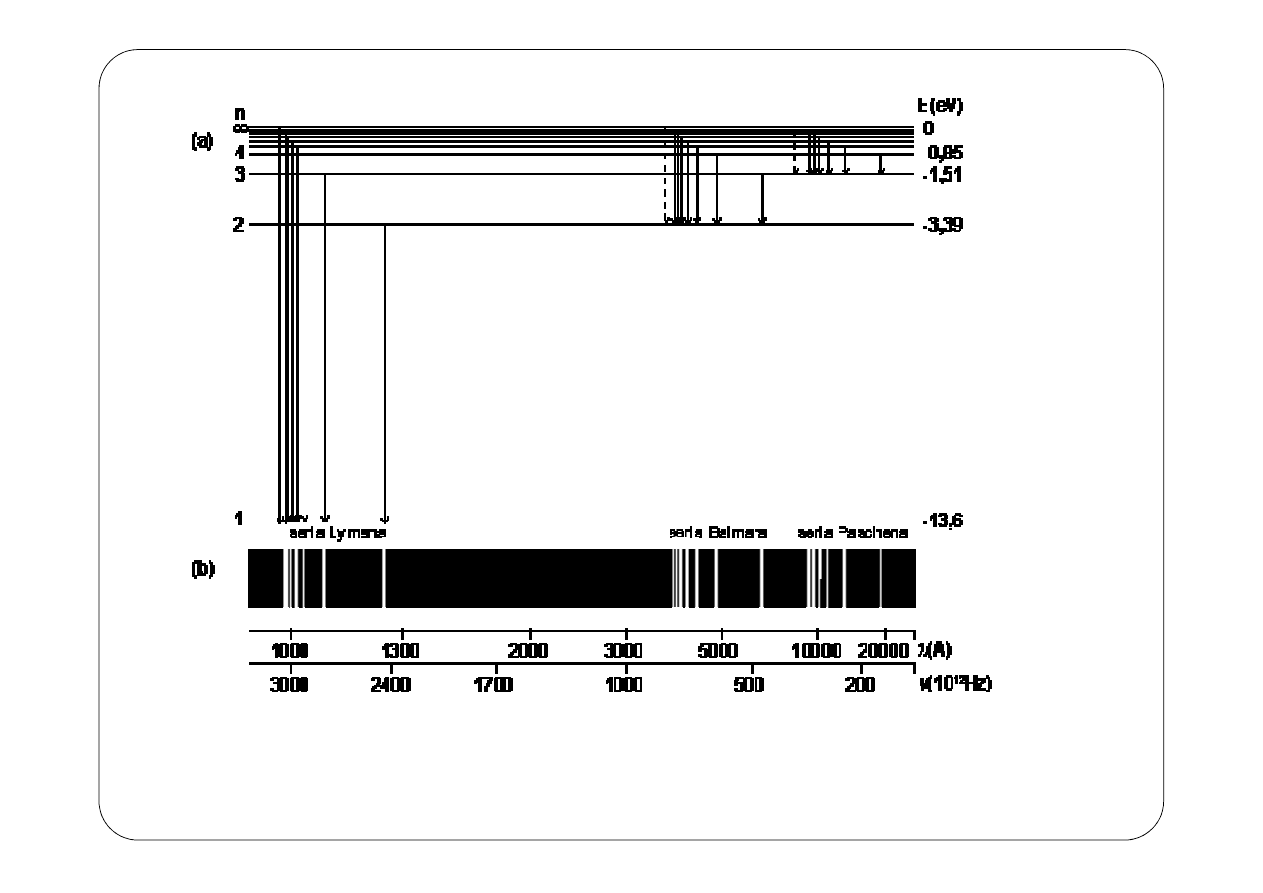
Rys. 1. Poziomy energetyczne dla atomu wodoru

Zad. 1.
Wzbudzony atom wodoru powraca do stanu podstawowego wypromieniowując
kolejno dwa kwanty promieniowania o długości fali
]
[
10
*
4051
9
1
m
−
=
λ
i
]
[
10
*
5
,
972
10
2
m
−
=
λ
. Określić energię stanu wzbudzonego i odpowiadającą mu
liczbę kwantową n.
Zad. 2.
Spoczywający atom wodoru wyemitował foton odpowiadający głównej linii serii
Lymana. Obliczyć prędkość jaką uzyskał atom w wyniku emisji.
Zad. 3.
Podczas jednego z przejść elektronu w atomie wodoru z jednego poziomu
stacjonarnego na drugi nastąpiło wypromieniowanie kwantu światła o częstotliwości
1
14
10
*
57
,
4
−
=
s
ν
. Wyznaczyć, o jaką wielkość zmieniła się energia elektronu w
atomie na koszt tego promieniowania.
Zad. 4.
Zgodnie z teorią Bohra promień pierwszej orbity elektronu w atomie wodoru
wynosi R = 0,53*10
-10
m. Wyznaczyć prędkość liniową i kątową ruchu elektronu po
orbicie.

Zad. 5.
Wyznaczyć promień a
o
pierwszej orbity borowskiej i prędkość v elektronu na tejże
orbicie. Jakie jest natężenie pola elektrycznego na tej orbicie?
Zad. 6.
Zgodnie z wyobrażeniami elektrodynamiki klasycznej moc promieniowania
wysyłanego przez elektron poruszający się z przyspieszeniem a wynosi:
2
2
2
4
2
c
a
e
N
o
πε
=
Oszacować czas życia jonu He
+
, przyjmując, że elektron porusza się jednostajnie po
orbicie kołowej o promieniu początkowym 10
-10
m.
orbicie kołowej o promieniu początkowym 10 m.
Zad. 7.
Wyznaczyć częstotliwość światła wysyłanego przez jon wodoropodobny przy
przejściu z poziomu o głównej liczbie kwantowej
µµµµ
do stanu, w którym promień orbity
jest k razy mniejszy.
Zad. 8.
Wyznaczyć długość fali odpowiadającej granicy Balmera.
Zad. 9.
Obliczyć pierwszy potencjał wzbudzenia wodoru.
Wyszukiwarka
Podobne podstrony:
(Fizyka II efekt fotoelektryczny [tryb zgodności])
(Fizyka ćwiczenia Bryła sztywna [tryb zgodności])
(Fizyka cwiczenia Dynamika pm [tryb zgodnosci])id (2)
(Fizyka II elektromagnetyzm [tryb zgodnosc
(Fizyka II jądrowa [tryb zgodności])id 1321
(Fizyka II, jądrowa [tryb zgodności])
(Fizyka II elektromagnetyzm [tryb zgodnosc
(Fizyka II Termodynamika [tryb zgodności])
(Fizyka II Ciało doskonale czarne [tryb zgodności])
(Fizyka II elektrostatyka [tryb zgodności])
(Fizyka ćwiczenia Drgania [tryb zgodności])
dyrektorzy mod II [tryb zgodności]
23 fizyka jadrowa [tryb zgodnos Nieznany
fizyka jadrowa zast [tryb zgodności]
Bazy Danych cz II [tryb zgodnos Nieznany (2)
więcej podobnych podstron