
48
10. ZALEśNOŚĆ STAŁEJ SZYBKOŚCI REAKCJI OD TEMPERATURY
WSTĘP
Szybkość reakcji drugiego rzędu:
A + B
→
C
(10.1)
zależy od stężenia substratów A oraz B
v = k’[A][B]
(10.2)
Gdy jeden z reagentów jest w dużym nadmiarze (np. A), jego stężenie w czasie
reakcji praktycznie się nie zmienia, czyli [A] = const., można więc włączyć
wartość [A] do stałej szybkości:
v = k[B] gdzie k = k’[A]
(10.3)
Reakcje tego typu nazywa się reakcjami pseudopierwszorzędowymi,
posiadającymi rozwiązanie takie jak reakcje pierwszorzędowe:
ln
[B]
[B]
o
= ⋅
k t
(10.4)
gdzie [B]
o
oznacza początkowe stężenie substratu B.
Reakcją omawianego typu jest reakcja chlorku kwasowego z alkoholem, gdy
alkohol metylowy jest w nadmiarze w stosunku do chlorku benzoilu:
RCOCl + ROH
→
RCOOR + HCl
(10.5)
Przebieg tego typu reakcji można wygodnie śledzić przez pomiar przewodnictwa
elektrycznego G
el
(lub oporu R) roztworu w czasie trwania procesu, które jest z
dobrym przybliżeniem proporcjonalne do ilości ładunków, czyli również do
stężenia HCl:
G
el
=
α
[HCl]
(10.6)
Stężenie substratu, [B] = [RCOCl], równe jest w danej chwili trwania procesu:
[B] = [HCl]
∞
- [HCl]
(10.7)
gdzie [HCl]
∞
oznacza stężenie HCl w chwili, gdy cała ilość chlorku kwasowego
przereaguje, czyli po zakończeniu reakcji.
Równania (10.6) oraz (10.7) prowadzą do zależności:
[B] =
α
(G
∞
- G)
(10.8)
49
Wobec tego równanie kinetyczne (11.4) przyjmuje postać:
ln
G
G
G
k t
∞
∞
−
= ⋅
(10.9)
Gdy zmiany przewodnictwa zapisywane są na rejestratorze xy lub za pomocą
danych cyfrowych na wyjściu przetwornika analogowo-cyfrowego (miernik
Metex, podłączony do PC), zależność przewodnictwa od czasu przedstawia się jak
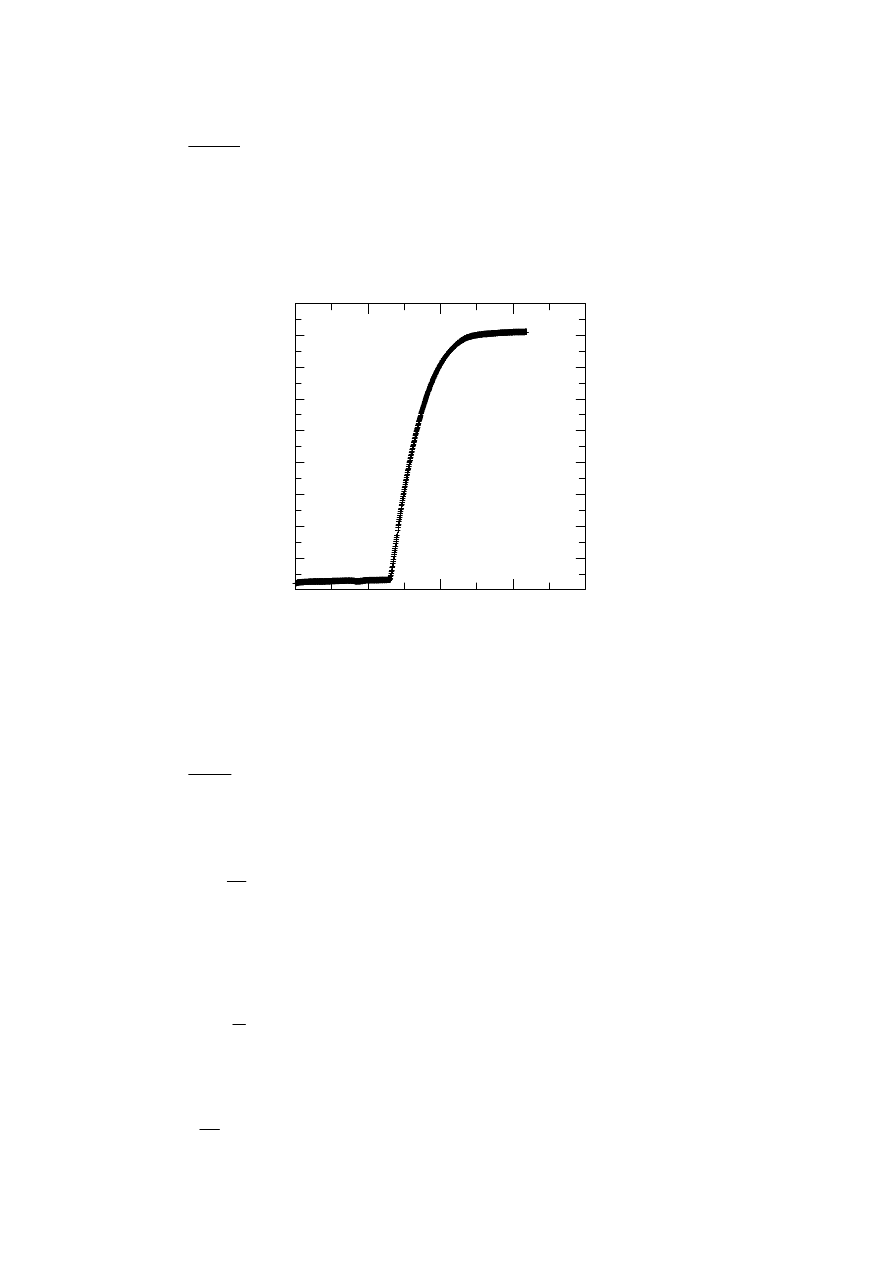
na rysunku 10.1.
czas [s]
p
rz
ew
o
d
n
ic
tw
o
Rys. 10.1 Zależność przewodnictwa roztworu od czasu podczas trwania metanolizy chlorku benzoilu
Ze względu na proporcjonalność zmian wysokości h na krzywej do
przewodnictwa, równanie (10.9) przyjmuje postać:
ln
h
h
h
k t
∞
∞
−
= ⋅
(10.10)
Stała szybkości reakcji k, zależy od temperatury zgodnie z równaniem Arrhenius’a:
k z e
E
RT
#
= ⋅
−
(10.11)
gdzie E
#
oznacza energię aktywacji.
Równanie to można napisać w postaci:
lnk = a -
b
T
(10.12)
gdzie:
b
E
R
#
=
(10.13)

50
CEL ĆWICZENIA
Celem ćwiczenia jest opisanie zależność stałej szybkości reakcji chlorku benzoilu
z metanolem od temperatury.
APARATURA
Komputer PC, drukarka.
Miernik Metex.
Konduktometr (np OH-102/1).
Ultratermostat (np. U-1.)
Mieszadło bezsilnikowe i mieszadełko magnetyczne (dipol).
Termometr elektroniczny.
Elektrody miedziane.
Pipeta automatyczna.
Penseta.
SZKŁO
Naczynie reakcyjne termostatowane.
Zlewki 50 ml, 100 ml.
Strzykawka (10 ml) z igłą.
ODCZYNNIKI
Metanol.
Roztwór chlorku benzoilu (C
6
H
5
COCl) w benzenie
5 mol dm
-3
.
WYKONANIE ĆWICZENIA
1. Pomiary wykonać dla temperatur bliskich 25, 30, 35, 40, 45 oC.
(Konduktometr OH 102/1 powinien pracować w pozycji „Range” 50 mS.)
2. Kolejność wykonywanych czynności:
- nastawić termometr kontaktowy na potrzebną temperaturę,
- przy pomocy strzykawki z igłą wlać do naczyńka reakcyjnego 10 cm
3
metanolu i włączyć mieszanie (50 obr/min.),
- po ustaleniu się temperatury w naczyńku reakcyjnym przystąpić do rejestracji
wyników pomiarów (opis działania programu rejestrującego wyjaśni
prowadzący ćwiczenie),
- pobrać za pomocą pipety automatycznej 0,2 cm
3
5 mol dm
-3
roztworu chlorku
benzoilu w benzenie i wprowadzić do naczyńka reakcyjnego,
- zarejestrować krzywą zależności przewodnictwa od czasu,
- przygotować układ do przeprowadzenia reakcji w kolejnej temperaturze,
tzn.
przemyć naczyńko, elektrody i termometr metanolem,
- opisać uzyskane krzywe.
UWAGA !
- nie wylewać roztworu do zlewu lecz do odpowiedniego pojemnika na
odpady,
- przed wylaniem roztworu należy pincetą wyjąć mieszadełko (dipol),

51
OPRACOWANIE WYNIKÓW
1. Uzyskane wyniki zależności przewodnictwa od czasu dołączyć do ćwiczenia.
2. Wykreślić krzywe zależności przewodnictwa od czasu trwania. Wyznaczyć z
krzywych
G = f (t) wartość h oraz t dla kilku stałych punktów. Obliczyć
wartość
stałych szybkości reakcji, k.
4. Wyznaczyć w oparciu o równanie Arrhenius’a współczynniki opisujące
zależność temperaturową stałej szybkości reakcji.
5. Sporządzić wykres zależności logarytmu stałej szybkości reakcji od odwrotności
temperatury.
Wyszukiwarka
Podobne podstrony:
6 Zależność stałej szybkości reakcji od temperatury
Ad 8 Zależność stałej równowagi reakcji od temperatury
zaleznosc stalej szybkosci reakcji od temp
Zależność stałej równowagi reakcji od temperatury sprawozdanie, Politechnika Poznańska, Laboratorium
zaleznosc stalej szybkosci reakcji od temp (2)
Zależność stałej równowagi reakcji od temperatury sprawozdanie 2, Politechnika Poznańska, Laboratori
Zależność stałej równowagi reakcji od temperatury sprawozdanie 3
Ad 8 Zależność stałej równowagi reakcji od temperatury
Ad 8 Zależność stałej równowagi reakcji od temperatury
Ćw 7 Zależność stałej równowagi reakcji od temperatury
zaleznosc stalej szybkości reakcji od temp
zaleznosc stalej szybk reakcji od temp2
13 szybkość reakcji od temperatury
ZALEŻNOŚCI FUNKCYJNE SZYBKOŚĆI REAKCJI CHEMICZNYCH OD PARAMETRÓW STANU UKŁADU REAKCYJNEGO
O7?dania zależności współczynnika załamania cieczy od temperatury przy pomocy refraktometru
Badanie zależności współczynnika lepkości cieczy od temperatury, Lepkość
044 Pomiar zależności oporności metali i półprzewodników od temperatury sprawozdanie
47, Ćw 47 Zależność przewodnictwa elektrycznego elektrolitów od temperatury sprawdzenie reguły Walde
więcej podobnych podstron