
TECHNIKA CIEPLNA I TERMODYNAMIKA
Ćwiczenie
laboratoryjne
nr 1 (6)
BADANIE PRZEMIANY IZOBARYCZNEJ NA PRZYKLADZIE POWIETRZA WILGOTNEGO
1. Podstawowe prawa gazów doskonałych
Podstawowe równanie stanu, dotyczące gazów doskonałych, podał w 1834 roku C. Clapeyron. Matematyczna
postać tej zależności może być zapisana w postaci:
[J/kg] ( 1 )
gdzie:
p - ciśnienie absolutne [Pa],
v - objętość właściwa [ m
3
/kg],
R - indywidualna stała gazowa [ J/(kg K)],
T - temperatura bezwzględna [K].
Prawo to można też przedstawić zależnością:
p
1
v
1
/T
1
= p
2
v
2
/T
2
= R = const [ J/(kg K)]
gdzie :
p
1
, p
2
- ciśnienia absolutne [ Pa ],
v
1
, v
2
- objętości właściwe gazów [m
3
/kg ]
Indywidualną stałą gazową określa się na podstawie tablic lub oblicza z zależności :
R = R
u
/ M = 8315 / M
gdzie: R
u
– uniwersalna stała gazowa równa 8315 J /(kmol K),
M – masa molowa gazu , kg/ kmol
Wartość ciśnienia absolutnego jest sumą ciśnienia barometrycznego i nadciśnienia ( lub podciśnienia ) czyli
wartości mierzonej manometrem (manometry mierzą tylko nadciśnienie lub podciśnienie). Do pomiaru tych wartości
dla gazów wystarczają najczęściej się manometry cieczowe.
W obliczeniach termodynamicznych, inaczej niż w zagadnieniach chemicznych, nie stosuje się zależności
wymagających znajomości masy i objętości gazu, ponieważ zwykle ich nie znamy.
Pierwsza zasadę termodynamiki można sformułować następująco:
Ciepło doprowadzone z zewnątrz do nieruchomego układu zamkniętego jest zużywane na zmianę jego
energii wewnętrznej oraz wykonanie pracy nad siłami zewnętrznymi ( pracy zewnętrznej).
Pierwszą postać pierwszej zasady termodynamiki wyraża zależność :

dq = du + dl
z
= c
v
dT + p dv [ J / kg ] [ 2 ]
2 )
gdzie :
dq - elementarna zmiana ciepła [ J / kg ],
du - energia wewnętrzna właściwa ( dla 1 kg gazu), [ J / kg ]
du = c
v
dT
c
v
- ciepło właściwe przy stałym ciśnieniu [ J / ( kg K) ]
dl
z
- praca zewnętrzna dla 1 kg gazu ( równa p dv ) [ J / kg ].
Istnieje umowa, że parametry termodynamiczne wyrażone literami małymi odnoszą się do jednostki masy czyli do
1 kg gazu.
Druga postać I zasady termodynamiki moze byc wyrazona :
dq = di + dl
t
= c
p
dT - v dp
( 3 )
[ 3 ]
gdzie:
di - entalpia gazu (właściwa), [ J / kg ]
dl
t
- praca techniczna dla 1 kg gazu, [ J / kg ]
2. Przemiana izobaryczna
Ogólne równanie izobary, czyli przemiany zachodzącej przy stałym ciśnieniu , ma postać :
v / T = const ( 4 )
Ponieważ różniczka stałej wartości ciśnienia dp = 0 , z definicji pracy technicznej mamy
dl
t
= 0 [ J / kg ]
Druga postać I zasady termodynamiki może być dla przemiany izobarycznej ujęta zależnością:
d q = d i = c
p
dT [ J / kg ] ( 5 )
Ze wzoru ( 5 ) wynika że ciepło przemiany izobarycznej jest równoważne zmianie entalpii odniesionej do końca i
początku przemiany. Można to ująć zależnością :
∆
q =
∆
i = i
2
- i
1
[ J / kg ] ( 6 )
3. Przemiana izobaryczna dla mieszaniny gazów
Do obliczeń termodynamicznych dotyczących przemian zachodzących w mieszaninach gazów ( np. dla powietrza
wilgotnego) konieczne jest wyznaczenie średnich parametrów fizycznych mieszaniny w oparciu o tzw. regule
addytywności. Własności termofizyczne, które stosują się do tej reguły nazywamy addytywnymi. Są to: ciepło
właściwe, entalpia, stała gazowa indywidualna i gęstość mieszaniny gazów. Jeżeli dowolny parametr addytywny
oznaczymy przez Y, to regułę addytywności można wyrazić:

(1)
gdzie:
g
1
, g
2
, g
n
- udziały masowe poszczególnych składników mieszaniny gazów.
Poniżej podamy przykłady wyznaczania średnich parametrów cieplnych dla przypadku powietrza wilgotnego,
traktowanego jako mieszaninę gazu suchego (azot, tlen) i pary wodnej.
Ciepło właściwe przy stałym ciśnieniu można zapisać:
(2)
gdzie:
,
X
- zawartość wilgoci w powietrzu wilgotnym (w kg pary wodnej na kg gazu suchego),
c
gs
- ciepło właściwe gazu suchego (przy stałym ciśnieniu),
c
p
- ciepło właściwe pary wodnej.
Analogicznie dla stałej gazowej mamy
(3)
gdzie:
R
gs
-
stała gazowa indywidualna dla powietrza suchego,
R
p
-
stała gazowa indywidualna dla pary wodnej
Do wykonania obliczeń dla powietrza wilgotnego niezbędna jest znajomość stałych gazowych i ciepeł właściwych
przy stałym ciśnieniu:
a) dla powietrza suchego odpowiednio 287 i 1005 J/(kg K) ;
b) dla pary wodnej 461 i 1930 J/ (kg K) .
Entalpia właściwa powietrza wilgotnego i
gw
będzie wyrażona:
(4)
gdzie:
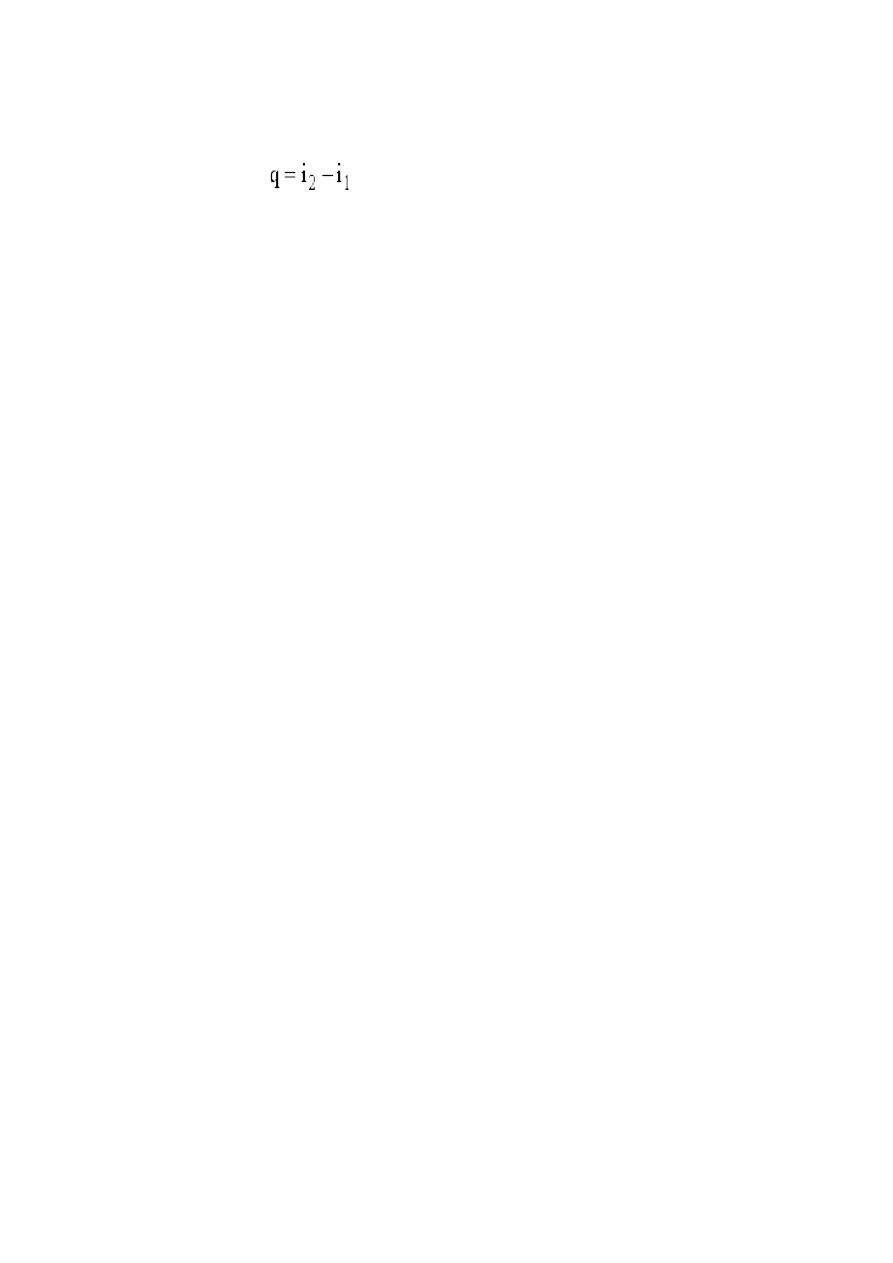
i
gs
, i
p
-
entalpie właściwe gazu (powietrza) suchego i pary wodnej.
Zależność (4) jest istotna do obliczenia ciepła przemiany izobarycznej, zgodnie z zależnością:
(5)
gdzie:
i
2
- entalpia mieszaniny gazów po przemianie,
i
1
- entalpia wlasciwa (przed przemiana izobaryczna).
Do określenia zawartości wilgoci w powietrzu stosuje się psychrometr Assmanna lub higrometr włosowy.
Związek wilgotności względnej
ϕ
zawartości wilgoci X wyraża wzór :
X = 0. 622
ϕ
p
s
/ (p
b
-
ϕ
p
s
)
gdzie :
p
s
- ciśnienie cząstkowe pary wodnej nasycającej powietrze w danej temperaturze ( maksymalna wartość przy
danej temperaturze),
ϕ
- wilgotność względna powietrza,
p
b
- ciśnienie barometryczne.
Wartość p
s
oblicza się dla powietrza z zależności :
p
s
= 1320 - 44,4 * t + 4.74 * t
2
[ Pa ]
gdzie : t - temperatura w
o
C .
4. Inne parametry przemiany izobarycznej
Pracę zewnętrzną przemiany izobarycznej oblicza się z definicji :
d l = p dv
i po scałkowaniu w granicach od v
1
do v
2
otrzymuje się :
l
z
= p ( v
2
- v
1
) [ J / kg]
Natomiast praca techniczna przemiany izobarycznej wynika z wartości różniczki ciśnienia: d p = 0, czyli jest
równa zeru.
Przyrost energii wewnętrznej ( d u = c
p
dT ) w tej przemianie opisuje równanie :
∆
u = c
p
( T
2
- T
1
) [ J/ kg ]
5. Zagadnienia do kolokwium z tematu ” Badanie przemiany izobarycznej dla powietrza wilgotnego”
1. Pierwsza zasada termodynamiki, II postać I zasady w ujęciu dla izobary.
2. Równanie stanu gazu, postacie ujmujące gęstość i objętość właściwa.
3. Reguła addytywności w zastosowaniu do obliczeń stałej gazowej, ciepła właściwego i entalpii mieszaniny gazów
4. Ilość ciepła wymienianego przy przemianie izobarycznej.
5. Praca zewnętrzna dla przemiany izobarycznej
6. Równanie i wykres przemiany izobarycznej.
7. Równanie i wykres przemiany izotermicznej.
8. Wyjaśnić pojęcia i podaj jednostki : energii wewnętrznej, pracy zewnętrznej, entalpii, entalpii właściwej i stałej
gazowej indywidualnej i uniwersalnej.
9. Obliczanie pracy zewnętrznej i zmiany energii wewnętrznej w przemianie izobarycznej.
10. Zasada działania higrometru włosowego.
11. Pojęcia: wilgotność względna i zawartość wilgoci.
Opracowanie sprawozdania z tematu
” Przemiana izobaryczna”.
Sprawozdanie powinno zawierać:
1. Opis układu pomiarowego.
2. Obliczenie zawartości wilgoci, stałej gazowej, ciepla właściwego i entalpii powietrza wilgotnego jako
mieszaniny dwuskładnikowej.
3. Określenie teoretycznej wilgotności względnej
ϕ
2
dla momentu końca przemiany izobarycznej i
porównanie jej z wartością pomiarowa.
4. Obliczenie ciepła przemiany izobarycznej , pracy zewnętrznej i objętości właściwych dla początku i końca
przemiany.
5. Wykonanie wykresu izobary w układzie pracy ( ciśnienie w funkcji objętości właściwej, p – v).
6. Wnioski.
NAZWISKO ......................... Imię ............ II rok Grupa: .......... maj 2004
Sprawozdanie z ćwiczenia laboratoryjnego nr (1) 7 Z = ........
„Badanie parametrów przemiany izobarycznej”
1. Dane ogólne:

2. Obliczenie zawartosci wilgoci
dla temperatury
a) cisnienie pary wodnej w stanie nasycenia
;
;
b)
c) obliczenie wilgotności teoretycznej dla stanu 2
3. Obliczenie ciepła właściwego i stałej gazowej dla powietrza wilgotnego
4. Obliczenie objętości właściwych
5. Obliczenie pracy zewnętrznej
6. Obliczenie ciepła przemiany q
7. Ciepło właściwe przy stałej objętości
8. Przyrost energii wewnętrznej
9. Sprawdzenie poprawności obliczeń za pomocą współczynnika weryfikacyjnego Z
*Na odwrocie: schemat układu, wykres izobary, wnioski (
ϕ
2
,
ϕ
2.teor
)
Alfabetyczny ciąg parametrów występujących w równaniach opisujących
procesy termodynamiczne

1. Alfabet polski:
a, c
p
, c
v
, g, h, i, I, k, l
z
, l
t
, L
z
, L
t
, m,
, M, p, p
b
, p
c
, p
d
, p
s
**, q, Q, R, R
u
, s, t, T, u, U, w, , Z
2. Alfabet grecki:
ρ
,
ν
, v, V,
χ
,
ϕ
, x, X,
* dwa znaczenia
Document Outline
- TECHNIKA CIEPLNA I TERMODYNAMIKA
- 2. Obliczenie zawartosci wilgoci dla temperatury
- a) cisnienie pary wodnej w stanie nasycenia
Wyszukiwarka
Podobne podstrony:
Technika cieplna termodynamika ściąga
Termodynamika techniczna i technika cieplna
Technika cieplna i termodynamika
PWTC C2, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
Badanie nagrzewnicy powietrza, Technika cieplna
Przewodzenie ciepła@-3, Technika cieplna
kinetyka moja-technika, Technika cieplna
sprawozdanie z wilgotności, studia, technika cieplna
Strona tytuowa, fdff, Technika cieplna
Termoanemometr, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab wynik
Zagadnienia Techniki Organizatorskie i?cyzyjne
Rotametr, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab wynik zajac
Zakres tematyki obowiązujący na zaliczeniu części laboratoryjnej, ZiIP UR Kraków, II Semestr, Techni
wyklady ulepszone, SGGW TRiL, Technika Cieplna Tril sggw
PWTC C1-C2, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab maciejko
Parametry techniczne?tonu komórkowego i?ramiki
więcej podobnych podstron