
Genetyczne
Genetyczne
podstawy
podstawy
odporności i
odporności i
oporności
oporności

Genetyczne podstawy odporności i oporności
Układ odpornościowy jest pod względem inteligencji” drugim po
układzie nerwowym układem komórkowym organizmu. Ma on,
podobnie jak układ nerwowy, zdolność uczenia się,
zapamiętywania, reagowania na różne bodźce i umiejętność
oceny tych bodźców pod kątem ich oddziaływania na organizm.
Główną rolą tego układu jest rozróżnianie obcych białek (anty
genów) i reakcja immunologiczna, której celem jest zwalczenie,
usunięcie tych obcych białek. Zastanawiające jest, iż układ
może rozróżnić ogromną liczbę antygenów
i odpowiedzieć na infekcje, mimo że ma tylko pięć klas
przeciwciał. Zdolność ta wynika przede wszystkim ze
specyficznego sposobu genetycznej kontroli syntezy przeciwciał,
ale także z posiadania przez organizmy wyższe unikatowego
układu genetycznego, jakim jest główny układ zgodności
tkankowej.

Genetyczne podłoże różnorodności przeciwciał
Immunoglobuliny, czyli przeciwciała, wykryte w 1890 roku przez von
Behringa
i Shibasaburo Kitasato, są grupą złożonych białek obecnych w
surowicy krwi
i płynach tkankowych wszystkich ssaków. Ich wytwarzanie przez
limfocyty B jest stymulowane przez kontakt układu odpornościowego
organizmu z obcą immunogenetycznie cząsteczką (antygenem). Są
one elementem odporności swoistej (nabytej, adaptatywnej), ich
zadaniem jest rozpoznanie i neutralizacja obcych antygenów (np.
bakterii czy wirusów). Cząsteczka przeciwciała ma masę 150 kDa i
składa się z dwóch łańcuchów ciężkich (ang. heavy — H), po 50 kDa
każdy, połączonych z dwoma łańcuchami lekkimi (ang. light — L), o
masie po 25 kDa. Jest pięć typów łańcuchów ciężkich (gr. α — alfa, δ
— delta, ε — epsilon, γ — gamma i µ— mi) i dwa typy lekkich (κ —
kappa i λ — lambda) Stosunek przeciwciał, które mają łańcuch lekki
typu κ, do łańcucha λ zależy od gatunku (np. u ludzi wynosi on 70:30,
u myszy 1:20, u koni 1:25). Immunoglobuliny dzieli się na podstawie
różnic w budowie łańcuchów ciężkich na 5 klas : IgA, IgD, IgE, IgG i
IgM. Nazewnictwo to pochodzi od:
Ig — skrót od angielskiego słowa immunoglobulin, natomiast A, D, E,
G i M od symboli łańcuchów ciężkich.

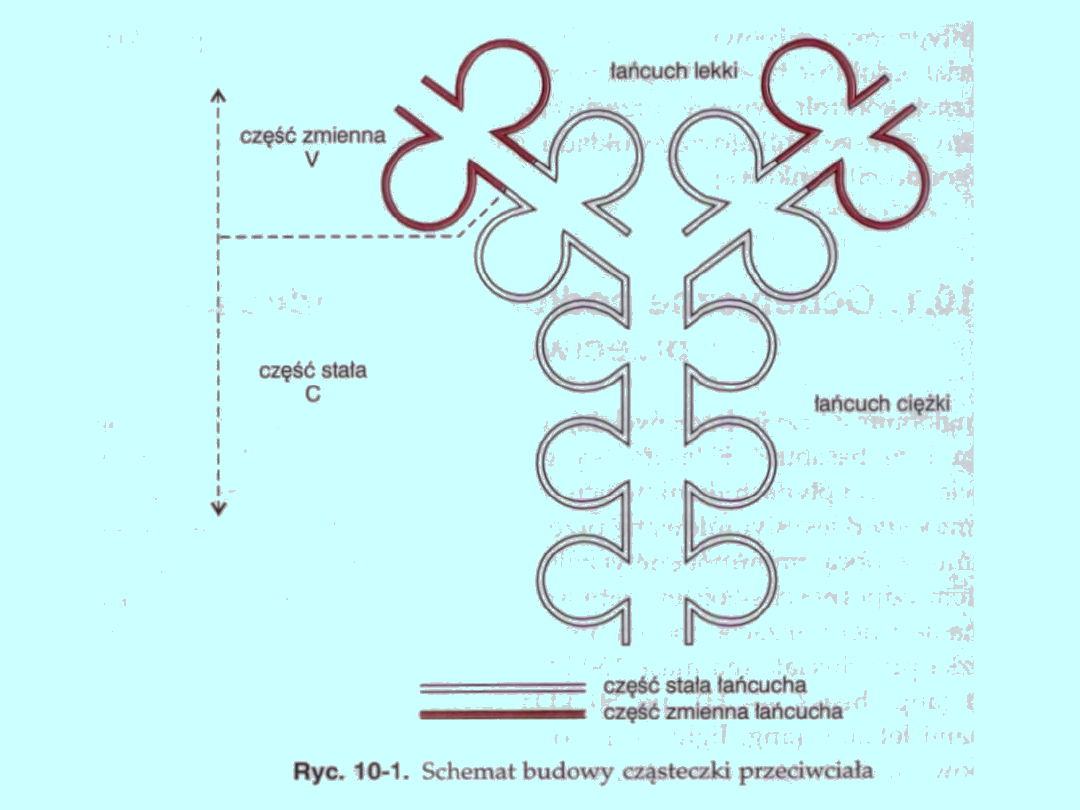
Przeciwciało ma kształt litery Y (ryc. 10-1), utworzonej przez łańcuchy
ciężkie,
a wzdłuż jej ramion znajdują się łańcuchy lekkie. Łańcuchy ciężkie
połączone są ze sobą wiązaniami dwusiarczkowymi, których liczba i
miejsce zależą od klasy
i podklasy immunoglobuliny. Zarówno łańcuchy ciężkie, jak i lekkie
mają części zmienne (ang. variable — V) oraz części stałe (ang.
constant — C). W części zmiennej znajdują się trzy regiony
hiperzmienne (ang. hypervariable), oznaczone HV1, HV2 i HV3.
Ponieważ regiony te determinują swoistość przeciwciał, nazywane są
także regionami determinującymi dopasowanie (ang. complementarity
determining regions — CDR). W części stałej łańcucha ciężkiego,
między domeną CH1 i CH2, znajduje się tzw. region zawiasowy (ang.
hinge region), w którym są wiązania dwusiarczkowe łączące oba
łańcuchy ciężkie.
Genetyczne podłoże powstawania przeciwciał zostało wyjaśnione
przez Susumu Tonegawa w 1976 roku. Badacz ten odkrył, iż informacja
genetyczna immunoglobulin zawarta jest w znajdujących się w
różnych chromosomach czterech grupach „minigenów”, które nazwał
segmentami.

Różnorodność przeciwciał, ich swoistość wynikają z tego, iż
dziedziczone są nie całe geny immunoglobulinowe, ale ich
segmenty. Proces syntezy przeciwciała następuje po
skompletowaniu genów, czyli połączeniu się segmentów po
jednym z każdej grupy minigenów. Dopiero po połączeniu w
całość segmenty te tworzą kompletny funkcjonalny gen.
Proces ten zachodzi w poszczególnych limfocytach B podczas
ich dojrzewania. Za to odkrycie Tonegawa otrzymał
w 1987 roku Nagrodę Nobla.
Część zmienna łańcucha lekkiego jest determinowana przez
dwa geny V (ang. variable) i J (ang. joining), natomiast
łańcucha ciężkiego przez trzy geny: V, D (ang. diversity) i J.
Część stała obu rodzajów łańcuchów jest kodowana przez
gen C. Geny kodujące łańcuch ciężki znajdują się u człowieka
w 14 chromosomie, natomiast geny łańcucha lekkiego typu κ
w 2, typu λ w 22 chromosomie, u myszy natomiast
odpowiednio w chromosomach 2, 6 i 16.

Różnorodność przeciwciał wynika z wielu przyczyn, przede
wszystkim z:
• rearanżacji genów części zmiennych (V) i stałych (C) łańcuchów
immunoglobulin
• rekombinacji między wieloma genami V
• insercji minieksonów
• mutacji somatycznych
Różnorodność ciężkich łańcuchów immunoglobulinowych wynika
z rekombinacji (rearanżacji) genów V D, J i C, a łańcuchów lekkich
z rekombinacji regionów V, J i C. Teoretycznie jest możliwość
powstania do 1011 różnych immunoglobulinowych sekwencji domen.
Jednak rzeczywista liczba powstałych wariantów przeciwciał wynosi
107-108. Przypuszczalnie jest wiele genów kodujących region V. Dla
łańcucha ciężkiego ich liczba nie jest dokładnie znana (kilkadziesiąt,
może kilkaset), dla lekkiego — kilka. Istnieją co najmniej 3 rodziny
genów (liczące 1—9 genów każda) dla regionu D, 6 genów
funkcjonalnych i 3 pseudogeny regionu J, natomiast dla regionu C >
30 genów u ludzi i > 300 u myszy dla łańcucha lekkiego typu κ oraz
6 u ludzi i 4 u myszy dla łańcucha typu λ.

Ogólnie liczbę genów determinujących poszczególne regiony
łańcuchów immunoglobulin można określić jako kilkaset
genów V, kilkadziesiąt genów D i kilka genów J. Geny
determinujące region C różnią się od pozostałych tym, że
wpływają na funkcję przeciwciała,
a nie na jego powinowactwo do antygenu.
Kompletne funkcjonalne geny kodujące cząsteczki przeciwciał
powstają z omówionych wyżej genów, których kolejność
łączenia się jest następująca:
gen D z genem J następnie z genem V; powstały kompleks
DJV łączy się z genem kodującym część stałą łańcucha
ciężkiego. W funkcjonalnym genie łańcucha lekkiego nie ma
genu D (ryc. 10-2). Rekombinacyjne łączenie się genów,
zachodzące dzięki aktywności enzymu — rekombinazy, jest
głównym źródłem różnorodności przeciwciał.
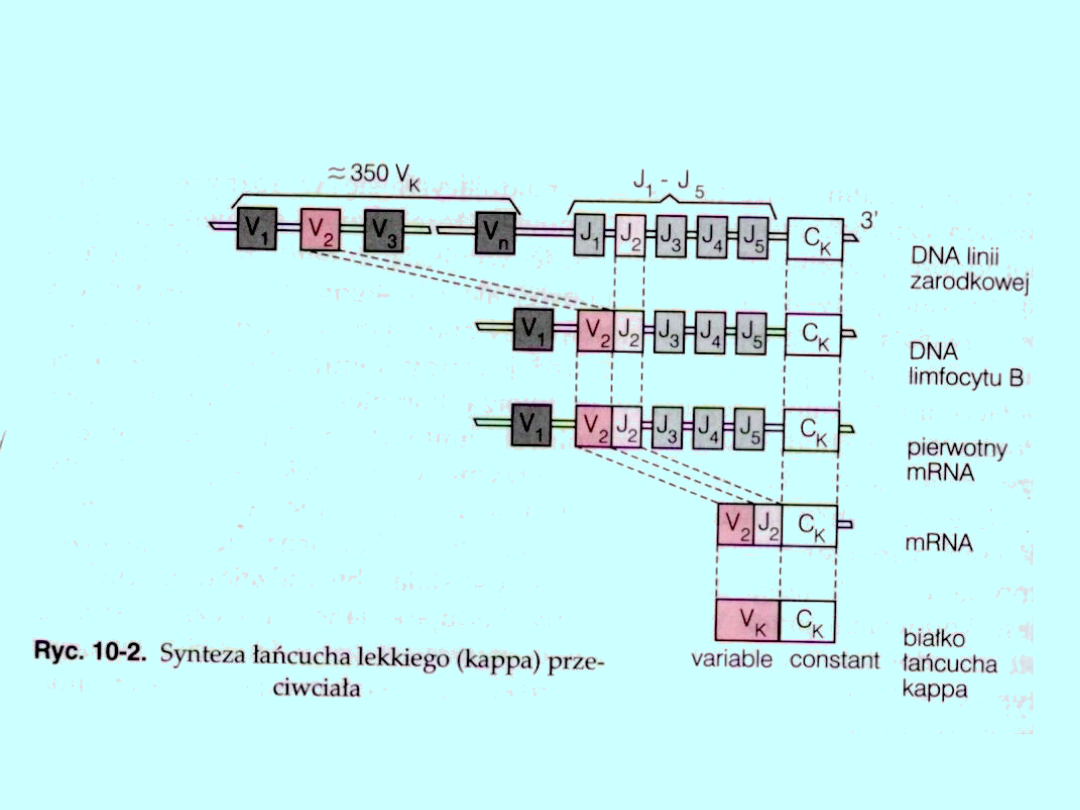

Podczas procesu powstawania genu kompletnego do
połączeń między genami — segmentami (V-J V-D i D-J mogą
być wstawiane nukleotydy (od 1 do 15), bądź też usuwane
(do około 20 nukleotydów). Ponieważ Są to nowopowstałe
odcinki DNA, prowadzi to do zmienności na złączach i
utworzenia nowego genu, tym samym liczba wariantów
genu DJ może być zwiększona około 10 razy, natomiast genu
VDJ następne 10 razy. Dodatkowo na różnorodność
sekwencji przeciwciał mają wpływ mutacje somatyczne
zachodzące w rekombinowanym genie V (dla łańcucha
lekkiego) i VDJ (dla łańcucha ciężkiego). Każdy limfocyt B
wytwarza tylko jeden rodzaj łańcucha ciężkiego i jeden
lekkiego, które razem stanowią przeciwciało, będące
specyficznym receptorem tego limfocytu. Geny kodujące
łańcuchy mają zdolność niezwykle szybkiego mutowania
w odpowiedzi na pobudzenie limfocytu B poprzez związanie
obcego białka (antygenu). Najczęściej są to mutacje
punktowe, powodujące zmianę pojedynczego aminokwasu,
rzadziej natomiast delecje, insercje lub konwersje.
Pojedyncza nawet zmiana aminokwasu
w części zmiennej łańcucha ciężkiego może doprowadzić do
całkowitej utraty przez przeciwciało zdolności wiązania
antygenu lub też do zwiększenia jego powinowactwa do
antygenu.

Genetyczne podłoże różnorodności receptorów
limfocytów T
W odpowiedzi immunologicznej organizmu biorą udział dwie populacje
limfocytów: limfocyty T i limfocyty B, przy czym limfocyty T
uczestniczą w odpowiedzi typu komórkowego, atakując i niszcząc
komórki zakażone (Tc — cytotoksyczne limfocyty T), oraz odpowiedzi
typu hormonalnego (Th — pomocnicze limfocyty T), podobnie jak
limfocyty B, które odpowiadają za syntezę przeciwciał.
Dwie subpopulacje limfocytów T (Tc i Th) różnią się receptorami
błonowymi. Limfocyty pomocnicze mają receptory CD4, cytotoksyczne
— CD8. Reaktywność tych receptorów znajdujących się na limfocytach
pomocniczych
i cytotoksycznych jest skierowana odpowiednio na antygeny MHC
klasy II
i klasy L.
Proces rearanżacji elementów genów receptorowych, który następuje
podczas dojrzewania komórek T w grasicy, zachodzi podobnie jak
rekombinacja genów przeciwciał. Poprzez proces rearanżacji genów,
jeden do czterech elementów zostaje włączonych do genów
kodujących pierwotną strukturę białek receptora komórki T. Znane Są
dwa rodzaje receptorów limfocytów T — receptory składające się z
łańcuchów α i β oraz receptory składające się z łańcuchów γ i δ. U
człowieka geny kodujące łańcuchy receptorów znajdują się w
chromosomie 7 (dla łańcuchów β i γ) i 14 (dla łańcuchów α i δ). Części
zmienne łańcuchów kodowane są przez geny V i J (łańcuchy α i γ) i
przez geny V D i J (łańcuchy β
i γ).

Na przykład u myszy 100 regionów łańcucha α-V i 50 regionów
łańcucha
α -J może tworzyć do 5000 różnych genów dla łańcucha α.
Podobnie, około 500 różnych genów kodujących łańcuch β może
być utworzonych z 20 genów β-V, 2 regionów D i 12 genów dla
łańcucha
β-J. Oczywiście jest mało prawdopodobne, że wszystkie elementy
genów
są włączone w rearanżacje, ale teoretycznie losowe kombinacje
łańcuchów α i β mogą dać do 2,5 x 106 α-β heterodimerów. Gdyby
zostały wzięte pod uwagę wszystkie mechanizmy biorące udział w
tworzeniu różnorodności struktury receptorów limfocytów T, liczba
różnych receptorów wyniosłaby do 1015 receptorów α-β i 1018 γ-δ.
Potencjał dla różnorodności receptorów komórek T jest istotnie
wyższy niż wynosi liczba komórek T obecnych
w organizmie.

Główny układ zgodności tkankowej — MHC
Główny układ zgodności tkankowej został odkryty w wyniku
badań nad genetycznym tłem przyjmowania lub odrzucania
przeszczepu u myszy. Bodźcem do podjęcia tych badań było
odkrycie przez Landsteinera grup krwi systemu ABO i
wyjaśnienie zjawiska aglutynacji krwinek czerwonych biorcy
pod wpływem surowicy krwi dawcy. Prowadzone w latach 30.
przez Petera Gorera poszukiwania innych antygenów
grupowych krwi, odpowiedzialnych za przyjęcie przeszczepu,
doprowadziły do wykrycia grup (klas) antygenów oznaczonych
I, II
i III. Przełomowe znaczenie dla poznania i wyjaśnienia roli tych
antygenów miało wytworzenie przez Georga Snella linii
kongenicznych myszy różniących się tylko locus zgodności
tkankowej, który kontroluje ich syntezę. Badania polegające na
przeszczepach skórnych między tymi liniami, wykonywanych
dla kilkunastu kolejnych pokoleń, wykazały, iż reakcja na ten
zabieg zależy przede wszystkim od locus głównego układu
zgodności tkankowej (ang. major histocompatibility complex —
MHC), a tylko w niewielkim stopniu od innych loci, nazwanych
słabymi antygenami zgodności tkankowej (ang. minor
histocompatibility loci). Za badania nad MHC Snell wraz z
Francuzem Daussetem
i Amerykaninem Benacerrafem otrzymali w 1980 roku Nagrodę
Nobla.

Różnice między słabymi antygenami zgodności tkankowej a MHC są
zarówno natury jakościowej, jak i ilościowej. Geny słabych
antygenów zgodności tkankowej nie są jeszcze dobrze poznane i,
być może dlatego, często ich efekt jest niedoceniany. Tymczasem
niektóre z tych antygenów stymulują silniejszą odpowiedź
transplantacyjną niż antygeny MHC. W zasadzie antygeny minor H
loci nie biorą udziału w reakcji immunologicznej prowadzącej do
syntezy przeciwciał, natomiast mogą być rozpoznawane przez
limfocyty T w połączeniu z antygenami MHC, podobnie jak to
występuje przy rozpoznawaniu antygenów wirusowych. U myszy loci
słabych antygenów zgodności tkankowej (minor H loci) są najlepiej
poznane i wiadomo, że większość z nich znajduje się w
chromosomie 2. Do słabych antygenów transplantacyjnych myszy
należą między innymi: H-Y (tylko u samców), H-1, H-3, H-5 i inne.
Antygeny te są istotną barierą podczas transplantacji tkanek,
zwłaszcza transplantacji szpiku kostnego. Nawet wówczas, gdy
biorca
i dawca są zgodni pod względem haplotypów MHC, słabe antygeny
transplantacyjne mogą spowodować odrzucenie przeszczepu.

W dziedziczeniu słabych antygenów zgodności tkankowej
obserwuje się pewne charakterystyczne zjawiska. Antygen H-Y
występuje tylko u samców, gdyż gen kodujący go jest
zlokalizowany w chromosomie Y. Zatem jest on przekazywany
przez ojca męskim potomkom. Natomiast inny antygen,
nazwany Mta (ang. maternally transmitted antigen), pochodzi
tylko od matki, ponieważ jest on kontrolowany przez gen
mitochondrialny (zjawisko to jest omówione w rozdziale:
Podstawowe mechanizmy dziedziczenia cech).
Ponieważ główną funkcją genów MHC jest determinowanie
antygenów leukocytarnych (ang. leukocyte antigens LA),
nazewnictwo tego układu u poszczególnych gatunków stanowi
symbol zawierający w pierwszym członie nazwę gatunku, a
drugim podstawową funkcję — LA (tab. 10-I).
Główny układ zgodności tkankowej jest ogromnie
konserwatywnym regionem DNA, jego struktura i funkcje są
podobne u ludzi i wszystkich gatunków zwierząt. Umożliwia to
prowadzenie badań molekularnych MHC u jednego gatunku z
zastosowaniem sond molekularnych uzyskanych z DNA innego
gatunku.


Struktura i funkcje głównego układu zgodności tkankowej
U ludzi i zwierząt MHC jest odcinkiem DNA składającym się ze
specyficznych regionów genów kodujących trzy klasy białek —
klasę I, II i III, będących glikoproteinami. U drobiu nie stwierdzono
regionu klasy III. Wykryto natomiast specyficzny region klasy IV,
kodujący białka zlokalizowane na krwinkach czerwonych. Z
powodu powiązań tego układu
z układem grupowym krwi B, MHC u drobiu nazwano kompleksem
B. Ponieważ wiele białek MHC zostało zidentyfikowanych metodą
serologiczną, często są one nazywane antygenami MHC. Białka
(cząsteczki) MHC tak ze względu na podobieństwo na poziomie
struktury białka, jak i na poziomie genów zaliczane są do
nadrodziny immunoglobulin.
Mechanizm dziedziczenia układu zgodności tkankowej jest taki jak
w przypadku jednej pary allei. Potomek otrzymuje od każdego
rodzica po jednym chromosomie z każdej pary chromosomów
homologicznych, a wraz z nim — haploidalny genotyp MHC
(haplotyp). Ponieważ MHC zawiera wiele genów oraz, jak już
wspomniano, układ ten cechuje ogromny polimorfizm,
w populacji istnieje bardzo duża liczba różnych haplotypów.
Zwłaszcza niektóre geny MH, należące do klasy I i II (np. regionu K
D i L u myszy i B, C i A u ludzi), są wysoce polimorficzne.
W wielu przypadkach polimorfizm ten jest wynikiem konwersji
genów, rzadziej mutacji punktowych, crossing over czy
rekombinacji wewnątrzgenowych.

W obrębie MHC znajdują się regiony szczególnie często
uczestniczące w rekombinacjach genetycznych. Polimorfizm
alleliczny obserwowany w loci MHC charakteryzuje się tym, iż:
• liczba alleli w większości loci jest bardzo duża ( >50)
• allele często różnią się dużą liczbą mutacji punktowych typu
zmiany
sensu, powodujących podstawienia aminokwasów w cząsteczce
MHC (> 20 dla loci klasy II i > 30 dla loci klasy I); w większości
innych systemów genetycznych allele różnią się nielicznymi
podstawieniami nukleotydów
• polimorfizm występuje głównie w odcinkach istotnych
funkcjonalnie,
a więc w tych, które kodują miejsce wiązania peptydów; zjawisko
polimorfizmu w innych systemach genetycznych częściej
obserwowane jest w regionach, których znaczenie funkcjonalne
jest mniej istotne
• polimorfizm w obrębie MHC, co zostało już udowodnione,
wpływa na możliwość immunologicznego rozpoznania obcych
białek.

Mimo iż początkowo uważano, że MHC pełni funkcję tylko w
odrzucaniu przeszczepu, obecnie wiadomo, że białka kodowane przez
ten region biorą udział w mechanizmach rozpoznania
immunologicznego, w tym także
w interakcji różnych komórek limfoidalnych oraz limfocytów i komórek
prezentujących antygen.
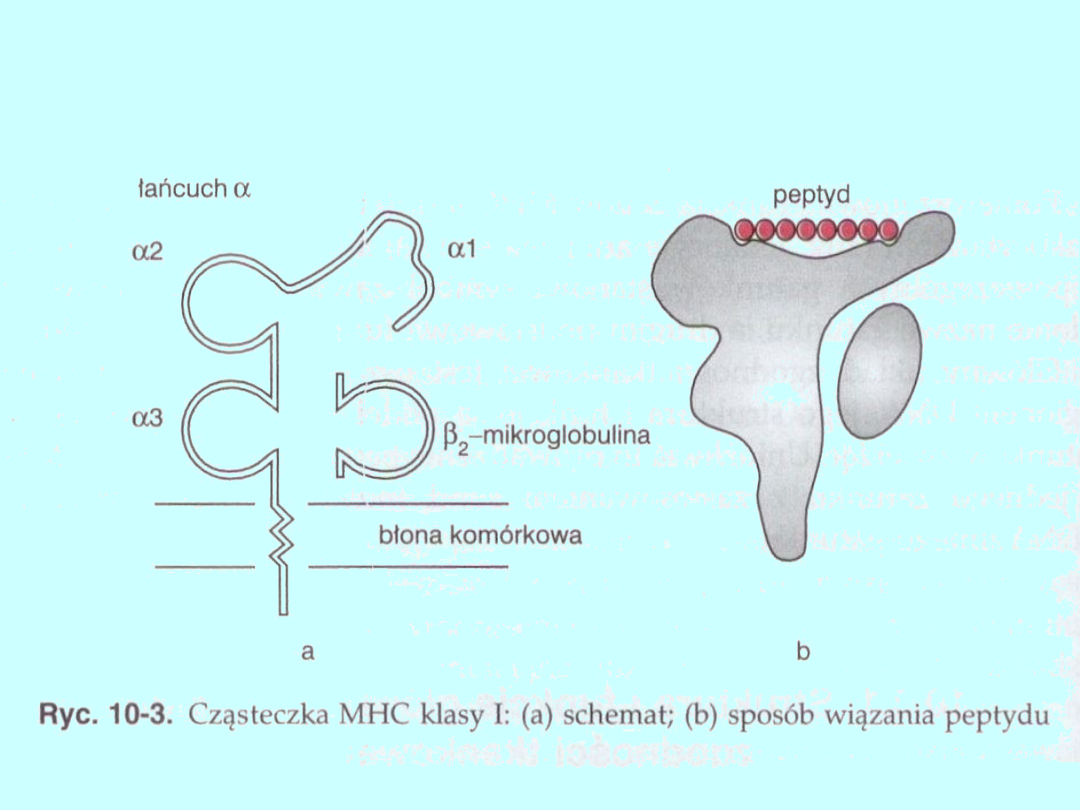
Cząsteczki MhC klasy I są obecne na powierzchni wszystkich komórek
jądrzastych i warunkują zachowanie się cytotoksycznych limfocytów
T, biorąc tym samym udział w reakcji przeciwko infekcji wirusowej, a
także w odrzucaniu przeszczepu. Cząsteczki te składają się z dwóch
łańcuchów polipeptydowych lekkiego i ciężkiego (ryc. 10-3). Łańcuch
ciężki jest kodowany przez geny MHC, natomiast związany z nim
niekowalencyjnie łańcuch lekki β2-mikroglobuliny (białko o masie 12
kDa) jest determinowany przez gen znajdujący się poza układem
MHC.

Łańcuch ciężki składa się z trzech części:
Najdłuższy, N-końcowy fragment łańcucha ciężkiego, stanowi około
80% jego długości i znajduje się na zewnątrz komórki. Jest on
kodowany przez geny MHC i ma trzy koliste domeny, oznaczone
symbolami αl, α2 i α3, każda złożona z około 90 aminokwasów.
Domena α3 jest ściśle sprzężona z β2-mikroglobuliną Ma ona
wewnątrzłańcuchowe dwusiarczkowe wiązanie i podobną strukturę
trzeciorzędową do domeny immunoglobuliny. Domeny αl
i α2 odznaczają się polimorfizmem, który jest podstawą różnic
między cząsteczkami MHC klasy I pochodzącymi od różnych
osobników. W domenach tych występują alloantygeniczne miejsca,
zawierające determinanty specyficzne dla osobników. Fragment
węglowodanowy (CHO) jest dołączony do domeny α2. Domeny αl i α2
tworzą rowek osadzony na
β2-mikroglobulinie i domenie α3, które są między nim a błoną
komórkową. W rowku tym wiązane są antygeny, które następnie są
prezentowane limfocytom T.
Druga część łańcucha ciężkiego to zawierający około 20
aminokwasów fragment hydrofobowy, przechodzący przez błonę
komórkową.
Trzecią częścią jest liczący około 20—40 aminokwasów fragment
hydrofilowy cząsteczki MHC klasy I (C-końcowy), który leży w
cytoplazmie komórki.

Cząsteczki MHC klasy II, stwierdzane tylko na powierzchni
wyspecjalizowanych komórek układu odpornościowego (makrofagi,
komórki dendrytyczne i limfocyty B), regulują immunologiczne
rozpoznanie antygenów za pomocą limfocytów B iT. Cząsteczki te są
zbudowane z dwóch niekowalencyjnie połączonych łańcuchów o
podobnej budowie, oznaczonych symbolami α i β, kontrolowanych
przez geny zlokalizowane w obrębie MHC (ryc. 10-4). Łańcuchy te,
podobnie jak łańcuch ciężki cząsteczki klasy I, składają się z trzech
części: zewnątrzkomórkowej N-końcowej, śródbłonowej i
wewnątrzkomórkowej. Oba łańcuchy mają w części N-końcowej po
dwie koliste domeny. Domeny α 2 i β2 są strukturalnie podobne do
domen części stałych łańcuchów ciężkich immunoglobulin. Domeny
zewnętrzne (α 1 i β1) obu łańcuchów tworzą rowek podobny do
tworzonego przez domeny α 1 i β2 łańcucha ciężkiego białek MHC
klasy I. Polimorfizm cząsteczek MHC klasy II dotyczy przede
wszystkim domen
α 1 i β1. Cząsteczki MHC Masy II mają zdolność wytwarzania
dimerów złożonych z dwóch łańcuchów α i dwóch łań cuchów β.
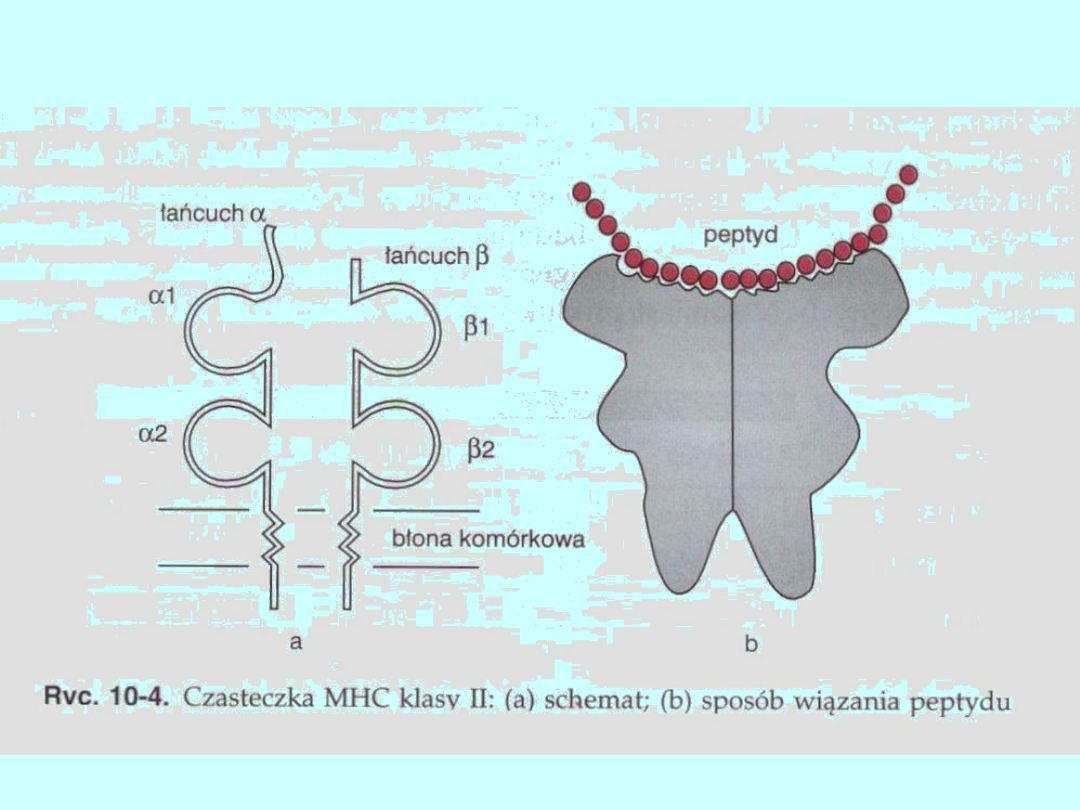

Zarówno białka MHC klasy I, jak i klasy II prezentują obcy peptyd
(antygen) limfocytom T. Jednak cząsteczki klasy I mogą wiązać
jedynie krótki, złożony z kilku aminokwasów peptyd, ponieważ
mają zamknięte miejsce wiążące. Natomiast białka MHC klasy II
mogą wiązać peptydy różnej długości, od kilkunastu do ponad
20 aminokwasów, gdyż ich miejsce wiążące pozostaje otwarte z
obu stron.
Cząsteczki MHC klasy III wchodzą w skład układu dopełniacza
(komplementu). Zadaniem układu dopełniacza jest uzupełnianie
(dopełnianie) roli przeciwciał w zakresie unieszkodliwiania
antygenu.
W jego skład wchodzą białka surowicy i płynów tkankowych,
których jest łącznie z czynnikami regulującymi około 30. Białka
te są oznaczane literą C (ang. complement) i liczbą. Białka C2,
C4 i czynnik B (BF) u ludzi są kontrolowane przez loci MHC klasy
III, u myszy natomiast przez loci regionu S w obrębie H-2.

Główny układ zgodności tkankowej myszy
Badania głównego układu zgodności tkankowej były prowadzone
początkowo u myszy, a ich wyniki miały ogromne znaczenie dla
późniejszych badań MHC człowieka, a potem również zwierząt
gospodarskich.
Pierwotnie w MHC u myszy zidentyfikowano regiony K, I, S i D, które
określono symbolem H-2 (ryc. 10-5). Późniejsze badania ujawniły,
że także geny w regionach sprzężonych Qa
i Tla kodują cząsteczki MHC. Geny kodujące białka MHC klasy I
znajdują się w regionach H-2K i H-2D (tzw. klasyczne cząsteczki
klasy I, oznaczane symbolem Ia). Geny zlokalizowane w regionach
Qa i Tla kodują cząsteczki zaliczane także do klasy I, z tym jednak,
że określane są one jako cząsteczki nieklasyczne (Ib), niektóre z
nich też biorą udział w odpowiedzi immunologicznej. Geny klasy I
MHC mają po osiem eksonów kodujących funkcjonalne domeny
białek MHC klasy I. Dotychczas wykryto co najmniej 15 genów klasy
Ia, kontrolujących syntezę klasycznych białek MHC klasy I. Badania
sekwencji genu Qa-2,3 wskazują na wysoką homologię (80%) tego
genu z genami klasycznych antygenów transplantacyjnych.
Natomiast produkty genów kompleksu Tla i Qa wykazują wiele
różnic
w porównaniu z antygenami transplantacyjnymi. W regionie Qa-2,3
i Tla zmapowano dotychczas 31 genów.


Gen kodujący łańcuch lekki β2 –mikroglobulinę) cząsteczek
klasy I, bardzo istotny dla ekspresji produktów genów klasy I,
znajduje się poza MHC, u myszy w 2, u człowieka w 15
chromosomie, w grupie sprzężeniowej z locus dehydrogenazy
sorbitolu. Gen ten u ludzi składa się z ośmiu eksonów,
natomiast u myszy z trzech eksonów. Sekwencja
aminokwasowa β2 –mikroglobuliny wykazuje wysoką homologię
z domeną immunoglobulin i odpowiednimi domenami
antygenów transplantacyjnych klasy I.
Białka klasy II są determinowane przez geny zlokalizowane
w subregionach H2-A i -E, -P, -ON oraz -M. Każda podklasa ma
co najmniej jeden gen łańcucha α i β, z wyjątkiem H2-P, który
ma pojedynczy pseudogen oznaczony symbolem H-2Pb. Wzór
eksonów
i intronów genów klasy II wskazuje na bliską współzależność
między tymi genami i podobieństwa struktury z genami klasy I
oraz genem 13. Białka klasy III są kontrolowane przez geny
regionu S.
Wśród regionów H-2 na szczególną uwagę zasługuje region I
(między regionami K i S),
w którym znajdują się geny kontrolujące odpowiedź
immunologiczną (wytwarzanie przeciwciał przeciwko ponad 10
różnym antygenom), oznaczone symbolem Ir (ang. immune
response).

Główny układ zgodności tkankowej człowieka
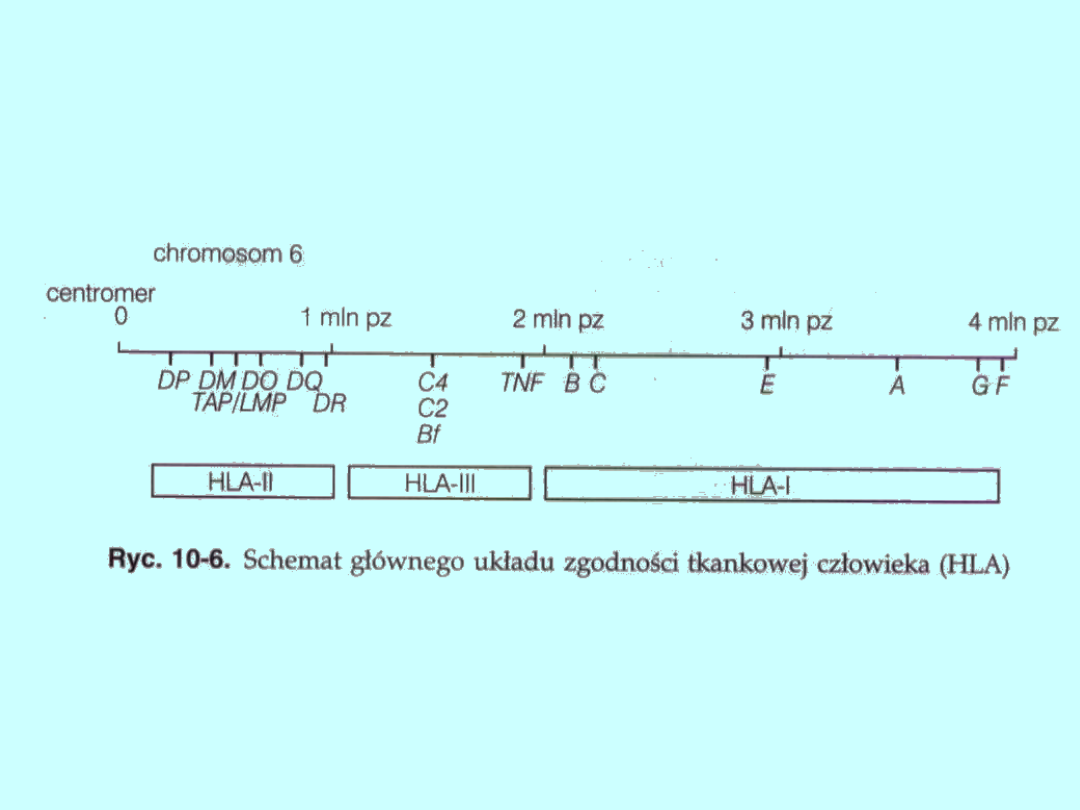
U ludzi MHC (HLA) znajduje się w krótkim ramieniu chromosomu 6,
zajmuje łącznie około 4 mpz DNA (4 miliony par zasad), czyli ponad
0,1% całego genomu. Częstość rekombinacji między skrajnymi
końcami tego kompleksu genów wynosi około 1%.
Struktura HLA przedstawiona jest na liniowym diagramie (ryc. 10-6).
Klasyczne cząsteczki klasy I kodowane są przez 3 loci — HLA-E, -B i
–C, natomiast cząsteczki kontrolowane przez loci HLA-E, -F i -G
należą do nieklasycznych cząsteczek klasy I. Geny klasy II HLA
znajdują się w pięciu podklasach: DQ, DR DP, DOB/DNA i DM przy
czym trzy pierwsze kodują klasyczne cząsteczki klasy II, podczas
czwarta podklasa DOB/DNA, determinuje syntezę nieklasycznych
cząsteczek klasy II. Odkryty niedawno locus DM jest nieco inny niż
pozostałe, bowiem jego sekwencja jest w takim samym stopniu
podobna do genów klasy I, jak i do genów klasy II. Cząsteczka MHC
kodowana przez ten locus odgrywa szczególną rolę
w prezentacji antygenów, co potwierdza fakt, iż komórki nie
wykazujące ekspresji tej cząsteczki mają upośledzoną zdolność
prezentacji antygenów.

Podobnie jak u myszy, region klasy II HLA zawiera także geny, które
strukturalnie nie należą do genów klasy II. Najbardziej interesujące z
immunologicznego punktu widzenia są geny włączone w przetwarzanie
własnych białek komórkowych. Biorą one udział w proteolizie białek, m.in.
białek transkrypcyjnych oraz białek nieprawidłowych. Są to geny TAPl i
TAP2 kodujące peptydowe transportery, przenoszące peptydy (pocięte
białka) do siateczki śródplazmatycznej w celu prezentacji ich przez
cząsteczki klasy I MHC. Dwa inne geny LMP2 i LMP7 kodują podjednostki
kompleksu białek cytoplazmatycznych nazywanych proteasomami. O
szczegónej roli proteasomu świadczy określanie go jako
„wewnątrzkomórkowego układu immunologicznego”.
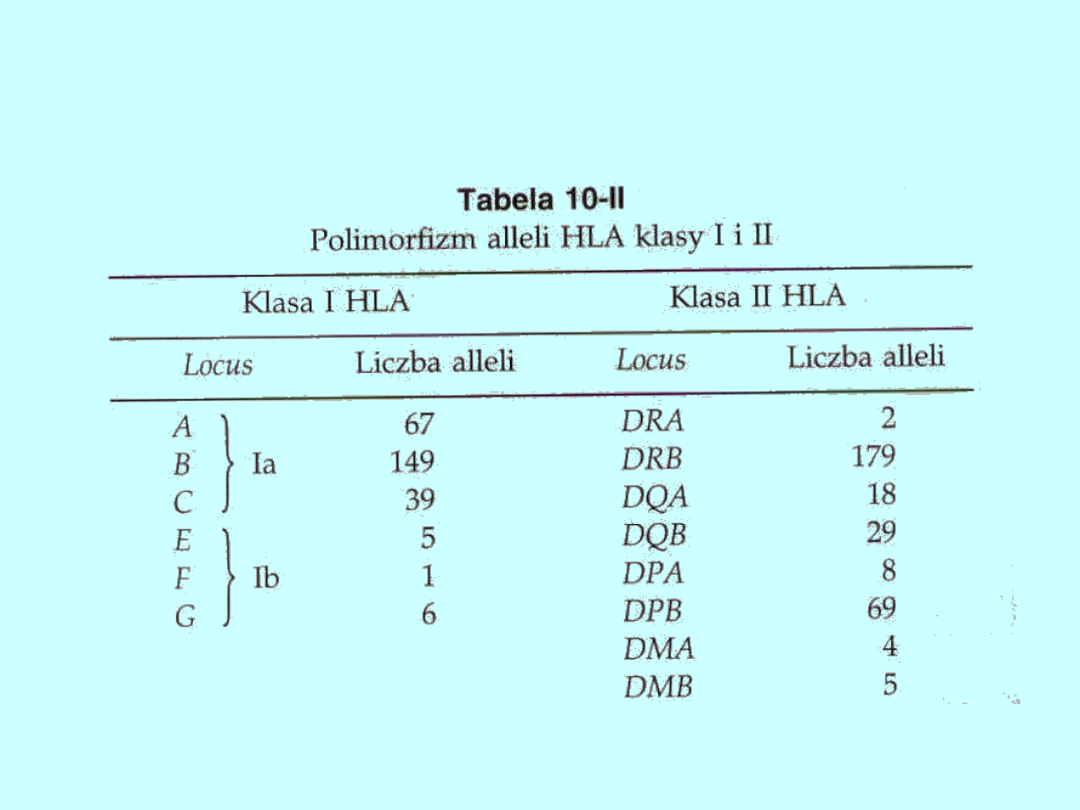
Dotychczas wykryto 267 alleli klasy I HLA, 314 alleli klasy II i 40 alleli klasy
III. Ta liczba alleli wynika z ogromnego polimorfizmu genów MHC.
Stwierdzono na przykład, że geny HLA-A, -b, -DRB i -DPB występują w
postaci kilkudziesięciu alleli (tab. 10-II). Nieliczne z genów MHC, na przykład
DRA, mają tylko 2 allele. Jest pewnym paradoksem, iż cząsteczka DR jest
kodowana przez wysoko polimorficzny gen DRB (determinujący syntezę
łańcucha β) oraz dialleliczny gen DRA (kontrolujący syntezę łańcucha α).
Ponadto w obrębie HLA wykryto także kilkanaście pseudogenów, nie
podlegających transkrypcji (np. HLA kląsy II - DPB2 i DPA2) oraz geny
kodujące inne białka, m.in. geny dla 21-hydroksylazy (CYP21), białek szoku
cieplnego 70 (HSP70) i dwa geny dla czynnika martwicy nowotworu (TNFA i
TNFB).

Jak wspomniano na początku tego podrozdziału, główny układ
zgodności tkankowej jest regionem względnie konserwatywnym i
istnieje wiele homologii między MHC u ludzi i różnych gatunków
zwierząt. Na przykład homologia genów klasy II u ludzi i myszy jest
następująca:
myszy: Aα Aβ Eα Eβ P O/N M
ludzie: DQα DQβ DRα DRβ DP DOB/DNA DM
Główny układ zgodności tkankowej zwierząt gospodarskich
Główny układ zgodności tkankowej zwierząt gospodarskich jest
mniej poznany. Wiadomo jednak, iż homologia między
poszczególnymi gatunkami
i człowiekiem jest duża. Porównanie genów znajdujących się w
obrębie MHC u poszczególnych gatunków zwierząt zawarto
w tabeli 10-III.


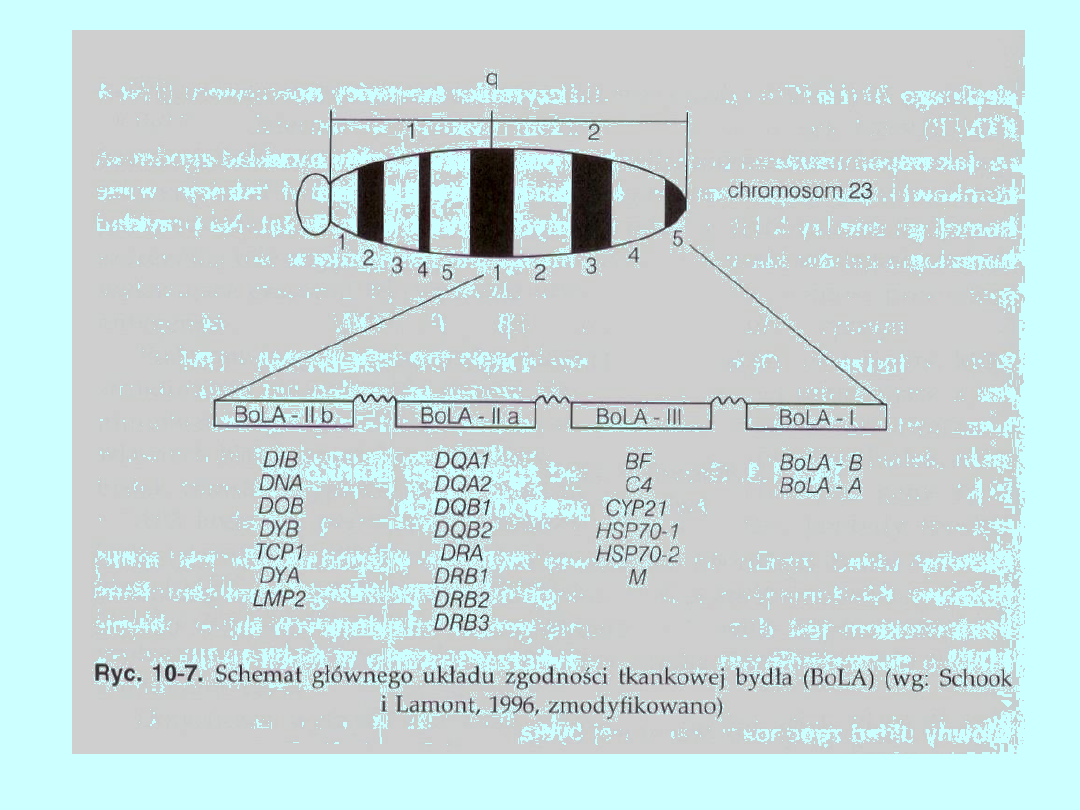
Główny układ zgodności tkankowej bydła
Główny układ zgodności tkankowej bydła zlokalizowano w 23
chromosomie, w którym znanych jest także ponad 30 genów
strukturalnych i kilkanaście markerów rnikrosatelitarnych. Jest to
najlepiej poznany chromosom bydła. Liczba poznanych haplotypów
BoLA jest już bardzo długa i stale się zwiększa. Struktura BoLA
przedstawiona jest na rycinie 10-7.
Produkty genów klasy I Są to klasyczne cząsteczki MHC. Nie wykryto
dotąd cząsteczek klasy I będących nieklasycznymi cząsteczkami. Geny
klasy I należą do dwóch grup — A i B, różniących się delecją 6 par
zasad w eksonie 5, który koduje krótki fragment transbłonowy
łańcucha cząsteczki MHC. W obrębie klasy II obserwowany jest duży
polimorfizm genów. Za pomocą analizy molekularnej (RFLP)
zidentyfikowano już 46 haplotypów DRB, 26 DQB i 31 DQA. W locus
DRB wykryto pseudogen (DRB1), różniący się od genów tego locus
kodonem „stop” w eksonie kodującym transbłonowy fragment
łańcucha cząsteczki MHC. Homologia między genami BoLA i HLA jest
stosunkowo duża. Na przykład gen DRB3 wykazuje 85% homologii z
genem HLA — DRB1, natomiast DQA bydła i człowieka — 75%
homologii.

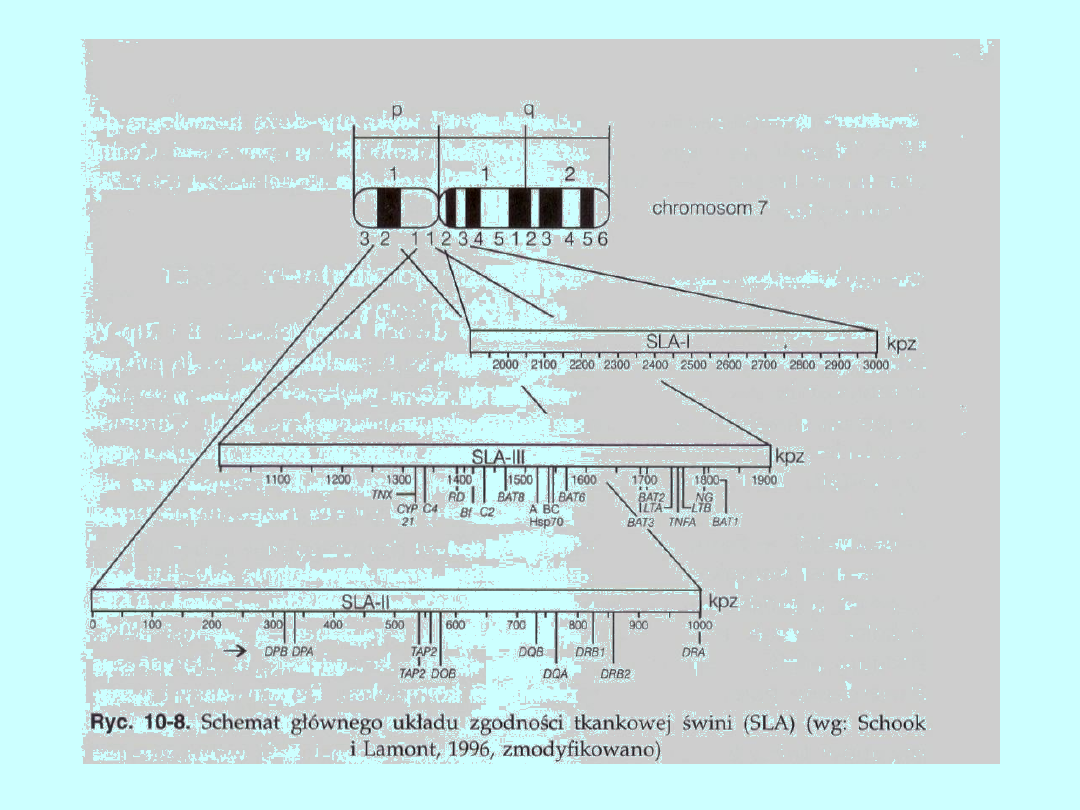
Główny układ zgodności tkankowej świni
Główny układ zgodności tkankowej świń został zmapowany w
chromosomie 7 ponad ćwierć wieku temu. Regiony klasy I i II
znajdują się blisko siebie, odległość między nimi wynosi 0,4 cM.
Natomiast odległość między genami klasy I i III oraz III i II jest co
najmniej o 100 tys. par zasad mniejsza niż w MHC u ludzi. Nie jest
znana dokładna liczba genów klasy I SLA, szacuje się, że jest ich
około 7—10. Tylko kilka genów regionu klasy I wykazuje ekspresję.
Są to PD1, PD7 i PD14, których homologia wynosi około 80—85% i
bardziej różniące się od nich (podobieństwo około 50%) PD6 i PDI5.
Wydaje się, że region klasy I SLA jest mniejszy od analogicznego
regionu
u ludzi i myszy. Region klasy II zawiera wiele genów, spośród których
przypuszczalnie tylko DR i DQ wykazują ekspresję na poziomie
białka. Niektóre geny, DQA, DQB, DRA i DRB, mają dużą homologię,
w granicach 75—87%, z odpowiadającymi im genami HLA. Podobnie
jak u innych gatunków, w SLA znajdują się także pseudogeny. Jest
nim na przykład gen DRB2, w którym stwierdzono delecję
nukleotydu w kodonie 53.
W regionie klasy III, w przeciwieństwie do innych gatunków, znajdują
się po jednym genie CYP21, C2 i C4. W regionie tym są także inne
geny typowe dla tego układu (ryc. 10-8).

Główny układ zgodności tkankowej owcy
Główny układ zgodności tkankowej owiec oznaczony jest skrótem OLA,
ale można również spotkać określenie Ovar (ang. ovine aries). Dotąd
nie sporządzono mapy fizycznej tego układu, ale informacje uzyskane
za pomocą analizy sprzężeń wykazują podobieństwa OLA do MHC u
ludzi i bydła. Mapa sprzężeniową owczego chromosomu 20, w którym
znajduje się główny układ zgodności tkankowej, ma długość 5,6 cM. W
regionie OLA klasy I zidentyfikowano blisko sprzężone loci: OLA -A i -B,
a częstość rekombinacji między nimi wynosi 0,6%. W regionie klasy II,
podobnie jak u bydła, obok genów MHC znajdują się pseudogeny.
Najlepiej poznany jest pseudogen DRB2. W wyniku mutacji, które
wykryto w tym pseudogenie, w eksonach 3 i 4 znajdują się kodony
„stop”, powodujące, iż nie jest on funkcjonalny. Geny klasy II wykazują
duży polimorfizm, przy czym geny z locus DQB cechuje większy
polimorfizm niż z locus DQA i DRA.
Struktura genetyczna regionu OLA klasy III wykazuje dużą homologię
do HLA. Długość tego regionu u owiec wynosi około 150 tys. par zasad.
Cechą charakterystyczną klasy III OLA jest duplikacja loci dopełniacza
C4 i 21-hydroksylazy (CYP21).

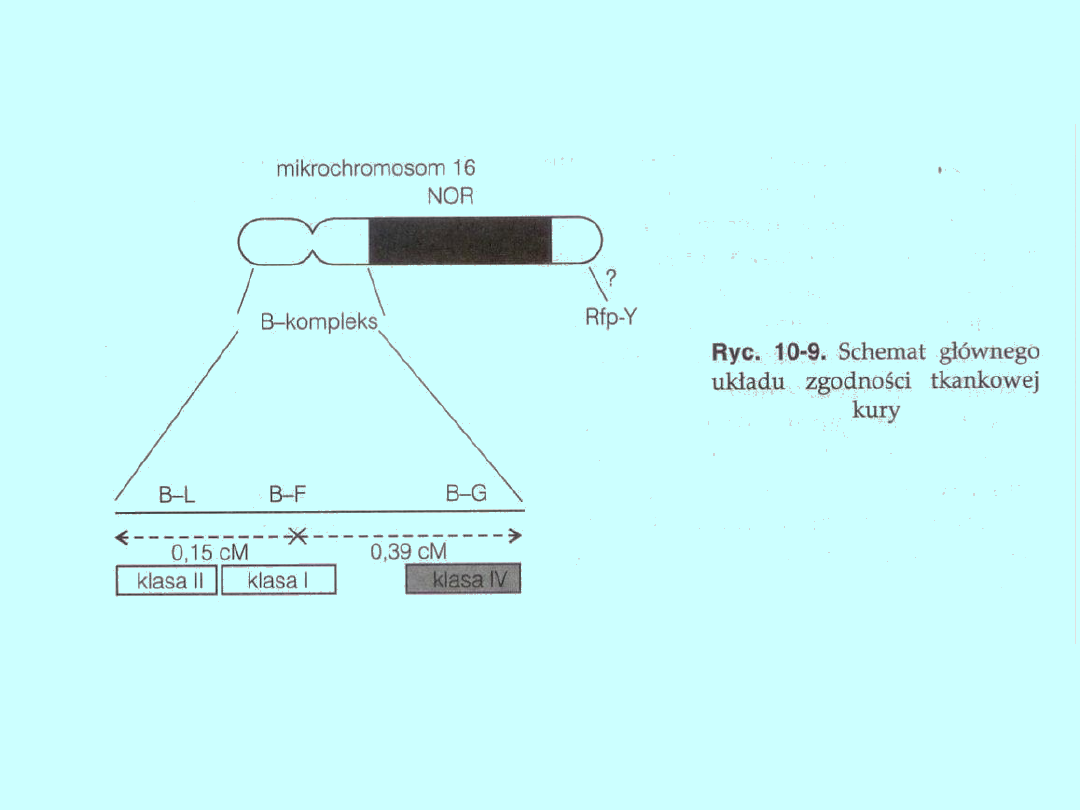
Główny układ zgodności tkankowej kury
U drobiu geny MHC są zlokalizowane w dwóch kompleksach: B i Rfp-Y,
które są klasyfikowane niezależnie. Kompleks B znajduje się w 16
mikrochromosomie, natomiast w odniesieniu do Rfp-Y większość badaczy
uważa, że jest on zlokalizowany również w tym chromosomie (ryc. 10-9).
Chromosom 16 jest jedynym chromosomem u drobiu mającym obszar
jąderkotwórczy (NOR). Za typowy MHC uważany jest kompleks B,
przypuszcza się natomiast, że kompleks Rfp-Y jest włączony w proces
rozpoznania przez komórki NK — naturalnych zabójców. Długość
kompleksu B u drobiu wynosi prawdopodobnie 300—400 kpz, częstość
rekombinacji między skrajnymi loci tego układu — około 0,5%. Z kolei,
częstość rekombinacji regionu Rfp-Y z regionem B wynosi 100%. Badania
MHC
u drobiu koncentrują się na kompleksie B. Dotychczas stwierdzono
ponad 30 haplotypów tego kompleksu. Region klasy I oznaczony jest
symbolem B-F, klasy II — B-L, a klasy IV — B-G. O ile funkcje regionów B-
F i B-L są znane, o tyle funkcja regionu B-G wciąż nie jest wyjaśniona. U
drobiu nie ma regionu klasy III, chociaż niedawno zmapowano w obrębie
MHC u drobiu gen G9a należący do klasy III HLA. Wyniki badań
prowadzonych na dużych populacjach referencyjnych wskazują na
możliwość sprzężenia przynajmniej kilku genów klasy III z MHC drobiu.
Jak już wspomniano przy omawianiu budowy cząsteczki klasy I, gen
łańcucha lekkiego (β2-mikroglobuliny) znajduje się poza głównym
układem zgodności tkankowej. U drobiu zlokalizowano go metodą FISH
(hybrydyzacja fluorescencyjna in situ) w dużym mikrochromosomie
(numer 9 lub 10 pod względem wielkości).

Identyfikacja cząsteczek głównego układu zgodności
tkankowej
Określanie genotypu osobnika pod względem układu zgodności
tkankowej (haplotypu) może być przeprowadzane dwoma podstawowymi
sposobami:
1) za pomocą metod serologicznych, pozwalających na identyfikację
określonej cząsteczki (białka, antygenu) MHC,
2) poprzez analizę molekularną DNA, dzięki której możliwe jest wykrycie
obecności danego allelu MHC.
Do badań serologicznych wykorzystywane są surowice lub, od pewnego
czasu, przeciwciała monoklonalne. Natomiast bezpośrednia identyfikacja
genów MHC jest możliwa dzięki takim technikom genetyki molekularnej,
jak:
• hybrydyzacja z sondą komplementarną do danego allelu (ang. allele
specific oligonucleotides — ASO), poprzedzona amplifikacją danego
fragmentu DNA (PCR),
• metoda RFLP.
Cząsteczki MHC klasy II można również identyfikować w mieszanej
hodowli limfocytów (MLC). Udoskonaleniem tej techniki jest test HTC, w
którym używane są homozygotyczne komórki stymulujące.
Zainteresowani tym zagadnieniem znajdą szczegółowe informacje
w podręczniku immunologii.

Znaczenie głównego układu zgodności tkankowej
Związek MHC z odpornością na choroby
Najważniejszą funkcją cząsteczek MHC jest udział w odpowiedzi
immunologicznej organizmu na infekcje wewnątrzkomórkowe. Mechanizm ten
przed stawiony jest
w podrozdziale: Zarys przebiegu reakcji odpornościowej.
Rola głównego układu zgodności tkankowej w odporności/podatności na wiele
chorób
u ludzi jest przedmiotem intensywnie prowadzonych badań. Znane są już
powiązania antygenów MHC z zapadalnością na różne choroby.
U zwierząt gospodarskich analogiczne badania są znacznie mniej
zaawansowane, ale ich wyniki świadczą o wpływie MHC na
podatność/odporność na niektóre choroby.
Na przykład, badania układu zgodności tkankowej u bydła (BoLA) wykazały
jego związek
z odpornością na mastitis, białaczkę, tuberkulozę, inwazję kleszczy i
pasożytów oraz trypanosomatozę (tab. 10-IV).
U owiec najbardziej zaawansowane są badania nad zależnością między
podatnością/odpornością na inwazje pasożytnicze a głównym układem
zgodności tkankowej. Podstawowym celem tych badań jest ustalenie
antygenów MHC mogących być wskaźnikami selekcyjnymi odporności owiec
na pasożyty wewnętrzne.
Główny układ zgodności tkankowej u koni (ELA) jest najmniej poznany, ale
stwierdzono już jego związek z odpornością na raka skóry.


U trzody chlewnej geny klasy I są przypuszczalnie głównymi genami
włączonymi
w regulację odpowiedzi immunologicznej na inwazję nicieni Trichinella
spiralis.
U kur główny układ zgodności tkankowej jest związany z odpornością na
chorobę Mareka, kokcydiozę, mięsaka Rousa i cholerę ptasią.Coraz
częściej u zwierząt gospodarskich identyfikowane są haplotypy związane
z określoną reakcją na infekcje. Na przykład, haplotypy klasy II bydła
uznane za skorelowane
z odpornością/podatnością na białaczkę są następujące:
DQA *3A-DQB *3A-DRB2* 2A-DRB3.2 *11 — odporność
DQA*12-DQB*12-DRB2*3A-DRB3.2*8 — podatność
Związek MHC z cechami produkcyjnymi i reprodukcyjnymi
Główny układ zgodności tkankowej, oprócz szczególnej roli w reakcji
immunologicznej, oddziałuje także na inne cechy (produkcyjne i
reprodukcyjne).
U bydła mlecznego stwierdzono istotne oddziaływanie niektórych
cząsteczek MHC klasy I na cechy związane
z użytkowością mleczną, natomiast u bydła ras mięsnych zauważono
korelację między przyrostami masy dała i przekrojem mięśnia
najdłuższego grzbietu
a obecnością określonych antygenów MHC.
Wyniki badań prowadzonych na trzodzie chlewnej świadczą o wpływie
MHC na cechy tuczne i rzeźne świń, przy czym stwierdzono różną
współzależność danego haplotypu z cechami produkcyjnymi zależnie od
rasy.

Badania znaczenia głównego układu zgodności tkankowej w reprodukcji
zwierząt gospodarskich prowadzone były przede wszystkim na świniach.
Dotyczyły one wpływu MHC na stopień owulacji, przeżywalność zarodków i
płodów oraz liczebność miotu. Wykazano wyraźny wpływ haplotypu
rodziców na te cechy. Również u bydła antygeny MHC mogą wpływać na
zamieralność zarodków, obniżać stopień przeżywalności i masę dała
cieląt. Wykazano ponadto istotny związek niektórych antygenów klasy II z
za trzymaniem łożyska. U koni natomiast stwierdzono, iż geny ELA mogą
wpływać na zmniejszenie płodności przy kojarzeniach ogierów i klaczy
o identycznych haplotypach.
Dokładne poznanie struktury i funkcji głównego układu zgodności
tkankowej zwierząt gospodarskich oraz jego związku z odpornością,
reprodukcją
i produkcyjnością powinno
w przyszłości umożliwić wykorzystanie cząsteczek (antygenów) MHC jako
markerów genetycznych w doskonaleniu zwierząt pod względem tych
cech.

Zarys przebiegu reakcji odpornościowej
W odpowiedzi na wniknięcie patogenów (wirusy, bakterie i pasożyty) do
organizmu układ immunologiczny reaguje w różny sposób, zależnie od
rodzaju patogenu i miejsca infekcji. Zasadniczą rolę w ich rozpoznaniu,
bez względu na to, czy są to antygeny zewnątrzkomórkowe czy
wewnątrz komórkowe, odgrywają cząsteczki głównego układu
zgodności tkankowej. Przebieg reakcji immunologicznej jest niezmiernie
skomplikowany i jak dotychczas, nie do końca został poznany. Obecna
wiedza pozwala na przedstawienie jedynie w zarysie przebiegu reakcji,
zwłaszcza w odniesieniu do zakażenia zewnątrzkomórkowego.
Cząsteczki MHC klasy I biorą udział w odpowiedzi układu
immunologicznego na wirusową infekcję wewnątrzkomórkową. W
zakażonej komórce białka wirusowe ulegają proteolizie (w cytosolu),
czyli są degradowane do peptydów. Peptydy te są następnie
przekazywane do siateczki śródplazmatycznej. W siateczce
śródplazmatycznej są syntetyzowane cząsteczki klasy I MHC. Tutaj też
następuje związanie cząsteczki MHC z peptydem, po czym powstały
kompleks transportowany jest na powierzchnię komórki, gdzie zostaje
rozpoznany przez obecne w pobliżu limfocyty T cytotoksyczne,
nazywane inaczej zabijającymi, mające na powierzchni cząsteczkę CD8.
Limfocyty te uwalniają cytokiny hamujące replikację wirusów i
cytotoksyny, które zabijają zakażoną komórkę (ryc. 10-10a).
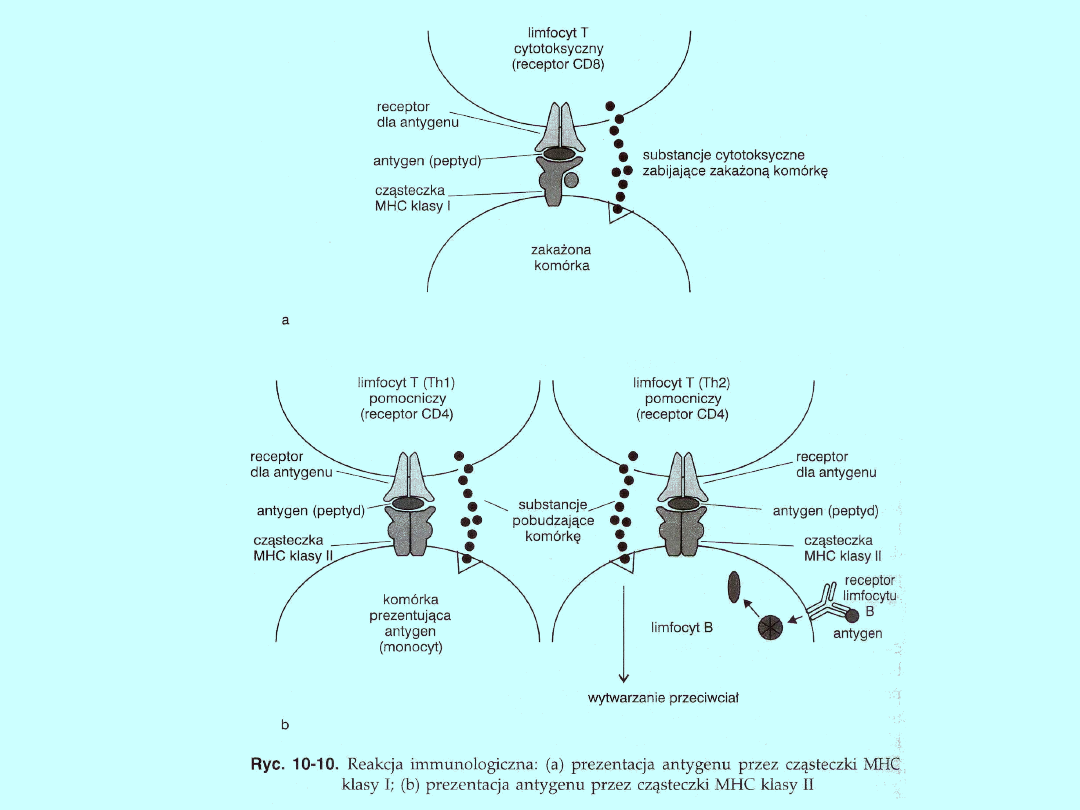

Cząsteczki MHC klasy II uczestniczą w reakcji przeciwko infekcji
zewnątrzkomórkowej, prezentując przede wszystkim obce
antygeny, które zostały pochłonięte przez wyspecjalizowane
komórki układu immunologicznego — komórki dendrytyczne,
makrofagi lub limfocyty B. Podczas infekcji bakteryjnej, jeśli
bakterie zostaną pochłonięte przez makrofagi, są rozkładane na
peptydy w wakuolach (endosomach). Peptydy te wiążą się z
cząsteczkami MHC klasy II, przedostającymi się z siateczki
śródpiazmatycznej. Powstały kompleks jest transportowany na
powierzchnię komórki i tutaj rozpoznawany przez limfocyty T CD4
typu zapalnego (Thl). Limfocyty te nie niszczą komórek tak jak
limfocyty T cytotoksyczne (CD8), ale uwalniają limfokiny aktywujące
komórkę do zwalczenia infekcji (ryc. 10-10b). W określonych
przypadkach, gdy jest zbyt mała liczba limfocytów B zdolnych do
rozpoznania antygenu (co może wystąpić przy pierwszym zetknięciu
się organizmu z danym antygenem) bądź gdy fagocytowane
cząsteczki lub bakterie są dużych rozmiarów, makrofagi mogą
pełnić rolę pośrednią, prezentując limfocytom B cząsteczki po
fagocytozie i wstępnej fragmentacji. Makrofagi wchłaniają,
degradują i prezentują wszystkie antygeny
(ryc. 10-10b).

Jeśli bakterie zostaną pochłonięte przez limfocyty B, w
odpowiedzi immunologicznej biorą udział limfocyty T CD4
pomocnicze, określane jako Th2. Dojrzały limfocyt B ma na swej
powierzchni przeciwciała IgM lub IgM i IgD, które służą jako
receptory antygenów. Obce białko rozpoznane przez limfocyt B
jest przekazywane do wakuoli (endosomów) i tam trawione na
krótkie peptydy. Następnie peptydy te są wiązane przez
cząsteczki klasy II, które dotarły tu z siateczki
śródplazmatycznej. Utworzony kompleks, po przedostaniu się na
powierzchnię komórki, jest rozpoznawany przez limfocyt
pomocniczy T. Limfocyt ten daje sygnał limfocytom B do
proliferacji (namnażania) i syntezy przeciwciał. Zaktywowane
limfocyty B rozpoczynają syntezę przeciwciał wtórnych (IgG, IgE
lub IgA), które różnią się od pierwotnych tylko strukturą
łańcucha ciężkiego. Tak więc wytwarzanie przeciwciał przez
limfocyty B jest kontrolowane przez cząsteczki MHC
i limfocyty T (ryc. 10-10b).
Zdolność cząsteczek MHC do wiązania peptydów, a raczej ich
pojemność jest różna. Jedna cząsteczka MHC klasy I może w
swym rowku związać około 1000 różnych peptydów, natomiast
cząsteczka klasy II może ich związać dwa razy więcej.

Cząsteczki MHC biorą także udział w usuwaniu własnych białek
pochodzących z komórek, które uległy apoptozie. Apoptoza (gr.
apoptosis — opadanie) jest to programowana śmierć komórki,
czyli jej fizjologiczna śmierć. Podczas tego procesu komórka
początkowo kurczy się i oddziela od sąsiednich komórek,
chromatyna ulega kondensacji na obrzeżach jądra, wkrótce
potem jądro, a następnie cała komórka pęka, a jej fragmenty są
trawione przez sąsiadujące komórki.
Genetyczna oporność na choroby
Zmienność obserwowana u zwierząt dotyczy nie tylko cech
użytkowych (mleczność, nieśność itd.), ale także
oporności/podatności na choroby zakaźne i inwazyjne. Ostatnio
coraz więcej uwagi poświęca się genetycznie uwarunkowanej
oporności na choroby. Oporność na choroby jest definiowana jako
właściwość organizmu uniemożliwiająca rozwój choroby pomimo
wniknięcia patogenu. Genetyczna oporność nie obejmuje typowej
odpowiedzi immunologicznej.
Mechanizm dziedziczenia genetycznej oporności na różne choroby
nie został jeszcze w pełni poznany. Na ogół jest to cecha
poligeniczna, chociaż w przypadku niektórych schorzeń
stwierdzono, iż oporność na nie zależy od pojedynczego genu o
dużym efekcie, np. mutacja
w genie FUT1 odpowiadająca za oporność prosiąt na chorobę
obrzękową.

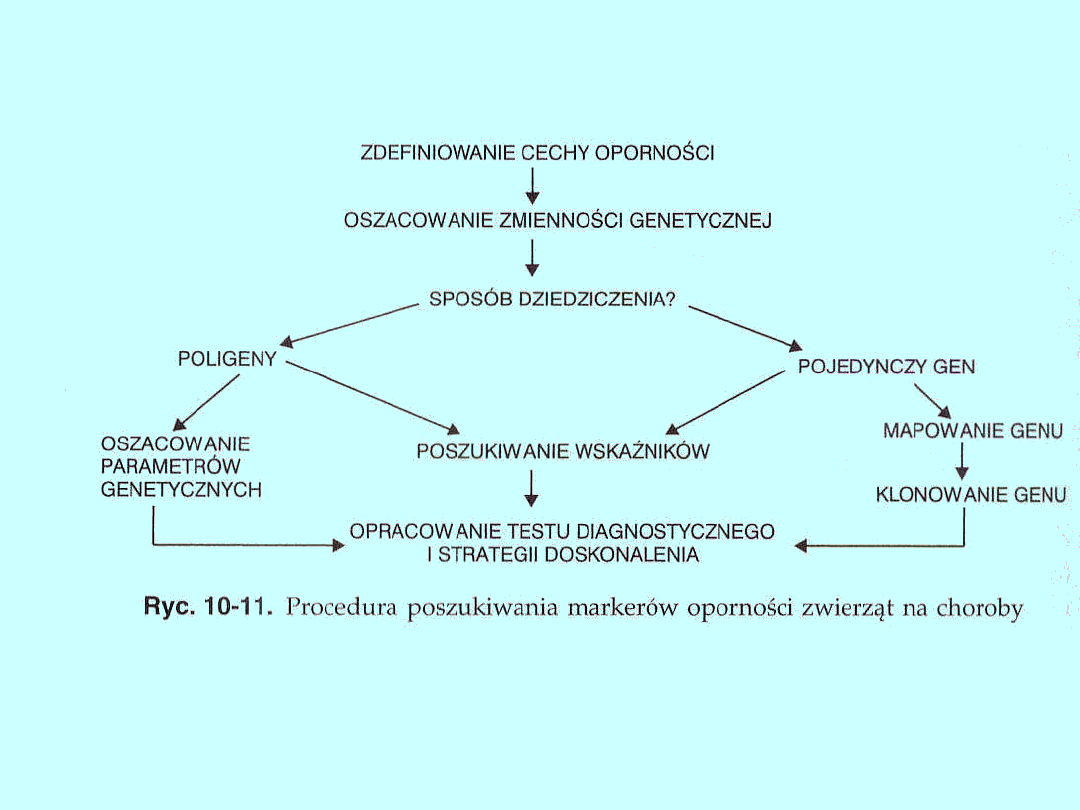
W ośrodkach naukowych wielu krajów prowadzone są intensywne badania,
których celem jest znalezienie takich genów.
Podstawowe założenia poszukiwania genów odpowiedzialnych za oporność
zwierząt na choroby obrazuje schemat (ryc. 10-11).
Wybór cechy będącej wskaźnikiem oporności powinien być przeprowadzony
z uwzględnieniem pewnych kryteriów. Cecha ta powinna:
• charakteryzować się dużą genetyczną zmiennością i odziedziczalnością
• mieć istotną wartość ekonomiczną; może nią być produkt nadający się do
sprzedaży bądź zmniejszający koszty produkcji
• być łatwa do mierzenia bez ponoszenia wysokich kosztów.
Gdy cecha — wskaźnik oporności jest już wybrana, należy oszacować jej
zmienność genetyczną. Umożliwi to poznanie sposobu jej dziedziczenia. W
przypadku gdy oporność na chorobę jest cechą poligeniczną, następnym
krokiem jest oszacowanie parametrów genetycznych: odziedziczalności tej
cechy i jej korelacji genetycznej
z innymi cechami istotnymi ekonomicznie. Informacje te mogą być
przydatne
w opracowaniu strategii doskonalenia oporności. Jeśli okaże się, iż cecha
oporności jest warunkowana pojedynczym genem, celowe jest zmapowanie
tego genu, czyli określenie jego położenia w chromosomie, następnie
sklonowanie go i poznanie sekwencji nukleotydów.

Zasadniczym krokiem w badaniach genetycznej oporności jest
poszukiwanie sprzężeń między genetyczną opornością,
warunkowaną wieloma lub jednym genem, a markerami
genetycznymi, takimi jak antygeny erytrocytarne czy białka
polimorficzne (markery klasy I) lub niekodujące sekwencje DNA
(markery klasy II). Sprzężenia takie są szczególnie korzystne w
selekcji, gdyż umożliwiają określanie opornością zwierzęcia bez
konieczności zarażania go patogenami.
W opracowaniu strategii doskonalenia oporności genetycznej
wykorzystuje się zarówno metody tradycyjne, jak i techniki
inżynierii genetycznej.
Tradycyjna praca hodowlana w kierunku zwiększenia oporności
zwierząt może być prowadzona w drodze selekcji pośredniej na
podstawie takich cech, jak:
• cechy eksterierowe (widoczne gołym okiem),
• cechy, które są określane za pomocą testów serologicznych lub
elektroforezy,
• cechy ustalane za pomocą badań molekularnych DNA.

Klasycznymi przykładami cech eksterierowych są: ciemna
obwódka wokół oczu u bydła rasy hereford (bydło z biało
umaszczoną głową), związana z opornością na raka oczu, i
barwne upierzenie drobiu, wskazujące na większą niż u
osobników białych oporność na choroby wirusowe.
Znajomość cech określanych metodami serologicznymi, które
mogą być wskaźnikami oporności na choroby, umożliwiałaby
prowadzenie selekcji wśród zwierząt młodych. Wyniki badań
prowadzonych na owcach w Australii i Nowej Zelandii wskazują
na zależność między genotypem hemoglobiny a częstością
zarażenia pasożytem Haemonchus contortus. Zwierzęta z
hemoglobiną AA są bardziej oporne niż osobniki z hemoglobiną
AB i BB. Innym markerem biochemicznym mogą być antygeny
erytrocytarne grup krwi. Na przykład, u bydła opornego na
białaczkę częściej występują antygeny erytrocytarne B, Y2 D' i
P'.
Największe możliwości ograniczania występowania chorób u
zwierząt na drodze hodowlanej stwarzają wyniki badań
molekularnych określających sekwencje nukleotydowe genów,
jak również badania genetycznej struktury głównego układu
zgodności tkankowej (MHC).

Ustalenie na tej podstawie oporności (lub podatności) na choroby
jest możliwe już u zarodka, co ma zasadnicze znaczenie w hodowli
bydła wobec coraz szerzej stosowanego ich transferu.
Na zmienność w podatności na choroby infekcyjne i pasożytnicze
składają się zarówno różnice osobnicze, jak i rasowe. Na przykład,
rodzime rasy bydła w Indii są bardziej wrażliwe na brucelozę niż ich
mieszańce z rasami europejskimi. W Kenii zarażenie bydła motylicą
wątrobową jest o wiele częstsze u ras importowanych z Europy niż u
ras miejscowych. Powszechnie znana jest oporność rodzimego bydła
afrykańskiego N’Dama na infekcję świdrowca Trypanosoma brucei
brucei, która prowadzi do śpiączki afrykańskiej (trypanosomatoza).
Choroba ta dziesiątkuje populacje bydła afrykańskiego. Różnice
rasowe w oporności/podatności na choroby mogą być
wykorzystywane do krzyżowania w celu uzyskania mieszańców
opornych na daną chorobę.
Zmienność podatności zwierząt na choroby najlepiej poznano u kur.
Dzięki wysokiej plenności i szybkiej rotacji pokoleń prowadzona u
tego gatunku intensywna selekcja w kierunku oporności na chorobę
Marek umożliwiła wytworzenie rodów kur całkowicie niewrażliwych
na to schorzenie,
z zachowaniem ich wysokiej produkcyjności.

Mechanizm oporności na chorobę Mareka przypuszczalnie polega na
ograniczaniu rozwoju guzów u zainfekowanych ptaków, nie
zabezpieczając ich przed infekcją. Zjawisko oporności u kur
obserwowane jest także w odniesieniu do kokcydiozy i salmonellozy.
Kokcydioza powoduje obniżony stopień wzrostu, zmniejszone
wykorzystanie paszy, a także, zwłaszcza u młodych kurcząt,
śmiertelność. Za wskaźnik oporności na kokcydiozę przyjęto liczbę
produkowanych oocyst. Badania genetycznych uwarunkowań
oporności na kokcydiozę wskazują na rolę genów głównego układu
zgodności tkankowej (MHC) i genów zlokalizowanych poza tym
układem. Kokcydioza jest równocześnie przykładem choroby, której
częstość występowania jest w dużej mierze stymulowana działaniem
czynników środowiskowych, w tym przypadku jest to temperatura
otoczenia. Zależność ta jest następstwem zróżnicowanej zdolności
termoregulacji u młodych ptaków.
Wyniki badań wrażliwości kur na bakterie Salmonella (S.
typhimurium, S. pullorum, S. gallinarum, S. enteritidis) sugerują, że
oporność na nie zależy od funkcji fagocytarnych komórek przede
wszystkim śledziony i wątroby. Ponadto świadczą one, iż oporność na
salmonellozę jest dominująca i może być warunkowana pojedynczym
genem.

Wykorzystanie zjawiska genetycznej oporności w celu poprawy
zdrowotności zwierząt gospodarskich ma szczególne znaczenie w
przypadku chorób trudnych do zwalczania metodami
weterynaryjnymi. Należą do nich stany zapalne gruczołu mlecznego
(mastitis), które są przyczyną poważnych strat ekonomicznych w
hodowli bydła mlecznego. Jedną z dróg ograniczania występowania
mastitis u bydła jest wykorzystanie w pracy hodowlanej różnic w
genetycznych skłonnościach do tego schorzenia. Obserwowane są
zarówno różnice rasowe, jak i indywidualne.
Na przykład, krowy rasy nizinnej czarno-białej i czerwonej duńsskiej
- częściej zapadają na zapalenia gruczołu mlecznego niż
holsztyńsko-fryzyjskiej, simentalery czy szwyce.
Oprócz różnic rasowych w podatności krów na mastitis stwierdzono
także wyraźne różnice w częstości występowania tego schorzenia
między rodzinami (po matkach) i liniami (po ojcach). Ze względu na
stosowaną sztuczną inseminację problem przekazywania przez ojca
oporności na mastitis jest bardzo istotny. Prowadzone są badania
nad możliwością wprowadzenia do oceny wartości hodowlanej
buhajów cechy „choroba” (mastitis). W Norwegii od 1978 roku
mastitis jest już włączone jako cecha selekcyjna w programach
hodowlanych.

Ocena rozpłodników jest dokonywana na podstawie zdrowotności
gruczołu mlecznego ich potomstwa żeńskiego. Inną drogą
zwalczania mastitis jest selekcja buhajów
w kierunku zmniejszenia zawartości komórek somatycznych w mleku
ich córek. Ta metoda selekcji jest zalecana na przykład w Szwecji.
Jednakże badania niektórych autorów wykazały istotną rolę
poszczególnych rodzajów komórek somatycznych w zabezpieczaniu
wymienia przed drobnoustrojami chorobo twórczymi. Można zatem
przypuszczać, iż selekcja w kierunku zmniejszenia zawartości
komórek somatycznych w mleku może zmniejszyć zdolność krów do
reakcji na infekcje gruczołu mlecznego. Wydaje się, iż byłoby celowe
prowadzenie selekcji pośredniej, opartej na wskaźnikach
fenotypowych oporności. Wielu badaczy wiąże skłonność krów do
stanów zapalnych (mastitis) z budową i wielkością wymienia oraz
strzyków, która
w znacznym stopniu jest uwarunkowana genetycznie. Stwierdzono
na przykład, że mastitis najczęściej występuje u krów, których
wymiona wykazują morfologiczne i fizjologiczne odchylenia od
normy, takie jak: nieproporcjonahy rozwój przednich i tylnych
ćwiartek, zbyt duża wielkość i niskie zawieszenie, za duże lub za
małe strzyki.

Obecnie w programach hodowlanych kładzie się wyraźny nacisk
na cechy morfologiczne wymion i zdolność wydojową krów, w
celu ograniczania występowania mastitis poprzez selekcję.
Podstawowymi kryteriami tej selekcji są, oprócz wydajności,
kształt i wielkość wymienia oraz strzyków, ustawienie strzyków,
wysokość zawieszenia wymienia i szybkość oddawania mleka.
Wybór tych cech jest uzasadniony ich uwarunkowaniem
genetycznym i powiązaniem ze stanem zdrowotnym wymienia.
Celem tych działań jest wyselekcjonowanie krów o prawidłowej
budowie wymienia, charakteryzujących się wysoką produkcją
mleka i zwiększoną opornością na mastitis.
Innym schorzeniem u bydła, którego leczenie jest bezskuteczne,
jest białaczka limfatyczna. Jej występowanie stwierdzono na
wszystkich kontynentach, ale najczęściej atakuje ona bydło w
krajach strefy umiarkowanej. Ponieważ wszelkie metody
zwalczania białaczki (poza eliminacją zwierząt zarażonych)
stosowane przez lekarzy weterynarii nie przynoszą oczekiwanych
wyników, coraz więcej uwagi poświęca się zagadnieniom wpływu
założeń genetycznych na skłonność do tego schorzenia, jak
również niekorzystnym warunkom środowiska (np. niedobór
niektórych pierwiastków, jak: magnez, wapń, kobalt i mangan).

Na podstawie licznych badań można sądzić, że skłonność do białaczki
jest przekazywana przez rodziców, a zwłaszcza przez chore matki.
Wydaje się, że większa zapadalność na białaczki krów od matek
chorych jest następstwem nie tylko dziedziczenia skłonności do tej
choroby, ale także zakażenia przez łożysko, siarę i mleko oraz, co
zostało udowodnione, przez uprzednio zarażoną wirusem białaczki
komórkę jajową. Wpływ buhajów na skłonność ich córek do białaczki
nie jest tak silny jak wpływ matek. Wiadomo, iż wirus białaczki
limfatycznej nie jest przenoszony podczas sztucznej inseminacji przez
nasienie. Z drugiej jednak strony wielu badaczy stwierdzało, że krowy
po niektórych buhajach znacznie częściej zapadają na tę chorobę, co
może być dowodem na dziedziczenie podatności na białaczkę.
Badania nad genetyczną opornością świń na choroby dotyczą przede
wszystkim biegunek u prosiąt, ale także innych schorzeń, na przykład
schorzeń kończyn. Genetyczne uwarunkowanie oporności prosiąt na
biegunki okresu noworodkowego i poodsadzeniowego wywoływane
szczepami K88 E. coli i PIS E. coli jest opisane w podrozdziale: Mutacje
genowe. W tym miejscu należy podkreślić, że praktycznie nie jest
możliwe uzyskanie zwierząt opornych na kilka chorób jednocześnie.
Można jedynie mówić o doskonaleniu cechy oporności na określone
schorzenie.

U owiec stwierdzono zróżnicowaną oporność na pasożyty
wewnętrzne. Stwarza to możliwość wykorzystywania tej właściwości
w ograniczaniu stopnia inwazji pasożytniczych u tego gatunku
zwierząt. Oporność owiec na pasożyty żołądkowo-jelitowe może
przejawiać się jako zdolność żywiciela do kontrolowania
występowania pasożyta, przez zmniejszanie jego ilości
i ograniczanie przeżywalności (ang. resistance), lub też jako zdolność
do współżycia z pasożytem (ang. resilience) poprzez utrzymywanie
produkcyjności na nie zmienionym poziomie nawet podczas inwazji.
Genetyczna zmienność zdolności do współżycia żywiciela z
pasożytem,
w odróżnieniu od genetycznej zmienności oporności, cieszy się
mniejszym zainteresowniem wśród badaczy, przede wszystkim z
powodu trudności w znalezieniu odpowiedniego wskaźnika tego
stanu. Stwierdzono, iż między opornością owiec na zarażenie
nicieniami żołądkowo-jelitowymi (np. Haemonchus contortus) a
„resilience” istnieje dodatnia korelacja genetyczna, której wartość
waha się w granicach 0,5—0,6. Prowadząc selekcję
w kierunku oporności na pasożyty można oczekiwać poprawy
skorelowanej z nią cechy zdolności współżycia z pasożytem.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
Wyszukiwarka
Podobne podstrony:
Genetyczne podstawy odporności
Genetyczne podstawy nowotworów, Biologia medyczna
GENETYCZNE PODSTAWY NOWOTWORÓW(1)
genetyka podstawowe wiadomości, Nauka, biologia, genetyka
ściąga-genetyczne, Genetyczne podstawy chorób SGGW
GENETYCZNE PODSTAWY ROZWOJU not Nieznany
Prelekcja 12 Genetyczne podstawy transplantacji - poprawiona, Biologia, Genetyka, Prelekcje genetyka
GENETYCZNE PODSTAWY ONKOGENEZY, Fizjoterapia, biologia medyczna
studenci genetyczne uwarunkowanie odporno
Genetyczne podstawy nowotworów, ^^Szkoła ^^, Biologia
studenci genetyczne uwarunkowanie odporności
B.M. GENETYCZNE PODSTAWY NOWOTWORÓW, Biologia molekularna
Genetyczne podstawy i kryteria systematyki gleb Polski, Genetyczne podstawy i kryteria systematyki g
Prelekcja 12 Genetyczne podstawy transplantacji
Genetyczne podstawy nowotworów, Biologia medyczna
GENETYCZNE PODSTAWY NOWOTWORÓW(1)
genetyka podstawowe wiadomości, Nauka, biologia, genetyka
więcej podobnych podstron