
Fizyka statystyczna
• Fizyka stanów równowagi
• Fizyka stanów nierówności
(zjawiska transportu)

Fizyka statystyczna stanów
równowagi
Układy złożone z dużej liczby cząsteczek
wymagają innego opisu teoretycznego, niż
układy z niewielką liczbą cząsteczek. W
pomiarach interesujące są wielkości
makroskopowe takie jak ciśnienie, ciepło
właściwe, namagnesowanie, przewodnictwo
cieplne i elektryczne.
W opisie teoretycznym wprowadza się
procedurę uśredniania po stanach
mikroskopowych.

Stany mikroskopowe układu - określony
przez podanie stanów wszystkich jego
cząstek.
• klasyczny stan określony przez trzy współrzędne
wektora położenia r i trzy współrzędne wektora
pędu p.
• W fizyce kwantowej stan układu określony przez
zbiór liczb kwantowych (elektrony w atomie) i
wektorów falowych k i spinów (elektrony
swobodne)
Q - zbiór liczb charakteryzujących stany
wszystkich cząstek, m
s,
(s) - magnetyczna liczba
spinowa
}
,..
,
,
,...
,
{
2
1
2
1
N
N
p
p
p
r
r
r
Q
}
,..
,
,
,...
,
{
2
1
2
1
N
s
s
s
N
m
m
m
k
k
k
Q
N - liczba cząsteczek w układzie i jest rzędu 10
23
.
Stany makroskopowe układu cząsteczek
wynikają ze stanów mikroskopowych.
X = X{Q(t)}
X - wielkość
makroskopowa
t - czas
Parametry makroskopowe (X) określają stan
makroskopowy układu. Parametry X są
uśredniane w trakcie pomiaru, np. w czasie T.
dt
t
Q
X
T
X
T
0
)
(
1

Jeżeli <X> nie zmienia się w czasie mówimy, że
układ jest w stanie równowagi. Obliczenie <X> jest
praktycznie niemożliwe (całka z 10
23
zmiennych!).
Obliczanie wartości średniej <X> realizuje się po
wprowadzeniu prawdopodobieństwa P(Q)
wystąpienia odpowiedniego stanu
mikroskopowego. Następnie wielkość X jest
uśredniana po różnych stanach Q, wziętych z
odpowiednimi prawdopodobieństwami.
Q
Q
X
Q
P
X
X
)
(
)
(
Obliczanie jest uwarunkowane znajomością
funkcji P(Q), W fizyce statystycznej stosuje się
trzy typy takich funkcji rozkładu, zwanych
rozkładami,

Funkcje rozkładu
•
Rozład mikrokanoniczny
- wszystkie stany
układu są jednakowo prawdopodobne P(Q) =
const. Rozkład mikrokanoniczny stosuje się do
opisu układów odizolowanych, ustalona energia,
liczba cząstek itp...
•
Rozład kanoniczny
- układ znajduje się w
kontakcie cieplnym z otoczeniem, ale nie zmienia
swoich innych parametrów (rozkład Maxwella).
•
Rozład wielki kanoniczny
- rozkład opisuje
układy, które wymieniają nie tylko energię z
otoczeniem, ale i cząsteczki (rozkład Fermiego-
Diraca, rozkład Bosego-Einsteina).

Kinetyczna teoria gazów
Ten sam zakres zagadnień jak w klasycznej
termodynamice. Przyjmuje się istnienie atomów i
cząsteczek. Podstawowymi prawami są prawa
mechaniki, zastosowane do atomów tworzących
układ.
Wielkości makroskopowe - ciśnienie, temperatura,
objętość.
Kinetyczna teoria gazów posługuje się stosunkowo
prostymi technikami uśredniania.

Gaz doskonały - opis
makroskopowy
• Cząstki poruszają się chaotycznie i podlegają
prawom Newtona.
• Całkowita liczba cząstek jest bardzo duża.
• Objętość cząstek jest bardzo małą częścią
objętości całego gazu, można ją pominąć.
• Poza momentem zderzenia na cząstki nie
działają żadne siły.
• Zderzenia są sprężyste i czas zderzenia można
pominąć.
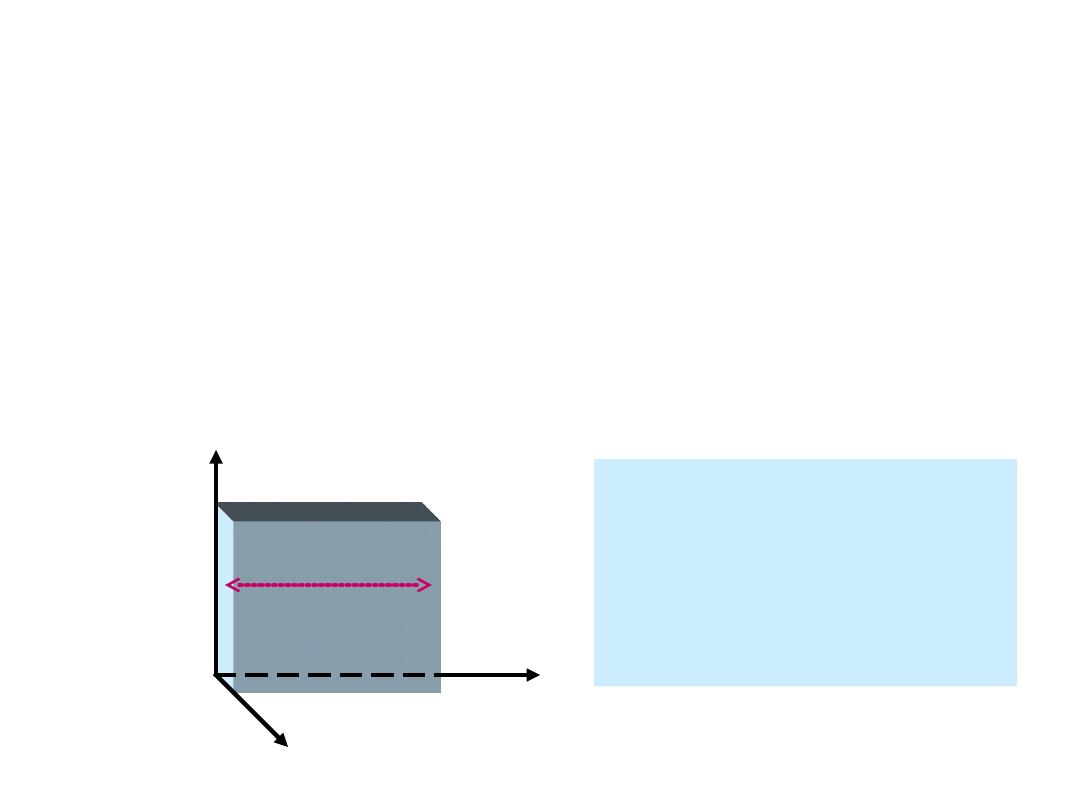
Obliczanie ciśnienia na
podstawie kinetycznej teorii
gazów
Rozważamy gaz doskonały zamknięty w
sześciennym pudełku o boku l, którego ścianki są
doskonale sprężyste. Po zderzeniu ze ścianką
zmiana pędu
P = -mv
x
- mv
x
= -2 mv
x
l
l
l
x
y
z
Zakładamy, że
cząstka zderza się ze
ścianką pudełka nie
zderzając się z innymi
ściankami po drodze.

Czas przelotu cząstki od ścianki do ścianki:
l/v
x
Liczba zderzeń w jednostce czasu: v
x
/2l
Szybkość przekazywania pędu ściance przez
cząstkę o masie m:
l
mv
l
v
mv
x
x
x
2
2
2
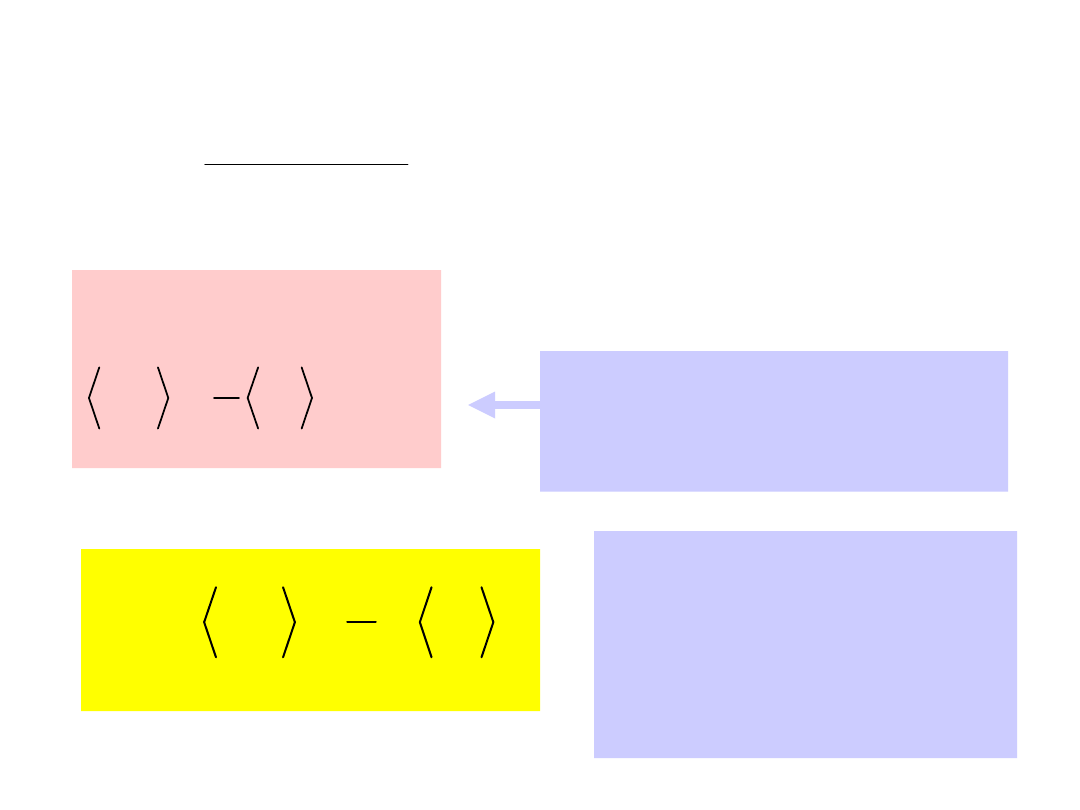
Ciśnienie wywierane przez cząstki na
ściankę:
...
2
2
2
1
3
x
x
v
v
l
m
p
N - liczba cząstek w naczyniu
n
o
- koncentracja cząstek
0
3
n
N
l
0
2
2
2
1
0
,
...
mn
N
v
v
mn
p
x
x
- gęstość
2
2
2
2
2
2
v
3
1
v
v
v
v
v
x
z
y
x
Wszystkie kierunki
prędkości są
równoważne
2
2
v
3
1
v
p
x
Z prawa Pascala
wynika, że ciśnienie
wywierane na
wszystkie ścianki jest
jednakowe
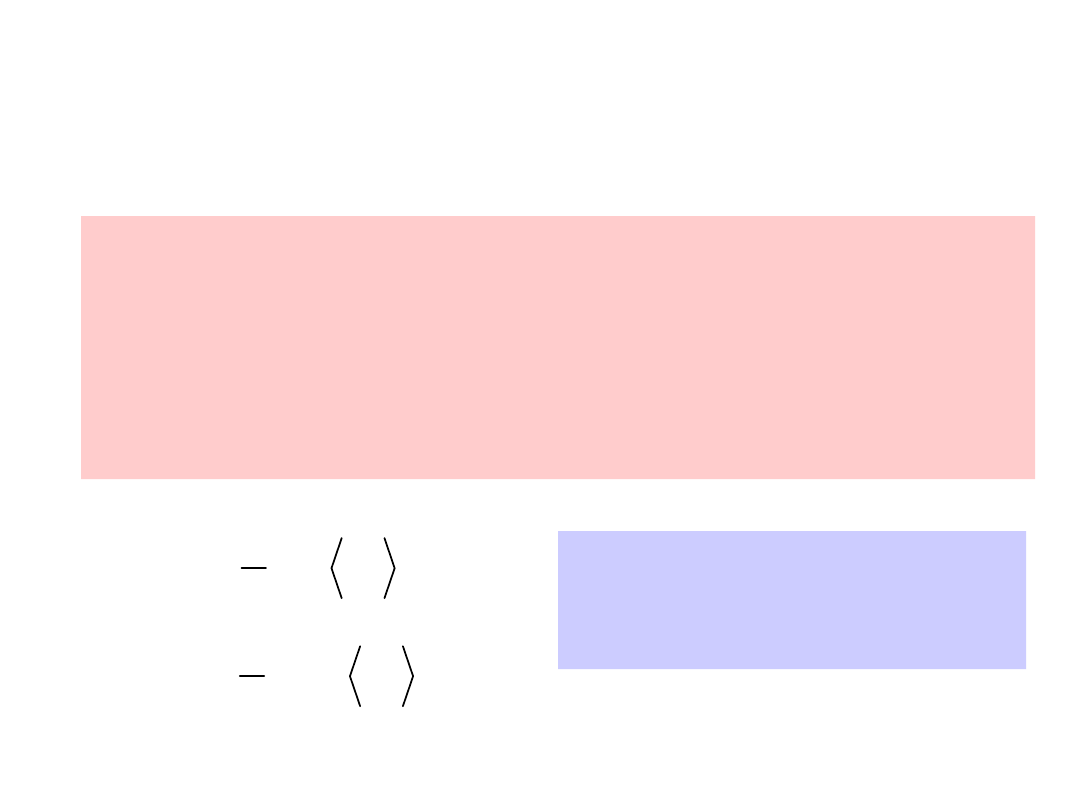
Kinetyczna interpretacja
temperatury
Jeżeli obie strony ostatniego równania
pomnożymy przez objętość V, a następnie
skorzystamy z równania gazu doskonałego,
to otrzymamy związek temperatury z
energią kinetyczną cząsteczek.
2
v
V
3
1
pV
2
v
V
n
3
1
pV
n - liczba moli
- masa molowa
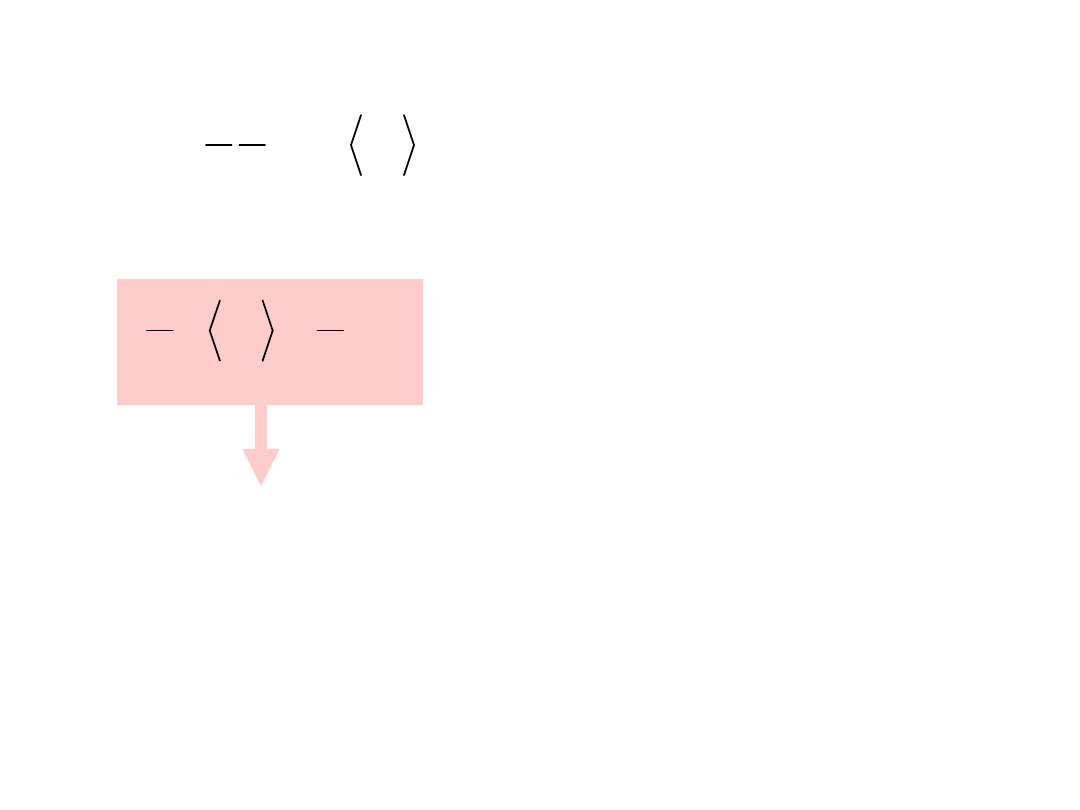
2
v
V
n
2
1
3
2
pV
RT
2
3
v
2
1
nRT
pV
2
Def. Temperatury: Całkowita energia
kinetyczna
ruchu postępowego jednego
mola gazu jest proporcjonalna do
temperatury.
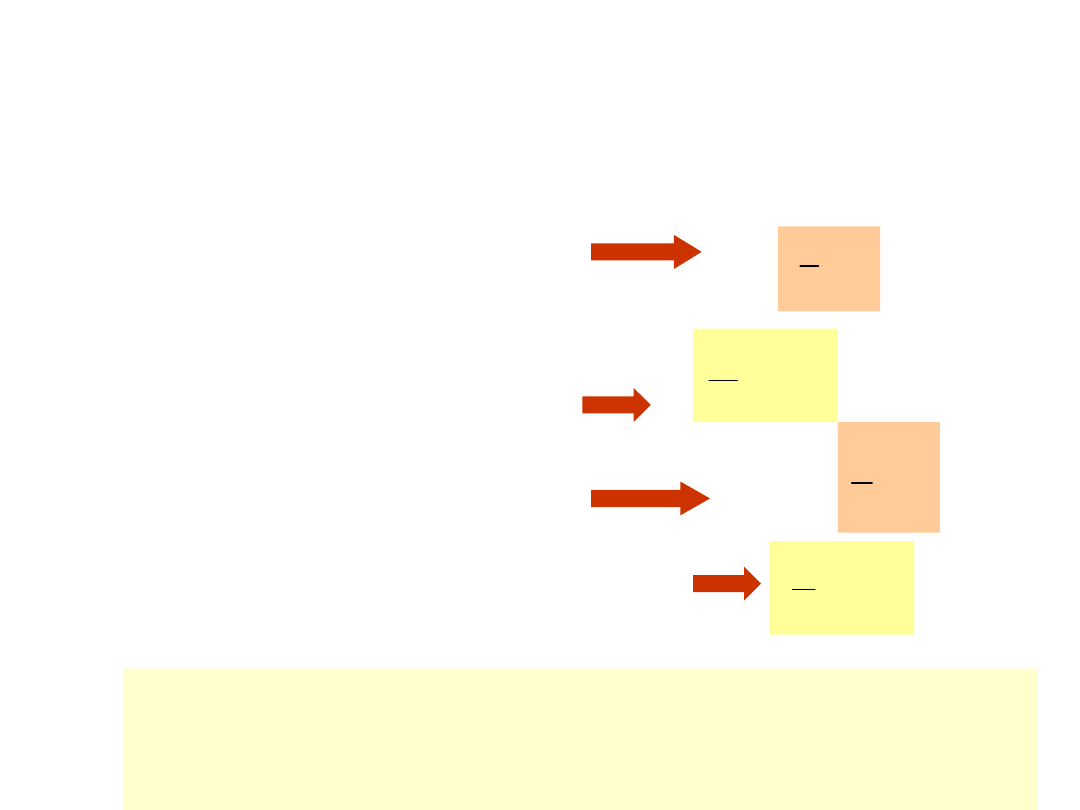
Zasada ekwipartycji energii
Energia cząsteczek gazu:
• Energia kinetyczna ruchu
postępowego opisana
wyrazami typu:
• Kinetyczna energia rotacji -
• Kinetyczna energia drgań
atomów tworzących
cząsteczkę -
• Energia potencjalna drgań
atomów tworzących
cząsteczkę -
2
x
mv
2
1
2
x
I
2
1
2
v
2
1
2
kx
2
1
k – stała sprężystości, µ - masa
zredukowana, - prędkość kątowa I –
moment bezwładności

Dostępna energia zależy tylko od
temperatury i rozkłada się w
równych porcjach na sposoby, w
jakie cząsteczki mogą ją absorbować.
Każdy z niezależnych sposobów absorpcji
energii nazywany jest stopniem swobody.
Na każdy składnik energii przypada
½
RT
Clerc Maxwell:
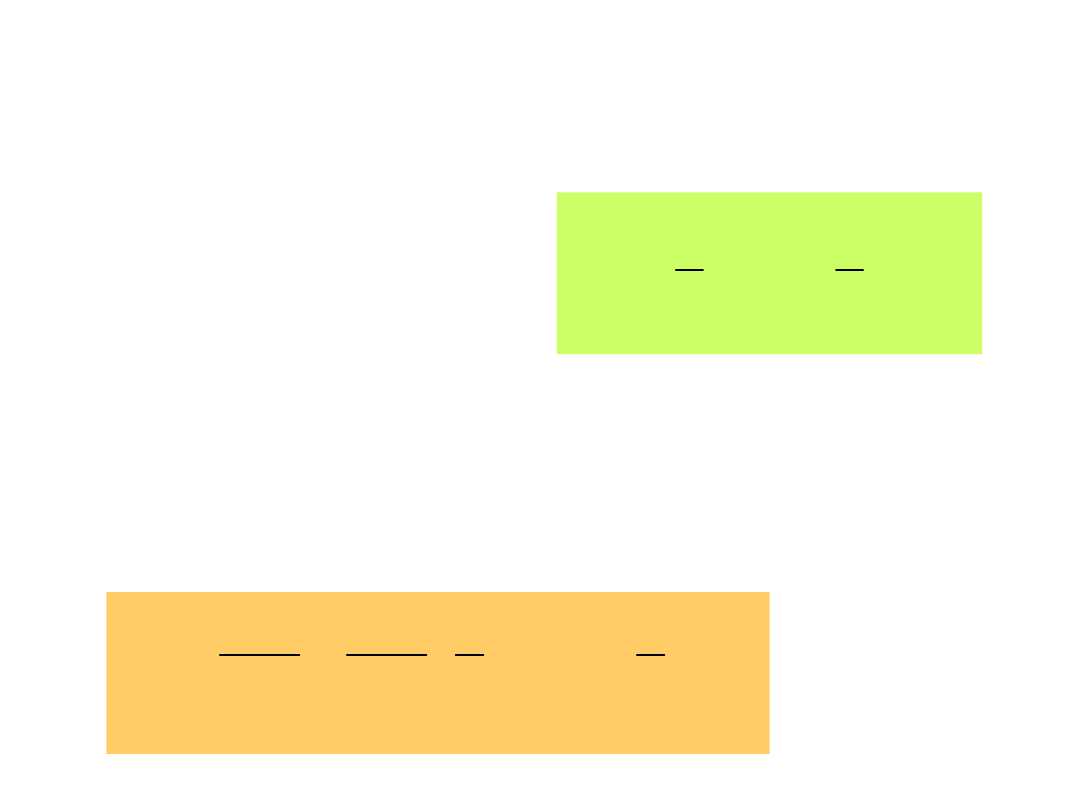
Ciepło właściwe
nRT
2
3
NkT
2
3
U
Energia wewnętrzna U
gazu doskonałego
N – liczba cząsteczek, n liczba moli
Ciepło właściwe gazu doskonałego w stałej
objętości
R
2
3
nRT
2
3
ndT
d
ndT
dU
c
v
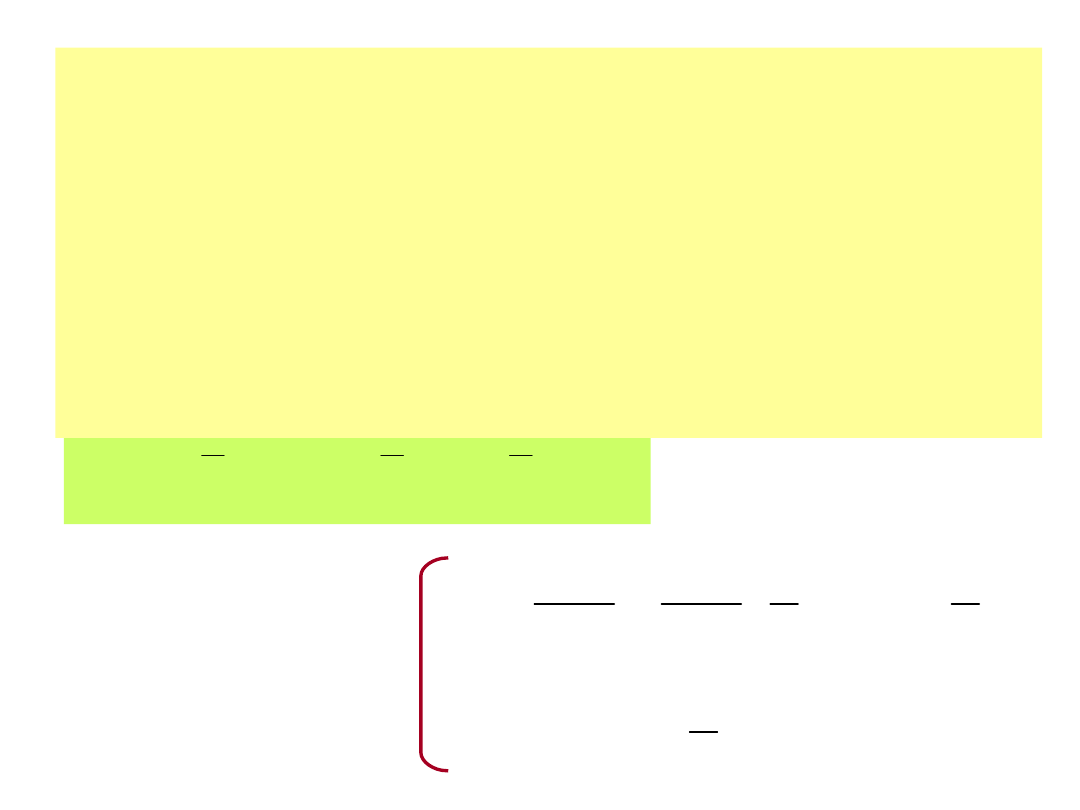
Dla gazów dwuatomowych, lub o jeszcze
bardziej złożonej strukturze energia
wewnętrzna jest sumą wszystkich rodzajów
energii. Przy obliczaniu ciepła właściwego
należy to uwzględniać.
Na przykład dla dla gazu dwuatomowego
(ruch postępowy i rotacyjny):
nRT
2
RT
2
1
n
RT
2
1
n
U
5
2
3
R
2
7
R
c
c
R
2
nRT
2
ndT
d
ndT
dU
c
v
p
v
5
5
Obliczanie ciepła
właściwego w
stałej objętości c
v
i
przy stałym
ciśnieniu c
p

Rozkład Maxwella prędkości
cząsteczek
Prędkości poszczególnych cząsteczek gazu
są różne. Dla danego gazu istnieje
charakterystyczny rozkład prędkości, który
zależy od temperatury.
Podane przez Maxwella prawo rozkładu
prędkości cząsteczek ma postać:
kT
mv
e
v
kT
m
N
v
N
2
2
2
3
2
2
4
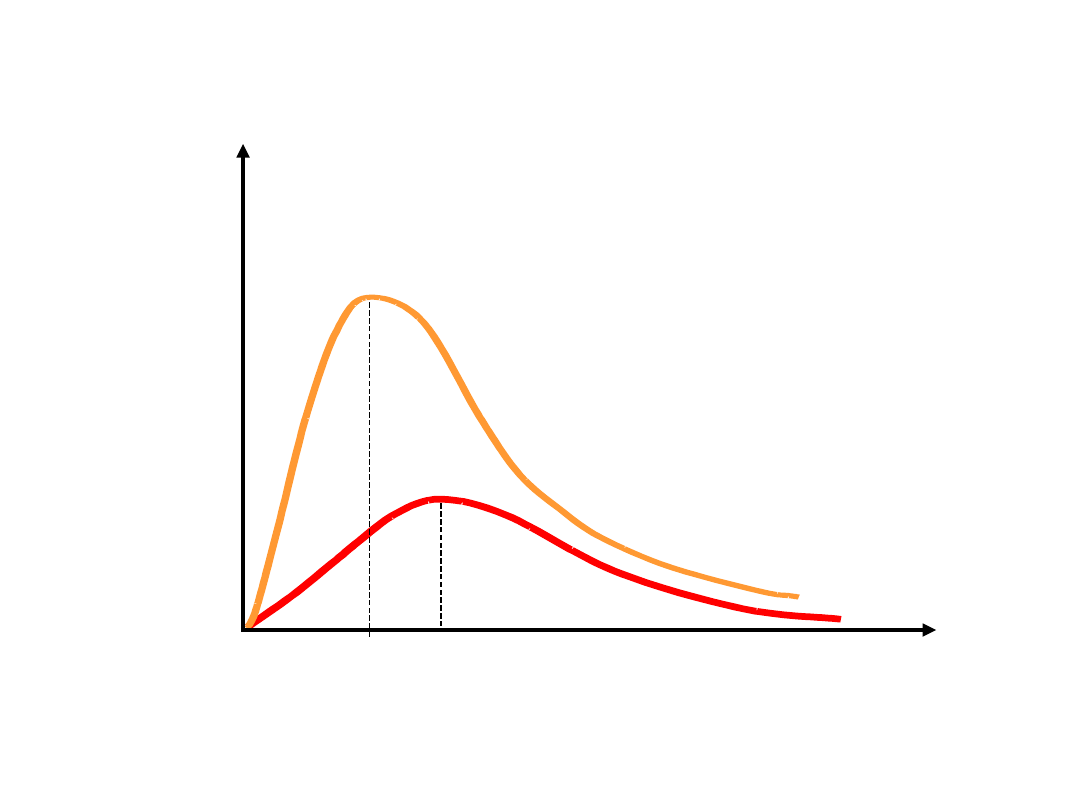
v
N(v
)
T
1
T
2
T
2
> T
1
v
p1
v
p2
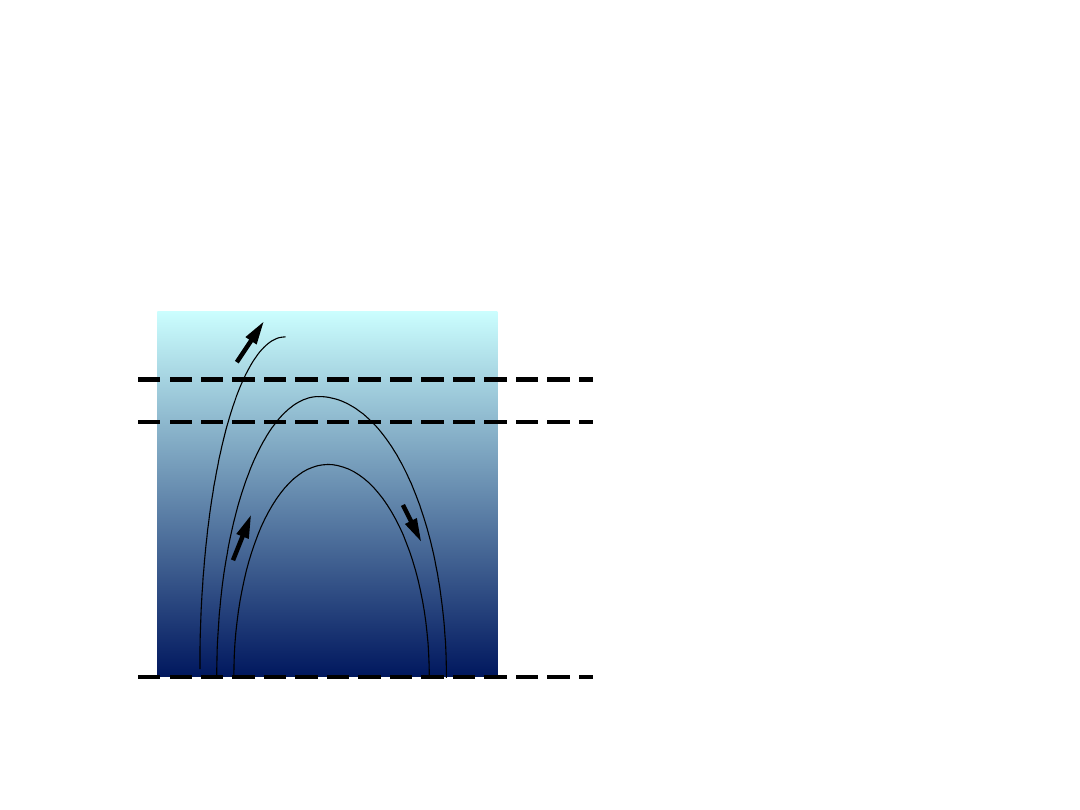
Boltzmann (1876 r.) wyprowadził prawo
rozkładu prędkości analizując zachowanie
cząsteczek gazu doskonałego w stałej
temperaturze T i w jednorodnym polu
grawitacyjnym.
z = 0
z
z + dz
n
v
– liczba cząstek gazu w jednostce
objętości, maleje ze wzrostem z
Ciężar gazu na jednostkę powierzchni w
warstwie o grubości dz równy różnicy ciśnień
dp
dz
mg
n
v
Na podstawie równania gazu doskonałego
można napisać:
kT
n
p
nRT
pV
v
0
N
V
n
n
v
0
N
V
n
n
v
objętość
Liczba
Avogadra
Liczba
moli
dz
kT
mg
n
dn
p
dp
v
v
Na podstawie poprzednich równań
otrzymujemy:
Po scałkowaniu otrzymujemy
kT
mgz
v
e
const
n
Zmiana n
v
po przejściu przez warstwę o
grubości dz:
dz
e
const
dn
kT
mgz
v
n
v
gdy z
Koncentracja maleje z wysokością.
2kT
mv
z
z
z
z
z
z
e
const
dv
v
n
mgdz
dv
mv
2
W warstwie o grubości dz część cząsteczek
gazu nie jest w stanie wydostać się wyżej.
Dla tych cząstek spełniony jest warunek:
mgz
mv
2
1
z
2
stąd
po
wyeliminowaniu z
i dz
Liczba cząstek na jednostkę
objętości o prędkościach w
przedziale v
z
, (v
z
+ dv
z
)
Otrzymany rozkład jest słuszny nawet przy
braku pola grawitacyjnego, stosować go
można dla cząsteczek poruszających się w
kierunku y i x. Można więc napisać:
2kT
mv
y
y
y
2kT
mv
x
x
x
y
x
e
const
dv
v
n
e
const
dv
v
n
2
2
Aby znaleźć rozkład prędkości N(v)
wprowadzamy przestrzeń prędkości.
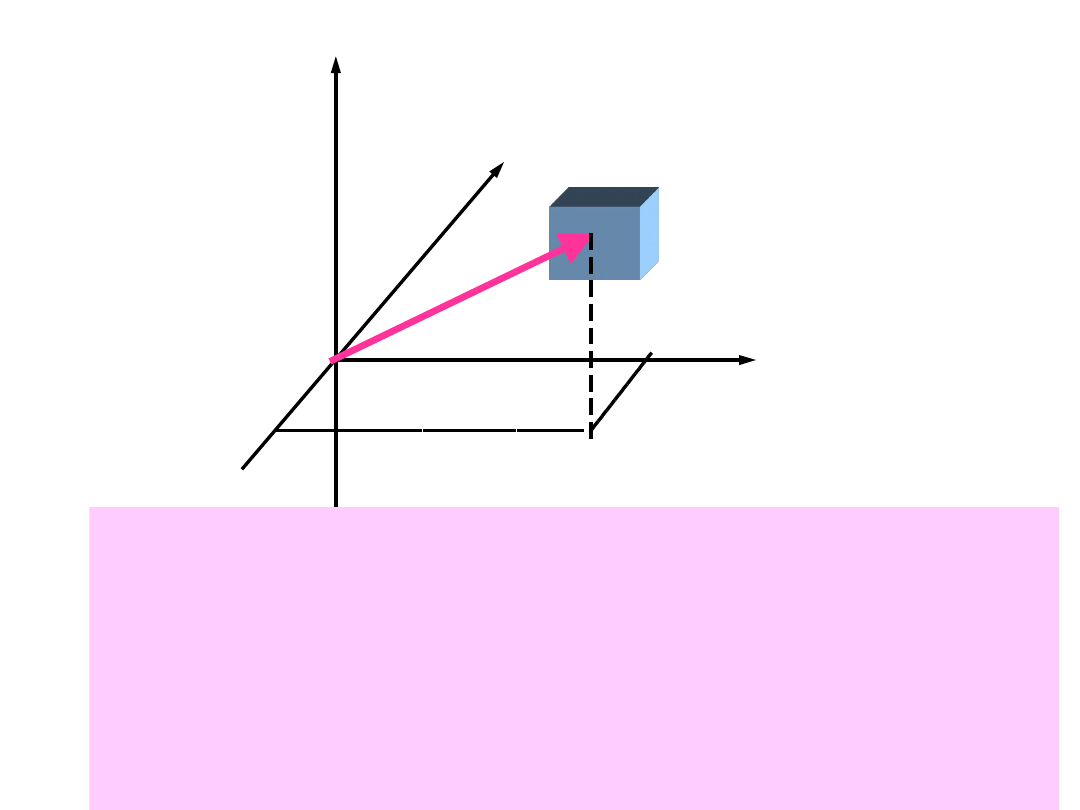
v
y
v
z
v
v
x
v
y
dv
x
dv
y
dv
z
v
x
Przestrzeń
prędkości
Dowolny punkt leżący wewnątrz elementu o
objętości dv
x
dv
y
dv
z
odpowiada cząstce, której
prędkości zawarte są w przedziale v
x
, v
x
+ dv
x
, v
y
, v
y
+ dv
y
, v
z
, v
z
+ dv
z
. Wyrażenie n
v
(v
x
) przedstawia
prawdopodobieństwa tego, że dana cząstka będzie
miała prędkości w przedziale (v
x
, v
x
+ dv
x
).
Podobnie n
v
(v
y
), n
v
(v
z
).

Prawdopodobieństwo tego, że dana
cząstka będzie miał trzy składowe
prędkości w konkretnych przedziałach
jest iloczynem trzech niezależnych
prawdopodobieństw, czyli
z
y
x
kT
mv
kT
mv
kT
mv
dv
dv
dv
e
e
e
const
z
y
x
2
2
2
2
2
2
ale
2
2
2
2
z
y
x
v
v
v
v
z
y
x
kT
mv
dv
dv
dv
e
const
2
2
stą
d
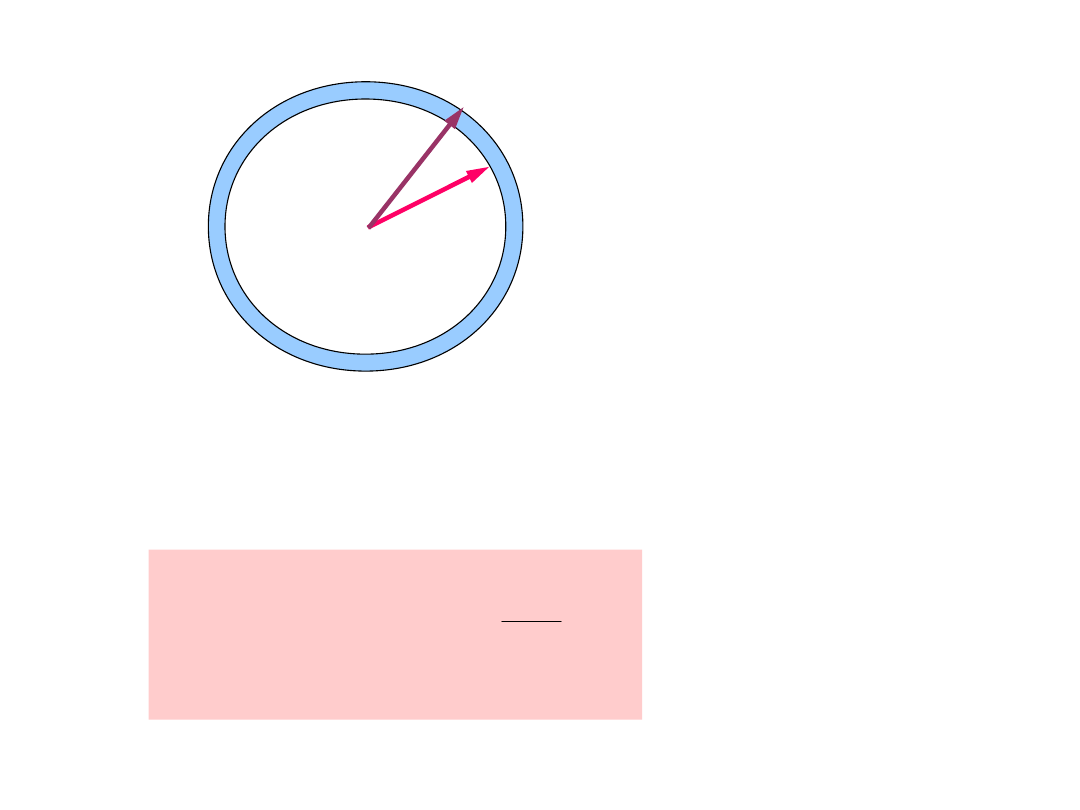
v
v +
dv
Równoważny
sześcianowi element
objętości w przestrzeni
prędkości - obszar
zawarty między dwiema
powierzchniami
kulistymi o objętości V.
dv
v
4
dv
dv
dv
V
z
y
x
2
dv
e
v
C4
dv
v
n
kT
mv
2
2
2
Stałą C wyznaczamy z warunku:
2
3
0
2
kT
m
n
4
C
n
dv
v
n
v
v
v
Następnie koncentracje zastępujemy
liczbą cząstek w pewnym
rozpatrywanym obszarze.
n
v
V N
n
v
(v)V N(v)
N
dv
v
v
N
v
0
2
2
)
(
Na postawie rozkładu Maxwella dla danej
temperatury obliczyć można:
1.
prędkość najbardziej
prawdopodobną v
p
- odpowiadająca
położeniu maksimum krzywej
2.
prędkość średnią <v>
3.
średni kwadrat prędkości <v
2
>
N
vdv
v
N
v
v
0
)
(
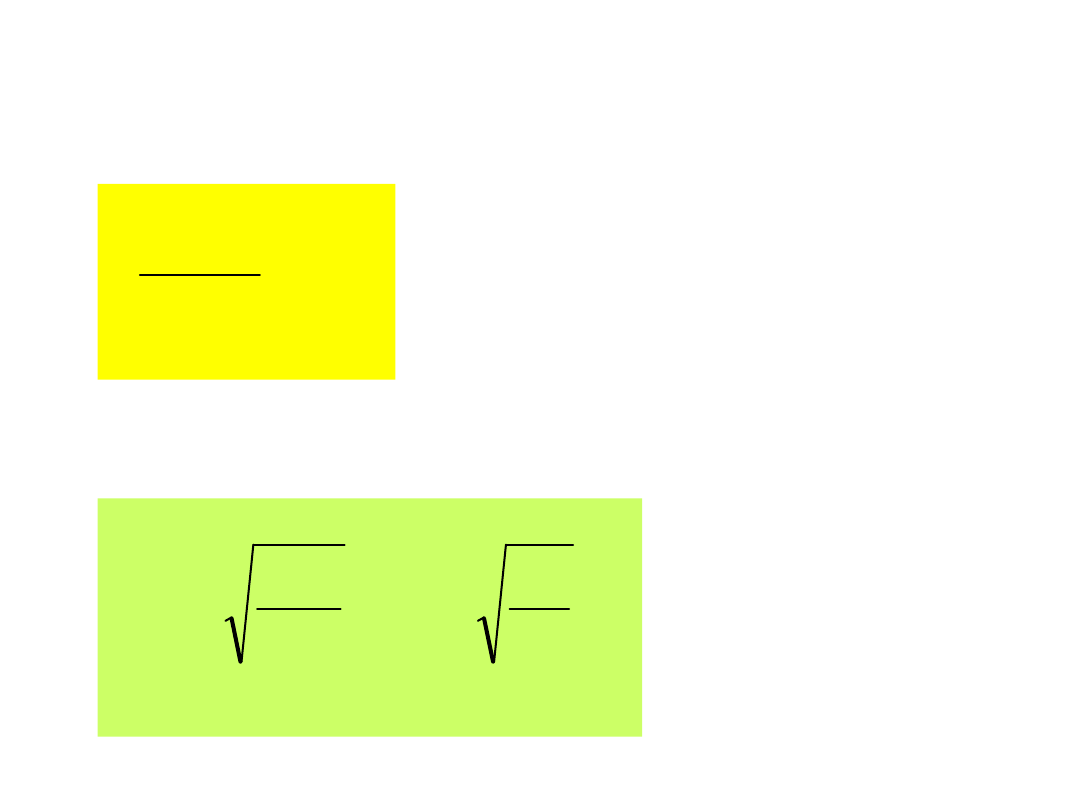
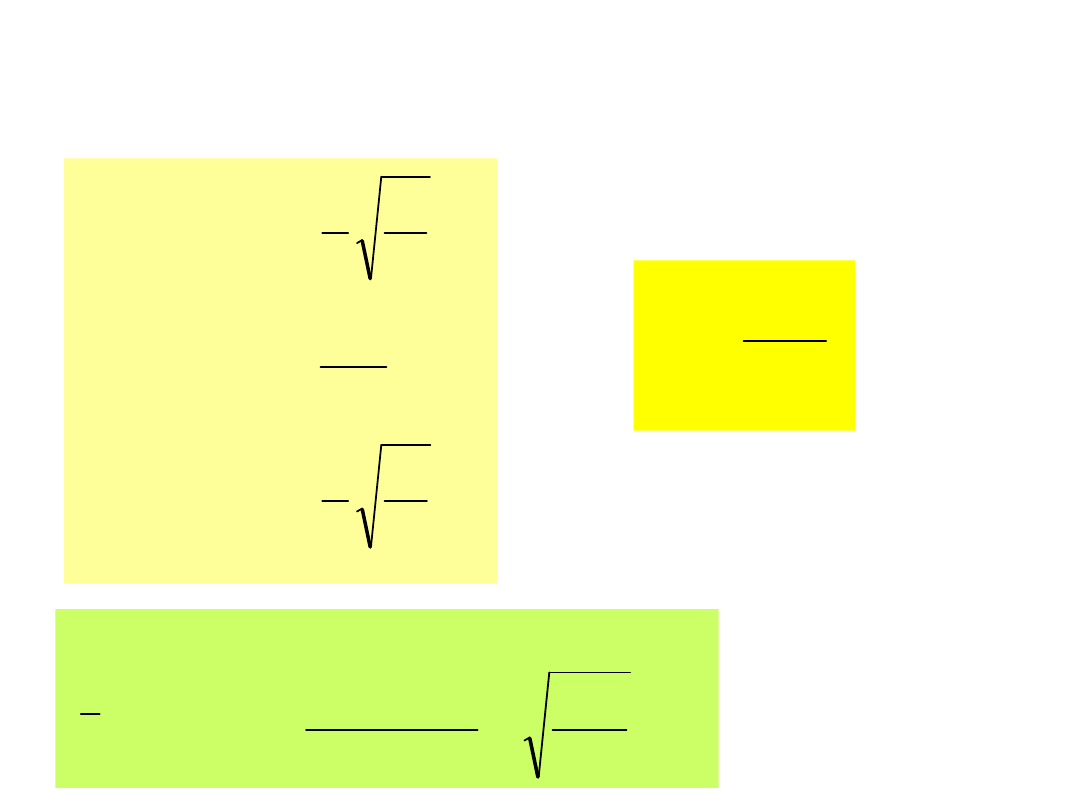
Ad 1. v
p
obliczamy żądając aby
0
dv
v
dN
otrzymujemy
m
kT
1.41
m
2kT
v
p
5
0
4
2
0
3
3
0
2
2
2
2
8
3
dv
e
v
2
1
dv
e
v
4
1
dv
e
v
v
v
v
Ad 2 . <V> obliczamy korzystając z
tablic całek
m
8kT
N
vdv
v
N
v
v
0
gdzie
2kT
m
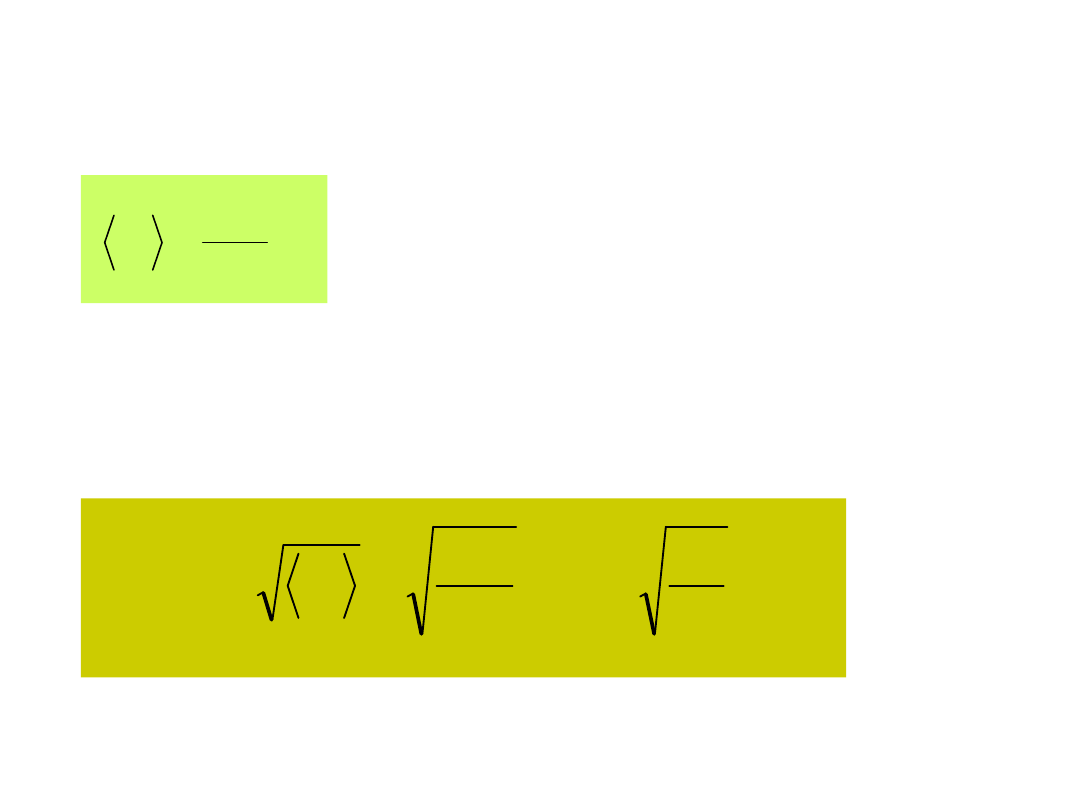
Ad 3 . <V
2
> obliczamy analogicznie
m
3kT
v
2
Następnie obliczamy prędkość średnią
kwadratową v
śr.kw
m
kT
1.73
m
3kT
v
v
kw
śr
2
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
Wyszukiwarka
Podobne podstrony:
zestaw 7 ZZP, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
a09 fizyka statystyczna (12 21) Nieznany
fizyka statystyczna
b07 fizyka statystyczna b
a10 fizyka statystyczna (26 29) RXDNND343VPDYZLZIPF2E7M75SZIUCSJC6OZ2UA
FIZYKA STATYSTYCZNA
b06 fizyka statystyczna a OMNTZ Nieznany (2)
07 Fizyka statystycznaid 6862 Nieznany (2)
a08 fizyka statystyczna (01 10) Nieznany
a08 fizyka statystyczna (01 11) Nieznany
zestaw 8 dynamika bryly szt, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
a10-fizyka statystyczna (26-29)
b09 fizyka statystyczna d EV4PL Nieznany
A09 Fizyka statystyczna (12 25)
zestaw 13 kinetyczna teoria gazów, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
b08 fizyka statystyczna c MKGN4 Nieznany (2)
a09 fizyka statystyczna (12 25) Nieznany
zestaw 7 ZZP, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
więcej podobnych podstron