
1
POCHODNE
POCHODNE
WĘGLOWODORÓW
WĘGLOWODORÓW
Chlorocopochodne
Alkohole i fenole
Aldehydy i ketony
Kwasy karboksylowe
Aminy
Aminokwasy
Związki Nitrowe
Nitryle
Węglowodany

2
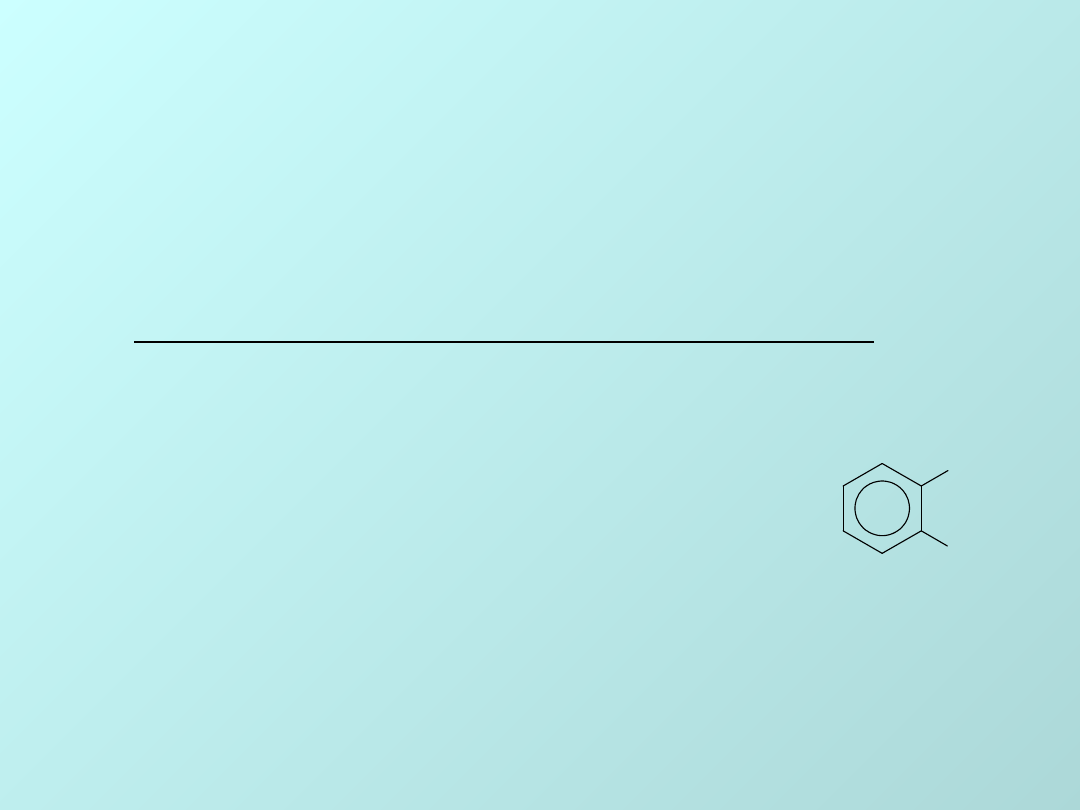
CHLOROWCOPOCHODNE
CHLOROWCOPOCHODNE
WĘGLOWODORÓW
WĘGLOWODORÓW
Pochodne węglowodorów powstają przez
podstawienie jednego lub kilku atomów wodoru
atomami
FLUORU, CHLORU, BROMU
lub
JODU.
CHLOROWCOALKANY C
C
n
n
H
H
2n+1
2n+1
-
-
X;
X;CH
3
—CH
2
—
Cl
chloroetan
CH
2
=CH—Cl chlorek winylu, chloroeten
CHLOROWCOALKINY
CHLOROWCOARE
NY
C l
chlorobenzen
Izomeria:
Izomeria:
3)
Izomeria optyczna
1) Izomeria konstytucyjna (łańcuchowa):
2) Izomeria położenia chlorowca:
3
CHLOROWCOPOCHODNE
CHLOROWCOPOCHODNE
WĘGLOWODORÓW
WĘGLOWODORÓW
Własności
Własności
1. Reakcje podstawienia nukleofilowego - S
Czynnikiem atakującym atom węgla jest anion lub
ujemny
biegun
spolaryzowanej
cząsteczki
substratu:
—OH ; —OR ; —NO
2
; —CN ; —NH
2
hydroksylowa aloksylowa nitrowa nitrylowa
aminowa
C
n
H
2n+1
—X + AgOH C
n
H
2n+1
—OH + AgX
alkohol
C
n
H
2n+1
—X + NH
3
C
n
H
2n+1
—NH
2
+ HX
amina
C
n
H
2n+1
—X + KCN C
n
H
2n+1
—CN + KX
nitryl;
2. Reakcje eliminacji - E
H X
—C—C— — C=C
+ HX
OH
-
Np.:CH
3
—CH
2
—Cl CH
2
=CH
2
+ HCl

4
HYDROKSYZWIĄZKI
ORGANICZNE
Alkohole i
fenole
ALKOHOL
ALKOHOL
E
E
Propanol
CH
3
—CH
2
—CH
2
—OH 1- propanol
Metanol
CH
3
—OH alkohol metylowy
Etanol
CH
3
—CH
2
—OH alkohol etylowy
CH
3
—CH—CH
3
2-propanol
OH
CH
2
—CH
2
OH OH
Glikole
Glikole
- alkohole zawierające dwie grupy —OH
glikol
etylenowy
CH
2
—CH—CH
2
gliceryna
OH OH OH

5
ALKOHOL
ALKOHOL
E
E
Własności chemiczne
1. Własności kwasowe
Elektroujemność tlenu w grupie —O—H ułatwia
oddzielenie protonu H, co nadaje alkoholom słabe
własności kwasowe.
Alkohole reagują z sodem i potasem, nieco
trudniej z magnezem i glinem wodór +
alkoholan
R—OH + Na R—O
-
Na
+
+ 1/2H
2
alkoholan
2. Reakcja z kwasami estry
Alkohole reagują z kwasami mineralnymi i
karboksylowymi dając estry i wodę.
C
2
H
5
—OH + HO—NO
2
C
2
H
5
—O—NO
2
+ H
2
O
azotan etylowy
CH
3
—OH + CH
3
—COOH CH
3
—COOCH
3
+
H
2
O
kwas octowy
octan metylu
6
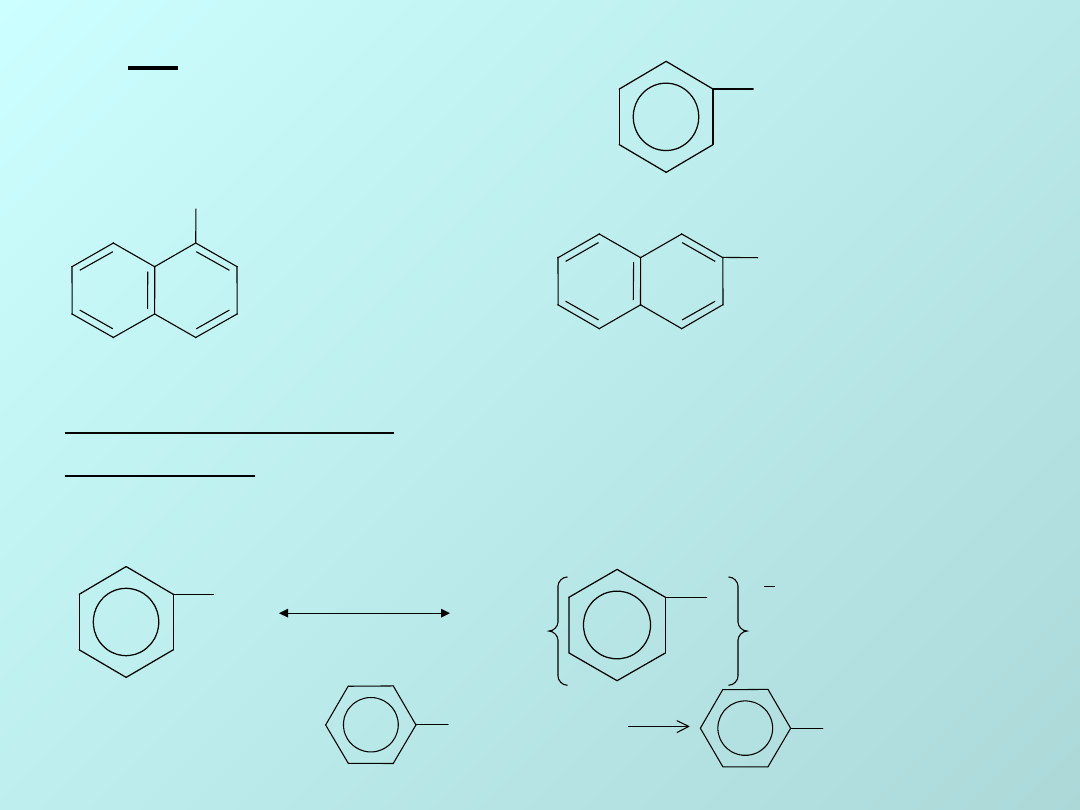
FENOL
E
C
6
H
5
—OH
OH
Fenol
Hydroksyben
zen
Nazwa całej grupy związków
pochodzi od nazwy
(C
6
H
4
-CH
3
)OH krezol -
hydroksytoluen
Własności
kwasowe:
Fenol
-
kwas
karbolowy.
Fenole wykazują bardziej polarny charakter
niż odpowiednie alkohole nasycone.
Wodny roztwór fenolu dysocjuje wg schematu:
OH
H
+
+
O
Łatwo rozpuszcza
się w NaOH:
OH +NaOH
ONa + H2O
fenolan sodu
OH
OH
-naftol
-hydroksynaftalen
-naftol
-hydroksynaftalen
7
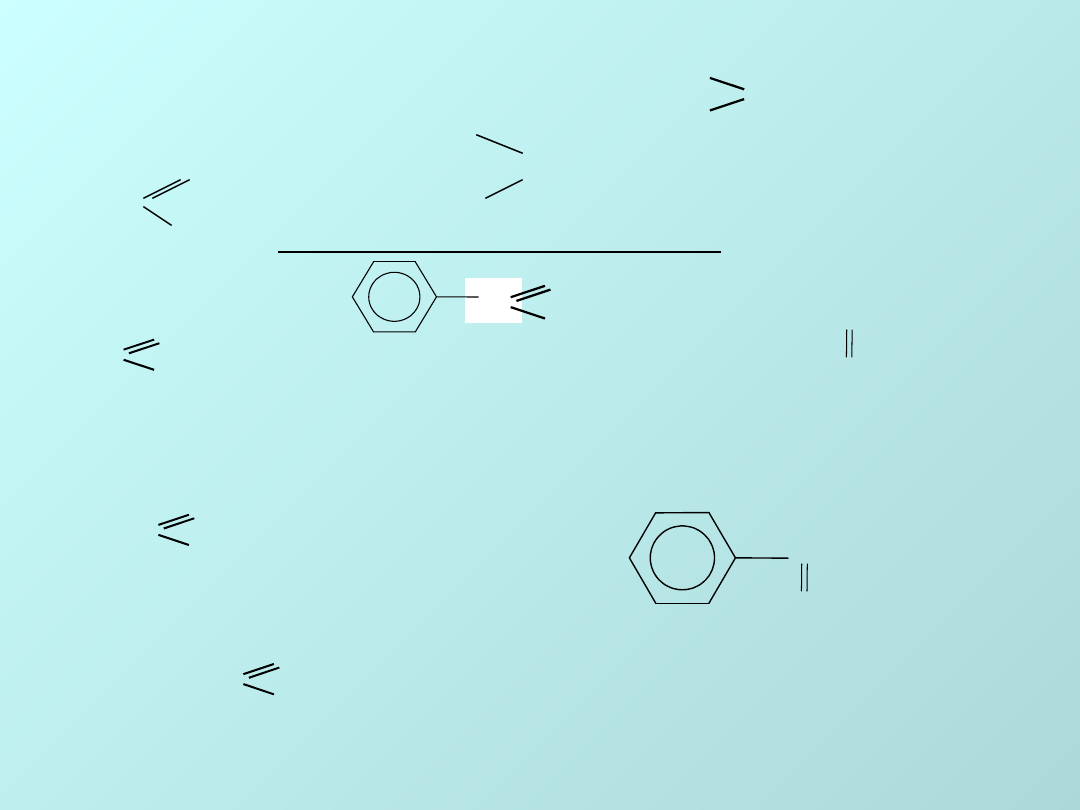
ALDEHYDY I KETONY
ALDEHYDY I KETONY
GRUPA KARBONYLOWA: C=O
ALDEHYD
O
H
R—C
KETON
R
R’ C=O
R=H, alkil lub aryl
R i R’ = alkil lub aryl
H— C
metanal, adehyd mrówkowy
CH
3
—C
etanal - aldehyd octowy
CH
3
—CH
2
—C
propanal - aldehyd propionowy
O
H
O
H
O
H
CH
3
—C—CH
3
O
keton dimetylowy, aceton
C
O
H
aldehyd
benzoesowy
C—CH
3
O
keton fenylowo-
metylowy, acetofenon

8
Aldehydy i ketony ulegają redukcji
redukcji
(uwodornieniu)
w obecności katalizatorów jak: pallad, nikiel,
platyna.
Aldehydy Alkohole pierwszorzędowe
Ketony Alkohole drugorzędowe
Reakcje odwrotne
do utlenienia
alkoholi
O
H
H
2
N
i
1-
butanol
Np.:
CH
3
—CH
2
—CH
2
—C
CH
3
—CH
2
—CH
2
—CH
2
—OH
CH
3
CH
3
CH
3
CH
3
C=O
[H]
CH-OH
aceton
2-propanon
Redukcja i utlenianie aldehydów i ketonów
Redukcja i utlenianie aldehydów i ketonów

9
I. Utlenienie odczynnikiem TOLLENSA:
wodny roztwór AgNO
3
, NH
3
i NaOH
Redukcja Ag
+
Ag
0
(lustro srebrowe):
II. Próba FEHLINGA
Utlenienie aldehydów za pomocą kationu
miedziowego Cu
2+
O
H
O
O
-
R—C + 2[Ag(NH
3
)
2
] OH
R—C
NH
4
+
+ 3NH
3
+ H
2
O + 2Ag
O
H
O
O
H
R—C + 2Cu(OH)
2
R—C + Cu
2
O + 2H
2
O
tlenek miedzi(I)
ceglastoczerwony osad
Aldyhydy łatwo ulegają utlenieniu
utlenieniu
do kwasów
karboksylowych zgodnie z równaniem:
O
H
O
O
H
R—C
R—C
aldehyd
kwas karboksylowy
10
O
OH
—C
grupa
karboksylowa
KWASY KARBOKSYLOWE
KWASY KARBOKSYLOWE
H—COOH
CH
3
—COOH
CH
3
—CH
2
—COOH
CH
3
—CH
2
—CH
2
—
COOH
kwas
mrówkowy
kwas octowy
kwas
propionowy
kwas
masłowy
CH
2
=CH—COOH
COOH
kwas benzoesowy
kwas akrylowy
kwas dikarboksylowy
kwas szczawiowy
COOH
COOH
COOH
CH
2
CH
2
COOH
kwas etanodikarboksylowy-1,2
kwas bursztynowy
COOH
COOH
kwas
benzenodikarbo-
ksylowy-1,2
kwas ftalowy

11
1.
1.
Własności kwasowe
Własności kwasowe
Własności kwasowe grupy karboksylowej wynikają z
polarnego charakteru grupy C=O, co ułatwia
dysocjację układu O—H.
Polaryzacja grupy —COOH:
R—C
O
O—H
+
-
Kwasy karboksylowe w roztworach wodnych ulegają dysocjacji:
R—COOH + H
2
O R—COO
-
+ H
3
O
+
np.
CH
3
—COOH + H
2
O CH
3
COO
-
+ H
3
O
+
kwas octowy
anion octanowy
Kwasy karboksylowe reagują zatem z
wodorotlenkami
alkalicznymi
:
R—C
+ Na OH R—C
Na + H
2
O
anion karboksylanowy
O
OH
O
O
+
-
-
+

12
Pochodne funkcyjne kwasów karboksylowych
Związki, w których grupa —OH
należąca do grupy karboksylowej
została zastąpiona inną grupą
funkcyjną (Y):
R—C
O
Y
Do najważniejszych funkcyjnych pochodnych kwasów
karboksylowych należą:
halogenki kwasowe
R—C
gdzie:
X = F, Cl,
Br, I
O
X
estry
R—C
O
OR
amidy
gdzie:
R” i R’ = H,
alkil lub aryl
R—C
R’
R”
O
N
bezwodnik
i kwasowe
R—C
R—C
O
O
O
13
HYDROKSYKWASY
Występują dwie grupy funkcyjne:
- hydroksylowa —OH
- karboksylowa —COOH
W reakcjach zachowują się jak alkohole, bądź jak
kwasy.
HO—CH
2
—COOH
-
kwas
hydroksyoctowy(glikolowy)
CH
3
—CH—COOH
-
kwas
-
hydroksypropionowy
(mlekowy)
OH
HOOC—CH
2
—CH—COOH
OH kwas
hydroksybursztynowy
(jabłkowy)
COOH
OH
Kwas o-
hydroksy-
benzoesowy
(salicylowy)
14
AMINY
Aminy
Aminy
można uważać za pochodne
amoniaku NH
3
.
Rzędowość amin:
R
R`
NH
amina drugorzędowa
R
R`
N—R``
amina trzeciorzędowa
R
R`—N—R```X
czwartorzędowa sól amoniowa
R R, R`, R``, R``` = alkil lub aryl
R—NH
2
amina pierwszorzędowa
15
CH
3
—NH
2
CH
3
—NH—CH
3
CH
3
—CH
2
N—CH
2
—CH
3
CH
3
—CH
2
AMINY
metyloamina
dimetyloamina
trietyloamina
anilina
NH
2
N
N,N-
dimetyloanilina
CH
3
CH
3

16
Otrzymywanie amin
Otrzymywanie amin
Działanie amoniaku na chlorowcoalkany lub
Działanie amoniaku na chlorowcoalkany lub
chlorowcoareny
chlorowcoareny
- Proces prowadzi do mieszaniny
amin o różnej rzędowości.
Poniżej przedstawiono reakcje działania amoniaku na
jodek metylu:
CH
3
—I + NH
3
CH
3
—NH
2
+ HI
metyloamina
CH
3
—I + H
2
N—CH
3
(CH
3
)
2
NH + HI
dimetyloamina
CH
3
—I + NH(CH
3
)
2
(CH
3
)
3
N +
HI
trimetyloamina
CH
3
—I + N(CH
3
)
3
[(CH
3
)
4
N]
+
I
-
jodek
tetrametyloamoniowy
Chlorowcoareny reagują z amoniakiem znacznie
trudniej - w obecności katalizatorów, pod ciśnieniem i w
wysokiej temp.
17
Aminy podobnie jak amoniak mają własności
zasadowe.
Aminy tworzą sole z rozcieńczonymi kwasami, przy
czym wolna para elektronowa azotu tworzy nowe
wiązanie kowalencyjne N—H:
1. Zasadowość amin
1. Zasadowość amin
CH
3
—NH
2
+ HCl (CH
3
—NH
3
) Cl chlorowodorek
metyloamoniowy
metyloamina
(chlorek metyloaminy)
(CH
3
)
2
NH + HCl (CH
3
)NH
2
Cl chlorowodorek
dimetyloamoniowy
dimetyloamina
(chlorek dimetyloaminy)
..
..
H
H
R—N: H —Br: R—N—H +
Br
H
H
+
-
2.
Utlenienie
2.
Utlenienie
amin
amin
Utlenienie amin pierwszorzędowych prowadzi do
nitrozwiązków.
CH
3
-CH
2
-CH
2
-CH
2
-NH
2
CH
3
-CH
2
-CH
2
-CH
2
-NO
2
n-butyloamina
1-nitrobutan
[O]
Własności amin
Własności amin
18
AMINOKWASY
Związki zawierające dwie grupy
funkcyjne:
amiową
—NH
2
karboksylową
—
COOH
H
2
N—CH
2
—COOH
-
aminokwas
(kwas aminooctowy, glicyna)
H
2
N—CH
2
—CH
2
—COOH
-
aminokwas
(kwas -aminopropionowy, -alanina)
H
2
N—CH
2
—CH
2
—CH
2
—COOH
-
aminokwas
(kwas -aminomasłowy)
C
O
O
H
N
H
2
C
O
O
H
N
H
2
C
O
O
H
N
H
2
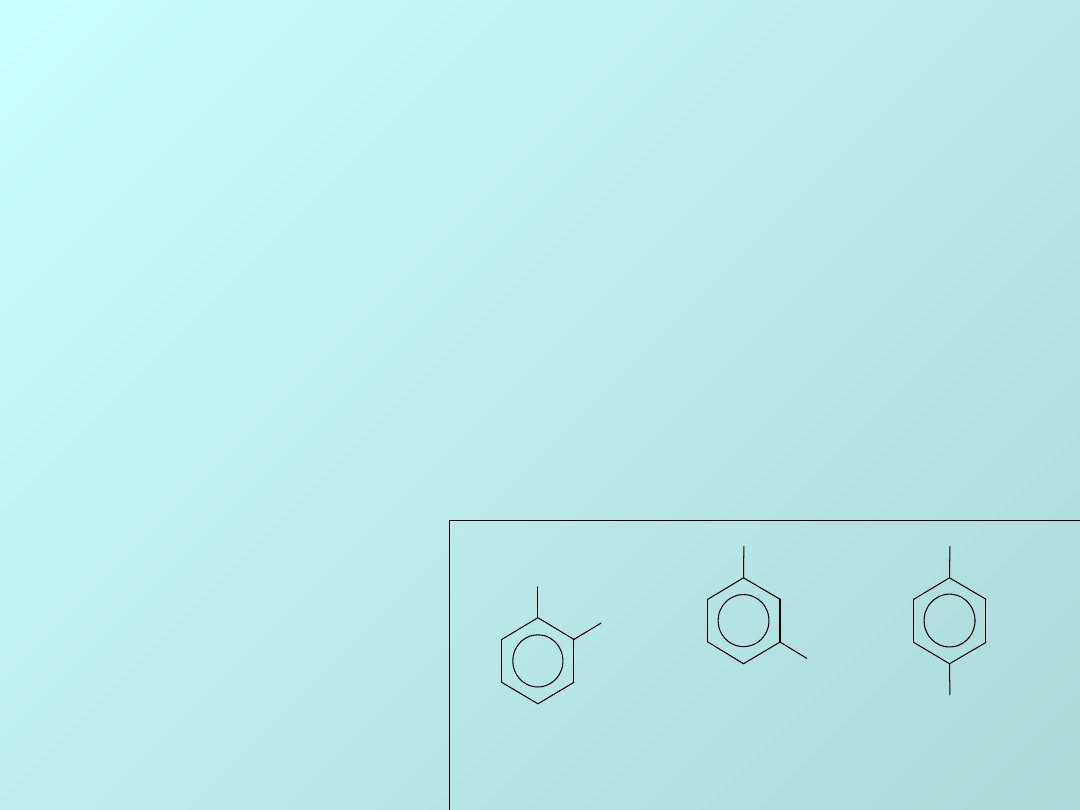
Kwas o-amino-
benzoesowy
Kwas m-amino-
benzoesowy
kwas p-amino-
benzoesowy
19
-
AMINOKWASY
Z uwagi na obecność grupy —NH
2
i —
COOH aminokwasy występują w postaci
soli wewnętrznych, które tworzą się
wskutek
przyłączenia
protonu
kwasowej grupy karboksylowej do
zasadowej grupy aminowej:
COO
H
3
N—C—H
R
+
-
H
3
N
+
—CH—COO
-
+ HCl [H
3
N—CH—COOH ]
+
Cl
-
R
kwas
R
jon obojnaczy
kation
chlorowodorek -aminokwasu
H
3
N
+
—CH-COO
-
+ Na OH [H
2
N—CH-COO]
-
Na
+
+ H
2
O
R
R
sól sodowa -aminokwasu
Dzięki temu aminokwasy mają charakter
amfoteryczny, tzn. mogą reagować zarówno z
kwasami jak i zasadami.
R
H
2
N—CH—COOH
20
POLIPEPTYDY I
BIAŁKA
Są to związki, które spełniają szereg funkcji
biologicznych.
Są
zbudowane
z
reszt
-
aminokwasów
połączonych
wiązaniami
wiązaniami
peptydowymi
peptydowymi
.
.
Wiązania te łączą szereg reszt aminokwasowych
tworząc łańcuchy polipeptydowe
łańcuchy polipeptydowe
.
.
N
H
CH
R
C
O
N
H
CH
R
C
O
N
H
CH
R
C
O
N
H
CH
R
C
O
`
``
fragment łańcucha
polipeptydowego
wiązanie
wiązanie
peptydow
peptydow
e
e
21
ZWIĄZKI NITROWE
Są to związki organiczne o budowie: R—NO
2;
R
= alkil, aryl
CH
3
—CH—CH
3
| 2-
nitropropan
NO
2
NO
2
NO
2
1,3-
dinitrobenzen
CH
3
—NO
2
nitrometan
Nitrozwiązki
ulegają
łatwo
reakcji
redukcji.
Praktyczne
znaczenie
ma
jednak
redukcja
nitrozwiązków aromatycznych, które przechodzą w
aminy pod wpływem różnych środków redukujących:
Często używa się cyny i kwasu solnego:
NO
2
NH
2
Sn, HCl
Używa się też soli, których
kationy mogą przejść na wyższy
stopień utlenienia:
NO
2
NH
2
+ 6TiCl
3
+ 6HCl
+ 6TiCl
4
+ 2H
2
O
anilin
a
nitrobenz
en
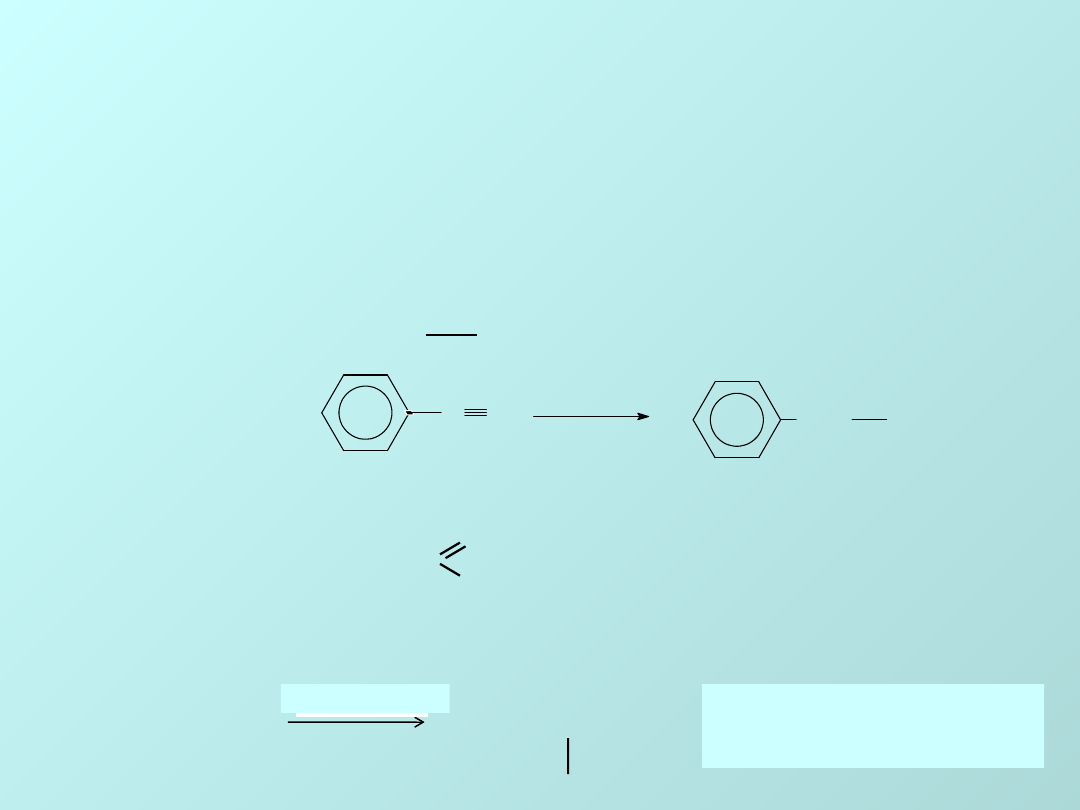
22
NITRYLE
Nitrylami
Nitrylami
nazywamy związki organiczne, w których
występuje ugrupowanie:
R—CN,
R = alkil lub aryl
Grupa —CN jest silnie spolaryzowana (moment
dipolowy wynosi ok. 4D.
1. Redukcja nitrylów prowadzi do amin
pierwszo-rzędowych:
C N
CH
2
NH
2
Li Al H
4
benzyloami
na
2. Nitryle ulegają hydrolizie:
R—CN + H
2
O R—C + H
2
O R—COOH
+ NH
3
amid kwas
O
NH
2
3. Duże znaczenie ma nitryl kwasu akrylowego:
benzonitryl
n CH
2
=CH—CN -(—CH
2
—CH—)
n
-
CN
poliakrylonitryl
(tworzywo sztuczne)
polimeryzacja

23
WĘGLOWODANY
WĘGLOWODANY
CUKRY
CUKRY
Są szeroko rozpowszechnione w przyrodzie - występują w organizmach
żywych - roślinnych i zwierzęcych.
Nazwa pochodzi z okresu gdy sądzono, że wszystkie związki tej grupy
mają
budowę
:
C
m
H
2m
O
m
lub C
m
(H
2
O)
m
a więc stosunek atomów H : O = 2 : 1 tak jak w
wodzie.
Pod względem chemicznym są to:
Wielohydroksyaldehydy
lub
Wielohydroksyketony
.
Występują w nich 2 grupy funkcyjne:
—OH i —CHO - aldozy
lub
—OH i C=O -
ketozy
Powstają w roślinach zielonych w procesie
fotosyntezy:
6CO
2
+ 6H
2
O (CH
2
O)
6
+ 6O
2
węglowodan
24
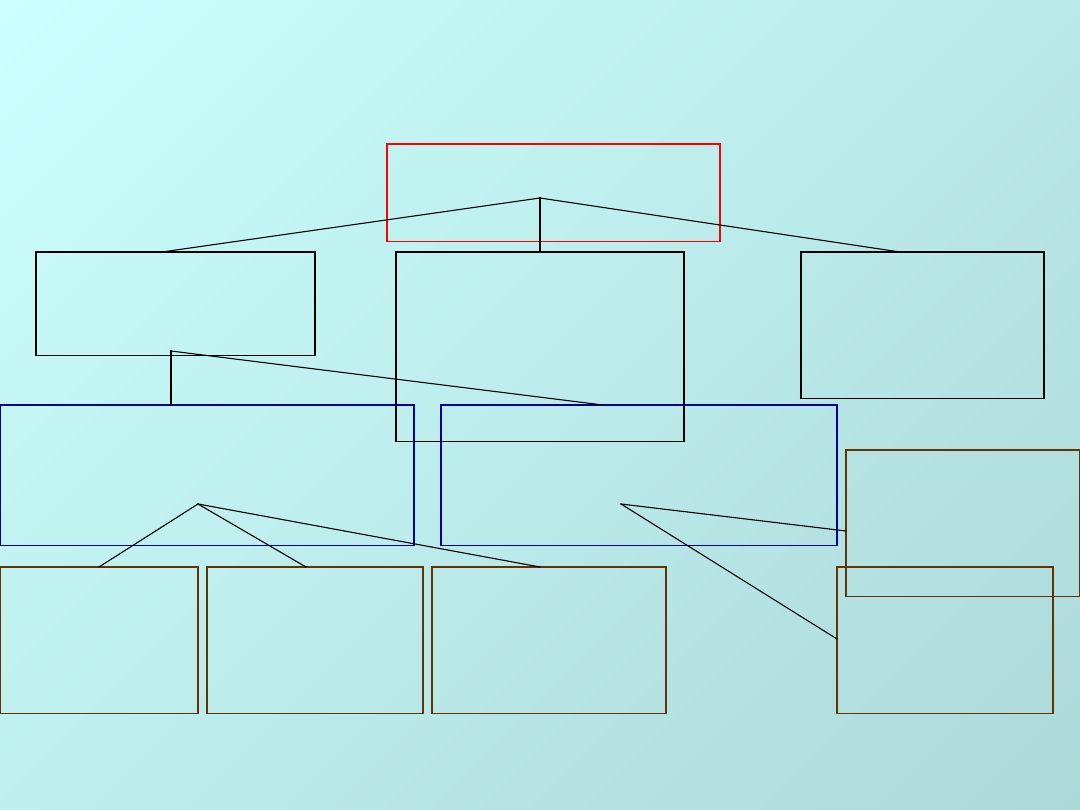
Klasyfikacja
węglowodanów
WĘGLOWODA
WĘGLOWODA
NY
NY
Monosachar
Monosachar
ydy
ydy C
n
H
2n
O
n
Oligosachary
Oligosachary
dy
dy
(C
6
H
10
O
5
)
n
;n=
2-9
Polisachar
Polisachar
ydy
ydy
(C
6
H
10
O
5
)
x
Wielohydroksyalde
hydy
Aldozy
Wielohydroksyket
ony
Ketozy
Aldotetro
zy
C
4
H
8
O
4
Aldopento
zy
C
5
H
12
O
6
Aldoheksoz
y
C
6
H
10
O
5
Ketopento
zy
C
5
H
12
O
6
Aldoheksoz
y
C
6
H
10
O
5
25
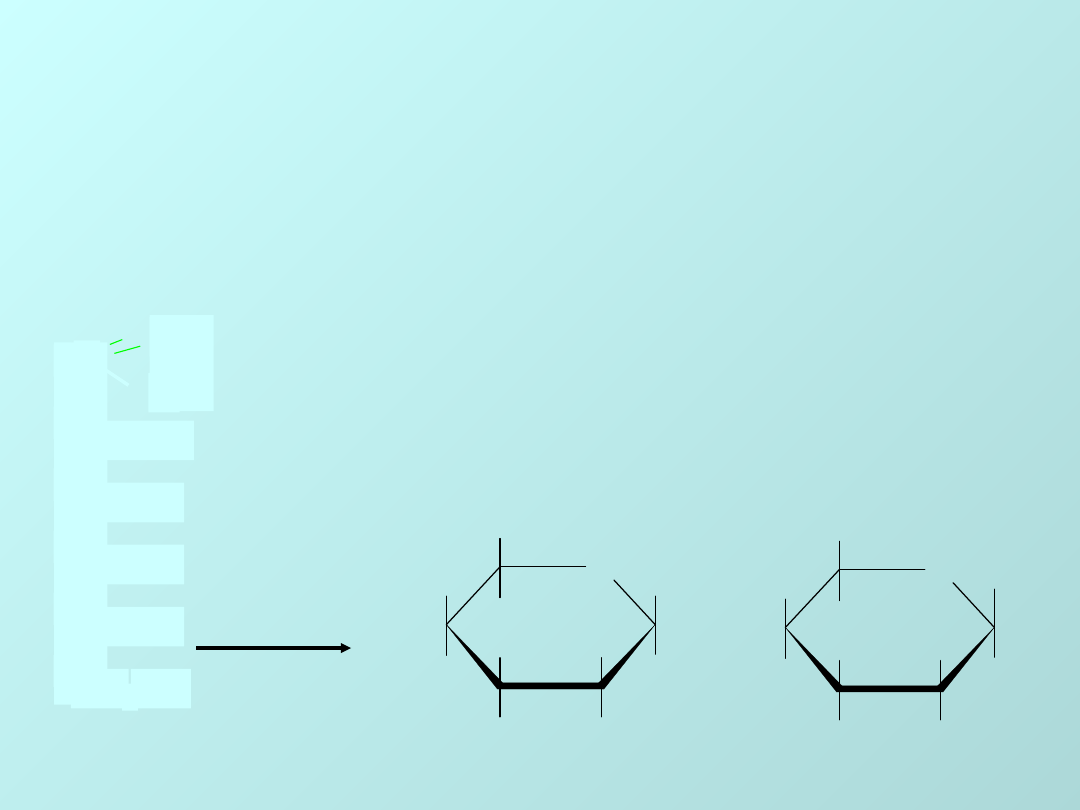
CUKRY PROSTE
MONOSACHARYDY
Glukoza
jest
aldoheksozą
.
Wzór sumaryczny: C
6
H
12
O
6
Budowę strukturalną można przedstawić za
pomocą następującego wzoru:
wzór
łańcuchowy glukozy
1
2
*
3
*
4
*
5
*
6
C
CHOH
CHOH
CHOH
CHOH
CH
2
OH
O
H
O
CH
2
OH
H
H
OH
H
OH
H
HO
H
OH
O
CH
2
OH
H
H
OH
OH
H
OH
H
HO
H
1
2
4
5
1
2
3
3
4
5
6
6
Podane wyżej wzory cyklicznych odmian
glukozy nie opisują faktycznych kształtów
cząsteczek. Znacznie bliższe rzeczywistości
są
wzory perspektywiczne Hawortha.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
10 Hist BNid 10866 ppt
2 Pochodna calkaid 21156 ppt
10 badania niereaktywneid 10789 ppt
10 Uklad pokarmowyid 11141 ppt
10 XML appsid 11206 ppt
10 Pochodna funkcji jednej zmiennej
10 PODLOGI I POSADZKIid 11002 ppt
22 10 2010 i 29 10 2010 Podatkiid 29474 ppt
10 TYPY OSOBOWOŚCIid 11129 ppt
10 Laborem Exercensid 10572 ppt
10 2 metodyka szkolenia2id 10746 ppt
10 Ubezpieczenia społeczneid 11134 ppt
wyk 10 pochodne kwasów karboksylowych
10 algebra booleaid 10784 ppt
10 ruchy przesuwczeid 11304 ppt
10 1 metodyka szkolenia1id 10717 ppt
10 Kinetyka chemicznaid 10897 ppt
10 Wypadki 1 17id 11196 ppt
więcej podobnych podstron