
1
Reakcje utlenienia-redukcji
(red-ox)
Są one zawsze sumą dwóch
procesów: redukcji i utlenienia; są
więc algebraiczną sumą reakcji
połówkowych red-ox, uzgodnionych
co do liczby przenoszonych
elektronów.

2
Pisanie reakcji połówkowych red-
ox
Przypadek prosty, gdy znamy postacie utlenioną i
zredukowaną. Przykład: reakcja połówkowa
utlenienia Fe
+2
do Fe
+3
.
(1) piszemy postać zredukowaną po lewej, a
utlenioną po prawej stronie strzałki: Fe
+2
Fe
+3
(2) sprawdzamy liczbę elektronów oddawanych
przez reduktor i piszemy je po stronie
zawierającej postać utlenioną: Fe
+2
Fe
+3
+ 1e
-
(3)
sprawdzamy,
czy
zgadza
się
liczba
poszczególnych atomów po obu stronach
równania (w naszym przykładzie się zgadza).

3
Pisanie reakcji połówkowych
red-ox
Bardzo często w reakcji połówkowej biorą udział
także inne składniki (np. jony H+, OH-,
woda...).
Przykład:
reakcja
połówkowa
utlenienia
siarczynu do siarczanu, t.j. siarczanu(IV) do
siarczanu(VI):
(1) SO
3-2
SO
4-2
(2) SO
3-2
SO
4-2
+ 2e
-
(3) SO
3-2
+ H
2
O SO
4-2
+ 2e
-
+ 2H
+

4
Pisanie reakcji połówkowych
red-ox
Niekiedy trudno jest, na pierwszy rzut oka,
stwierdzić liczbę przenoszonych elektronów.
Wtedy zamieniamy etapy 2 i 3 ze sobą.
Przykład : reakcja połówkowa utlenienia jonu
szczawia-nowego do CO
2
.
(1) (COO)
2-2
2CO
2
(3) liczba atomów się zgadza, zatem pozostaje
uzupełnić ładunki elektronami;
(2) (COO)
2-2
2CO
2
+ 2e
-
(zauważmy, że formalny stopień utlenienia węgla
w CO
2
jest +4, zaś w szczawianie +3).

5
Reakcje ważne w chemii
analitycznej
Redukcja
nadmanganianu
w
środowisku
kwaśnym:
MnO
4-
+ 8H
+
+ 5e
-
Mn
+2
+ 4H
2
O
Redukcja MnO
4-
w środowisku obojętnym (lub
słabo kwaśnym):
MnO
4-
+ 4H
+
+ 3e
-
MnO
2
+ 2H
2
O
Redukcja MnO
4-
w środowisku zasadowym:
MnO
4-
+ 1e
-
MnO
4-2

6
Reakcje ważne w chemii
analitycznej
Redukcja
dwuchromianu
w
środowisku
kwaśnym:
Cr
2
O
7-2
+ 14H
+
+ 6e
-
2Cr
+3
+ 7H
2
O
Redukcja wody utlenionej:
H
2
O
2
+2e
-
+ 2H
+
2H
2
O
Utlenienie wody utlenionej:
H
2
O
2
2H
+
+ O
2
+ 2e
-
(zauważmy, na podstawie dwóch ostatnich przykładów, że
formalny stopień utlenienia tlenu w wodzie utlenionej
jest -1, w wodzie -2, zaś w tlenie cząsteczkowym 0).

7
Reakcje red-ox
Są one złożeniem (sumą) reakcji
połówkowych. Jedną z nich trzeba
zapisać w kierunku utlenienia zaś
drugą w kierunku redukcji.

8
Reakcje red-ox
Przykład: reakcja utlenienia szczawianu dwuchromianem w
środo-wisku kwaśnym. Utleniaczem jest dwuchromian,
reduktorem jest szczawian:
Cr
2
O
7-2
+ 14H
+
+ 6e
-
2Cr
+3
+ 7H
2
O
(COO)
2-2
2CO
2
+ 2e
-
Uzgadniamy liczbę elektronów:
Cr
2
O
7-2
+ 14H
+
+ 6e
-
2Cr
+3
+ 7H
2
O
3(COO)
2-2
6CO
2
+ 6e
-
i sumujemy reakcje:
Cr
2
O
7-2
+14H
+
+6e
-
+3(COO)
22-
2Cr
+3
+7H
2
O+6CO
2
+6e
-
Po uporządkowaniu (w tym wypadku odjęciu stronami
składnika 6e
-
):
Cr
2
O
7-2
+14H
+
+3(COO)
2-2
2Cr
+3
+7H
2
O+6CO
2

9
Reakcje
dysproporcjonowania
Szczególnym typem reakcji red-ox są reakcje
dysproporcjonowania. Mogą zachodzić, jeśli
substancja może występować na przynajmniej
trzech
różnych
stopniach
utlenienia.
Dysproporcjonowanie polega na jednoczesnej
redukcji i utlenieniu substancji znajdującej
się na pośrednim stopniu utlenienia.

10
Reakcje
dysproporcjonowania
Przykład: Tlen w H
2
O
2
ma stopień utlenienia -1, zaś
może występować na stopniu 0 (w cząsteczce O
2
)
i ‑2 (w cząsteczce wody). Napisz reakcję
dysproporcjonowania wody utlenionej.
W tym celu składamy poprzednio podane reakcje
utlenienia i redukcji H
2
O
2
:
H
2
O
2
+2e
-
+ 2H
+
2H
2
O
H
2
O
2
2H
+
+ O
2
+ 2e
-
Sumą jest więc reakcja:
H
2
O
2
+ H
2
O
2
+ 2e
-
+ 2H
+
2H
2
O + 2H
+
+ O
2
+ 2e
-
Po uporządkowaniu:
2H
2
O
2
2H
2
O + O
2

11
Niektóre procesy red-ox i ich
wykorzystanie
Składniki wybielające
(składniki proszków do prania,
wybielacze). Jest to najczęściej podchloryn - silny
utleniacz:
OCl
-
+ 2e
-
+ H
2
O Cl
-
+ 2OH
-
Fotosynteza.
Jej najważniejszym etapem jest utlenienie
wody (w etapie "jasnym"):
12H
2
O + energia 6O
2
+ 24H
+
+ 24e
-
Zachodzą
tu
także dalsze procesy
red-ox.
W
szczególności, w etapie "ciemnym":
6CO
2
+ 24H
+
+ 24e
-
C
6
H
12
O
6
+ 6H
2
O

12
Niektóre procesy red-ox i ich
wykorzystanie
Wiązanie azotu przez bakterie:
N
2
+ 6e
-
+ 8H
+
2NH
4+
Procesy metalurgiczne
niemal zawsze wymagają redukcji
tlenków, siarczków i innych związków metali. Najczęściej
stosowanymi reduktorami są węgiel i wodór.
Elektrorafinacja
(np. miedzi) polega na elektrochemicznym
rozpuszczeniu (utlenieniu) miedzi surowej i wydzieleniu
jej (utlenieniu) na katodzie w postaci oczyszczonej.
Wszystkie procesy elektrochemiczne są procesami
redukcji lub utlenienia.
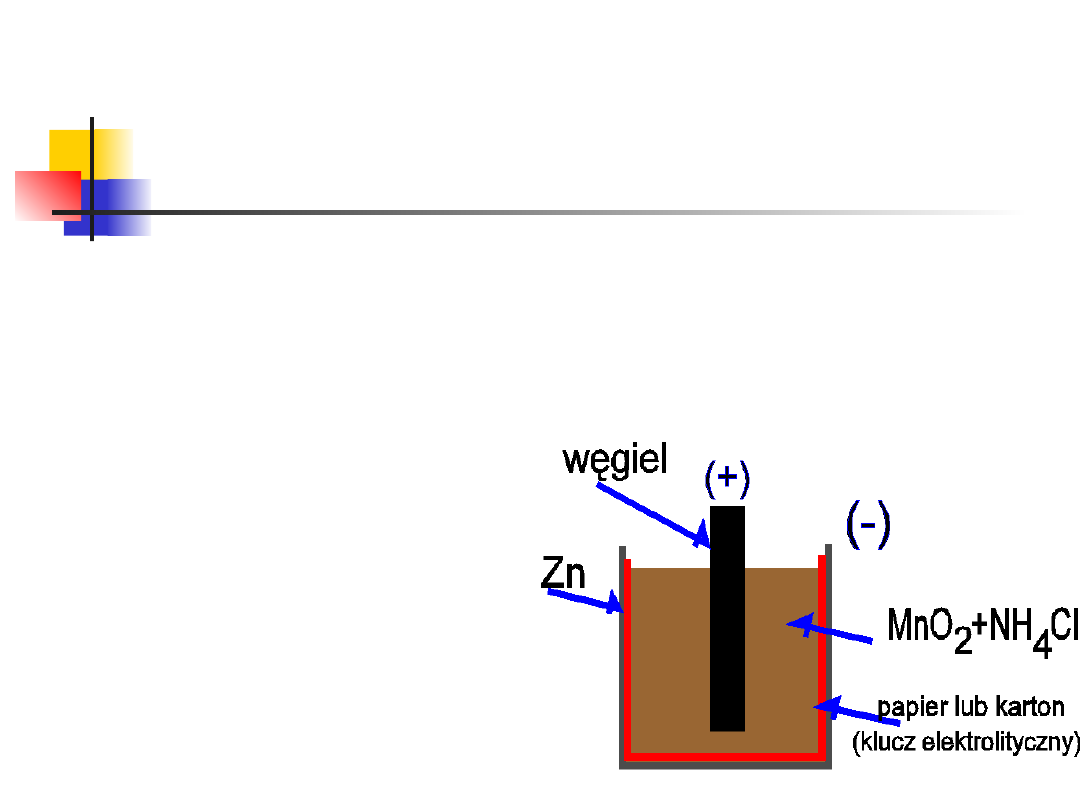
13
Niektóre procesy red-ox i ich
wykorzystanie
Bateria "sucha"
(ogniwo Leclanche'go):
Katoda:
2NH
0+
+2MnO
2
+2e
-
Mn
2
O
3
+2NH
3
+H
2
O
Anoda ("kwaśna"):
Zn
s
Zn
+2
+2e
-
Anoda ("alkaliczna"):
Zn
s
+2OH
-
ZnO+H
2
O+2e
-

14
Niektóre procesy red-ox i ich
wykorzystanie
Inne popularne typy baterii:
bateria srebrowa - katodą jest Ag, redukuje
się Ag2O, utlenia się Zn; środowisko zasadowe
bateria rtęciowa - utleniaczem jest HgO,
reduktorem Zn, środowisko zasadowe
akumulator niklowo-kadmowy - anodą jest Cd,
utleniaczem jest NiO, środowisko zasadowe.

15
Niektóre procesy red-ox i ich
wykorzystanie
Inne popularne typy baterii: akumulator
ołowiowy
Najbardziej rozpowszechniony, wykorzystuje
reakcje redukcji PbO
2
do Pb
+2
i utlenienia Pb
do Pb
+2
. Obecność H
2
SO
4
ułatwia oba
procesy (PbSO
4
jest słabo rozpuszczalny).

16
Niektóre procesy red-ox i ich
wykorzystanie
Szkło fotochromowe
, stosowane głównie do produkcji okularów,
zawiera domieszkę kryształów AgCl i CuCl. Naświetlanie
powoduje utlenienie jonów chlorkowych: Cl
-
+ Cl
+ e
-
Wydzielone elektrony redukują jony Ag
+
do srebra: Ag
+
+ e
-
Ag
i szkło ciemnieje. W ciemności następuje seria procesów
odtwarzających stan pierwotny:
Cl
+ Cu
+
Cu
+2
+ Cl
‑
Cu
+2
+ Ag Cu
+
+ Ag
+
Korozja
– to cała seria procesów elektrochemicznych
zachodzących na powierzchni metali.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
5 Reakcje utleniania i redukcji Reakcje w roztworach
CHEM OG, cw 4, REAKCJE UTLENIANIA I REDUKCJI
06 Sprawozdanie z reakcji utleniania i redukcji Naprawiony
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
3.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
3.Reakcje utleniania i redukcji, Zad
Reakcje utleniania i redukcji
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
instrukcja - REAKCJE UTLENIANIA I REDUKCJI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, l
Wyklad 4. Reakcje utleniajaco-redukcyjne, pwr biotechnologia(I stopień), I semestr, Chemia ogó
1 7 Reakcje utleniania i redukcj +Odpowiedzi
2.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
Ćw. 10 i 11 - reakcje utleniania i redukcji - sprawko, Chemia ogólna i nieorganiczna
Reakcje utleniania i redukcji
Reakcje utleniania i redukcji
Walkowiak, Chemia ogólna, Reakcje utleniająco redukcyjne
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
więcej podobnych podstron