
Orbitale Hartree-Focka (kanoniczne).
Energie orbitalne
Zauważmy, że orbitale ψ
p
są funkcjami własnymi operatora
Focka,
a wartościami własnymi są współczynniki liczbowe ε
p
Wobec tego, można się spodziewać, że współczynniki ε
p
będą miały związek z energią. Rzeczywiście, liczby te
nazywane są energiami orbitalnymi (np. dla i-tego elektronu
opisywanego orbitalem ψ
p
(i), energia orbitalna wynosi ε
p
).
Energię orbitalną ε
p
można interpretować jako energię
elektronu poruszającego się w polu jąder i w uśrednionym
polu potencjału wszystkich pozostałych elektronów.
Orbitale ψ
p
występujące w równaniach Hartree-Focka
nazywamy orbitalami Hartree-Focka (lub orbitalami
kanonicznymi).
)
(
)
(
)
(
ˆ
i
i
i
F
p
p
p

Energie orbitalne ε
p
są po prostu wartościami
średnimi odpowiednich operatorów Focka,
gdyż
Warto jednak pamiętać, że całkowita energia
elektronowa
nie
jest
sumą
energii
orbitalnych. Jest tak dlatego, że energia
orbitalna
każdego
elektronu
obejmuje
uśrednioną energię oddziaływania tego
elektronu
z
wszystkimi
pozostałymi
elektronami. Tak więc energia oddziaływania
między każdą parą elektronów liczona jest
dwukrotnie.
i
p
p
p
d
i
i
F
i
)
(
)
(
ˆ
)
(
*

Metoda rozwiązywania równań Hartree-Focka
Widzimy więc, że procedura wariacyjna (analogiczna do
tej, którą stosujemy np. w metodzie Ritza), mająca na
celu znalezienie orbitali odpowiadających najmniejszej
możliwej wartości energii, prowadzi w efekcie do
układu
równań
Hartree-Focka
(jest
to
układ
sprzężonych równań różniczkowo-całkowych).
Pamiętamy, że niewiadomymi w tych równaniach są
orbitale ψ
p
i to właśnie znalezienie tych orbitali jest naszym
zadaniem.
Występujące w operatorze Focka operatory ,
zależą od wszystkich orbitali, a więc operator Focka
zależy od wszystkich orbitali.
)
(
)
(
)
(
ˆ
i
i
i
F
p
p
p
)
(
ˆ i
J
p
)
(
ˆ i
K
p

Dochodzimy zatem do (pozornego) paradoksu:
aby obliczyć orbitale (co jest naszym celem),
musimy zbudować najpierw operator Focka, a
żeby to zrobić, musimy znać wszystkie orbitale.
Czyli aby obliczyć orbitale musimy znać orbitale!
Okazuje się, że ten pozornie niemożliwy do
rozwiązania problem można jednak rozwiązać.
Stosuje się do tego metodę iteracyjną.

Postępowanie w metodzie iteracyjnej jest następujące:
1. Zakładamy pewne startowe orbitale ψ
1
, ψ
2
, ψ
3
, ..., ψ
n/2
.
Ponieważ są to orbitale startowe oznaczmy je dodatkowym
symbolem (0). Mamy więc orbitale startowe: ψ
1(0)
, ψ
2(0)
, ψ
3(0)
, ...,
ψ
n/2(0)
2. Stosując te orbitale budujemy operatory Focka (obliczając
odpowiednie potencjały).
3. Wstawiamy zbudowane z orbitali ψ
1(0)
, ψ
2(0)
, ψ
3(0)
, ..., ψ
n/2(0)
operatory (ściślej: obliczone potencjały) do równań Hartree-
Focka.
4. Rozwiązujemy otrzymane równania Hartree-Focka uzyskując
wyniki: nowy zbiór orbitali ψ
1(1)
, ψ
2(1)
, ψ
3(1)
, ..., ψ
n/2(1)
(oznaczonych teraz symbolem (1), zestaw energii orbitalnych
ε
1(1)
, ε
2(1)
, ..., ε
n/2(1)
oraz całkowitą energię elektronową E
(1)
.
5.Sprawdzamy, czy uzyskane w punkcie #4 orbitale ψ
1
(1)
,
ψ
2
(1)
, ..., ψ
n/2
(1)
oraz całkowita energia elektronowa są
identyczne, jak odpowiednie wielkości obliczone z
orbitali, które zostały użyte do ich uzyskania (czyli w
tym przypadku ψ
1
(0)
, ψ
2
(0)
, ψ
3
(0)
, ..., ψ
n/2
(0)
).

Jeżeli oba zestawy są identyczne – mówimy, że doszło do
samouzgodnienia i kończymy procedurę (gdyż znamy już
dokładne, samouzgodnione orbitale).
Jeżeli oba zestawy nie są identyczne – wykonujemy
obliczenia dalej: znowu używamy orbitali (tym razem zbioru
ψ
1(1)
, ψ
2(1)
, ..., ψ
n/2(1)
) do konstrukcji operatorów Focka, po
czym rozwiązujemy równania Hartree-Focka. Uzyskujemy
kolejny zestaw orbitali (ψ
1(2)
, ψ
2(2)
, ..., ψ
n/2(2)
, energii
orbitalnych ε
1(2)
, ε
2(2)
, ..., ε
n/2(2)
, jak również całkowitą energię
elektronową E
(2)
. Wyniki porównujemy z poprzednimi
(sprawdzając, czy doszło do samouzgodnienia).
Postępowanie iteracyjne kontynuujemy tak długo, aż dojdzie
do samouzgodnienia wyników, tzn, aż do momentu, gdy
orbitale uzyskane w wyniku rozwiązania równań Hartree-
Focka nie będą różniły się od orbitali zastosowanych do
konstrukcji tych równań.
Metodę
Hartree-Focka
nazywamy
metodą
pola
samouzgodnionego (ang. self-consistent field, SCF)

Techniczna metoda (opracowana przez Roothaana)
rozwiązywania równań Hartree-Focka.
Jednym z etapów postępowania w metodzie SCF jest
rozwiązanie równań Hartree-Focka (dla danych orbitali).
Jak się okazuje, jest to zadanie bardzo trudne (nawet przy
użyciu metod numerycznych i bardzo szybkich maszyn
cyfrowych).
Roothaan
zaproponował
przybliżoną
metodę
rozwiązywania
równań
Hartree-Focka
na
drodze
konstrukcji analitycznych przybliżeń do orbitali Hartree-
Focka. Mianowicie, zakładamy orbitale ψ
p
w postaci
kombinacji liniowych pewnych znanych funkcji χ,
nazywanych funkcjami bazy.
Czyli każdy orbital ψ
p
przyjmuje postać:
m
i
i
i
p
p
c
1
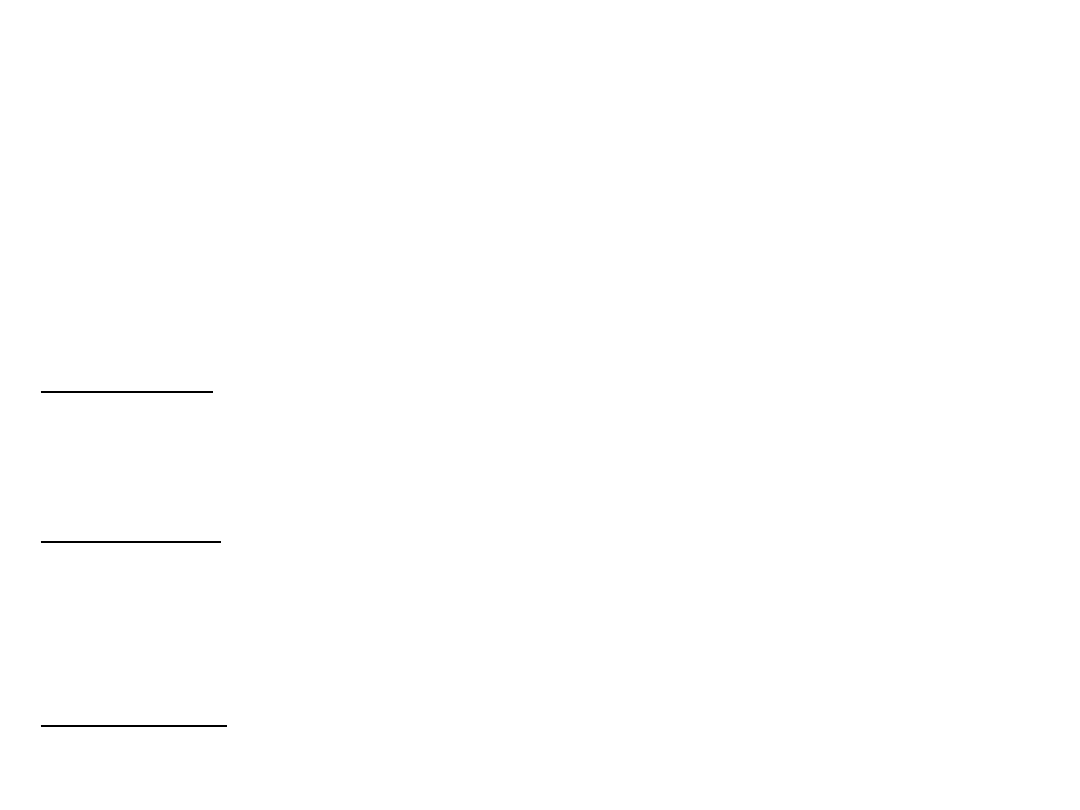
Po wstawieniu takiej formy orbitali do układu równań
Hartree-Focka okazuje się, że poszczególne równania
przestają
być
skomplikowany-mi
równaniami
różniczkowymi przechodząc w znacznie prostsze równania
algebraiczne. Po rozwiązaniu tych równań otrzymujemy
wyniki w postaci zestawu współczynników liczbowych c
pi
.
Ponieważ
funkcje
χ
i
znamy,
mamy
natychmiast
poszukiwane orbitale Hartree-Focka ψ
p
.
Uwaga #1: Metoda Hartree-Focka w połączeniu z techniką
Roothaana
jest
nazywana
metodą
Hartree-Focka-
Roothaana (HFR).
Uwaga #2: Metoda HF jest jedną z najpopularniejszych
metod stosowanych współcześnie w chemii kwantowej
(często w połączeniu z innymi metodami uwzględniającymi
tzw. korelację elektronową).
Uwaga #3: Metodę HF stosuje się prawie zawsze w
schemacie Roothaana (czyli stosuje się metodę HFR).
Uwaga #4: Metoda Hartree-Focka prowadzi do najlepszej
możliwej do uzyskania energii w ramach przybliżenia
jednoelektronowego a także do najlepszych orbitali
możliwych do uzyskania w ramach tego przybliżenia.
Uwaga #5: Intuicja współczesnych chemików (np. pojęcie
orbitali) opiera się przede wszystkim na pojęciach
określonych przez metodę Hartree-Focka i przybliżenie
jednoelektronowe.
Korelacja elektronów
Metoda SCF prowadzi do najlepszych rozwiązań w ramach
przybliżenia jednoelektronowego (do najlepszych orbitali i
najlepszej energii, którymi są odpowiednio orbitale
Hartree-Focka i energia Hartree-Focka).
W rzeczywistości elektrony nie poruszają się niezależnie i
korelują wzajemnie swoje ruchy (unikają się i starają się
przebywać jak najdalej od siebie).
Metoda HF nie uwzględnia zatem korelacji elektronowej,
gdyż każdy elektron (w metodzie HF) porusza się w
uśrednionym polu jąder i wszystkich pozostałych
elektronów.
Energia Hartree-Focka jest zatem zawsze wyższa niż
rzeczywista energia (czyli energia obliczona metodą
uwzględniającą korelację elektronową).

Definicja energii korelacji:
E
korelacji
= E
SCF
– E
dokładna
Widać, że energia korelacji będzie zawsze dodatnia,
oraz, że tak naprawdę energia korelacji to „błąd
popełniany przy obliczaniu energii za pomocą funkcji
Hartree-Focka, w odniesieniu do energii dokładnej”.
Omawiana
korelacja
elektronów
wynika
z
ich
wzajemnego oddziaływania kulombowskiego.
Inny rodzaj korelacji – korelacja wymienna –
uwzględniana w przybliżeniu elektronowym, związana z
unikaniem się elektronów o zgodnie skierowanych
spinach. Wyznacznikowa funkcja falowa a przede
wszystkim antysymetryzacja funkcji falowej umożliwiają
uwzględnienie tej korelacji.

Korelację elektronową można uwzględnić np.
poprzez wprowadzenie do funkcji falowej parametru
oznaczającego
odległość
między
elektronami.
Funkcję dla atomu He można np. zapisać w postaci:
Ψ = ψ(1)ψ(2)∙( 1 + c ∙ r
12
)
gdzie r
12
jest odległością między elektronami a c jest
parametrem wariacyjnym. W bardzo dokładnych
obliczeniach tego typu wprowadza się (nawet dla
najprostszych układów) do kilkudziesięciu tysięcy
parametrów wariacyjnych.
Uwzględnienie korelacji elektronowej wiąże się z
wyborem konkretnej metody obliczeniowej (każda z
nich oferuje inną drogę do obliczenia dokładnej
(skorelowanej) energii).

METODY WARIACYJNE Z WYZNACZNIKIEM
SLATERA
Metoda
oddziaływania
konfiguracji
CI
(configuration interaction)
W metodzie CI zakładamy funkcję falową w postaci
kombinacji liniowej wyznaczników Slatera, z których
każdy opisuje inną konfigurację elektronową układu:
Każda z funkcji Ψ jest wyznacznikiem (lub liniową
kombinacją wyznaczników);
Wszystkie funkcje Ψ muszą mieć tę samą symetrię;
Współczynniki
A
i
są
liczbami
określającymi
pośrednio udział danej konfiguracji w całkowitej
funkcji falowej.
N
i
i
i
A
1

Np. dla atomu helu (dwa elektrony) możemy rozpatrywać następujące
konfiguracje:
Ψ
1
= (1s)
2
(2s)
0
(3s)
0
...
Ψ
2
= (1s)
1
(2s)
1
(3s)
0
...
Ψ
3
= (1s)
0
(2s)
2
(3s)
0
...
.....................................
Ψ
N
= (1s)
0
(2s)
0
(3s)
0
... (??)
2
Biorąc pod uwagę wybraną liczbę konfiguracji (np. Ψ
1
, Ψ
2
, ... ,
Ψ
N
)
możemy utworzyć całkowitą funkcję falową Φ, natomiast
współczynniki kombinacji liniowej A
i
są nieznane i stanowią nasze
parametry wariacyjne, które obliczamy.
Zazwyczaj
uwzględnienie
zaledwie
kilku
wyznaczników
odpowiadających
konfiguracjom
o
najniższych
energiach
powoduje istotną poprawę wyniku (w porównaniu z metodą HF,
która uwzględnia tylko jeden wyznacznik).
Uwaga: redukcja funkcji Φ
CI
do jednego członu (czyli N=1), prowadzi do funkcji falowej dla
stanu podstawowego w przybliżeniu jednoelektronowym.
N
i
i
i
CI
A
1

Dla wielu zamkniętopowłokowych cząsteczek w stanie podstawowym
jednowyznacznikowa funkcja falowa bardzo dobrze opisuje stan układu
– w takiej sytuacji metoda HF prowadzi do poprawnych wyników, a
zastosowanie metody CI tylko nieznacznie zwiększa dokładność
obliczeń (współczynniki A
i
są bardzo małe dla wszystkich
uwzględnianych
konfiguracji
z
wyjątkiem
konfiguracji
stanu
podstawowego, dla którego A jest bliskie 1). Mówimy wówczas, że
mamy do czynienia z układem „jednokonfiguracyjnym” (udział
konfiguracji wzbudzonych jest nieznaczny).
Dla niektórych układów uwzględnienie korelacji (poprzez metodę CI)
jest konieczne, np. dla atomu berylu, w stanie podstawowym,
konfiguracja (1s)
2
(2s)
2
ma dużą „domieszkę” konfiguracji (1s)
2
(2p)
2
.
Uwzględnienie (w metodzie HF) tylko konfiguracji (1s)
2
(2s)
2
prowadzi
do niedokładnego wyniku, natomiast uwzględnienie obu konfiguracji w
metodzie CI (przy zaniedbaniu innych wyznaczników) wskazuje, że
uzyskana energia jest zgodna z doświadczeniem, natomiast udział
konfiguracji (1s)
2
(2p)
2
w funkcji stanu podstawowego atomu berylu jest
bardzo duży (powyżej 10%).
Wniosek: w zależności od problemu należy zastosować
odpowiednio dobraną metodę obliczeniową.
Zastosowanie pełnej metody CI (full CI) jest
najczęściej niemożliwe. Dlatego niektóre konfiguracje
(wyznaczniki) odrzucamy, często arbitralnie.
Umowny
charakter
pojęcia
„konfiguracja
elektronowa”.
Wieloreferencyjna metoda CI
Podejście, w którym dominuje (w rozwinięciu CI)
jeden wyznacznik (wyznacznik HF) jest nazywane
jednoreferencyjnym. Wówczas rozwinięcie (funkcję
falową) CI budujemy wymieniając orbitale zajęte w
tym wyznaczniku na wirtualne. Jednak dla pewnych
układów

(zwłaszcza otwartopowłokowych kompleksów van
der
Waalsa)
konieczne
jest
podejście
wieloreferencyjne.
Wieloreferencyjna metoda CI polega na tym, że
„przestrzenią modelową” jest kilka wyznaczników
(a nie jeden). A zatem, konstruujemy kilka
wyznaczników, które wydają się ważne (bo
odpowiadają ważnym konfiguracjom kompleksu) i
obsadzamy elektronami najniższe spinorbitale.
Następnie
konstruujemy
funkcję
(wieloreferencyjną) CI dodając do kombinacji
liniowej
człony
odpowiadające
innym
„konfiguracjom” (wymieniamy spinorbitale na
wirtualne „tworząc” konfiguracje wzbudzone).
Wnioski:
•
w metodzie CI zakładamy funkcję falową w postaci
liniowej kombinacji wyznaczników Slatera;
•
współczynniki kombinacji liniowej (w funkcji CI) są
traktowane jak parametry wariacyjne i można je
wyznaczyć np. metodą Ritza;
•
współczynniki kombinacji liniowej podlegają optymalizacji
aż do wyznaczenia najlepszej funkcji falowej;
•
Spinorbitale, z których składają się wyznaczniki, nie
podlegają zmianom (pozostają takie, jakie uzyskano w
metodzie HF);
•
zazwyczaj jest numerycznie niemożliwe uwzględnienie
wszystkich wyznaczników w rozwinięciu CI;
•
istotne jest, aby w rozwinięciu CI uwzględnić te
wyznaczniki, które odpowiadają ważnym konfiguracjom
elektronowym;
•
metoda CI jest metodą wariacyjną.

Metoda MC SCF (wielokonfiguracyjna metoda SCF)
Metoda MC SCF jest najbardziej ogólną z metod stosujących liniową
kombinację wyznaczników Slatera jako przybliżenie do funkcji
falowej.
W metodzie MC SCF postać funkcji falowej jest pozornie analogiczna
do funkcji stosowanej w metodzie CI (kombinacja liniowa
wyznaczników). Jednak istotną różnicą jest to, że również same
spinorbitale podlegają optymalizacji w celu zminimalizowania energii
•
W klasycznym wariancie metody MC SCF:
•
(i) bierzemy skończone rozwinięcie CI (ustalone są wyznaczniki i
orbitale do ich budowy);
•
(ii) obliczamy współczynniki A
i
przy wyznacznikach metodą Ritza
(orbitale pozostają bez zmian);
•
(iii) przy ustalonych współczynnikach A
i
wariujemy orbitale tak, aby
energia była jak najniższa;
•
(iv) wstawiamy uzyskane w punkcie (iii) orbitale do funkcji w punkcie
(i)
•
(v) powtarzamy całą procedurę aż dojdzie do samouzgodnienia.
Wniosek: metoda MC SCF jest metodą wariacyjną, obejmuje
postępowanie iteracyjne oraz jest znacznie dokładniejsza (i bardziej
kosztowna) od metody CI.

Metoda CAS SCF (metoda kompletnej przestrzeni aktywnej)
(Complete Active Space Self-Consistent Field)
Metoda CAS SCF jest wariantem (jednym z najważniejszych)
metody MC SCF. Idea metody CAS SCF jest następująca:
wykonujemy obliczenie HF dla cząsteczki otrzymując orbitale
molekularne i energie orbitalne;
część z tych orbitali, zazwyczaj podwójnie obsadzone wewnętrzne
orbitale, określamy jako przestrzeń nieaktywną;
pozostałe orbitale tworzą przestrzeń aktywną
z orbitali przestrzeni aktywnej tworzymy wszystkie możliwe
obsadzenia i wzbudzenia (czyli nowe konfiguracje)
kombinacja liniowa wyznaczników z punktu tworzy nam
funkcję falową;
dalej postępujemy jak w metodzie MC SCF.
Wniosek: metoda CAS SCF jest uproszczonym wariantem metody
ogólnej MC SCF, dzięki czemu można ją stosować do badania
większych molekuł.
Metoda CAS SCF jest metodą wariacyjną.

Metody niewariacyjne z wyznacznikami Slatera
Metoda sprzężonych klasterów (CC) – Coupled Cluster
Method
Obserwacja Sinanoğlu (1970): uwzględnienie korelacji
elektronowej (i) wewnątrz par elektronowych; (ii) pomiędzy
parami (para-para oraz para-para-para) pokrywa większość
efektów korelacyjnych w układzie.
Na tej obserwacji (aby uwzględniać korelację między grupami
elektronów) opiera się metoda CC.
Ogólna idea metody Coupled Cluster: coraz dokładniej
uwzględniać korelację elektronową, czyli
- wychodząc od niezależnych elektronów,
- poprzez niezależne pary elektronowe,
- niezależne układy para-para,
- niezależne układy para-para-para, itd.

Rozpoczyna się od wprowadzenia tzw. wyznacznika Slatera dla
próżni. Może nim być np. wyznacznik Hartree-Focka, Ф
0
.
Następnie zapisujemy równanie:
gdzie
jest naszym dokładnym rozwiązaniem (funkcją falową)
dla stanu podstawowego.
Symbol oznacza operator klasterowy, natomiast
nazywamy operatorem falowym.
Operator falowy przekształca funkcję Ф
0
w dokładną
funkcję falową opisującą stan podstawowy („dokładną” w
sensie metody CC).
Operator klasterowy jest sumą operatorów wzbudzeń:
gdzie operator z indeksem „1” jest operatorem wzbudzeń
jednokrotnych (pojedynczych), z indeksem „2” operatorem
wzbudzeń dwukrotnych (podwójnych), itd.
0
ˆ
exp
T
Tˆ
)
ˆ
exp(T
)
ˆ
exp(T
max
ˆ
...
ˆ
ˆ
ˆ
ˆ
ˆ
4
3
2
1
n
T
T
T
T
T
T

Zazwyczaj wykonuje się obliczenia ograniczając się do
wzbudzeń potrójnych (i niższych).
Oczywiście żądamy, aby funkcja falowa metody CC (czyli ψ
CC
)
spełniała równanie Schrödingera:
czyli
Zrozumienie równań metody CC jest możliwe praktycznie
wyłącznie na gruncie teorii drugiego kwantowania (drugiej
kwantyzacji), w której wprowadza się operatory kreacji i
anihilacji
(metody drugiego kwantowania opisali P. Jørgensen i J. Simons).
Metoda Coupled Cluster jest metodą niewariacyjną. Została ona
wprowadzona do chemii kwantowej przez Čižka i Paldusa a
rozwinięta przez Bartletta i polskich chemików kwantowych (K.
Jankowskiego i K. Kowalskiego). Prace nad metodą CC trwają do
dziś, ostatnio dotyczą one m.in. sformułowania równań CC w
takiej postaci, aby możliwe było wykonywanie obliczeń
równoległych tą metodą przy użyciu maszyn cyfrowych.
CC
CC
E
H
ˆ
0
0
)
ˆ
exp(
)
ˆ
exp(
ˆ
T
E
T
H

Inne
metody
niewariacyjne
umożliwiające
uwzględnienie korelacji elektronowej
/opracowane m.in.
przez Bartletta, Simonsa, Ortiza, Cederbauma/.
– Metoda EOM-CC czyli Metoda równań ruchu w sprzężonych
klasterach (Equation of Motion in Coupled Clusters) – umożliwia
opis stanów wzbudzonych na gruncie metody CC (uzyskiwanie
energii wzbudzeń w odniesieniu do stanu podstawowego).
/Bartlett, Simons/.
– Metoda MBPT czyli Wielociałowy rachunek zaburzeń (Many
Body Perturbation Theory), dotyczy sytuacji, w których układem
niezaburzonym jest układ opisywany funkcją HF natomiast
poprawki do energii określają nam energię korelacji elektronowej.
– Metoda OVGF (oparta na formalizmie tzw. funkcji Greena)
/Cederbaum, Ortiz, Simons, Zakrzewski/ umożliwiająca np.
dokładne obliczanie potencjałów jonizacji i powinowactw
elektronowych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Chemia kwantowa do druku (5)
Chemia kwantowa do druku (1)
Chemia kwantowa do druku
Chemia kwantowa do druku (2)
grz8 ściąga z teorii chemia xcałość do druku (2)
Chemia kolokwium1231 1 [do druku]
chemia rep do druku
Chemia egzamin [do druku]
sciagi do druku, Edukacja, Ziip, chemia
.II.Mechanika kwantowa, ROK 1 Technologia żywności Kraków UR, CHEMIA NIEORGANICZNA, Do egzaminu
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
DO DRUKU 2, Studia budownictwo pierwszy rok, Chemia budowlana, sprawozdania
Do druku impulsy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
Chemia fizyczna temodynamika cz I do druku
Do druku octowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
więcej podobnych podstron