Biosynteza hemu i porfiryn
Budowa i funkcje hemoglobiny
Agnieszka Voight
Marta Włodarczyk
Grupa IX
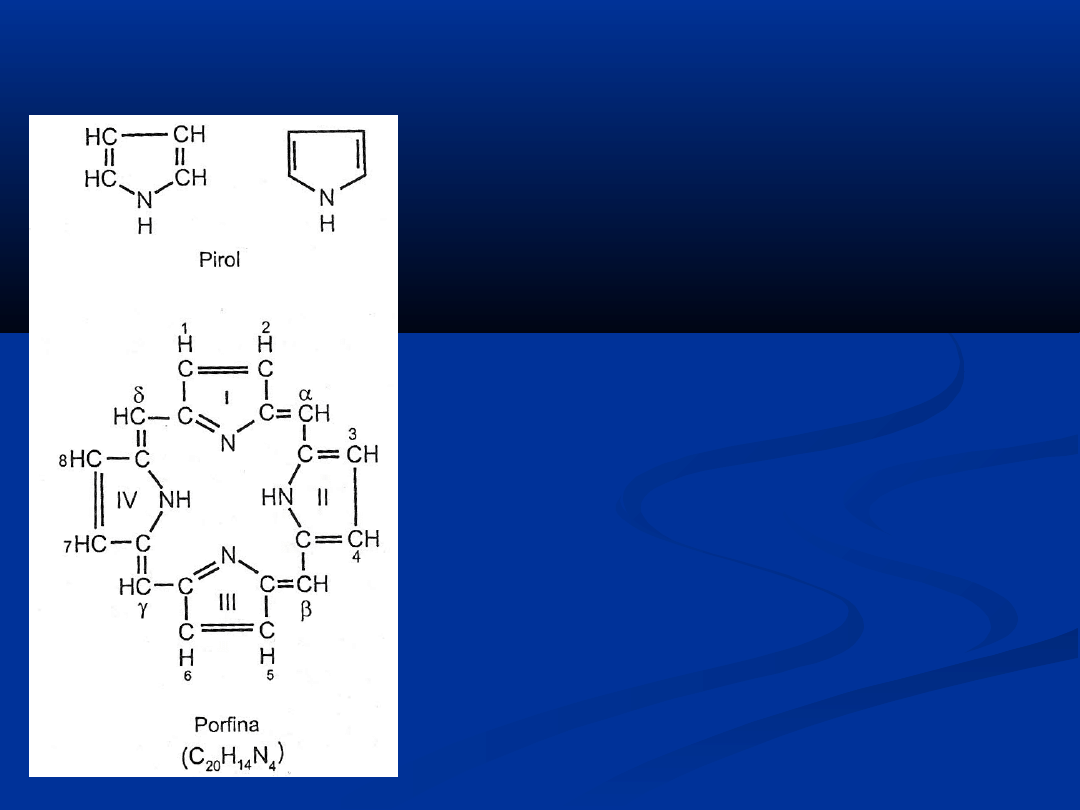
PORFIRYNY
Porfiryny są związkami cyklicznymi
Zbudowane są z 4 pierścieni pirolowych
połączonych mostkami metinowymi –CH=
Tworzą kompleksy z jonami metali, które łączą
się
z atomami azotu pierścieni pirolowych np.
żelazoporfiryny
(
hem hemoglobiny
)
porfiryna zawierająca magnez
(
chlorofil
)
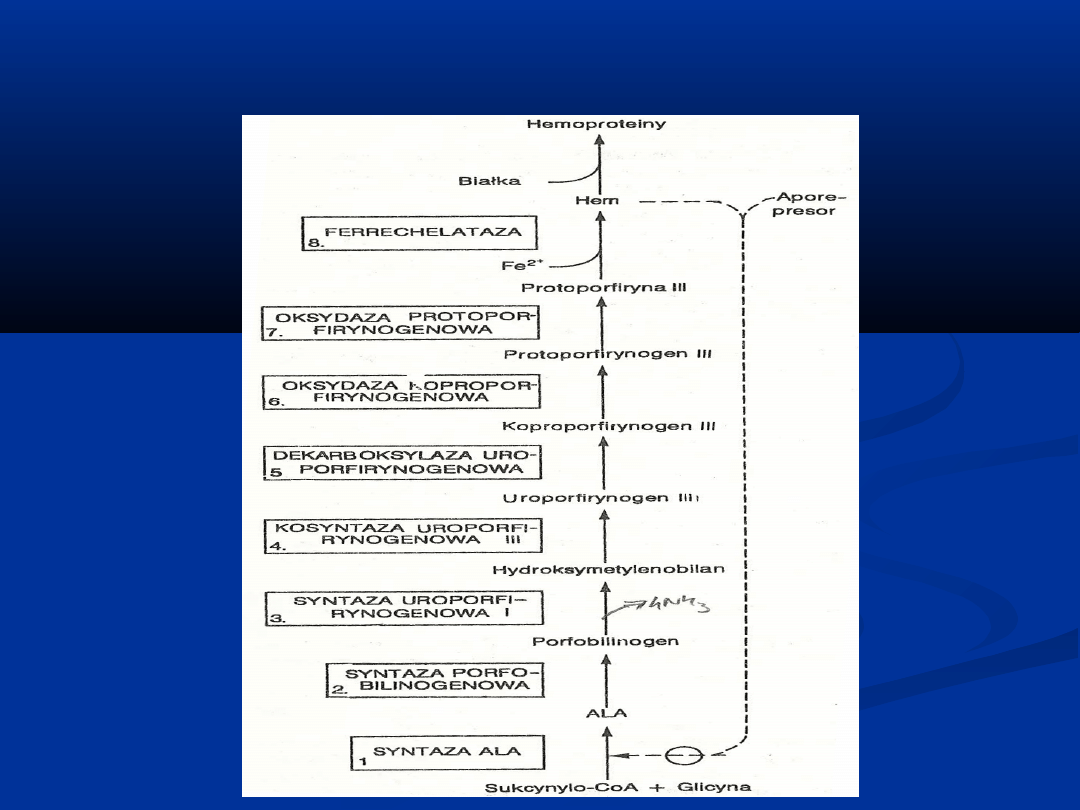
BIOSYNTEZA PORFIRYN
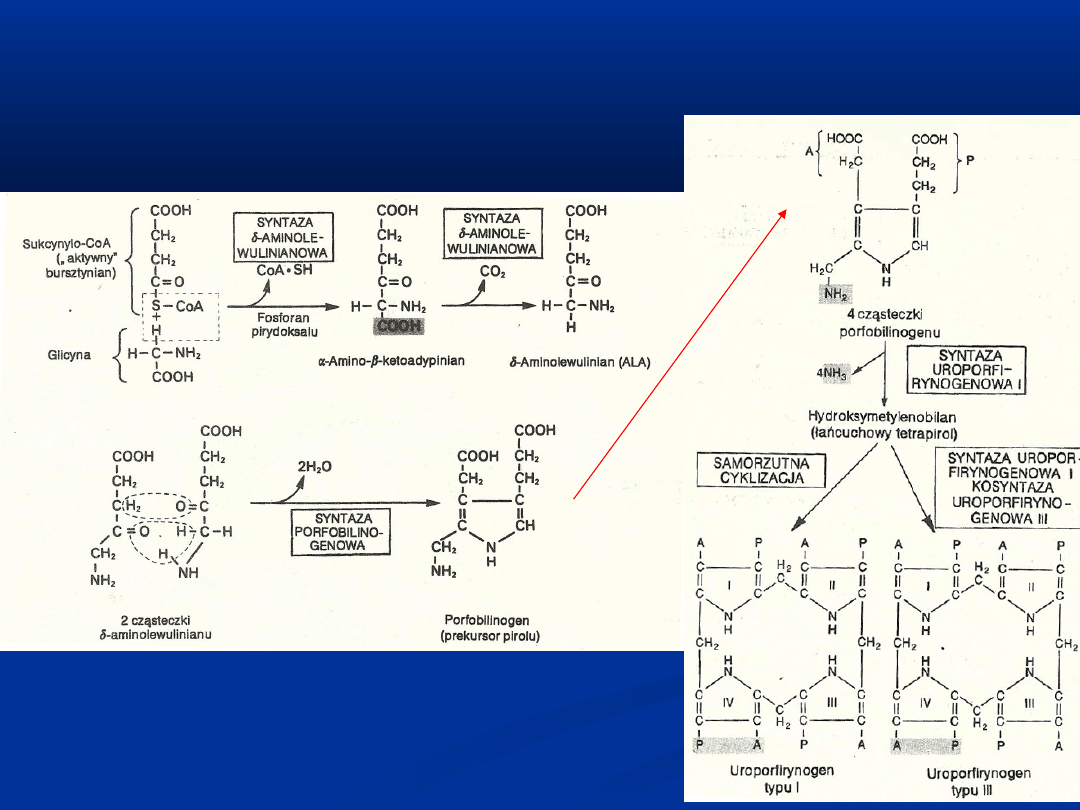
Sukcynylo-CoA (pochodzący z
mitochondrium z cyklu Krebsa)
Glicyna (aktywowana przez fosforan
pirydoksalu)
BIOSYNTEZA PORFIRYN
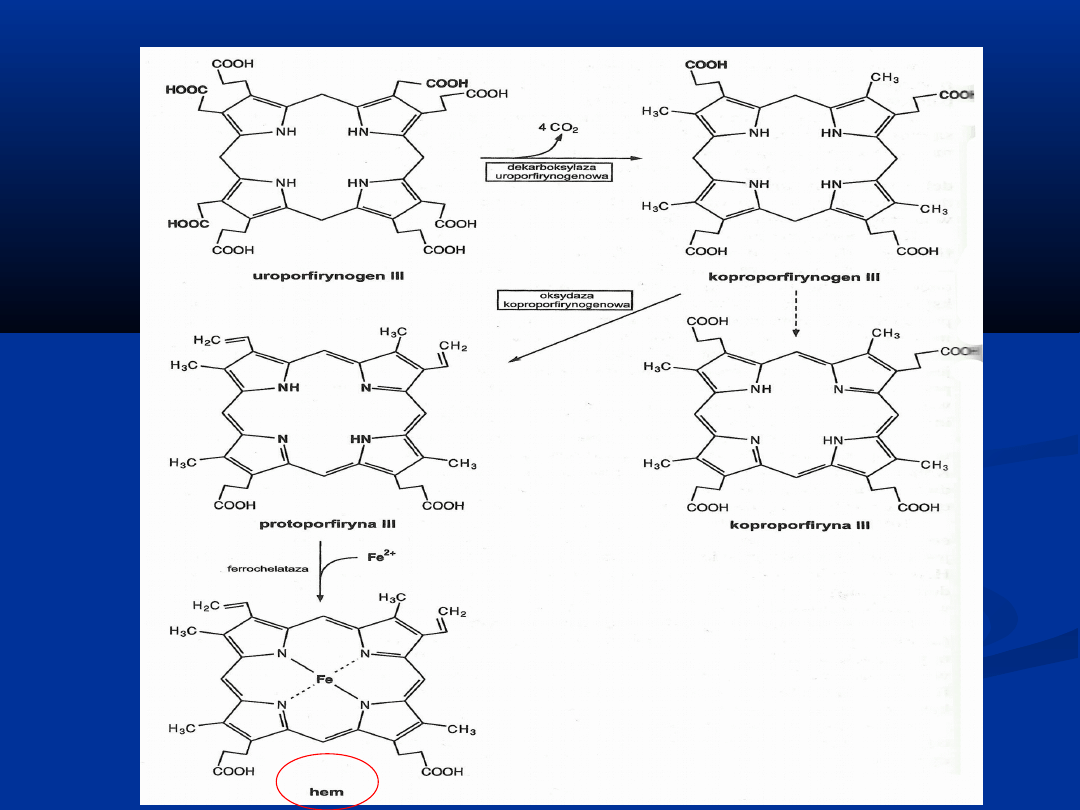
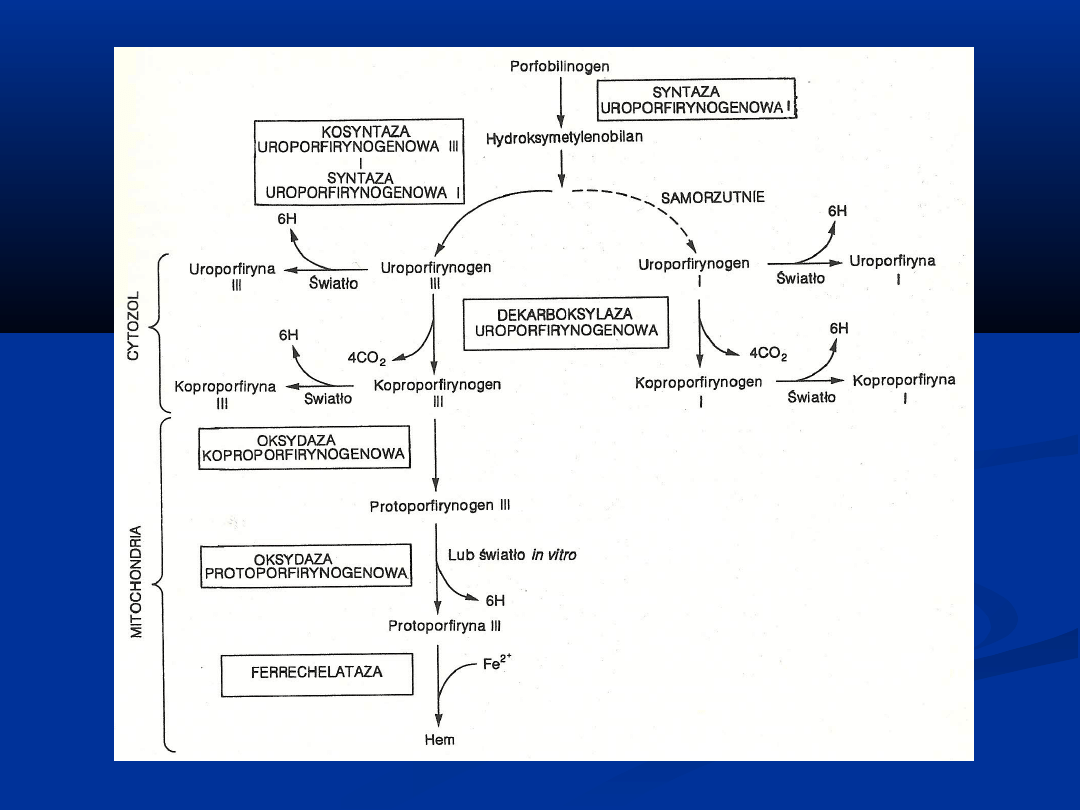
BIOSYNTEZA PORFIRYN

Syntaza delta-amino-lewulinianowa (ALA)
Jest to enzym kontrolujący nasilenie syntezy porfiryn w wątrobie
ssaków
Syntetyzowany w mitochondriach
Z dwóch cząsteczek ALA powstaje prekursor pirolu- porfobilinogen
(PGB)
Reakcja katalizowana przez syntazę ALA kontroluje syntezę hemu
Działanie ALA podlega regulacji ze strony hemu, który hamuje
syntazę ALA
(ujemne sprzężenie zwrotne)
Syntaza ALA ma krótki okres półtrwania ok. 1 h w wątrobie ssaków
(szybki metaboloizm)
Wiele ksenobiotyków powoduje znaczne zwiększenie stężenia
syntazy ALA w
wątrobie człowieka. Większość z nich jest metabolizowana w wątrobie
przy
udziale cytochromu P-450, w konsekwencji jest zwiększone
wykorzystanie
hemu przez cyt. P-450, zmniejsza się wewnątrzkomórkowe stężenie
hemu, co
wpływa na derepresję syntazy ALA i zwiększenie syntezy hemu
Glukoza i hematyna zapobiegają derepresji (hamują) syntazę ALA
34-8
34-8
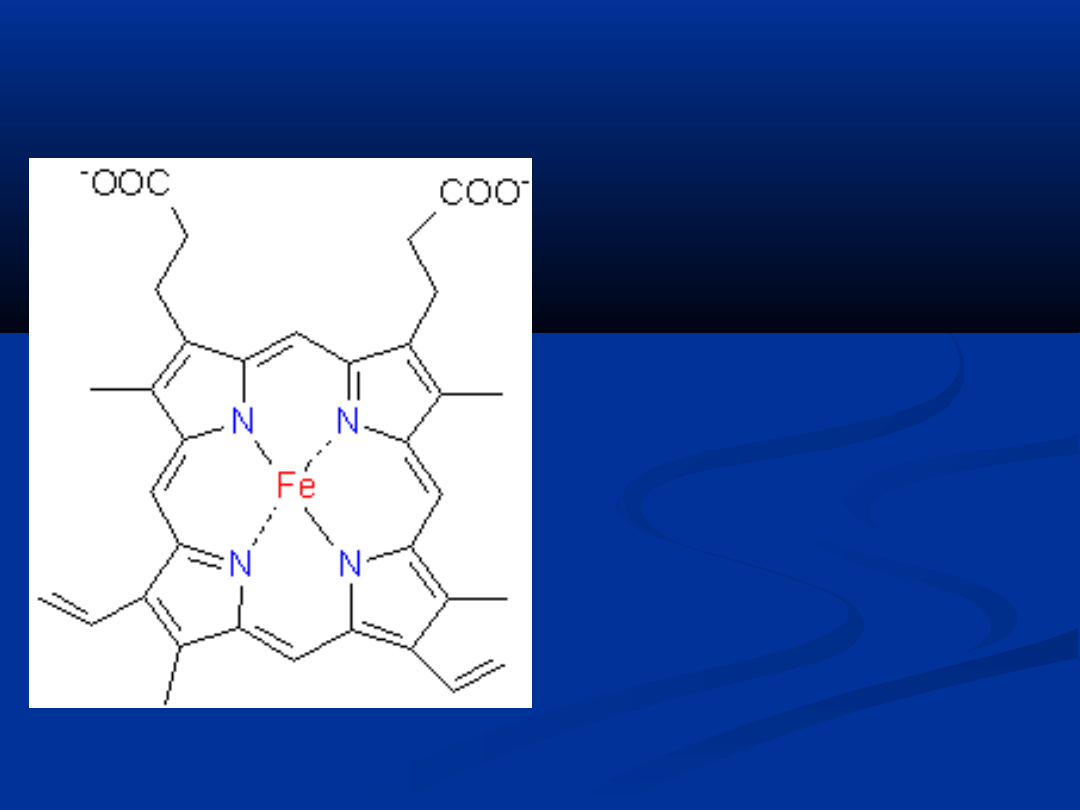
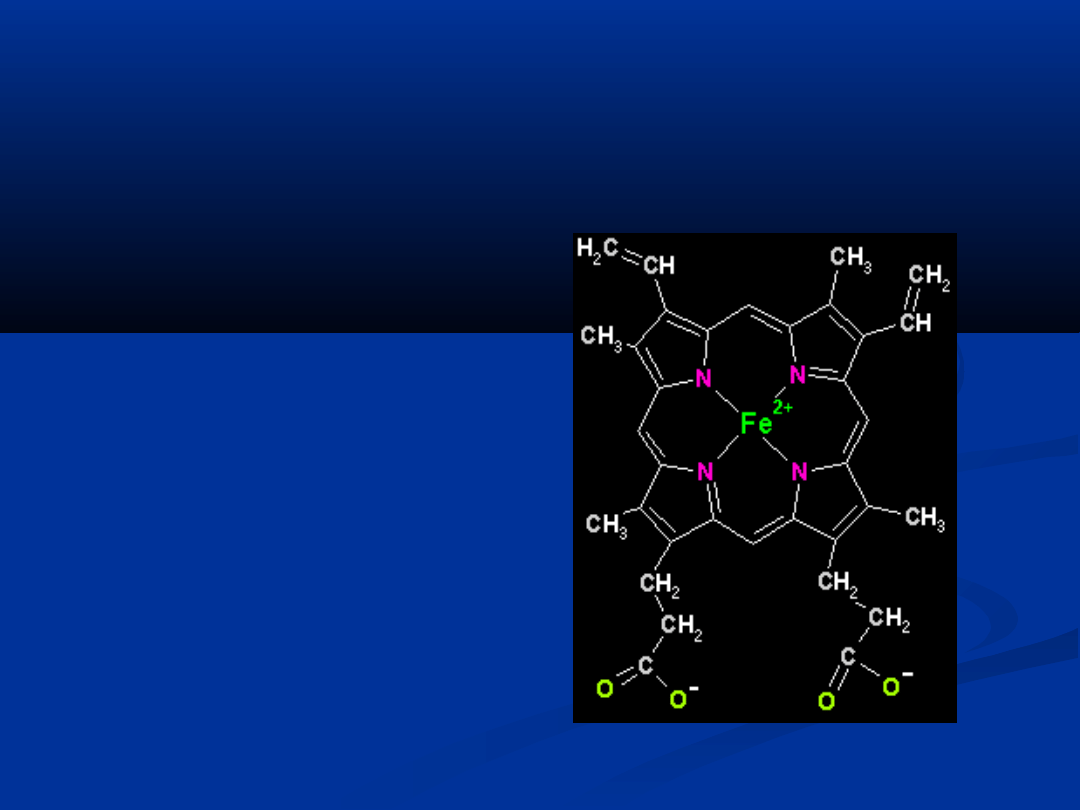
HEM
– jest to niebiałkowa grupa
barwnika krwi - hemoglobiny
Hem to pochodna pirolu.
Zbudowany jest z czterech
pierścieni pirolowych połączonych
grupami metinowymi =CH- z
atomem żelaza, które jest na
drugim stopniu utlenienia
Żelazo jest przyłączone do atomu
azotu dwoma wiązaniami
kowalencyjnymi i
niekowalencyjnymi
Najczęstszą odmianą hemu jest
tzw. protohem czyli podstawowy
składnik hemoglobiny
Hem jest pokrewny strukturalnie z
chlorofilem. (M. Nencki i L.
Marchlewski)
W większości tkanek ssaków (oprócz dojrzałych erytrocytów,
które nie posiadają mitochondriów)
Bardzo aktywne w syntezie hemu są komórki szpiku kostnego i
wątroby
W trakcie rozwoju erytrocytów hem musi zostać przetransportowany z
mitochondriów do cytoplazmy (mitochondria ulegają degradacji)
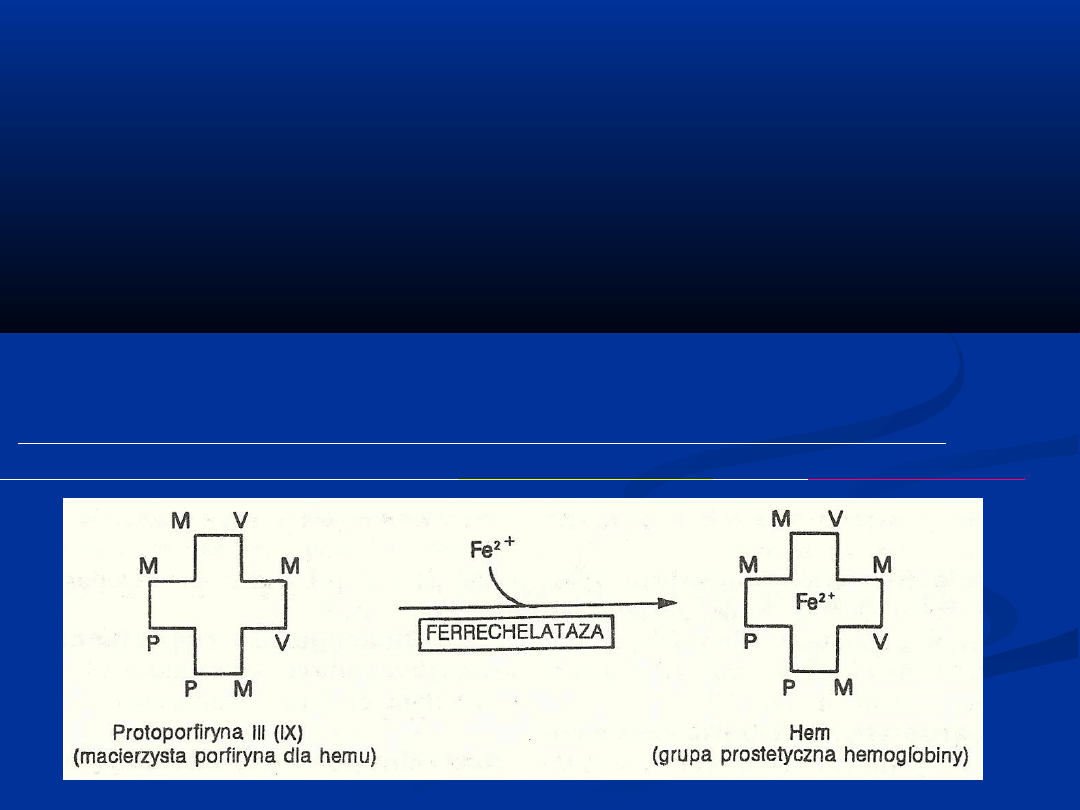
Synteza polega na wbudowaniu jonu żelaza do protoporfiryny
w reakcji katalizowanej przez
syntazę hemową
, czyli
ferrechelatazę
BIOSYNTEZA HEMU

Jon żelaza z porfiryną stanowi grupę
prostetyczną:
-
hemoglobiny
(transport tlenu we krwi)
-
mioglobiny
(magazyn tlenu w mięśniach)
-
cytochromu c
(udział w transporcie elektronów w łańcuchu
oddechowym)
-
cytochromu P-450
(hydroksylacja ksenobiotyków)
-
katalazy
(rozkład nadtlenku wodoru)
-
2,3 – diokygenazy tryptofanowej
(utlenianie tryptofanu)
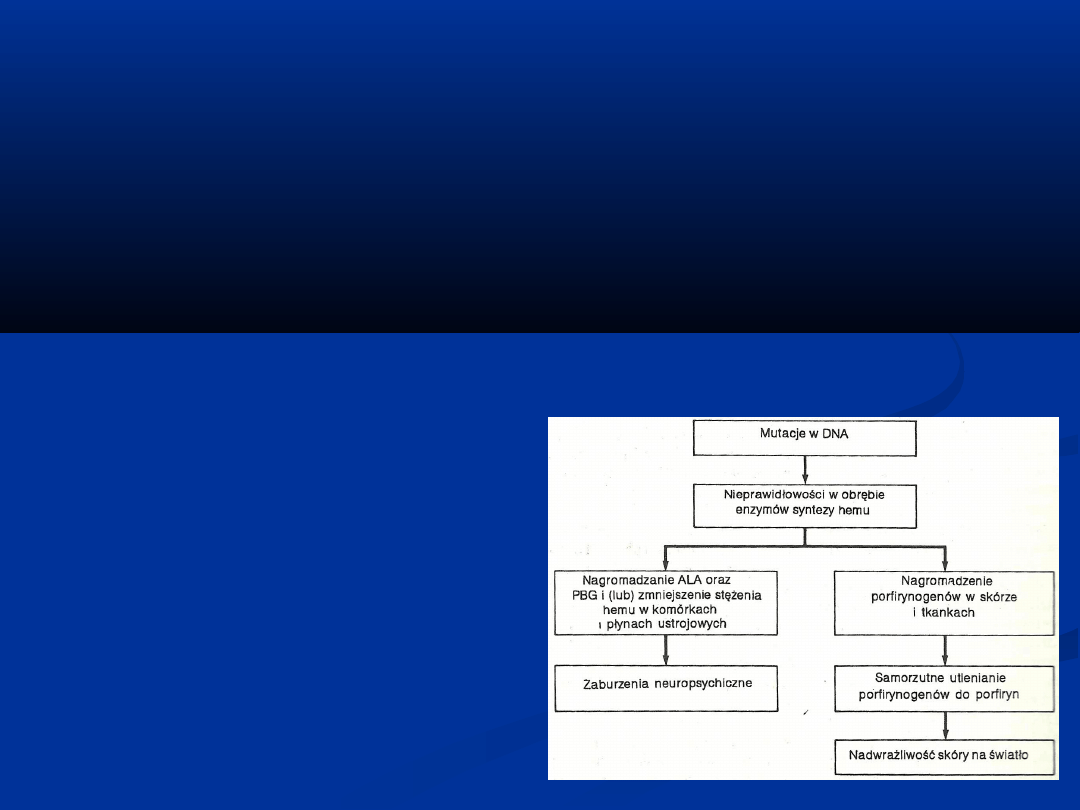
Porfirie
należą o grupy chorób wrodzonych lub nabytych
związanych z
zaburzeniami biosyntezy hemu. Są spowodowane wadami
enzymatycznymi.
Koproporfiryny i uroporfiryny
wydalanie ich wzrasta w
przypadku porfirii.
Występują w moczu i kale i można je rozdzielić za pomocą
ekstrakcji rozpuszczalnikami,a następnie zidentyfikować i
oznaczyć ilościowo metodami spektrofotometrycznymi.
PORFIRIE
Objawy porfirii :
-niedokrwistość
-ból brzucha, zaburzenia
neuropsychiczne
-nadwrażliwość skóry na światło
Chorzy powinni unikać środków znieczulających,
leków i alkoholu, które indukują cyt P-450
HEMOGLOBINA - BUDOWA
Jest
tetramerem
składającym się
z
czterech pierścieni hemowych
i
czterech łańcuchów
polipeptydowych
(parami
identycznych).
Łańcuchy te są związane ze sobą
wiązaniami niekowalencyjnymi.
Do każdego z tych łańcuchów
dołączona jest
grupa hemowa
.
Podstawowa hemoglobina –
występująca u dorosłych ludzi i
wszystkich kręgowców - HbA1
jest zbudowana z dwóch
łańcuchów alfa i dwóch
łańcuchów beta tworząc
strukturę alfa2beta2.

HEMOGLOBINA - BUDOWA
Występujący we wszystkich hemoglobinach
łańcuch
alfa
składa się ze 141 reszt aminokwasowych, jego
N-końcowym aminokwasem jest
walina
a C-
końcowym jest
arginina
.
Łańcuch beta
jest złożony ze 146 reszt
aminokwasowych. W łańcuchu beta N-końcowym
aminokwasem jest
walina
a C-końwoym jest
histydyna
.

Najczęściej występujące rodzaje
Najczęściej występujące rodzaje
hemoglobiny
hemoglobiny
HbA
=α
2
β
2
– hemoglobina prawidłowa u
ludzi dorosłych stanowiąca 97,5% całej Hb
HbF
= α
2
γ
2
– hemoglobina płodowa
HbS
= α
2
S
2
– hemoglobina sierpowatych
krwinek czerwonych
HbA
2
= α
2
δ
2
– hemoglobina prawidłowa u
ludzi dorosłych stanowiąca 2,5% całkowitej
hemoglobiny
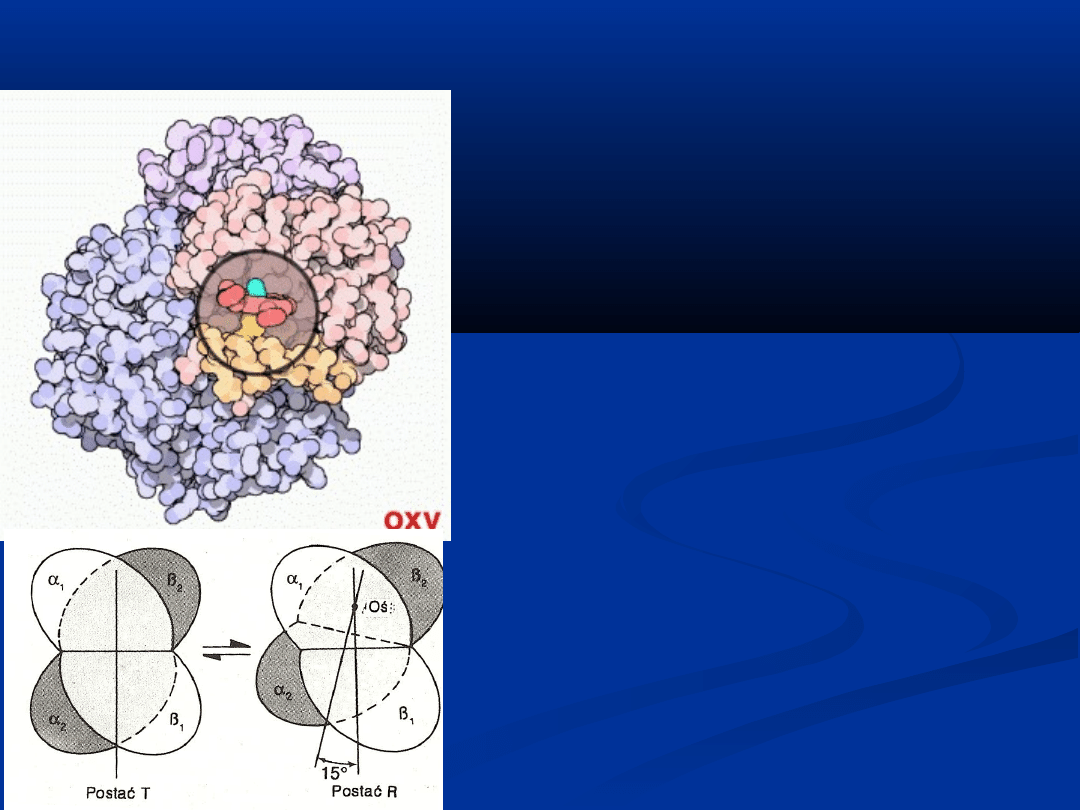
Przyłączenie cząstki tlenu do jednej z
czterech cząstek hemu hemoglobiny
powoduje zmianę struktury drugo-, trzecio- i
czwartorzędowej całego tetrameru.
Przyczyną jest wsunięcie atomu żelaza w
płaszczyznę pierścienia hemu po połączeniu
z tlenem.
W nieutlenowanej hemoglobinie występuje
żelazo wysokospinowe, co sprawia, że jon
Fe2+ znajduje się 0,075nm nad
pierścieniem hemowym. Związanie
hemoglobiny z cząsteczką tlenu powoduje,
że żelazo wysokospinowe przechodzi w
postać niskospinową (ale nadal pozostaje
dwuwartościowe).
Skutkiem tego jest przesunięcie całego
białka wiążącego hem. Doprowadza to w
rezultacie do pęknięcia wiązań
poprzecznych pomiędzy końcami
karboksylowymi wszystkich czterech cząstek
globiny. W efekcie dochodzi do rotacji pary
α1/β1 względem pary α2/β2 o 15°.
Oksyhemoglobina jest nietrwała i bardzo
łatwo dysocjuje na hemoglobinę i tlen przy
zmniejszeniu ciśnienia parcjalnego tlenu.

FUNKCJE HEMOGLOBINY
Oprócz transportu tlenu z płuc do tkanek, hemoglobina
uczestniczy w transporcie CO
2
z tkanek do płuc, skąd jest
on usuwany podczas oddychania
Bezpośrednio po odłączeniu tlenu cząsteczka hemoglobiny
wiąże CO
2
w ilości stanowiącej ok. 15% CO
2
transportowanego przez krew
CO
2
wchodzi w reakcję z końcowymi grupami α-aminowymi
hemoglobiny tworząc
karbaminian
, czemu towarzyszy
uwolnienie protonów współodpowiedzialnych za
efekt Bohra
CO
2
+ Hb-NH
3+
= 2H
+
+ Hb-NH-COO
-
Zmiana ładunku amino-końcowych gryp umożliwia
tworzenie wiązań poprzecznych pomiędzy łańcuchami α i β
w sposób typowy dla formy nieutlenowanej
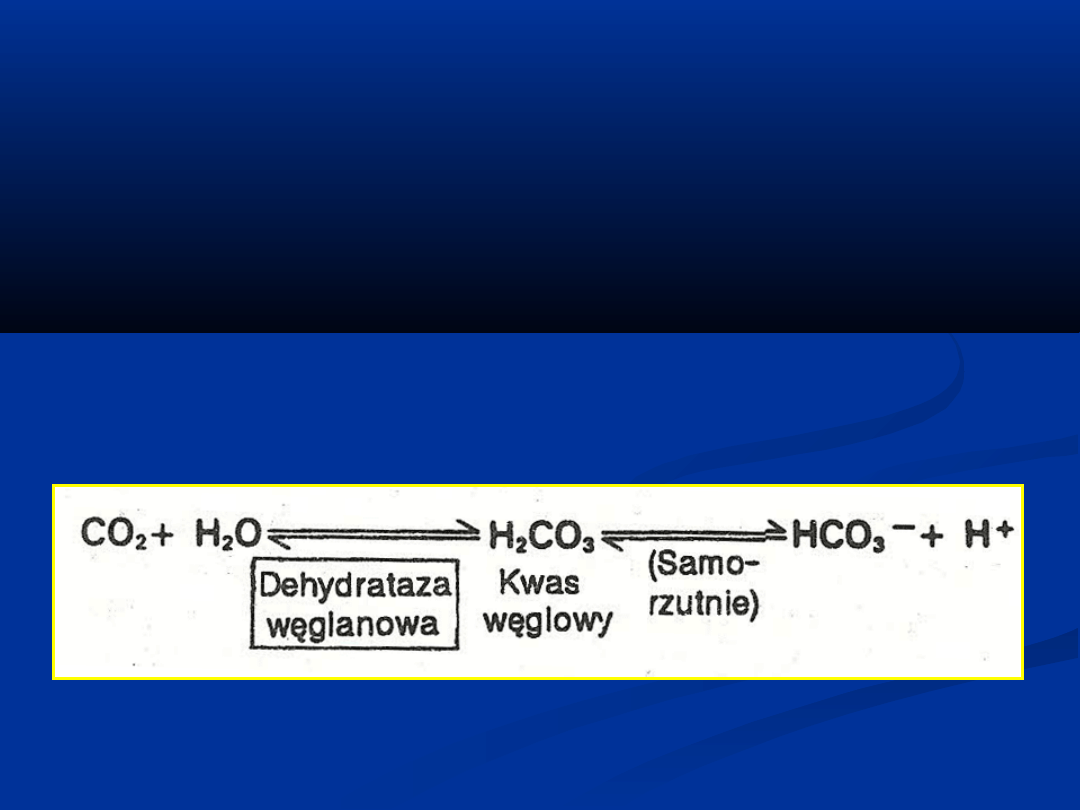
W płucach utlenowaniu hemoglobiny towarzyszy
W płucach utlenowaniu hemoglobiny towarzyszy
odłączenie i wydalanie CO
odłączenie i wydalanie CO
2
2
Z chwilą zaabsorbowania CO
Z chwilą zaabsorbowania CO
2
2
przez krew
przez krew
dehydrataza węglanowa
dehydrataza węglanowa
(anhydraza węglanowa
(anhydraza węglanowa
)
)
erytrocytów katalizuje utworzenie kwasu
erytrocytów katalizuje utworzenie kwasu
węglowego, który dysocjuje do wodorowęglanu i
węglowego, który dysocjuje do wodorowęglanu i
protonu na skutek przesunięcia równowagi reakcji
protonu na skutek przesunięcia równowagi reakcji
w kierunku dysocjacji
w kierunku dysocjacji

EFEKT BOHRA
Hemoglobina
pełni funkcję
układu buforowego
chroniącego
organizm przed szkodliwym wpływem kwasowości krwi
Odłączeniu 4 cząsteczek O
2
z hemoglobiny towarzyszy wiązanie
2H
+
, które wraz z wodorowęglanem tworzą
kwas węglowy
, który
pod wpływem
dehydratazy węglanowej
tworzy CO
2
, usuwany w
procesie oddychania
Stąd wiązanie tlenu zwiększa wydalanie CO
2
z powietrzem
wydechowym
Protony odpowiedzialne za efekt Bohra powstają w wyniku
rozerwania wiązań poprzecznych podczas przyłączania tlenu do
formy T
Protony te przekształcają wodorowęglan w kwas węglowy
usuwany jako CO
2
w naczyniach włosowatych pęcherzyków
płucnych
Zaś obecność protonów podczas odłączania tlenu i tworzenia
formy T jest konieczna, bo przyłączają się do reszt CH
3
łańcuchów
β
WZROST STĘŻENIA H
+
POWODJE ODŁĄCZENIE O
2
, A WZROST pO
2
POWODUJE ODŁĄCZENIE H
+
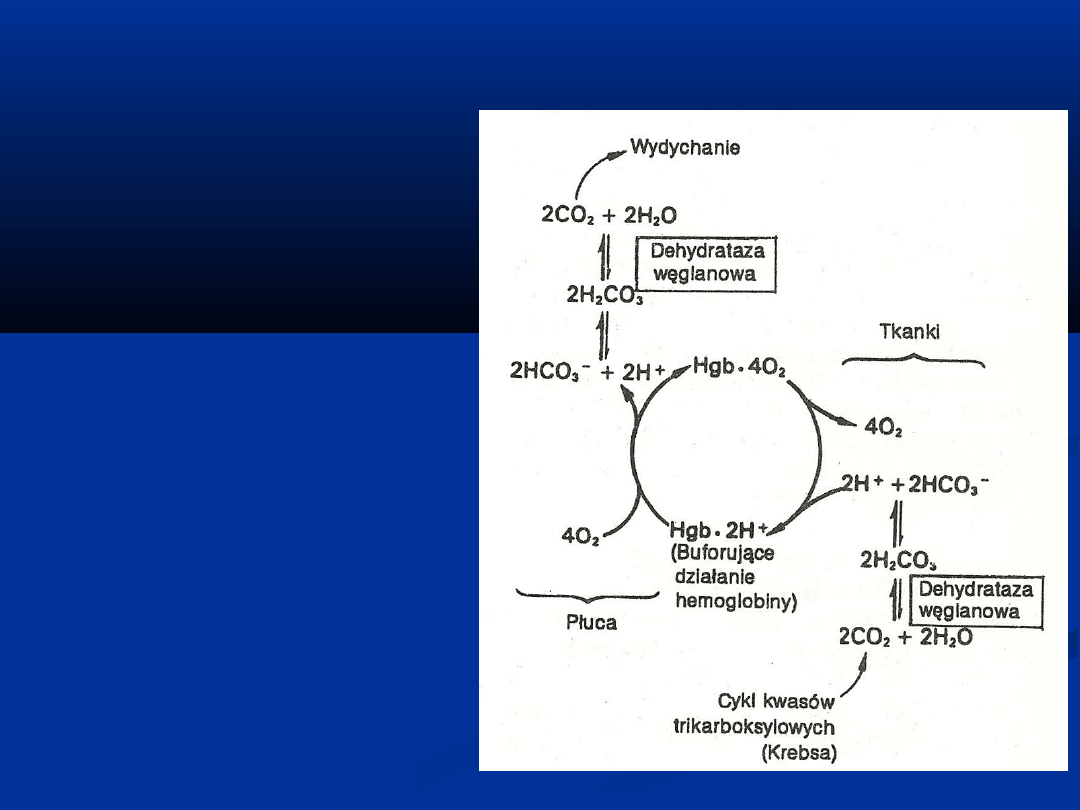
Powstający w tkankach
Powstający w tkankach
CO
CO
2
2
łączy się z wodą
łączy się z wodą
tworząc kwas węglowy
tworząc kwas węglowy
Kwas ten dysocjuje do
Kwas ten dysocjuje do
2H
2H
+
+
i jonu
i jonu
wodorowęglanowego
wodorowęglanowego
(2HCO
(2HCO
3
3
-
-
)
)
Nieutlenowana Hgb wiąże
Nieutlenowana Hgb wiąże
2H
2H
+
+
i transportuje je do
i transportuje je do
płuc
płuc
W płucach w wyniku
W płucach w wyniku
przyłączania O
przyłączania O
2
2
następuje
następuje
uwalnianie 2H
uwalnianie 2H
+
+
, które
, które
łączą się z jonami
łączą się z jonami
wodorowęglanowymi i
wodorowęglanowymi i
tworzą kwas węglowy
tworzą kwas węglowy
(2H
(2H
2
2
CO
CO
3
3
-
-
)
)
Kwas ten przekształcany
Kwas ten przekształcany
jest przez
jest przez
dehydratazę
dehydratazę
węglanową
węglanową
do CO
do CO
2
2
i
i
usuwany w procesie
usuwany w procesie
oddychania
oddychania
EFEKT BOHRA

FUNKCJE HEMOGLOBINY
Wiąże tlen i dostarcza go do tkanek
Wiąże tlen i dostarcza go do tkanek
organizmu
organizmu
Przyłącza dwutlenek węgla i przenosi
Przyłącza dwutlenek węgla i przenosi
go z tkanek do płuc w celu wydalenia
go z tkanek do płuc w celu wydalenia
go z organizmu
go z organizmu
Współdziała w utrzymaniu stałej
Współdziała w utrzymaniu stałej
kwasowości krwi
kwasowości krwi
Nadaje krwi czerwoną barwę
Nadaje krwi czerwoną barwę

Dziękujemy za uwagę
Dziękujemy za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
zestaw69, BIOSYNTEZA HEMU, BIOSYNTEZA HEMU
Biosynteza i rozpad hemu 2003
Biosynteza i rozpad hemu 2003 i Nieznany
Biosynteza i rozpad hemu 2003
BIOSYNTEZA BIAŁKA
17 Porfiryni i pochodne
transkrypcja biosynteza rna, INNE KIERUNKI, biologia
Oleksyszyn, biochemia II, biosynteza nukleotydów
biosynteza witamin
BIOSYNTEZA PURYN, Biochemia
Porfirie prezentacja
BIOSYNTEZA BIALEK
KWASY NUKLEINOWE I BIOSYNTEZA BIAŁEK, Spis treści
porfirie, PORFIRIE
Biosynteza lipidow2
Mineralokortykoidy struktura, biosynteza, przedstawiciele,
Biosynteza bialka
więcej podobnych podstron