
Śląski Uniwersytet Medyczny
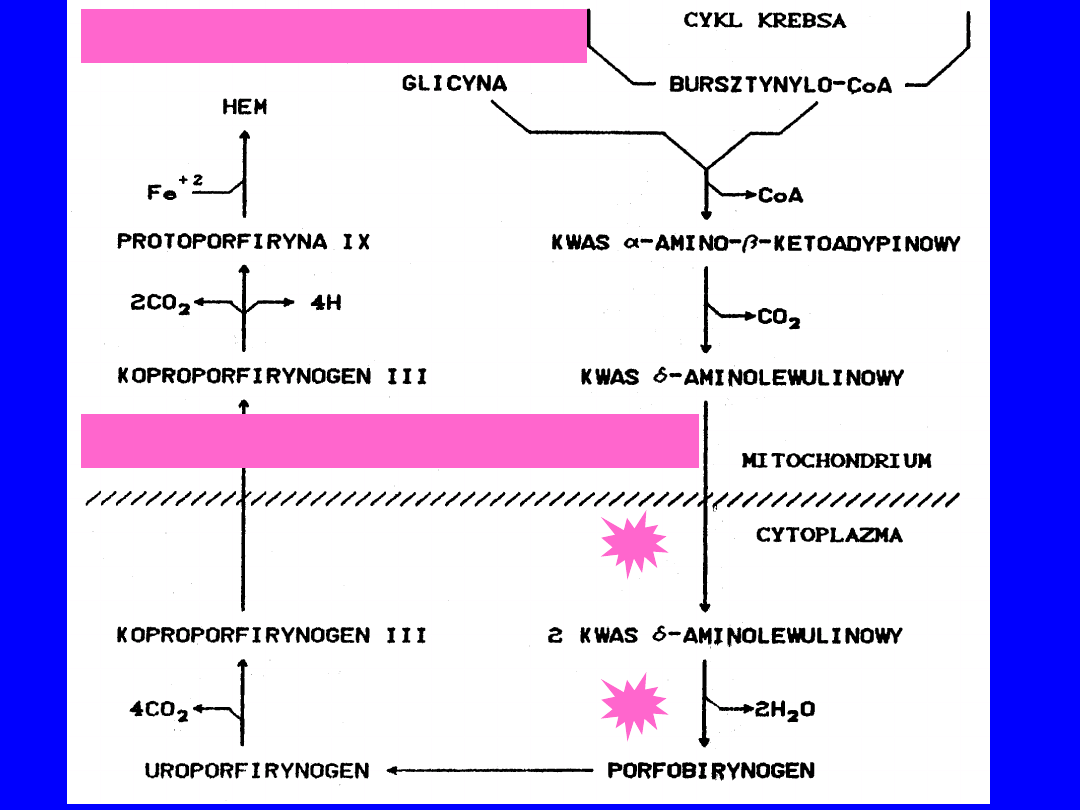
LOKALIZACJA BIOSYNTEZY HEMU
ERYTROBLASTY, WĄTROBA
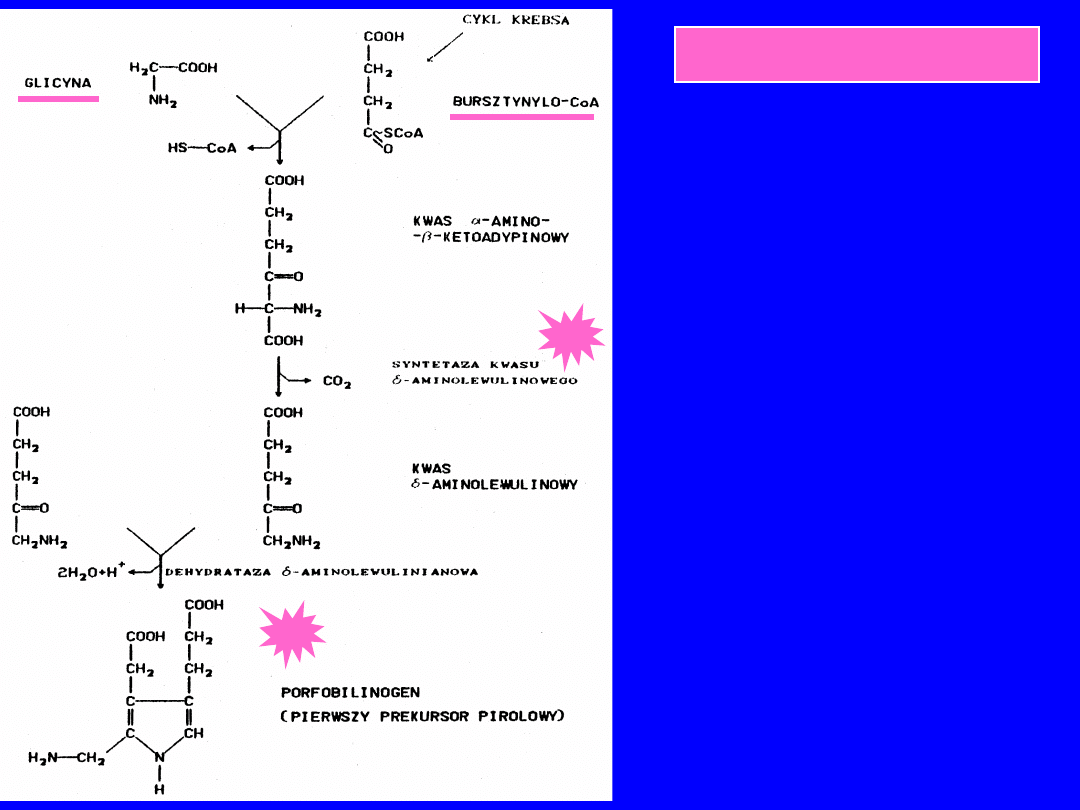
BIOSYNTEZA HEMU
NIEZALEŻNA
KONTROLA
GENETYCZNA
• Atom N i mostek
metylenowy z glicyny
• Wszystkie pozostałe z
bursztynylo CoA
ALA
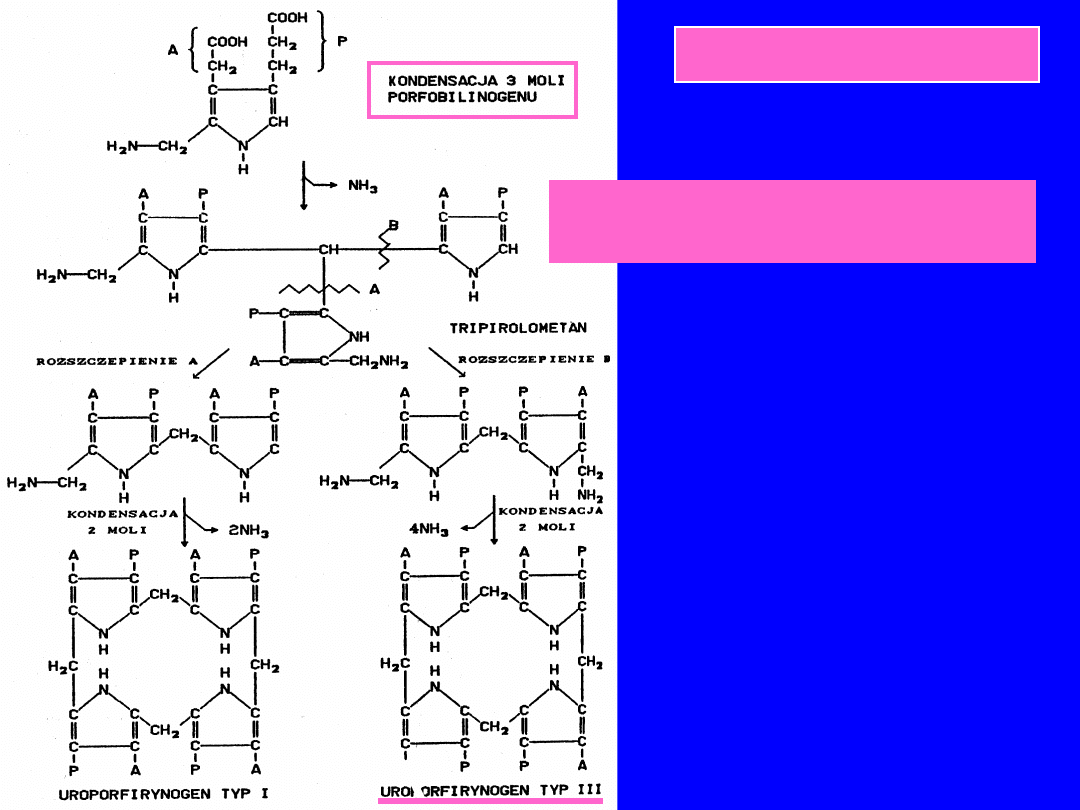
PRZEMIANA PORFOBILINOGENU
W UROPOFIRYNOGEN
BIOSYNTEZA HEMU
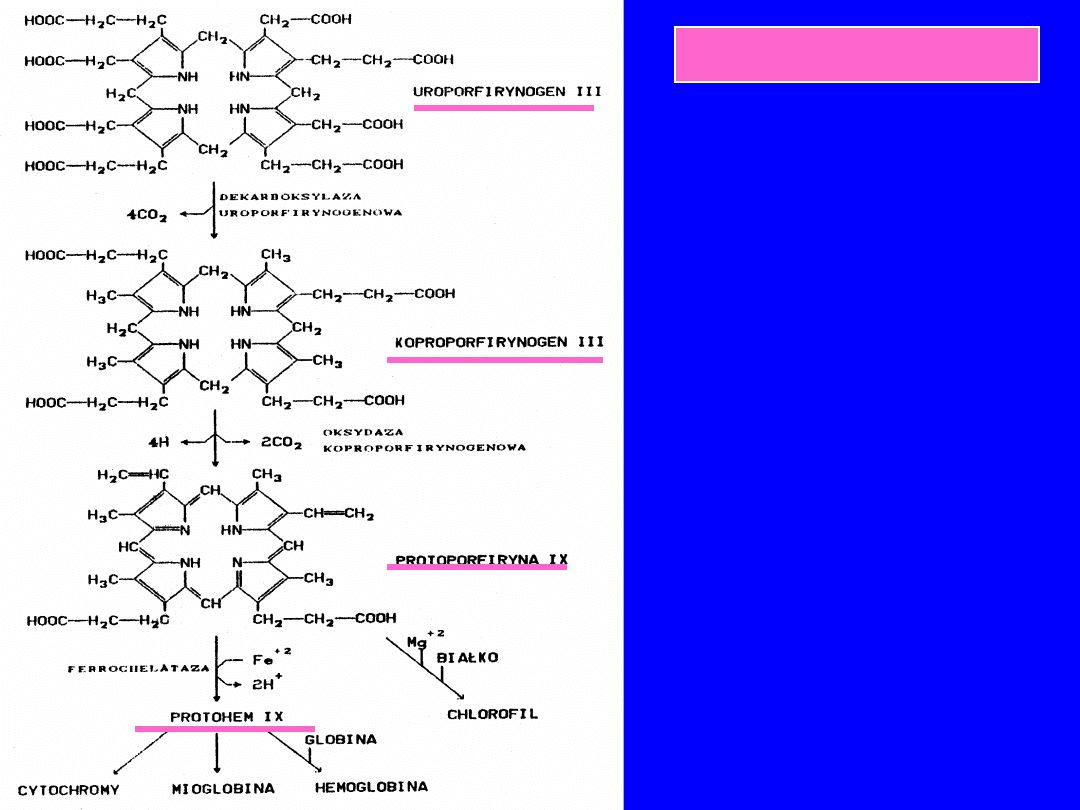
BIOSYNTEZA HEMU
PORFIRYNY
• Związki cykliczne, 4
pierścienie
pirolowe
połączone
wiązaniami
metinowymi
+
łańcuchy boczne
Kompleksy atomów azotu
pierścieni pirolowych z metalami
metaloporfiryny
Metaloporfiryny +białka
• Hemoglobiny
• Mioglobiny
• Cytochromy
• Katalaza
• 2,3-dioksygenaza tryptofanowa

KLUCZOWE ENZYMY
Syntaza ALA
•
Mitochondria
• Szybki obrót metaboliczny (T/2 = 1 godzina)
Regulacja
Hamowanie
• Hem + aporepresor
hamowanie syntezy białka enzymatycznego
• Hematyna
hamowanie depresji genu
• Glukoza
hamowanie indukcji
Pobudzanie
• Ksenobiotyki metabolizowane przez cytochrom p450
• Wzrost syntezy CYP450
wzrost zapotrzebowania na hem
wzrost zużycia hemu
spadek ilości hemu wewnątrzkomórkowego
derepresja syntazy ALA
wzrost syntezy ALA
• Sterydy – ułatwianie derepresji
Syntaza porfobilinogenu
•
Cytozol
• Jon Zn
2+
w centrum katalitycznym
• Hamowana przez Pb
BIOSYNTEZA HEMU

PORFIRYNY
PORFOBILINOGENY –
bezbarwne
PORFIRYNY –
barwne
Charakterystyczne widmo absorbcji pierścienia
porfirynowego w paśmie 400 nm - pasmo Soreta
Rozpuszczalne w mocnych kwasach nieorganicznych
lub w rozpuszczalnikach organicznych
• Fluoryzują w świetle UV
• Rozdział porfiryn (uro- i kaproporfiryny) – HPLC
• Oznaczanie ilościowe – spektrofotometryczne
• ALA i PBG w moczu – kolorymetrycznie
ALA - kwas
d
-aminolewulinowy
PBG - porfobilinogen

PORFIRYNY
PORFIRIE
PORFIRIE
Choroby metaboliczne, wrodzone lub nabyte defekty
enzymów biorących udział w porfirynogenezie
• 6 typów
• objawy kliniczne
gromadzenie metabolitów przed
blokiem enzymatycznym + brak produktu za
blokiem

PORFIRYNY
PORFIRIE
1. Zaburzenia syntezy na początkowych etapach
(przed syntezą porfirynogenów)
• gromadzenie ALA i PBG
• toksyczny wpływ ALA
hamowanie ATP-azy
w nerwach brzusznych i OUN
• toksyczny wpływ PBG
hamowanie uwalniania
acetylocholiny z zakończeń presynaptycznych

PORFIRYNY
PORFIRIE
2. Blok na etapie syntezy porfirynogenów
gromadzenie porfirynogenów
• porfirynogeny
utlenienie > porfiryny
•
światło
400 nm
stan wzbudzenia
reakcja z tlenem
tworzenie wolnych rodników
uszkodzenie komórek
uwolnienie enzymów lizosomalnych
uszkodzenie
skóry

PORFIRYNY
PORFIRIE
PODZIAŁ NA PODSTAWIE TKANKI, W KTÓREJ
WYSTĘPUJE NIEPRAWIDŁOWOŚĆ
•
Szpik kostny –
erytropoetyczne
•
Wątroba –
wątrobowe
•
Mieszane
Blok enzymatyczny
niedobór hemu
derepresja ALA
gromadzenie ALA, PBG, porfiryn
Czynniki indukujące napad porfirii:
• substancje metabolizowane przez CYP450

PORFIRYNY
PORFIRIE
Porfirie wtórne
•
Zatrucie Pb
połączenie Pb z grupami –SH białek enzymatycznych (ferrochelataza,
syntaza PBG)
spadek syntezy hemu
indukcja syntazy ALA
Diagnostyka: wzrost ALA i PBG w moczu
wzrost protoporfiryny w erytrocytach
Czynniki porfirynogenne
:
• fenoksykwasy, chlorfenole, dioksyny, pochodne benzenu i
fenoli, związki ołowiu, etanol
Niedokrwistość syderoblastyczna; niedobarwliwa
• W szpiku duża liczba erytroblastów, ze złogami nie wykorzystanego Fe tzw.
syderoblasty pierścieniowate
• Złogi te wybarwiają się na niebiesko błękitem pruskim
• W rozmazach barwionych MGG barwią się
zasadochłonnie
jako tzw. ciałka
Pappenheima;
nakrapiania zasadochłonne

PORFIRYNY
PORFIRIE
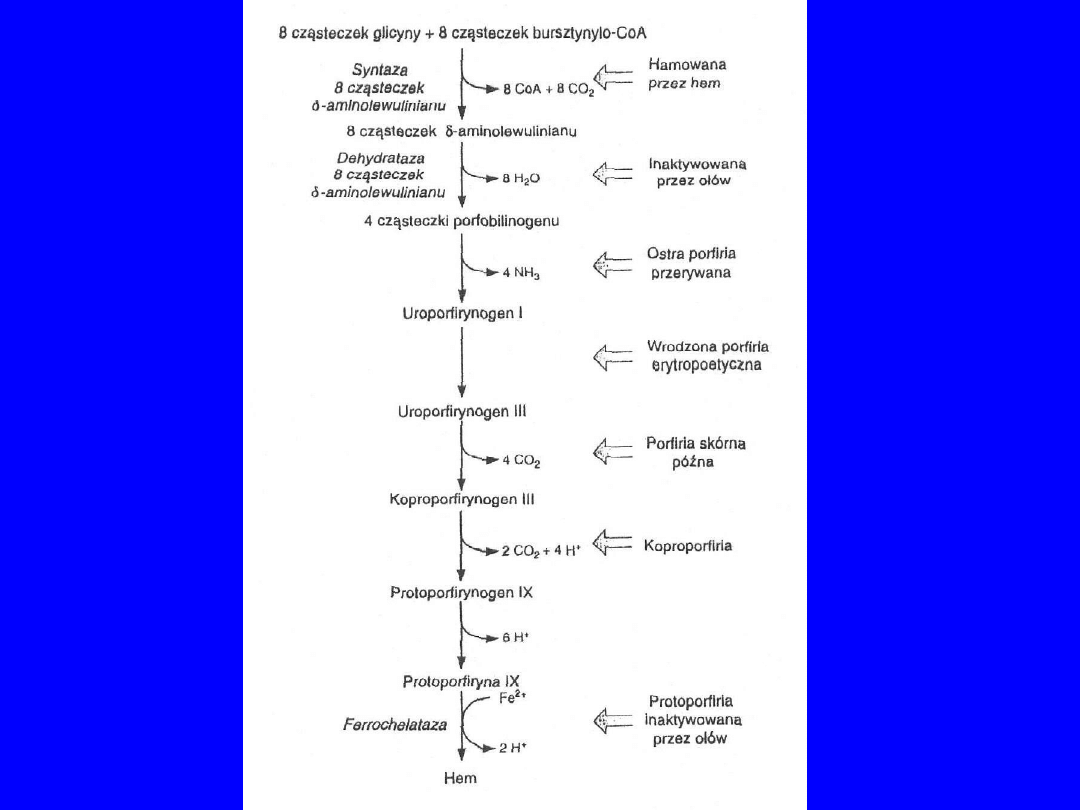
GLICYNA
+
BURSZTYNYLO
-C
O
A
KWAS
d
-
AMINO
-
-
KETOADYPINOWY
ALA syntetaza
KWAS
d
-
AMINOLEWULINOWY
we krwi i moczu
najczulszy test
ALA dehydrataza
PORFOBILINOGEN
PPG - deaminaza
PPG - izomeraza
UROPORFOBILINOGEN
III (UPG III)
Pb
2+
KOPROPORFIRYNOGEN
III (CPG III)
koproporfiryna III
CPG oksydaza
we krwi i moczu
CPG dekarboksylaza
PROTOPORFIRYNOGEN
IX
PROTOPORFIRYNA
Fe
2+
w surowicy
ferrochelataza
protoporfiryny
w erytrocytach
HEM
Pb
2+
Toksyczne działanie
ołowiu na biosyntezę
hemu

PORFIRYNY
PORFIRIE
Porfiria ostra przerywana (AIP)
Miejsce bloku:
syntaza uroporfirynogenu
–
deaminaza
porfobilinogenu
kompensacyjny wzrost syntazy ALA
wzrost stężenia ALA i
PBG w moczu
Substancje wywołujące napad – alkohol, hormony płciowe,
barbiturany
Diagnostyka
Stężenie ALA w moczu
Norma: 0,34 – 2,7 mg/g kreatyniny, 2,6 – 20,6
m
mol/d)
Stężenie PBG w moczu
Norma: 0 – 1,1 mg/d, 0-4,9
m
mol/d)
• Próba Hoescha – Ehricha
zwiększona ilość PBG w moczu
2 krople świeżo oddanego moczu + 2-2 ml odczynnika
aldehydowego Ehricha
czerwone
zabarwienie
• mocz oddany w czasie napadu porfirii przyjmuje
ciemnoczerwony
kolor

PORFIRYNY
PORFIRIE
Porfiria skórna późna
Miejsce bloku:
dekarboksylaza uroporfirynogenowa
Substancje wywołujące napad – alkohol, środki antykoncepcyjne
Diagnostyka
Stężenie ALA w moczu – norma
Stężenie PBG w moczu – norma
Wzrost stężenia uroporfiryny III i I w moczu
Norma: 0-40
m
g/g, < 48 nmol/d)
• Zakwaszony mocz
fluorescencja
na świetle UV
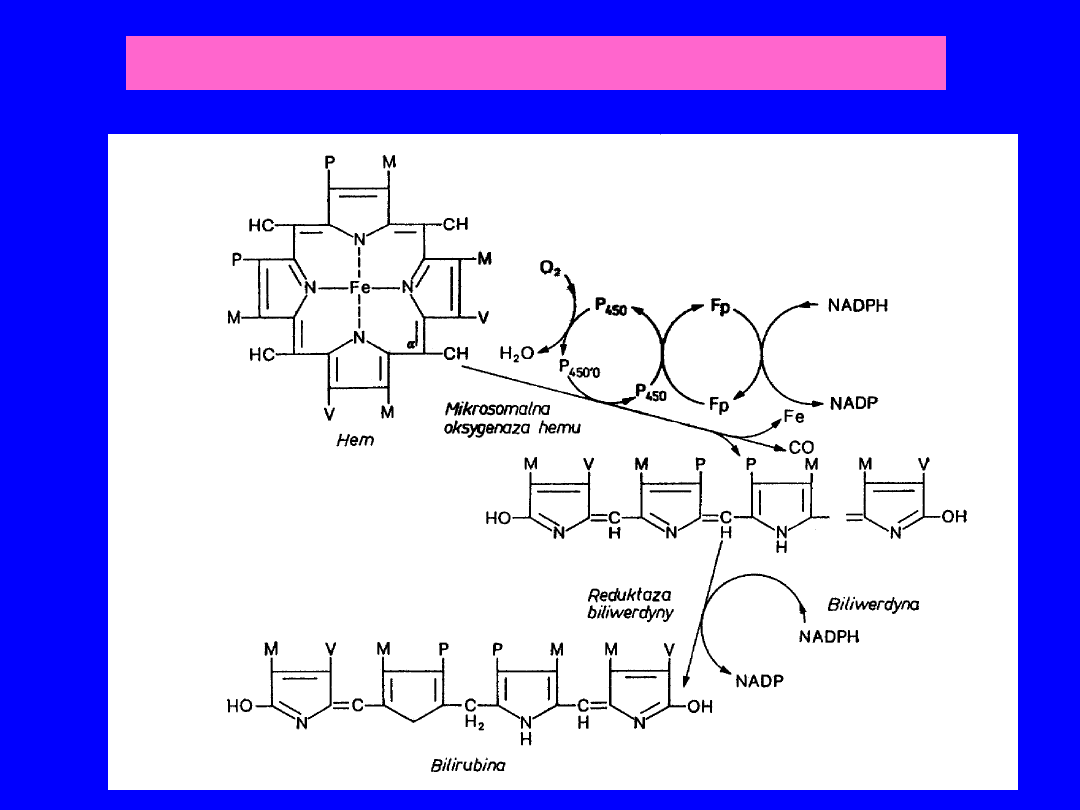
Enzymatyczna przemiana hemu w bilirubinę
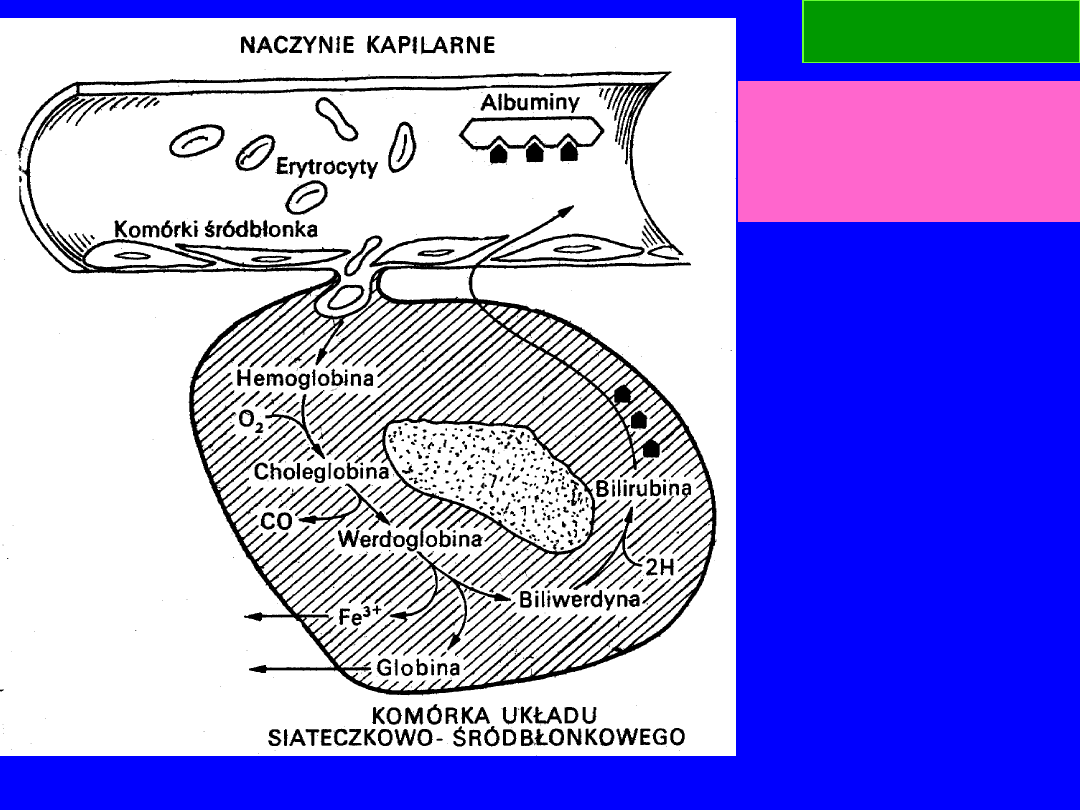
Rozpad hemoglobiny w
komórkach układu
siateczkowo-
śródbłonkowego
BILIRUBINA
Synteza
• Produkt katabolizmu
hemu (80% -
hemoglobina, 20% -
cytochromy, mioglobina
• Globina – ponownie
wykorzystana lub
proteoliza
Hem – katabolizm w
układzie siateczko-
śródbłonkowym
sledziony, wątroby,
szpiku

WYCHWYT
Krew
– bilirubina (
nierozpuszczalna w wodzie
) +
albumina
Albumina – 2 miejsca wiązania bilirubiny: wysokiego
powinowactwa (240 mg) i niskiego powinowactwa
!!!
• wypieranie bilirubiny z połączeń z albuminą przez leki
• ograniczona pojemność wiązania bilirubiny 20 – 25 mg%
• TRANSPORT do hepatocytu – ułatwiony, wysoce wydajny, nie
ogranicza szybkości wydalania
BILIRUBINA
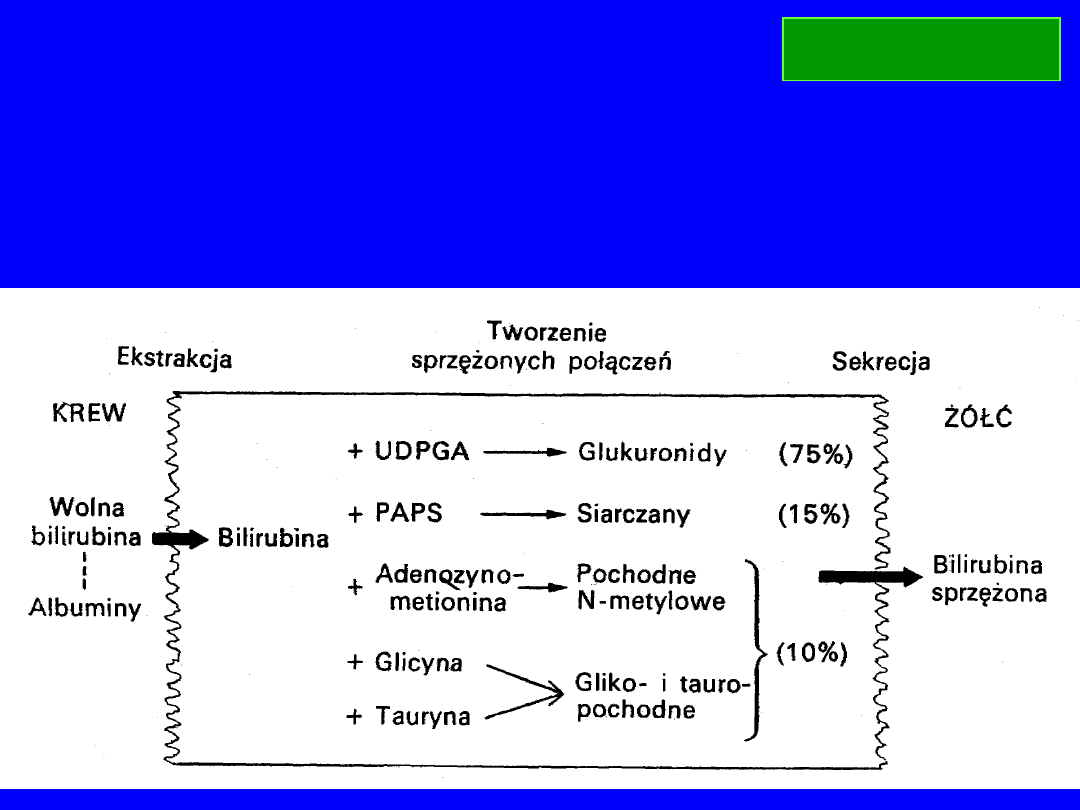
SPRZĘGANIE BILIRUBINY
Miejsce – siateczka endoplazmatyczna gładka
Enzym –
urydynodifosfo glukoronylo transferaza
Cel – rozpuszczalność bilirubiny w wodzie – zwiększenie polarności
BILIRUBINA

SPRZĘGANIE Z GLUKURONIANEM
UDP-glukoza > UDP-glukuronian
UDP-glukuronian + bilirubina
monoglukuronid + UDP
UDP-glukuronian + monoglukuronid
diglukuronid + UDP
2x monoglukuronid
diglukuronid + bilirubina
!!!
aktywność UDP-glukonylotransferazy jest indukowana przez leki
(fenobarbital)
WYDALANIE BILIRUBINY DO ŻÓŁCI
Transport aktywny – proces regulujący wydalanie
Powyżej 97% bilirubiny wydalanej do żółci jest sprzęgane
BILIRUBINA

PRZEMIANA BARWNIKÓW ŻÓŁCIOWYCH W JELICIE
Bilirubina sprzężona
jelito kręte i grube
-glukuronidazy
bakteryjne
rozprzęganie
bilirubina
enzymy bakteryjne
redukcja
urobilinogeny –
mezobilinogen, sterkobilinogen –
bezbarwne
90% urobilinogenu
sterkobilina – barwna
wydalanie z kałem
BILIRUBINA
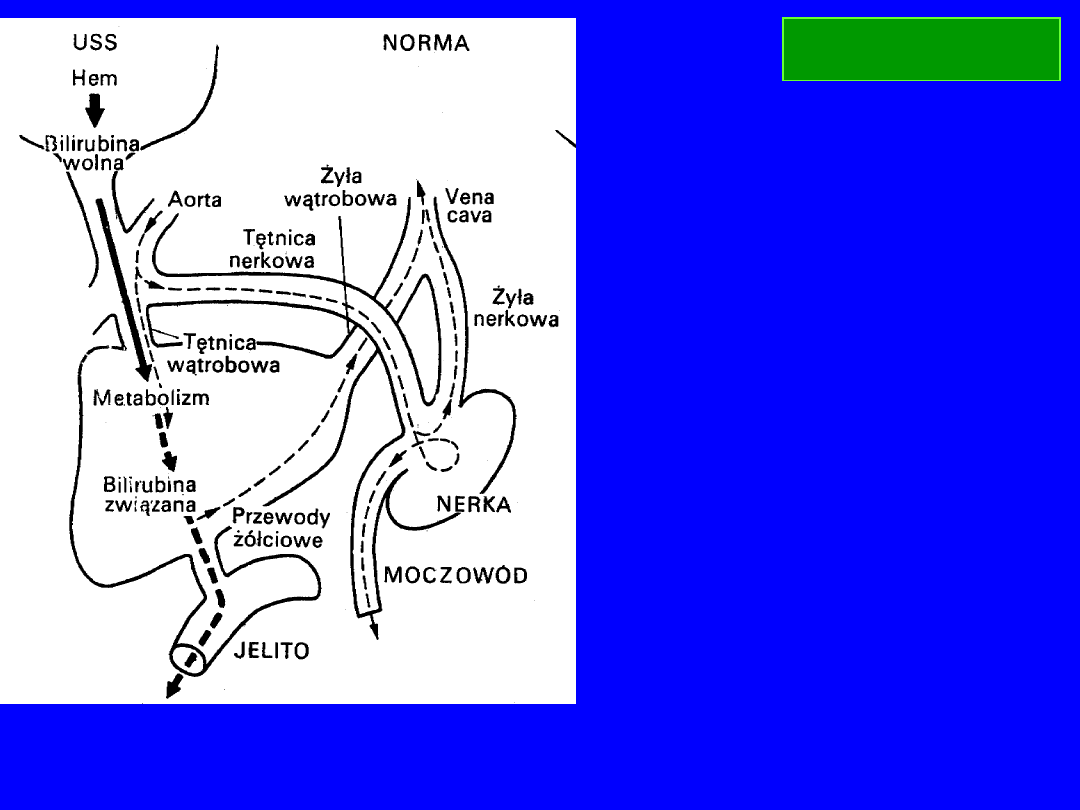
!!!
obniżenie
sterkobilinogenu w kale
żółtaczka mechaniczna
wzrost
sterkobilinogenu w kale
żółtaczka hemolityczna
norma : 30-300 mg/dobę
BILIRUBINA
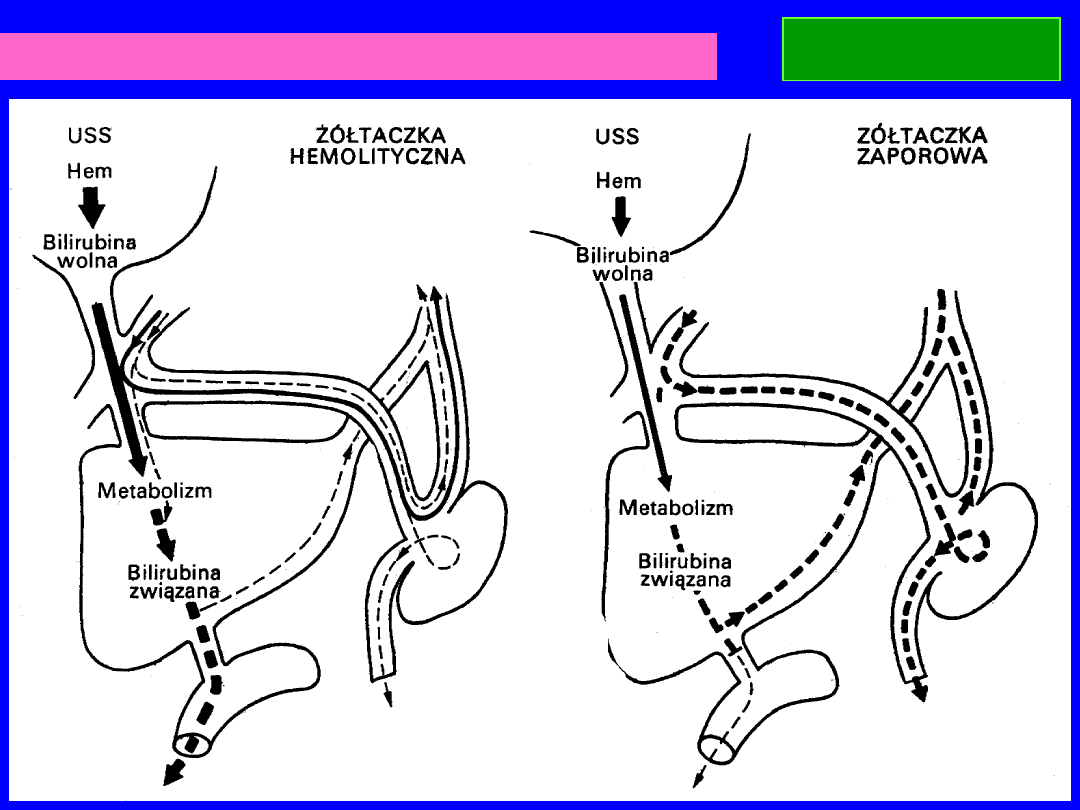
BILIRUBINA
Wydalanie bilirubiny w różnych typach żółtaczek.
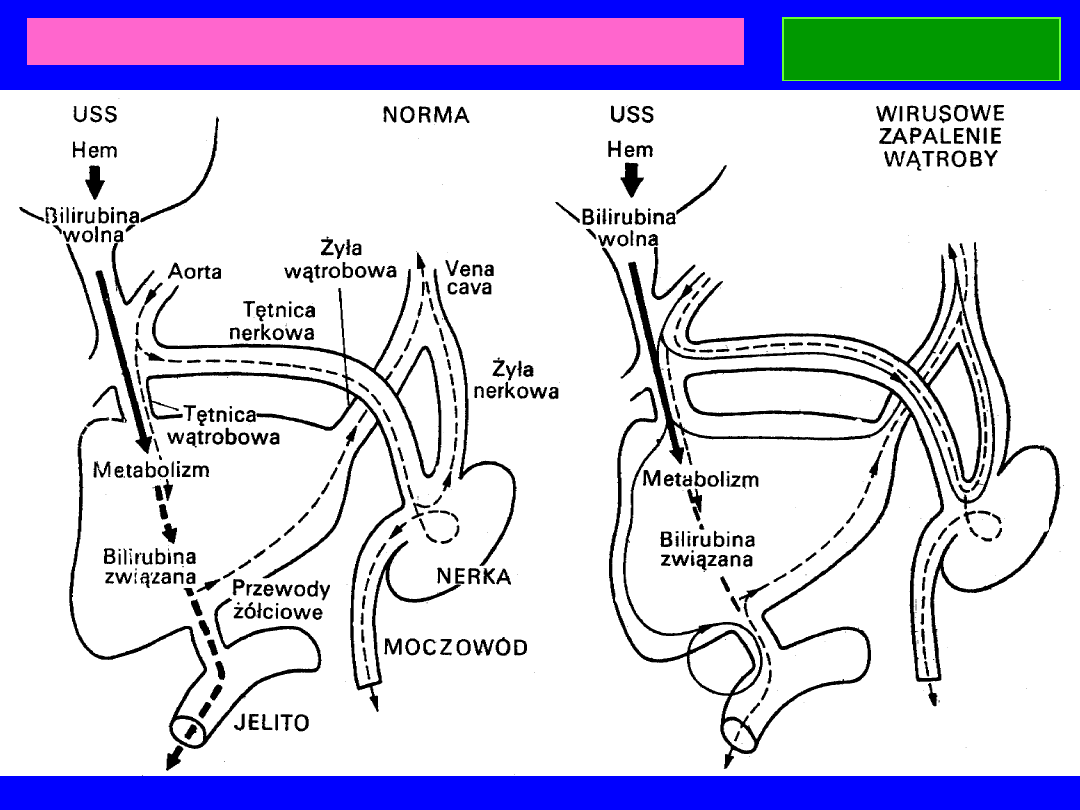
Wydalanie bilirubiny w różnych typach żółtaczek.
BILIRUBINA
Wyszukiwarka
Podobne podstrony:
Biosynteza i rozpad hemu 2003
Biosynteza i rozpad hemu 2003
2003 02 Fosdem February 2003, K Nieznany
Przyczyny rozpadania sie malzen Nieznany
2003 02 Fosdem February 2003, K Nieznany
2003 07 Szkola konstruktorowid Nieznany
mat fiz 2003 12 06 id 282350 Nieznany
2003 dm ksiazkaid 21715 Nieznany (2)
2003 MAJ OKE PPid 21717 Nieznany
2003 MAJ OKE PP MAPAid 21720 Nieznany
mat fiz 2003 10 11 id 282349 Nieznany
2003 12 Szkola konstruktorowid Nieznany
2003 GPWid 21716 Nieznany (2)
2003 styczen podst model id 381 Nieznany (2)
2003 MAJ OKE PP Iid 21718 Nieznany (2)
2003 STYCZEN OKE PP I ODPid 217 Nieznany (2)
DzU 2003 089 0828 id 148548 Nieznany
więcej podobnych podstron