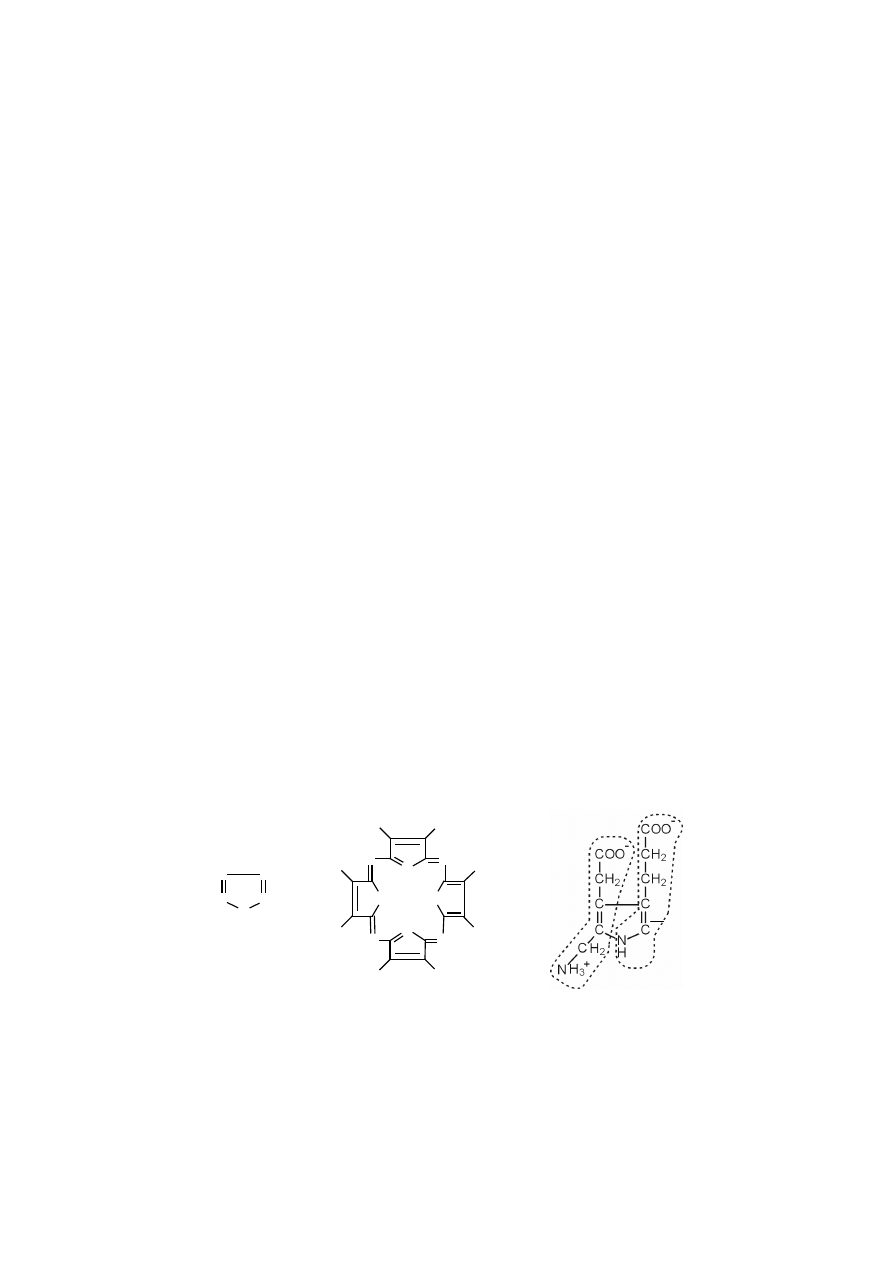
297
17.
PORFIRYNY I POCHODNE
Iwona śak
Porfiryny są makrocyklicznymi związkami, utworzonymi z czterech pier-
ś
cieni pirolowych, połączonych jednowęglowymi mostkami metinowymi.
Pirol jest pięcioczłonowym, heterocyklicznym związkiem aromatycznym,
który zawiera sześć elektronów
π
w cyklicznym sprzężonym układzie nakładają-
cych się pięciu orbitali p (każdy z czterech atomów C dostarcza 1 elektron
π
, atom
azotu o hybrydyzacji sp
2
dostarcza wolną parę elektronową, czyli dwa). Wolna pa-
ra elektronowa atomu azotu w pirolu jest mniej reaktywna ponieważ jest częścią
sekstetu aromatycznego. W wyniku tego pirol jest znacznie mniej zasadowy i mniej
nukleofilowy niż aminy alifatyczne. Atomy węgla pirolu natomiast są „bogatsze”
w elektrony i bardziej nukleofilowe niż atomy węgla jedynego wiązania podwój-
nego jakiegoś związku, dlatego pierścień pirolowy jest reaktywniejszy wobec elek-
trofili.
Pirol można otrzymać w wyniku działania na furan amoniakiem w obecności
tlenku glinu jako katalizatora i w temperaturze 400
°
C.
W organizmie pirol powstaje w postaci porfobilinogenu, który jest produk-
tem reakcji kondensacji dwóch cząsteczek kwasu
δ
-aminolewulinowego (na poniż-
szym rysunku pojedyncze cząsteczki
δ
-aminolewulinianu w obrębie porfobilinoge-
nu, zaznaczono poprzez wykropkowanie). Reakcję katalizuje syntaza porfobilino-
genowa.
CH
CH
HC
HC
N
H
IV
III
II
I
δ
γ
β
α
HN
CH
N
NH
HC
H
H
H
H
H
H
N
CH
HC
H
H
pirol
porfina
porfobilinogen
298
Wszystkie porfiryny zawierają makrocykliczny układ zwany porfiną, który
nie występuje w przyrodzie w stanie wolnym, lecz analogi porfiny z podstawiony-
mi łańcuchami bocznymi (do pierścieni pirolowych) są związkami bardzo istotny-
mi dla procesów życiowych. Typowymi przedstawicielami są hemy i chlorofile.
Rodzaj łańcuchów bocznych w porfirynach może być różny, zwykle występują
podstawniki zarówno o krótszym, jak i dłuższym łańcuchu alifatycznym.
Typowe podstawniki boczne porfiryn
CH
2
COO
-
CH
3
CH
2
CH
2
COO
-
CH CH
2
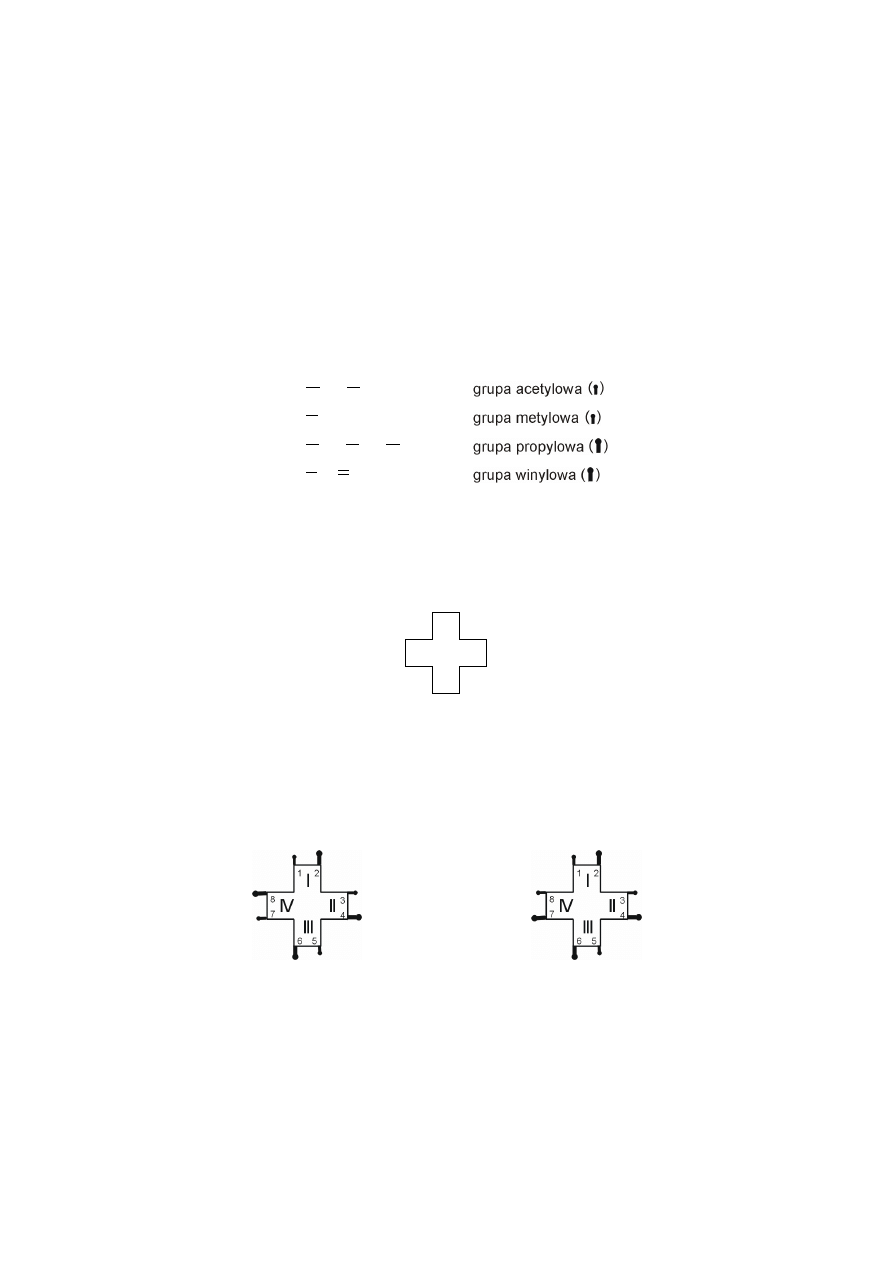
Strukturę porfiryn można przedstawiać za pomocą uproszczonych wzorów
Fischera. Cyfry rzymskie oznaczają numer pierścienia pirolowego, natomiast arab-
skie numery atomów węgli pierścieni pirolowych, do których przyłączone są pod-
stawniki (łańcuchy alifatyczne).
8
7
6
5
4
3
2
1
IV
III
II
I
uproszczony wzór Fischera porfiryny
Rozmieszczenie podstawników bocznych jest podstawą istnienia porfiryn
w czterech typach izomerycznych (typ I symetryczny i typy II, III, IV – asyme-
tryczne).
Biologicznie ważne izomeryczne typy porfiryn
typ I symetryczny
typ III asymetryczny
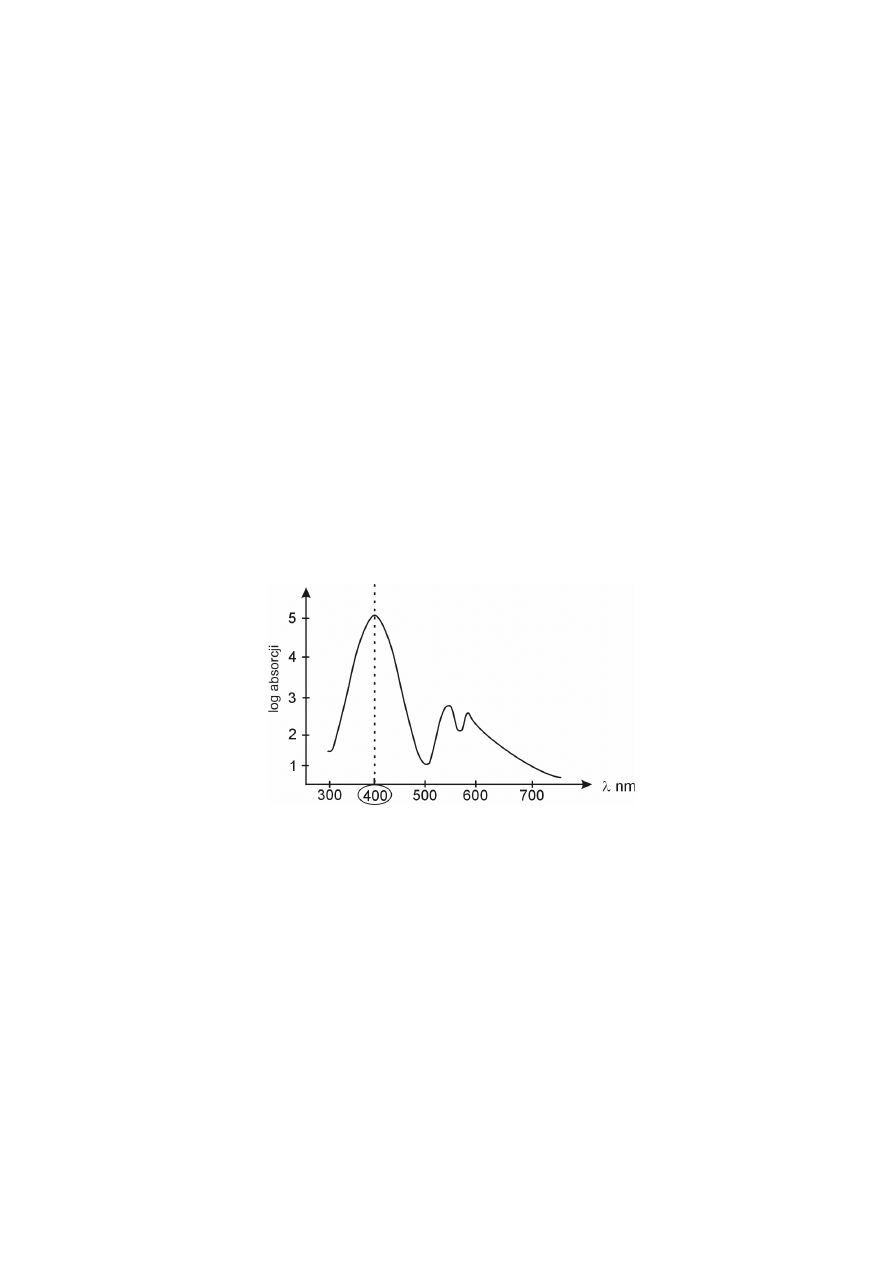
299
Asymetryczne rozmieszczenie podstawników w typie III porfiryn występuje
we wszystkich biologicznie ważnych porfirynach. Tego typu porfiryny określane
są też jako porfiryny IX, wynika to z faktu, że wykryto je jako dziewiątą formę
izomeryczną.
Symetryczne rozmieszczenie podstawników w typie I porfiryn występuje
tylko w tych, które powstają w warunkach patologicznych, np. we wrodzonej porfi-
rii erytropoetycznej.
Asymetryczne typy II i III porfiryn otrzymano jedynie syntetycznie i nie ma-
ją żadnego znaczenia biologicznego, dlatego nie zostały przedstawione ich wzory.
Cząsteczki porfiryn są płaskie, bardzo trwałe i silnie zabarwione. Tworzą
kompleksy z jonami metali (żelaza lub magnezu) umiejscowionymi w środku
struktury cząsteczki porfiryny, dzięki temu, że jony metali przejmują pary elektro-
nowe od atomów azotu piroli. Porfiryny pochłaniają światło i posiadają charaktery-
styczne widma absorpcyjne zarówno w części widzialnej, jak i nadfioletowej.
Wszystkie porfiryny, niezależnie od rodzaju posiadanych podstawników
bocznych, wykazują maksimum absorpcji przy długości fali około 400 nm, pasmo
to określane jest mianem pasma Soreta.
widmo absorpcyjne porfiryn
Roztwory porfiryn po naświetleniu światłem nadfioletowym wykazują silną,
charakterystyczną czerwoną fluorescencję, którą wykorzystuje się do wykrywania
nawet śladowych ilości wolnych porfiryn. Z punktu widzenia diagnostyki klinicz-
nej ważne jest wykrywanie w materiale biologicznym obecności uroporfiryn i ko-
proporfiryn, ponieważ związki te w zwiększonych ilościach wydalane są z organi-
zmu w przypadku stanu patologicznego, zwanego porfirią.
Uroporfiryna i koproporfiryna są metabolitami pośrednimi szlaku biosynte-
tycznego hemu. Barwna uroporfiryna III powstaje w cytoplazmie z bezbarwnego
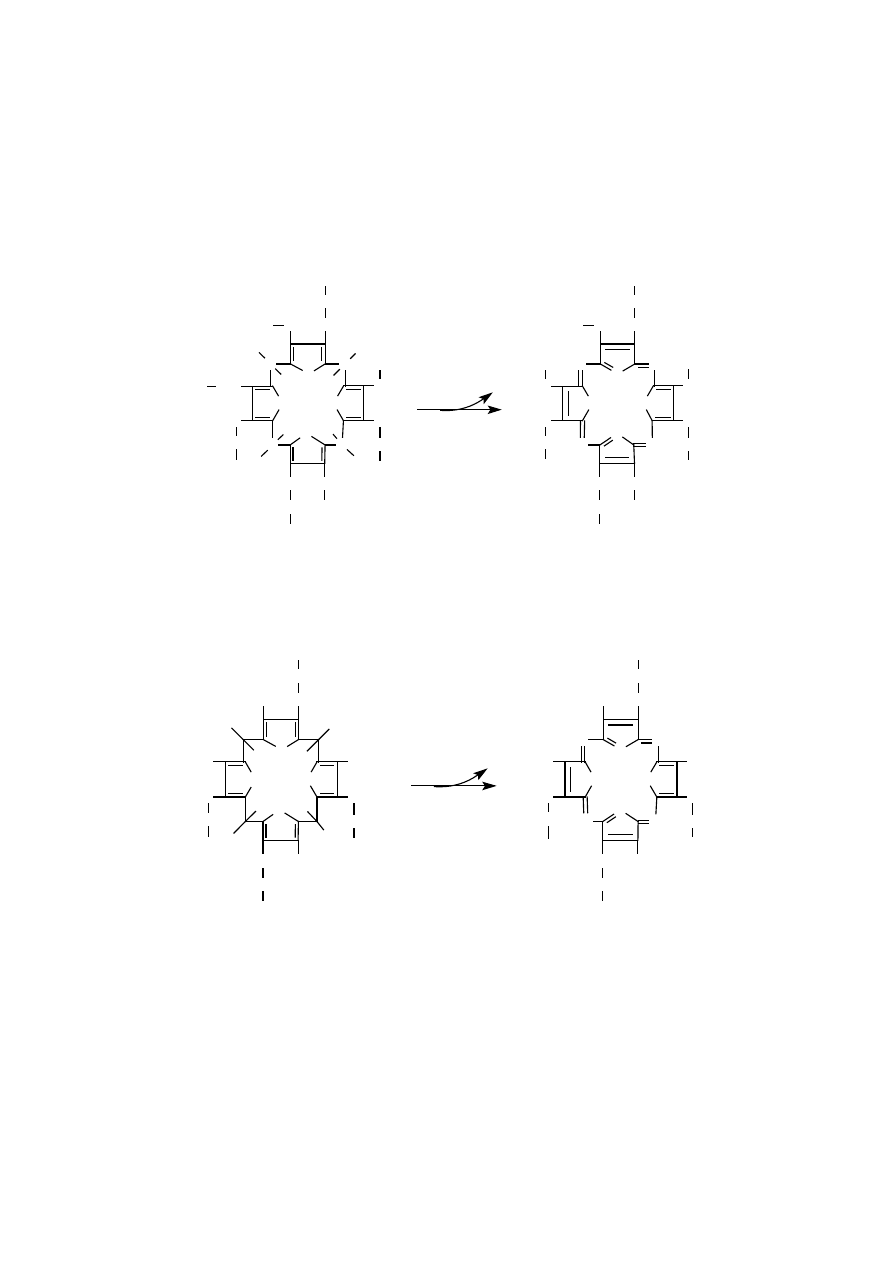
300
uroporfirynogenu III pod wpływem światła w reakcji samoutlenienia, tworzącej
mostki metinowe w tej porfirynie.
IV
III
II
I
HN
CH
N
NH
HC
CH
2
CH
2
CH
2
CH
2
H
2
C
H
2
C
-
OOC
H
2
C
COO
-
CH
2
COO
-
CH
2
COO
-
COO
-
-
OOC
N
CH
HC
CH
2
CH
2
CH
2
COO
-
-
OOC
6H
+
na
ś
wietle
samoutlenienie
H
N
H
C
C
CH
2
CH
2
CH
2
H
H
H
H
COO
-
-
OOC
HN
C
N
NH
C
CH
2
CH
2
CH
2
CH
2
CH
2
COO
-
H
2
C
H
2
C
CH
2
-
OOC
COO
-
COO
-
H
H
H
H
COO
-
H
2
C
-
OOC
I
II
III
IV
uroporfirynogen III
uroporfiryna III
W podobnej reakcji powstaje barwna koproporfiryna III z bezbarwnego ko-
proporfirynogenu III.
IV
III
II
I
HN
CH
N
NH
HC
CH
3
CH
2
CH
3
CH
2
H
2
C
H
3
C
H
2
C
CH
2
COO
-
CH
2
COO
-
-
OOC
N
CH
HC
CH
3
CH
2
CH
2
COO
-
6H
+
na
ś
wietle
samoutlenienie
H
N
H
CH
2
CH
2
CH
3
H
H
H
H
COO
-
HN
N
NH
CH
3
CH
2
CH
3
CH
2
CH
2
COO
-
H
3
C
H
2
C
CH
2
COO
-
H
H
H
H
H
2
C
-
OOC
I
II
III
IV
koproporfirynogen III
koproporfiryna III
Uroporfirynogen III jest wspólnym prekursorem dla wszystkich hemów,
chlorofili oraz witaminy B
12
.
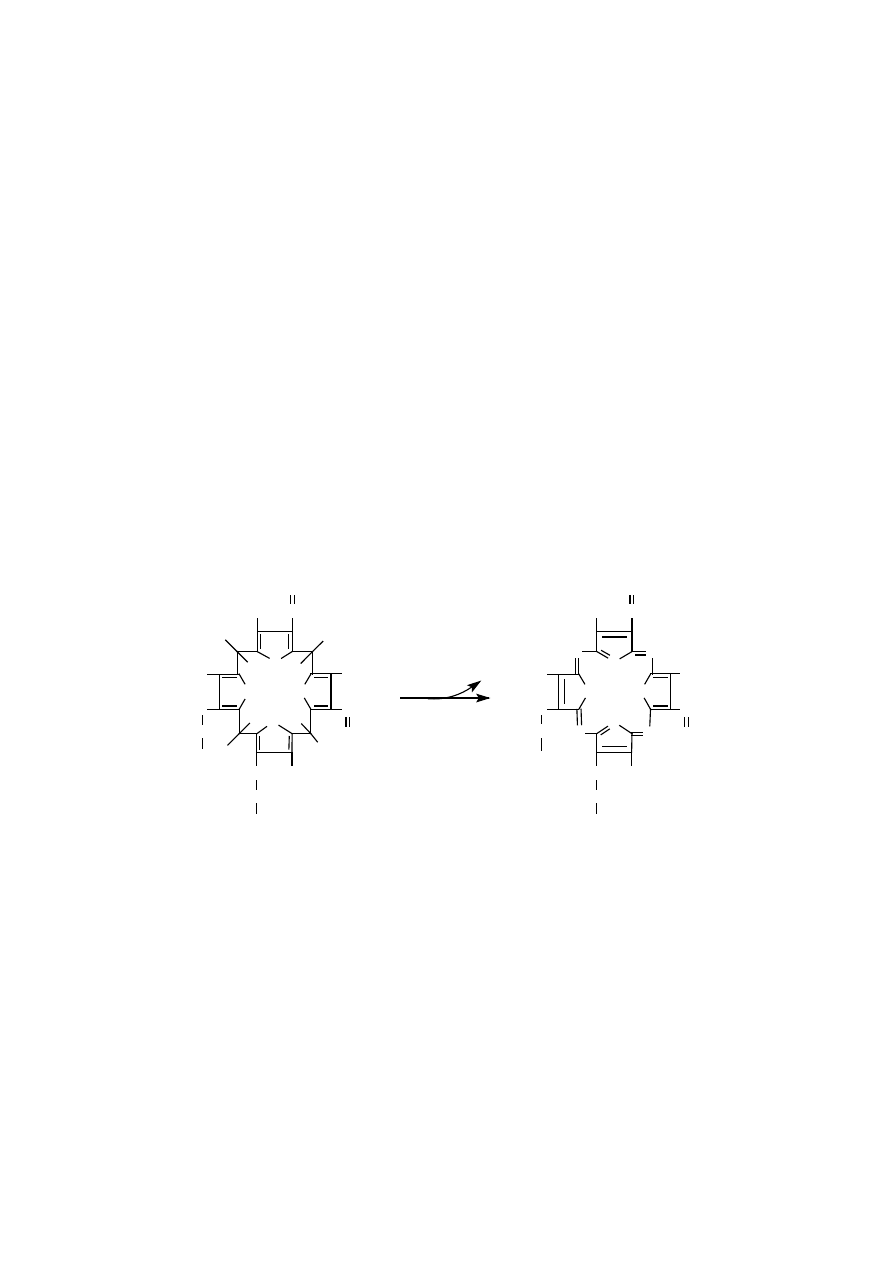
301
Uroporfirynę III wykryto pierwotnie w moczu, lecz nie jest to jedyne miej-
sce jej występowania w organizmie. Koproporfirynę III stwierdzono pierwotnie
w kale, obecna jest również w moczu.
Koproporfirynogen III powstaje z uroporfirynogenu III w cytoplazmie ko-
mórki w reakcji dekarboksylacji, która przekształca wszystkie boczne podstawniki
acetylowe uroporfirynogenu w podstawniki metylowe koproporfirynogenu. W sta-
nach patologicznych pojawiają się uroporfiryna I i koproporfiryna I, które powstają
na tych samych zasadach, jak ich fizjologiczne izomery typu III.
Koproporfirynogen III w mitochondriach przekształcany jest w protoporfi-
rynogen III w reakcji oksydacyjnej dekarboksylacji, przekształcającej dwie grupy
propylowe pierścieni pirolowych (I i II) w grupy winylowe. Reakcję katalizuje
oksydaza koproporfirynowa, która może działać wyłącznie na koproporfirynogen
III, fakt ten wyjaśnia zupełny brak w materiale biologicznym protoporfirynogenu I
i protoporfiryny I.
Barwna protoporfiryna III powstaje w mitochondriach z bezbarwnego proto-
porfirynogenu III w enzymatycznej reakcji utlenienia, tworzącej mostki metinowe
w tej porfirynie.
IV
III
II
I
HN
N
NH
CH
3
CH
CH
3
CH
2
CH
2
COO
-
H
3
C
H
2
C
CH
2
H
H
H
H
H
2
C
-
OOC
N
H
CH
CH
3
CH
3
H
H
H
H
H
6H
+
HN
CH
N
NH
HC
CH
3
CH
CH
3
CH
2
H
2
C
H
3
C
H
2
C
CH
2
CH
2
COO
-
-
OOC
N
CH
HC
CH
3
CH
CH
2
I
II
III
IV
utlenienie
oksydaza
protoporfirynogenowa
protoporfirynogen III
protoporfiryna III (lub IX)
Wstawienie do cząsteczki protoporfiryny IX centralnego jonu metalu, mia-
nowicie żelaza lub magnezu, determinuje dalsze przekształcenie porfiryny albo
w kierunku hemu, albo chlorofili. Dalsze modyfikacje prowadzące do chlorofili po-
legają na dołączeniu piątego pierścienia pirolowego, połączeniu jednego podstaw-
nika bocznego z długim hydrofobowym izoprenoidem, cząsteczką fitolu oraz
usunięciu pewnych wiązań podwójnych w niektórych pierścieniach pirolowych.
302
N
CH
N
N
HC
Fe
N
CH
HC
CH
CH
2
CH
3
CH
3
CH
CH
2
CH
3
CH
2
CH
2
COO
-
H
3
C
H
2
C
H
2
C
-
OOC
I
II
III
IV
+2
ż
elazoprotoporfiryna (hem)
ś
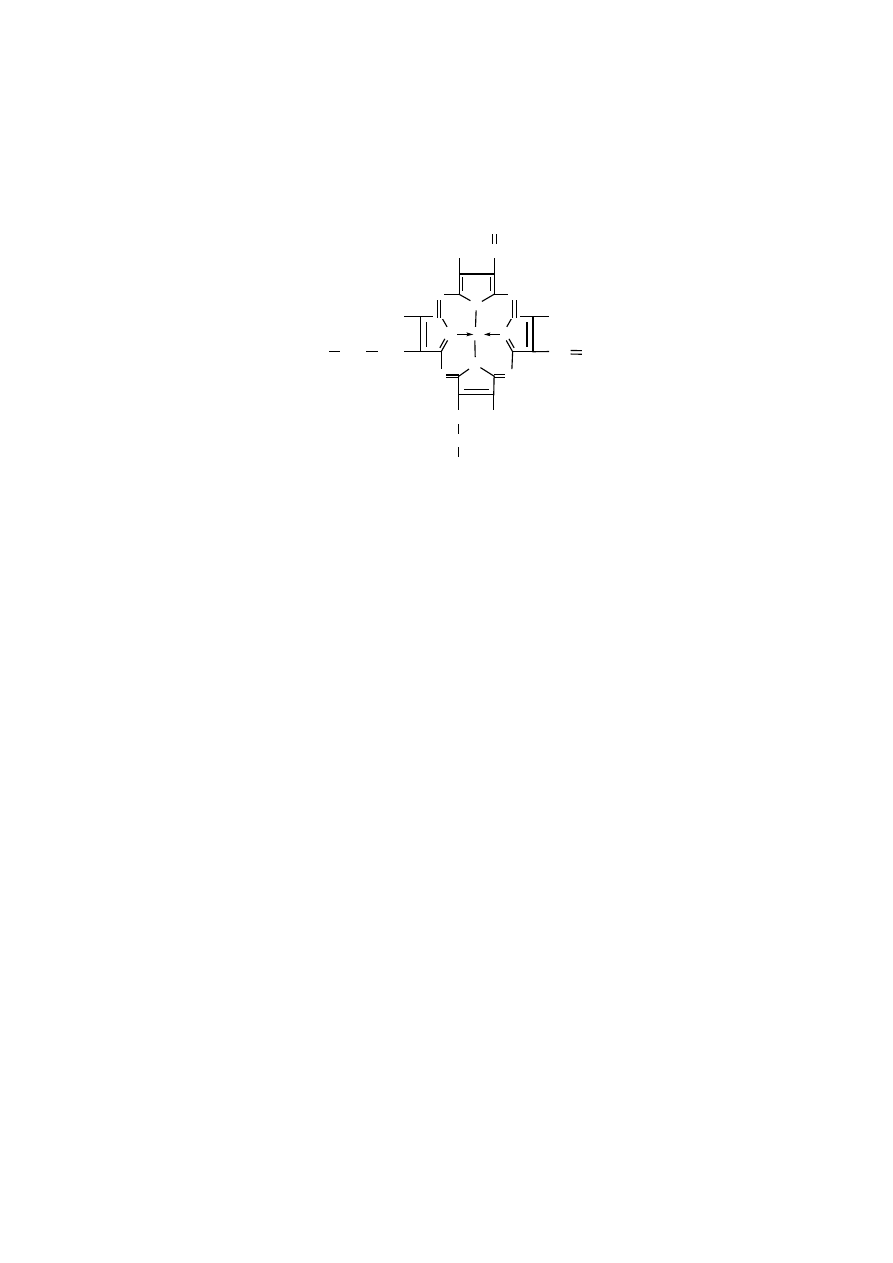
elazoprotoporfiryna, czyli hem to grupa prostetyczna wszystkich hemopro-
tein, do których należą hemoglobiny, mioglobina, cytochromy i niektóre enzymy,
mianowicie katalaza oraz peroksydaza. We wszystkich tych białkach ogólna struk-
tura hemu jest podobna, natomiast różnią się strukturą łańcucha polipeptydowego,
który jest specyficzny dla każdego typu białka. Poza tym, białka te różnią się war-
tościowością atomu żelaza w ich hemie. Atom żelaza występuje w postaci jonu
ż
elazawego (+2) w hemach funkcjonalnej hemoglobiny, oksyhemoglobiny, mio-
globiny i oksymioglobiny i tylko w tej postaci transportuje tlen. Atom żelaza
przyjmuje postać jonu żelazowego (+3) w hemach methemoglobiny, w katalazie
i peroksydazie. śelazo w postaci jonu zmieniającego wartościowość (+2 lub +3)
występuje w cytochromach, zależnie od ich aktualnego stanu funkcjonalnego, mia-
nowicie po przyjęciu elektronu lub jego oddaniu.
Atom żelaza wiąże się z 4 atomami azotu piroli poprzez dwa wiązania kowa-
lencyjne i dwa wiązania koordynacyjne. Poza tym, może tworzyć dwa dodatkowe
wiązania, mianowicie każde po innej stronie płaskiej płaszczyzny hemu, które
określa się jako piątą i szóstą pozycję koordynacyjną jonu żelaza Fe
+2
.
Piątą pozycję koordynacyjną żelaza w hemie hemoglobiny i mioglobiny zaj-
muje reszta histydyny proksymalnej łańcucha polipeptydowego globiny, związana
z nim kowalencyjnie.
W szóstej pozycji koordynacyjnej żelaza znajduje się miejsce dla cząsteczki
tlenu lub tlenku węgla, a w nieutlenowanej hemoglobinie pozycja koordynacyjna 6
nie jest obsadzona.
303
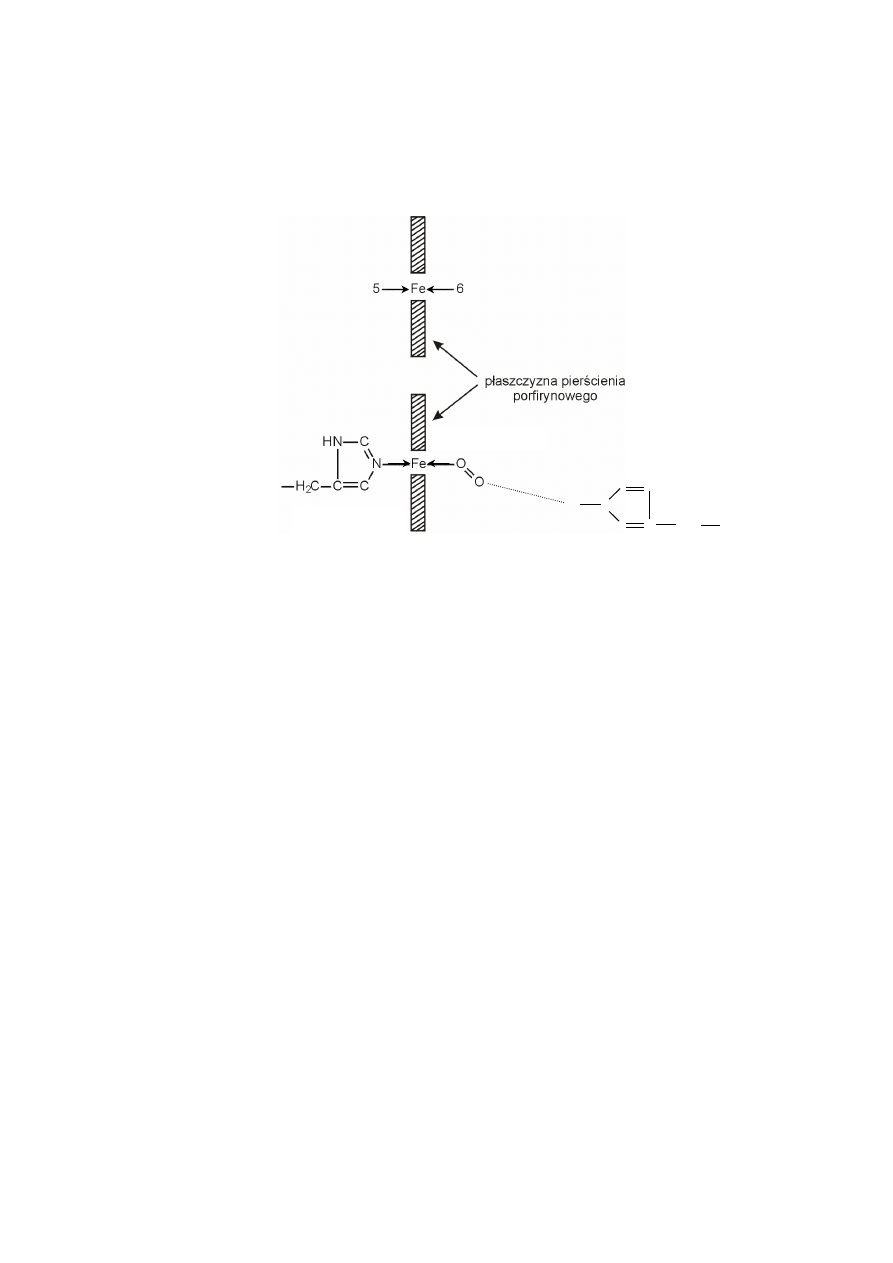
W hemie methemoglobiny, atom żelaza jest utleniony, a jego szósta pozycja
koordynacyjna obsadzona jest cząsteczką wody.
Wolny hem z jonem żelazawym okazuje się zdolny do wiązania tlenu, lecz
tylko na bardzo krótki czas, ponieważ prawie równocześnie tworzą się struktury
„kanapkowe” hem-O
2
-hem i następuje utlenienie żelaza do jonu żelazowego, który
nie może już wiązać tlenu.
W hemoproteinach łańcuch polipeptydowy globiny właśnie zabezpiecza
przed tworzeniem struktur „kanapkowych” hem-O
2
-hem. W przypadku hemoglo-
biny, szczególną rolę w tym zakresie spełniają dwie reszty histydynowe globiny,
zarówno związana kowalencyjnie z żelazem histydyna proksymalna, jak i dystalna,
która nie jest bezpośrednio związana z żelazem.
Hem cytochromów c i c
1
wiąże się kowalencyjnie z dwoma bocznymi łańcu-
chami reszt cysteinowych białka poprzez wiązanie tioeterowe, powstające w wyni-
ku reakcji między grupami winylowymi hemu a grupami -SH dwóch reszt cyste-
inowych.
Hem A oksydazy cytochromowej nie jest natomiast związany kowalencyjnie
z białkiem, różni się też innymi cechami od hemów cytochromów c i c
1
, posiada
bowiem długi, piętnastowęglowy łańcuch węglowodorowy, zamiast jednej grupy
winylowej, oraz grupę formylową, zamiast grupy metylowej.
H
H
H
N
HC
HC
NH
C
CH
2
His-93
proksymalna
His-64
dystalna
2
+
2
+
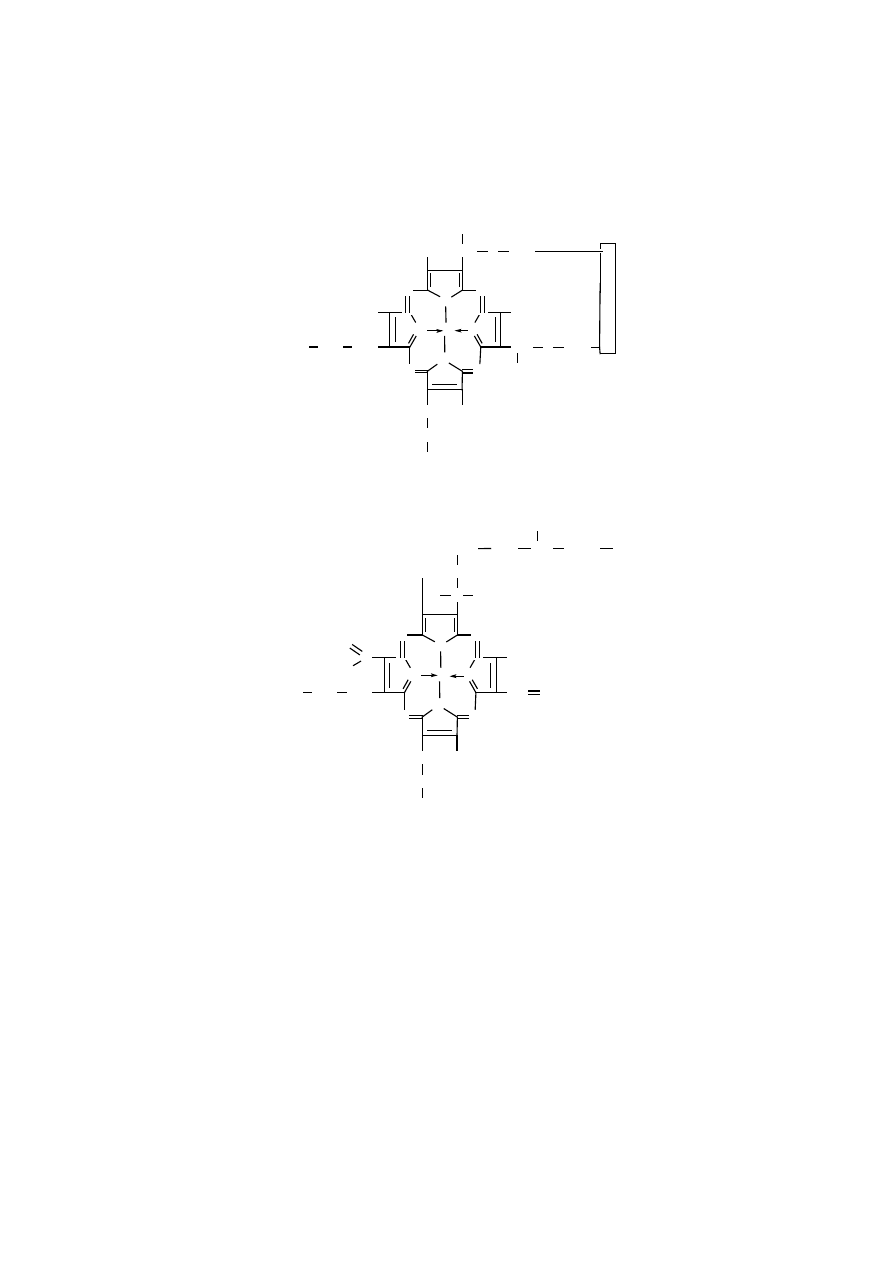
304
N
CH
N
N
HC
Fe
N
CH
HC
CH
CH
3
CH
3
CH
3
CH S
CH
3
CH
2
CH
2
COO
-
H
3
C
H
2
C
H
2
C
-
OOC
S CH
2
CH
2
CH
3
B
I
A
Ł
K
O
I
II
III
IV
+2
hem cytochromów c i c
1
N
CH
N
N
HC
Fe
N
CH
HC
C
CH
2
CH
3
CH
3
CH
CH
3
CH
2
CH
2
COO
-
C
H
2
C
H
2
C
-
OOC
OH
H
O
H
(CH
2
CH
2
CH
CH
2
)
3
H
CH
3
CH
2
IV
III
II
I
+2
hem A oksydazy cytochromowej
BARWNIKI śÓŁCIOWE
Barwniki żółciowe powstają w wyniku rozerwania makrocyklicznej struktu-
ry hemu i stanowią formę związków wydalniczych, w której usuwany jest z orga-
nizmu hem, głównie starych, eliminowanych z obiegu erytrocytów, ale również
hem pochodzący z wszystkich innych hemoprotein. W reakcji oksydacyjnego roz-
szczepienia pierścienia żelazoporfirynowego, która zachodzi w układzie siatecz-
kowo-śródbłonkowym, powstaje liniowy tetrapirol, zwany biliwerdyną, który jest
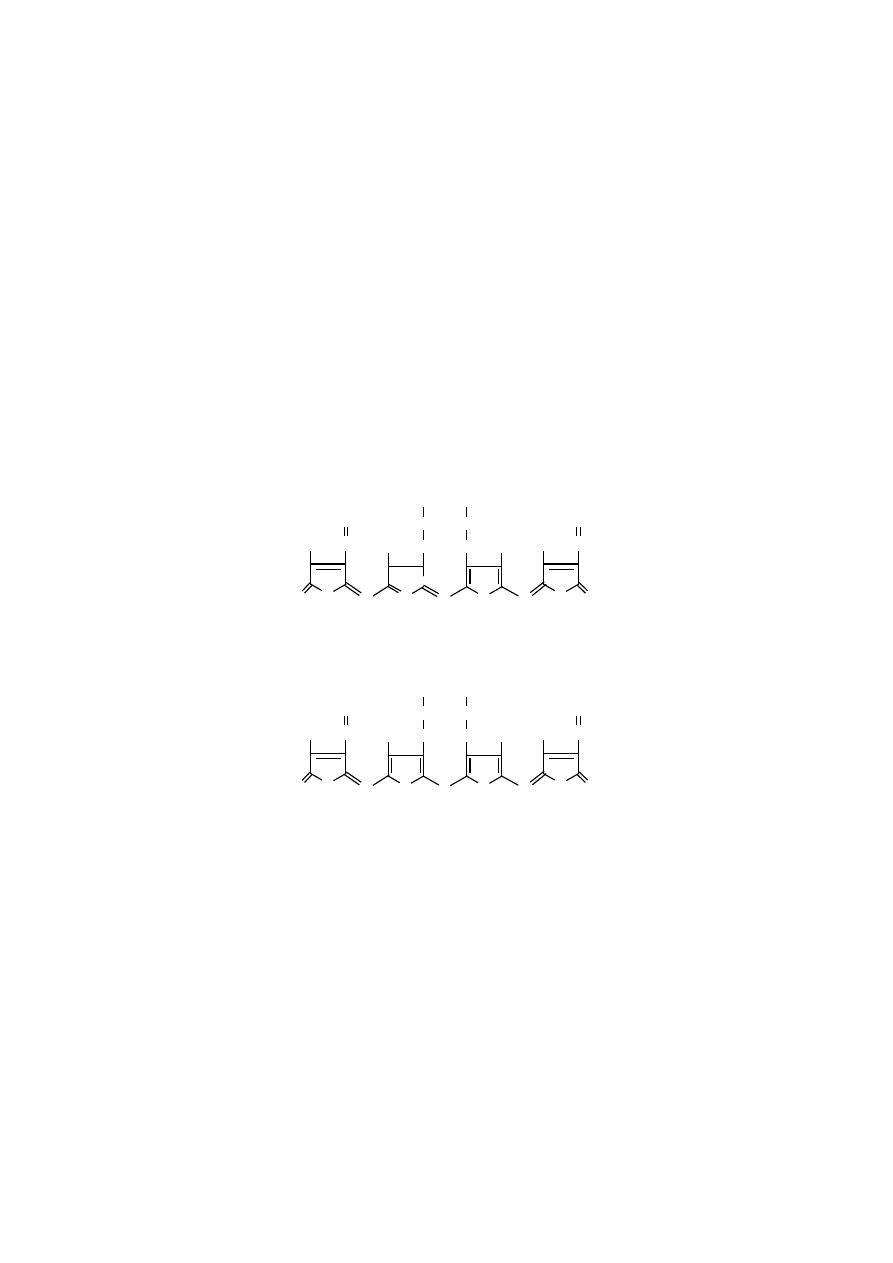
305
zielonym barwnikiem żółciowym. Ten rozpuszczalny w wodzie barwnik jest koń-
cowym produktem rozkładu hemu u ptaków, gadów i płazów. U ludzi i innych ssa-
ków biliwerdyna ulega redukcji do bilirubiny, czerwonopomarańczowego barwni-
ka żółciowego. Widocznym dowodem tych reakcji rozkładu hemu są zmiany kolo-
ru siniaka w różnym czasie od wynaczynienia krwi do tkanek. Cząsteczki bilirubi-
ny są lipofilne, dlatego we krwi transportowane są w połączeniu z albuminą. Bili-
rubina jest bardzo skutecznym przeciwutleniaczem, w przeciwieństwie do biliwer-
dyny. Bilirubina unieszkodliwiając dwa rodniki hydroksylowe jest utleniana do
biliwerdyny. Następnie biliwerdyna szybko ponownie ulega redukcji do bilirubiny.
Bilirubina związana z albuminą wykazuje około 1/10 efektywności witaminy C
w ochronie przed nadtlenkami rozpuszczalnymi w wodzie. Bilirubina to również
szczególnie silny przeciwutleniacz w błonach białkowo-lipidowych, gdzie rywali-
zuje z witaminą E.
IV
III
II
I
N
H
O
CH
3
CH
CH
2
CH
3
CH
2
CH
2
COO
-
N
C
H
N
H
CH
2
CH
2
COO
-
CH
3
C
H
N
H
C
H
O
CH
3
CH
CH
2
biliwerdyna
N
H
C
H
O
CH
3
CH
CH
2
N
H
CH
3
CH
2
CH
2
COO
-
C
H
N
H
CH
2
CH
2
COO
-
CH
3
C
H
N
H
O
CH
3
CH
CH
2
I
II
III
IV
H
bilirubina
W wątrobie bilirubina sprzęgana jest z dwoma cząsteczkami kwasu glukuro-
nowego. W wyniku tej reakcji powstaje diglukuronid bilirubiny, który charaktery-
zuje się zwiększoną polarnością i rozpuszczalnością w wodzie. W tej formie biliru-
bina wydzielana jest do żółci, a następnie do jelit.
306
H
IV
III
II
I
N
H
O
CH
3
CH
CH
2
N
H
C
H
O
CH
3
CH
CH
2
O O
H
OH
OH
OH
C
O
-
O
O
O
H
OH
HO
OH
C
O
-
O
N
H
CH
3
H
2
C
H
2
C
C
C
H
N
H
CH
2
CH
2
C
CH
3
C
H
O
O
O
O
diglukuronid bilirubiny
W jelicie odłączany jest kwas glukuronowy, a bilirubina redukowana pod
wpływem enzymów bakteryjnych do bezbarwnego liniowego tetrapirolu, zwanego
urobilinogenem, który utlenia się do żółto zabarwionej urobiliny lub przekształca
się do innych barwników pojawiających się w moczu i kale. W moczu stwierdza
się urobilinę.
IV
III
II
I
N
H
OH
CH
3
CH
2
CH
3
N
H
CH
3
CH
2
CH
2
COO
-
C
H
N
H
CH
2
CH
2
COO
-
CH
3
C
H
N
H
C
H
HO
CH
3
CH
2
CH
3
H
H
urobilina
W kale i moczu obecne są również dipirolowe barwniki, tzw. mezobilifuscyny.
III
II
N
H
CH
3
CH
2
CH
2
COO
-
OH
N
H
C
H
O
CH
3
CH
2
CH
3
IV
I
N
H
O
CH
3
CH
2
CH
3
HO
N
H
CH
2
CH
2
COO
-
CH
3
C
H
mezobilifuscyny
Wyszukiwarka
Podobne podstrony:
AMI 17 3 Pochodne zrozumieć definicję pochodnej
AMI 17 2 Pochodne tw o wartosci sredniej id 5905 (2)
AMI 17 1 Pochodne id 59051 Nieznany (2)
2010 12 17 pochodna funkcji
AMI 17 3 Pochodne zrozumieć definicję pochodnej
AMI 17 2 Pochodne tw o wartosci sredniej id 5905 (2)
2010 12 17 pochodna funkcji
AMI 17 1 Pochodne
AMI 17 3 Pochodne zrozumieć definicję pochodnej
AMI 17 2 Pochodne tw o wartości średniej
2 Pochodna calkaid 21156 ppt
SII 17 Technologie mobilne
Rozpuszczalniki organiczne pochodne alifatyczne (oprócz metanolu
17 Metodologia dyscyplin praktycznych na przykładzie teorii wychowania fizycznego
więcej podobnych podstron