
5. II zasada termodynamiki
5. II zasada termodynamiki
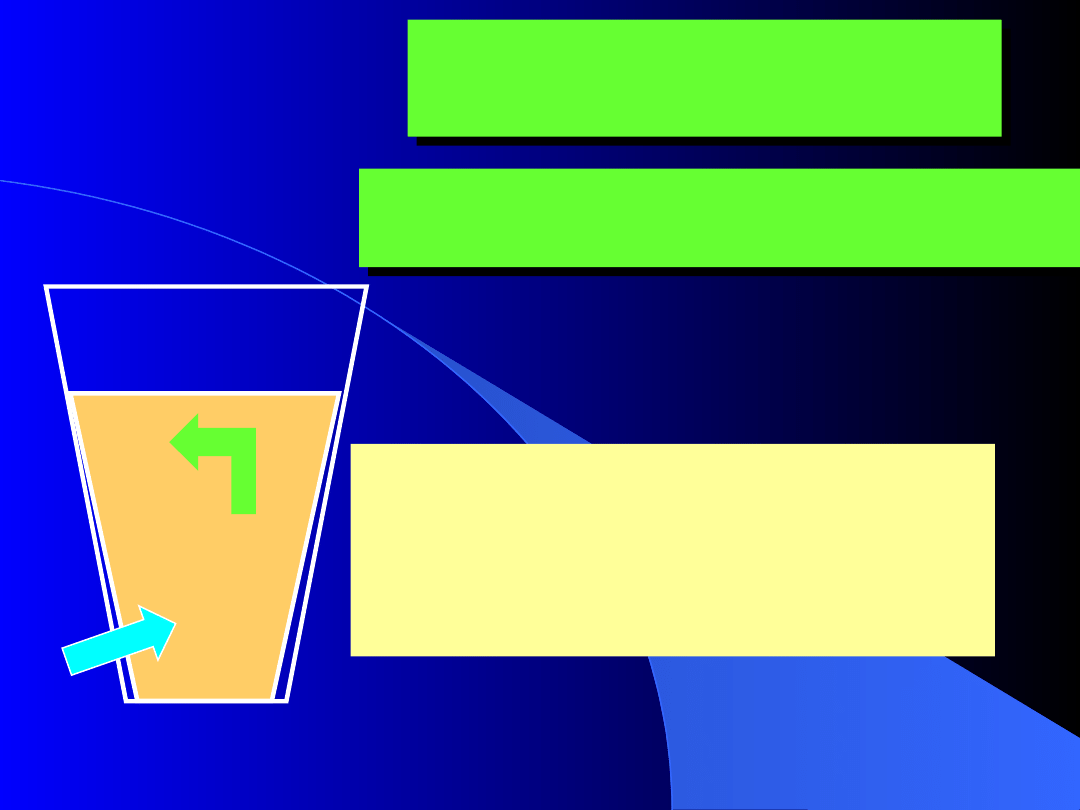
5.1. Jednokierunkowość przemian
w
u
d
E
E
E
T
1
T
ot
Q
1-2
2
1
1
0
Q
T
c
m
T
c
m
v
ot
v
ot
v
v
T
c
m
T
c
m
Q
1
2
1
w
u
d
E
E
E
T
1
T
ot
Q
1-2
ot
v
v
T
c
m
T
c
m
Q
1
2
1
Zjawisko odwrotne, choć
spełnia wymogi I zasady
termodynamiki, zajść nie
może

•wszystkie zjawiska w przyrodzie są
nieodwracalne
(jednokierunkowe)
•powrót do stanu początkowego pociąga za
sobą zmiany w
otoczeniu
•zjawiska odwracalne są swego rodzaju
„punktem
odniesienia”
•zjawiska są w różnym stopniu nieodwracalne
•im bardziej spontanicznie i gwałtownie
przebiega
zjawisko, tym trudniej
przywrócić układ do stanu
początkowego (tym bardziej nieodwracalny jest
proces)
Wnioski:

W pobliżu każdego stanu układu
znajdują się stany nieosiągalne na
drogach adiabatycznych.
II Zasada Termodynamiki:
Są to właśnie stany, które były stanami
wyjściowymi adiabatycznych przemian
nieodwracalnych, które skończyły się w
rozpatrywanym stanie. Układ
nieadiabatyczny można łatwo sprowadzić
do układu adiabatycznego jak pokazano to
przy sformułowaniu I zasady
termodynamiki.

•istnieje nowa, jednoznaczna funkcja
stanu,
zwana entropią S
•obowiązuje zasada wzrostu entropii
będąca
matematycznym, a
zarazem jedynym
użytecznym, sformułowaniem II zasady
termodynamiki
Wnioski:
Entropia wszystkich ciał
uczestniczących w procesie jest
funkcją niemalejącą.
5.2. Entropia
Różniczka niezupełna ciepła całkowitego dQ
c
posiada czynnik całkujący, który zamienia ją w
różniczkę zupełną jednoznacznej funkcji stanu
zwanej entropią.
T
Q
S
c
d
d
dS
jest różniczką zupełną

Ms
n
ms
S
T
q
s
c
d
d
T
v
p
u
s
d
d
d
T
p
v
i
s
d
d
d
v
p
u
q
c
d
d
d
p
v
i
q
c
d
d
d

s
zależy od parametrów
układu. Jeśli s=s(T,p)
p
v
p
i
T
T
T
i
T
s
T
p
d
d
d
1
1
T
p
v
i
s
d
d
d
p
p
T
i
T
T
s
1
v
p
i
T
p
s
T
T
1

p
p
T
i
T
T
s
1
v
p
i
T
p
s
T
T
1
T
p
T
i
T
p
p
T
s
1
2
p
T
i
T
2
1
p
T
v
p
i
T
T
T
p
s
1
2
p
T
T
v
T
T
p
i
T
T
v
p
i
T
1
1
1
2
2
2

Jednocześnie:
p
T
T
v
T
v
p
i
p
T
v
T
c
T
s
p
p
d
d
d
1
p
p
c
T
T
s
1
v
p
i
T
p
s
T
T
1

s
zależy od parametrów
układu. Jeśli s=s(T,v)
v
p
v
u
T
T
T
u
T
s
T
v
d
d
d
1
1
T
v
p
u
s
d
d
d
v
v
T
u
T
T
s
1
p
v
u
T
v
s
T
T
1

v
v
T
u
T
T
s
1
p
v
u
T
v
s
T
T
1
T
v
T
u
T
v
v
T
s
1
2
v
T
u
T
2
1
v
T
p
v
u
T
T
T
v
s
1
2
v
T
T
p
T
T
v
u
T
T
p
v
u
T
1
1
1
2
2
2
Jednocześnie:
p
T
p
T
v
u
v
T
v
T
p
T
c
T
s
v
v
d
d
d
1
v
v
c
T
T
s
1
p
v
u
T
v
s
T
T
1

Podobnie jak przy obliczaniu energii wewnętrznej
i entalpii, obliczanie entropii polega na całkowaniu
jej różniczki od stanu odniesienia do danego stanu.
s
s
v
T
s
s
s
p
T
s
v
T
v
T
p
T
p
T
,
,
0
,
,
0
0
0
0
0
,
,
d
lub
d

Ciecze i ciała stałe:
T
T
T
T
c
s
s
0
0
d
c
c
c
p
v
0
p
T
T
v
p
s
0
0
T
T
c
s
s
ln

Gazy doskonałe i półdoskonałe:
p
p
T
T
p
p
p
R
T
T
c
s
s
0
0
0
d
d
p
R
p
RT
T
T
v
p
s
p
p
T
0
0
0
p
p
R
T
T
c
s
s
T
T
p
ln
d

v
v
T
T
v
v
v
R
T
T
c
s
s
0
0
0
d
d
0
0
0
v
v
R
T
T
c
s
s
T
T
v
ln
d
0
0
0
v
v
R
T
T
c
s
s
v
ln
ln
0
0
0
p
p
R
T
T
c
s
s
p
ln
ln
v
R
v
RT
T
T
p
v
s
v
v
T

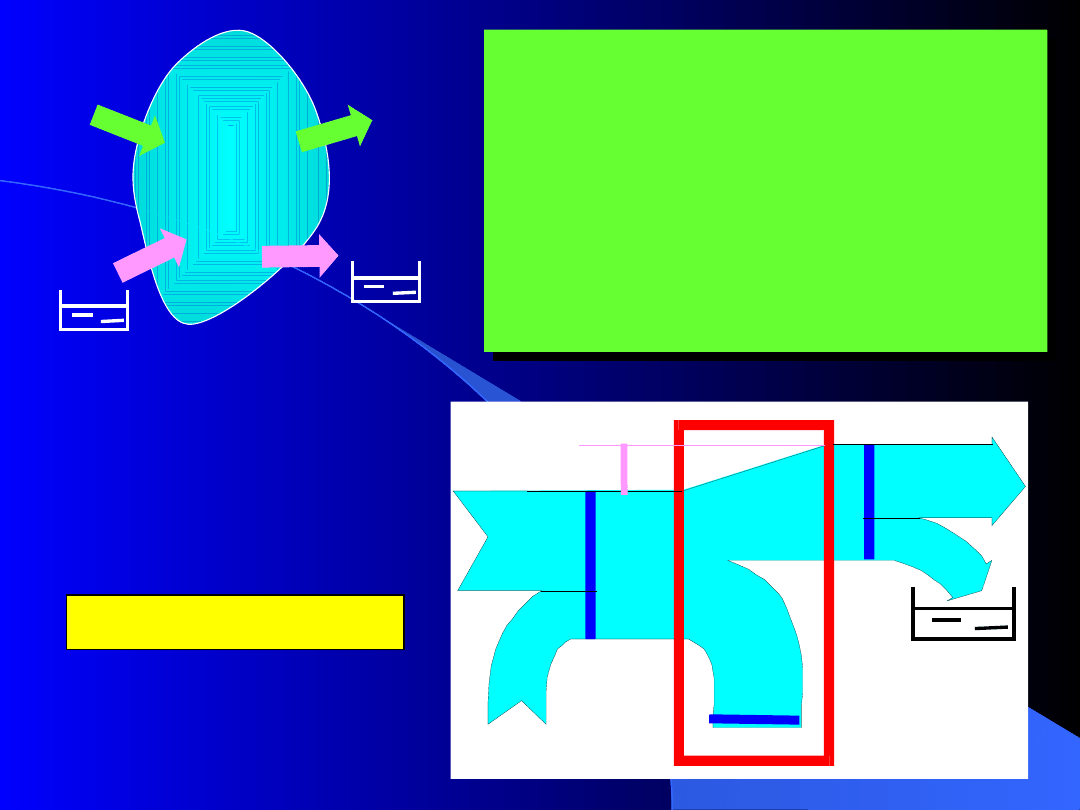
5.3. Zasada wzrostu entropii
Dla każdego rzeczywistego zjawiska nieodwracal-
nego suma przyrostów entropii wszystkich ciał
uczestniczących w zjawisku jest nieujemna:
0
0
0
Procesy nieodwracalne
Procesy odwracalne
Procesy niemożliwe

S
d
S
w
S
u
S
źrd
S
źrw
źrw
w
u
źrd
d
S
S
S
S
S
źr
d
w
u
S
S
S
S
S
d
S
w
S
u
S
źrd
S
źrw
źr
d
w
u
S
S
S
S
Wykres pasmowy
S
u
S
źr
S
w
S
d

źr
d
w
u
S
S
S
S
1
2
u
u
u
S
S
S
w
w
w
d
d
d
s
m
S
s
m
S
źr
c
źr
T
Q
S
d
źr
c
źr
T
Q
S

źr
d
w
u
S
S
S
S
d
d
w
w
w
d
d
d
s
m
S
s
m
S
źr
c
źr
T
Q
S
d
źr
c
źr
T
Q
S
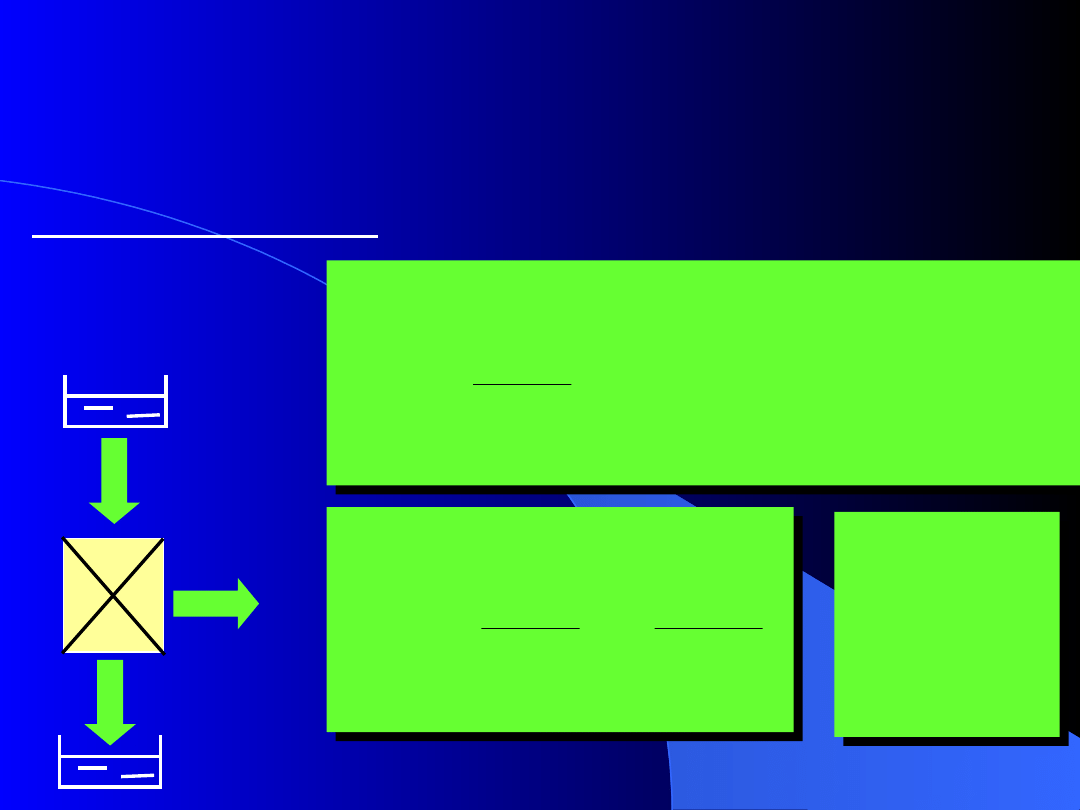
5.4. Szczególne przypadki II zasady
termodynamiki
Silniki cieplne
Q
d
.
N
T
d
0
d
d
T
Q
0
Q
w
.
T
w
w
w
d
d
T
Q
T
Q
0
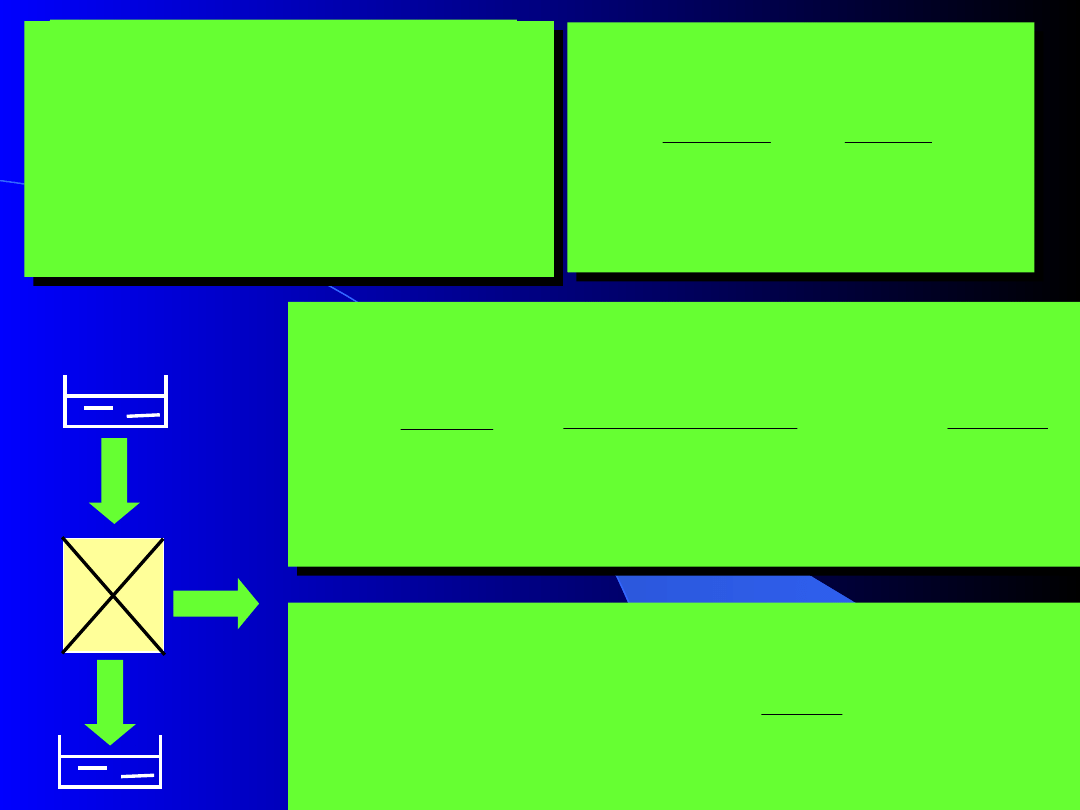
d
d
w
w
T
Q
T
Q
Termodynamiczna skala
temperatur
Q
d
.
N
T
d
Q
w
.
T
w
d
Q
N
d
w
d
w
d
Q
Q
Q
Q
Q
1
d
w
d
w
T
T
Q
Q
d
w
c
T
T
1
max
1

Q
d
.
N
T
d
Q
w
.
T
w
5
.
0
600
300
1
K
K
c
75
.
0
1200
300
1
1
K
K
T
T
d
w
c
Przykład:
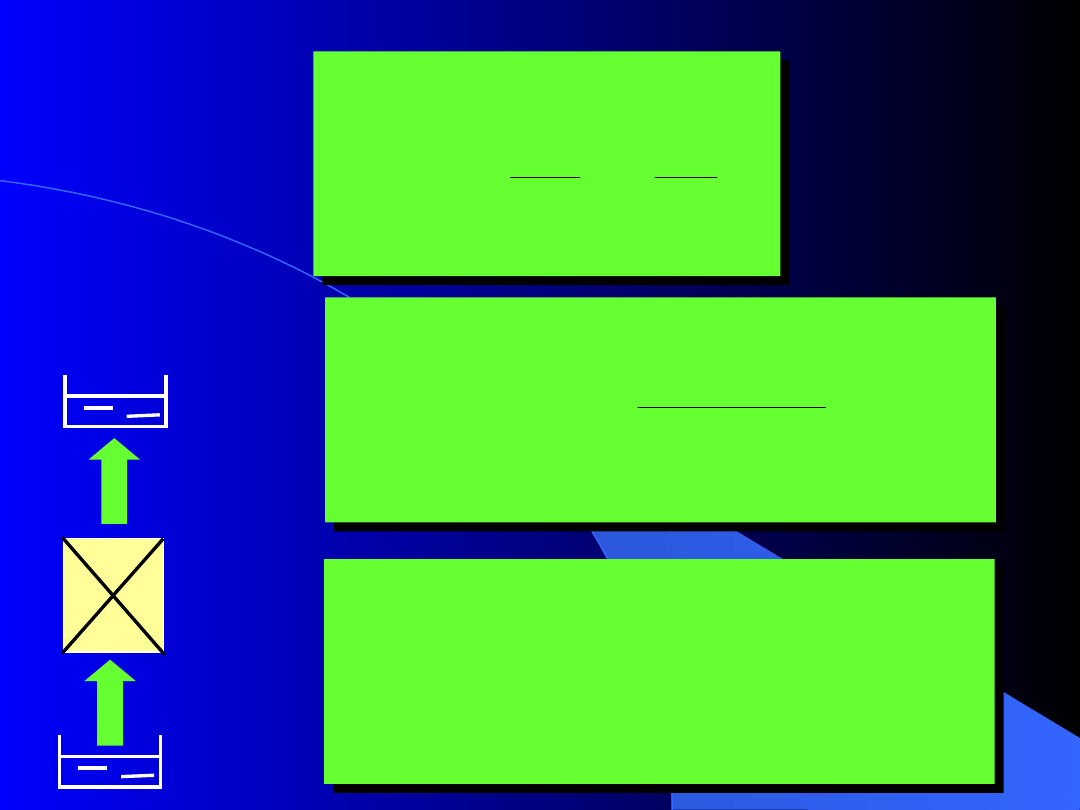
Q
.
T
1
0
2
1
1
2
T
T
T
T
Q
Q
.
T
2
1
2
T
Q
T
Q
Przykład:
1
2
T
T
1
2
T
T
Proces samorzutny
Proces odwracalny
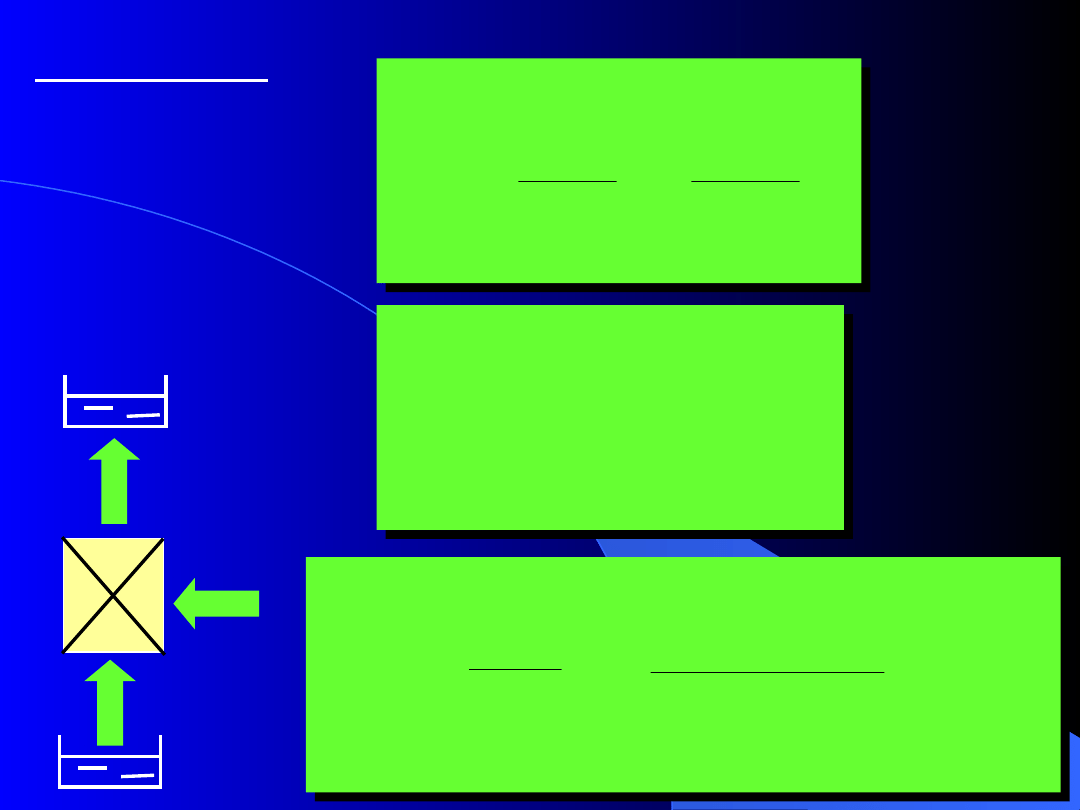
Ziębiarka
Q
w
.
N
T
w
=T
ot
Q
d
.
T
d
w
w
d
d
T
Q
T
Q
w
d
Q
N
Q
N
Q
d
Z
1
1
d
w
d
Q
Q
Q
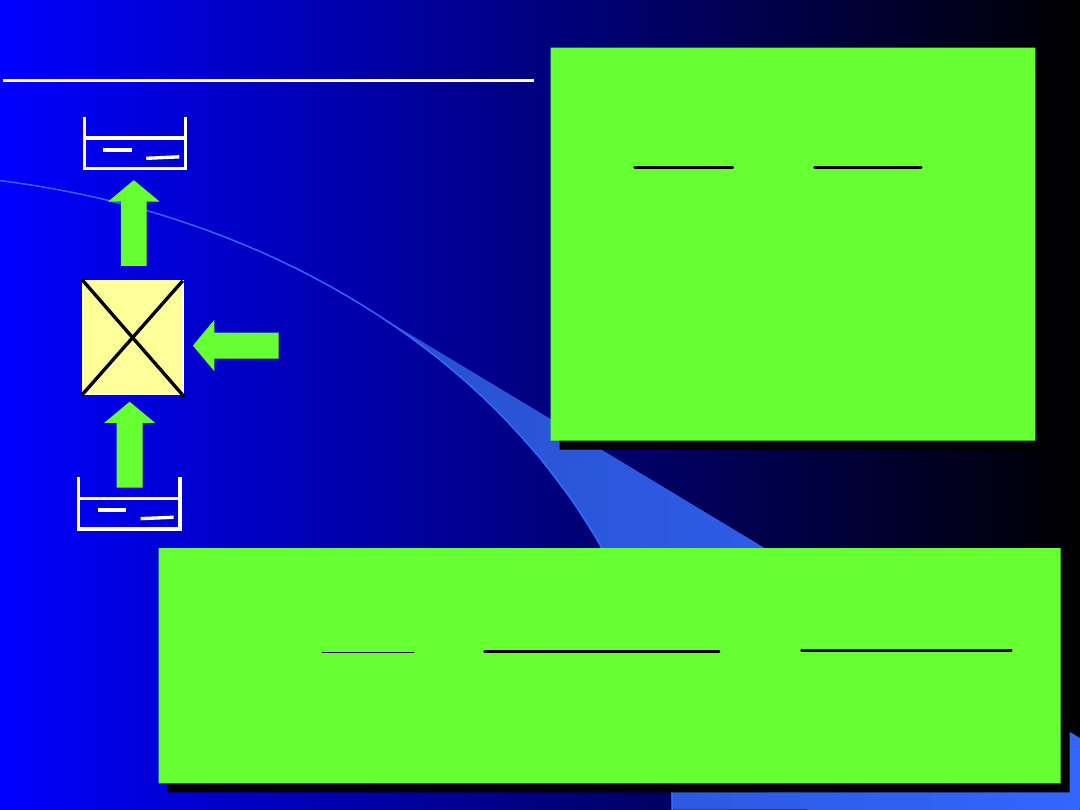
Ziębiarka odwracalna
Q
w
.
N
T
w
=T
ot
Q
d
.
T
d
w
w
d
d
T
Q
T
Q
w
d
Q
N
Q
N
Q
d
Z
d
w
d
Q
Q
Q
d
w
d
T
T
T
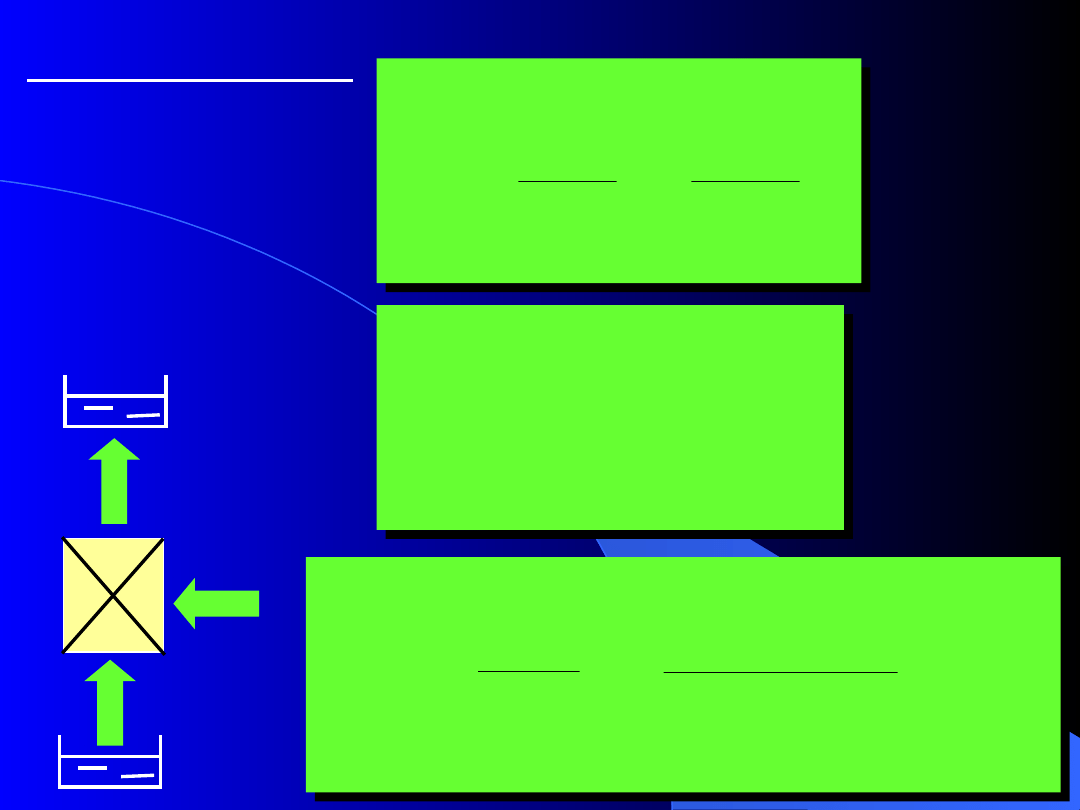
Pompa ciepła
Q
w
.
N
T
w
>T
ot
Q
d
.
T
d
w
w
d
d
T
Q
T
Q
w
d
Q
N
Q
N
Q
w
PC
1
d
w
w
Q
Q
Q
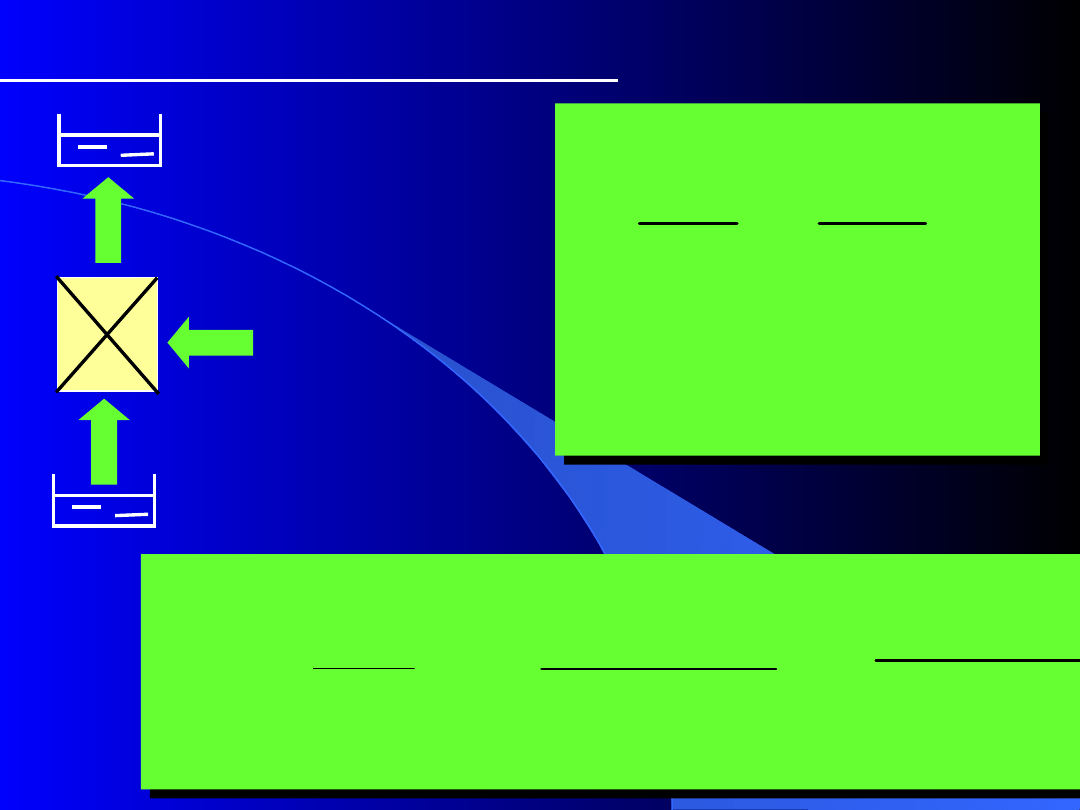
Pompa ciepła odwracalna
Q
w
.
N
T
w
>T
ot
Q
d
.
T
d
w
w
d
d
T
Q
T
Q
w
d
Q
N
Q
N
Q
w
PC
d
w
w
Q
Q
Q
d
w
w
T
T
T
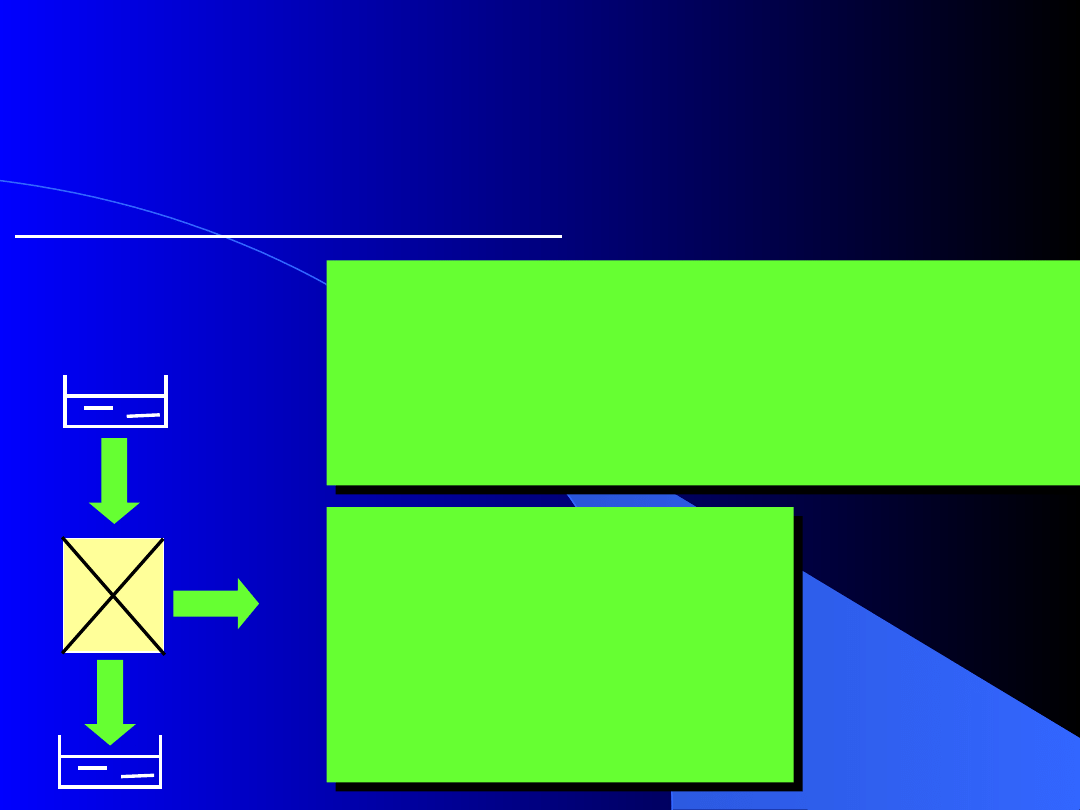
5.5. Skutki i elementy nieodwracalności
zjawisk
Dla silników cieplnych
Q
d
.
N
T
d
N
N
N
L
L
L
max
max
Q
w
.
T
w
ot
ot
T
N
T
L
Dla ziębiarek i pomp ciepła
Q
w
.
N
T
w
min
min
N
N
N
L
L
L
Q
d
.
T
d
ot
ot
T
N
T
L
Prawo Gouy’a - Stodoli
T
1
Q
.
Q
.
T
2
ot
ot
T
T
T
T
T
Q
T
N
2
1
1
2
Elementy nieodwracalności zjawisk
Egzergia służy wartościowaniu
energii - maksymalna praca
użyteczna jaką można uzyskać w
danych warunkach otoczenia.
•Tarcie - ciepło tarcia bezpowrotnie
odpływa do otoczenia
•Przepływ ciepła - zawsze w kierunku
spadku temperatury
•Mieszanie (dyfuzja)
•Spontaniczne reakcje chemiczne
T
źr
N
Q
f
.
ot
źr
f
ot
T
T
Q
T
N

ot
ot
ot
s
s
T
i
i
b
C
E
b
Sprawność egzergetyczna
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
18 entropia i II zasada termodynamiki
13. II zasada termodynamiki
2 7 II zasada termodynamiki i sprawnosc cyklu?rnota
II ZASADA TERMODYNAMIKI ENTROPIA 2
13 II zasada termodynamikiid 14454
I i II zasada Termodynamiki
18 entropia i II zasada termodynamiki
II zasada termodynamiki
kubica,biofizyka, I i II zasada termodynamiki w opisie układów biologicznych
II zasada termodynamiki w procesach biologicznych
suchecki,termodynamika,II zasada termodynamiki
II i III zasada termodynamiki
I zasada Termodynamiki
2 Bilans energii Pierwsza zasada termodynamiki
Pierwsza i druga zasada termodynamiki (entropia, zjawiska odwracalne)
więcej podobnych podstron