
Siarka i jej
związki

Występowanie
• Występuje w przyrodzie w stanie wolnym
i w postaci związków chemicznych
(baryt – BaSO
4,
celestyn – SrSO
4
).
Największe złoża siarki znajdują się w USA,
Meksyku, Japonii i na Sycylii, a w Polsce w
okolicy Tarnobrzega. Znajdują się płytko pod
powierzchnią Ziemi i są wydobywane metodą
odkrywkową.
• Siarka gromadzi się głównie w wewnętrznej
części płaszcza i jądrze Ziemi (1,8 – 2,9%)
• W organizmie ludzkim: mięśnie: 5000 -
11000 ppm, kości: 500 - 2400 ppm, krew: 1,8
g/l. Całkowita zawartość (70 kg): 140 g.

Informacje ogólne
• Leży w 16. grupie układu okresowego
(blok p)
• W jej atomie na powłoce walencyjnej
znajduje się 6 elektronów.
• W odróżnieniu od tlenu, w stanie
wolnym tworzy cząsteczki
ośmioatomowe, więc jest ciałem
stałym o niezbyt wysokiej
temperaturze topnienia.
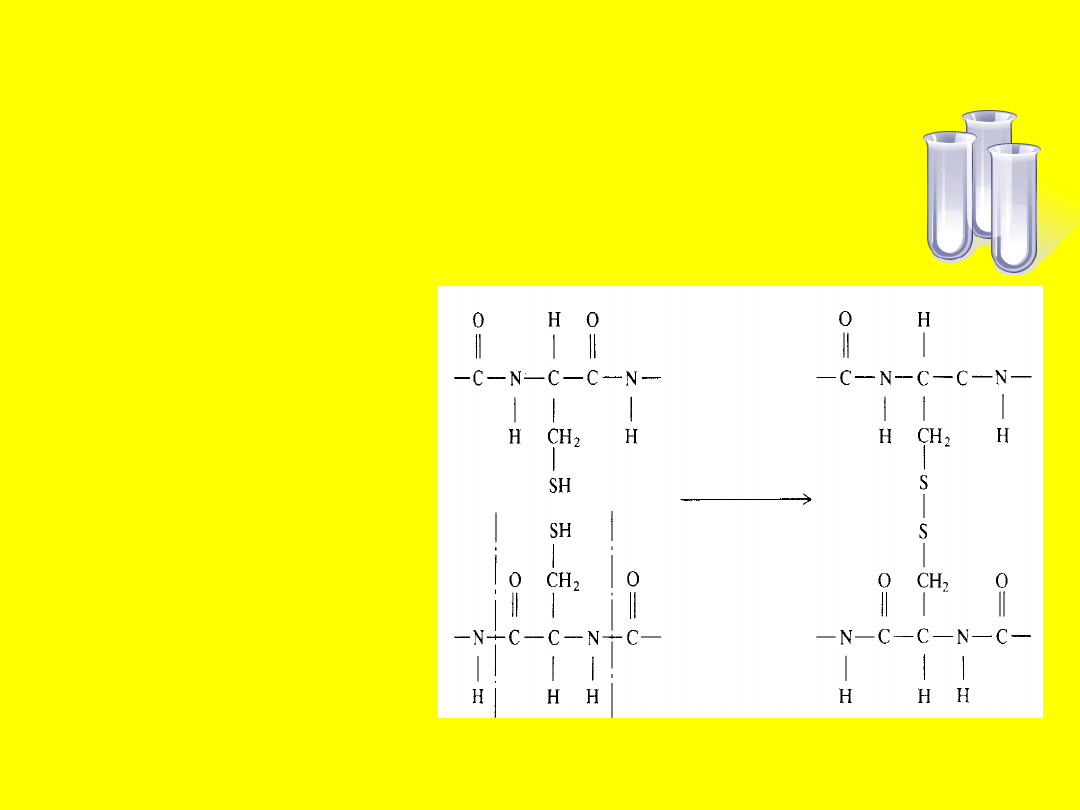
Rola
siarki w
białkach
Mostki dwusiarczkowe
( czyli wiązania siarka –
siarka) spinają łańcuchy
białka lub jego
fragmenty, tworząc
skomplikowane
struktury przestrzenne,
warunkujące ich funkcje
biologiczne. Białko
pepsyna ułatwia
trawienie pokarmów w
organizmie człowieka.
W jej cząsteczce
występują trzy wiązania
dwusiarczkowe, które
wzmacniają jej
strukturę, zapewniając
jej trwałość w
nieprzyjaznym
środowisku panującym
w żołądku.

Proces wulkanizacji
Wulkanizacja – ogrzewanie kauczuku
z siarką, podczas którego
powstają mostki siarczkowe między
łańcuchami węglowymi. Przy
stosunkowo małej liczbie tworzonych
wiązań siarczkowych produktem jest
guma, przy większej – ebonit.

Odmiany alotropowe
Obie odmiany różnią się właściwościami fizycznymi,
zbudowane są z takich samych cząsteczek,
utworzonych z ośmiu atomów, połączonych w
pierścień. Ich struktura różni się jedynie
sposobem ustawienia atomów względem siebie:
• Rombowa – trwała odmiana w warunkach
naturalnych
• Jednoskośna – powstaje z odmiany rombowej w
wyniku powolnego ogrzewania do temp. 95,9˚C.
Uwaga: siarka nie topi się w tym procesie! Ta
odmiana ma jasnożółte zabarwienie, jest
nietrwała, w temp. pokojowej powoli przekształca
się z powrotem w siarkę rombową .
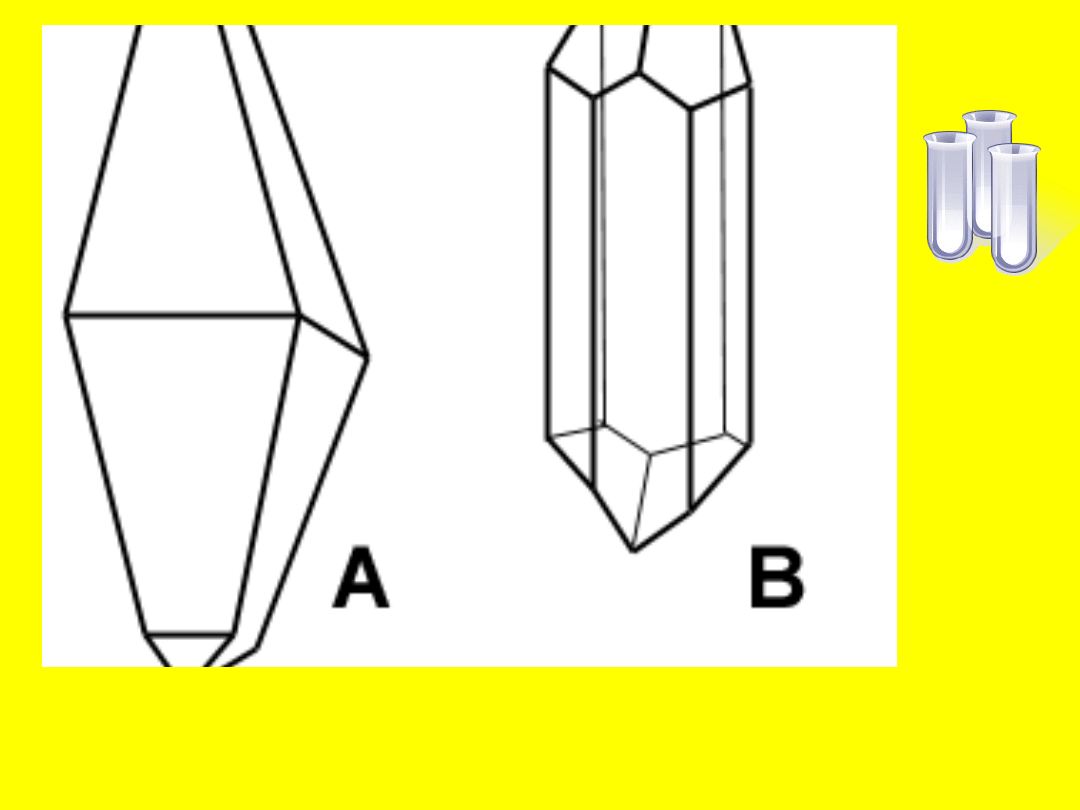
A – kryształ siarki rombowej
B – kryształ siarki jednoskośnej

Siarczki metali
• Siarka jest wprawdzie mniej aktywnym
pierwiastkiem niż fluorowce, ale reaguje z
wieloma metali tworząc siarczki. Oznacza
to, że ma właściwości utleniające, co
można wykazać na przykładzie reakcji
miedzi z siarką ( powstaje siarczek miedzi
(I) – Cu
2
S), lub z żelazem (powstaje
siarczek żelaza (II) - FeS)
• Siarkowodór (H
2
S) uwalniany przy
rozkładzie materii organicznej tworzy
nierozpuszczalne siarczki metali, głównie
FeS (triolit) i FeS
2
(piryt).

Uwalnianie
siarki z
siarczków
Siarka jest
uwalniana z
minerałów
siarczkowych
poprzez utlenianie:
2FeS
2
+ 2H
2
O +
7O
2
→ 2FeSO
4
+
2H
2
SO
4
Siarczki rozkładają
się w wysokich
temperaturach do
SO
2
i H
2
S, które
uwalniane są do
atmosfery poprzez
wulkany.

COS – siarczek karbonylu
*
S = C = O
• Najbardziej rozpowszechniona w atmosferze
gazowa forma siarki.
• Główne źródła:
fotochemiczna produkcja w oceanie
spalanie biomasy i paliw kopalnych
utlenianie dwusiarczku węgla (CS
2
)
• Usuwanie: roślinność, utlenianie przez rodniki
OH
• Rola: prekursor aerozoli, główne źródło aerozoli
siarczanowych w stratosferze

Neutralizacja rtęci
W laboratoriach rozlaną rtęć
neutralizuje się, poprzez
posypywanie jej siarką. W wyniku tej
reakcji powstaje czarny siarczek
rtęci (II)
Hg+S→HgS

Stopnie utlenienia siarki w
związkach
-
II → H
2
S (w związkach
chemicznych z metalami i
wodorem)
0 → S
8
IV → SO
2
i VI → SO
3
– w
połączeniach z tlenem ( tlenki,
kwasy tlenowe i ich sole)

Tlenek siarki (IV) - SO
2
• Powstaje podczas prażenia siarczków, przy dostępie tlenu.
Ma to duże znaczenie w metalurgii.
• Powstaje też w reakcji siarczanu (IV) sodu z kwasem solnym
Na
2
SO
3
+2HCl→SO
2
↑+2NaCl+H
2
O
• W przyrodzie jego naturalnym źródłem są wyziewy wulkanów.
• Silnie trujący, bezbarwny gaz o przenikliwym, duszącym
zapachu
• Dobrze rozpuszcza się w wodzie, a jego wodne roztwory mają
odczyn kwasowy. Reaguje więc z wodą i z wodorotlenkami
metali
• Ma właściwości wybielające i bakteriobójcze (zastosowanie w
przetwórstwie spożywczym)
• Ma negatywny wpływ na środowisko np. rośliny, głównie
drzewa iglaste (w tym najbardziej na jodłę)
• Towarzyszy pokładom węgla kamiennego, ropy naftowej i
gazu zimnego głównie w postaci FeS.

Siarkowodór
H
2
+S→H
2
S↑
• Siarkowodór ma bardzo
charakterystyczny i nieprzyjemny
zapach.
• W jego reakcji z azotanem (V) ołowiu
(II) powstaje czarny siarczek ołowiu (II)
Pb(NO
3
)
2
+H
2
S→PbS↓+2HNO
3
Jonowo: Pb
2+
+H
2
S→PbS↓+ 2H
+

Powstawanie
siarkowodoru
Można go otrzymać działając mocnymi
kwasami na siarczki metali np.
FeS+2HCl→H
2
S↑+FeCl
2
Tworzy się też podczas beztlenowego
rozkładu białek (np. w produktach
gnicia jajek).

Właściwości
siarkowodoru
• Jest silnie trujący. Niszczy hemoglobinę we
krwi, wytrącając zawarte w niej żelazo w
postaci siarczku żelaza (II).
• Niektóre wody mineralne (np.”Zuber” w
Krynicy) zawierają go, ale w tej postaci działa
leczniczo, gdyż jego zawartość jest minimalna.
Nadaje też tym wodom charakterystyczny
zapach.
• Jest gazem palnym. Spala się niebieskim
płomieniem. Przy dużym dostępie tlenu tworzy
się tlenek siarki (IV), a przy ograniczonym
siarka
Woda siarkowodorowa
Roztwór siarkowodoru w wodzie to woda
siarkowodorowa (słabo kwasowy odczyn).
Wprowadzenie jej lub gazowego
siarkowodoru do roztworów soli metali
ciężkich (kadm, antymon, miedź) powoduje
wytrącenie barwnych siarczków tych metali.
Ze względu na charakterystyczne barwy
mają zastosowanie w analizie chemicznej.
Żółty: CdSO
4
+H
2
S→CdS↓+H
2
SO
4
Pomarańczowy: 2SbCl
3
+3H
2
S→Sb
2
S
3
+6HCl
Czarny: CuSO
4
+H
2
S→CuS↓+H
2
SO
4

Kwas siarkowy (VI) -
H
2
SO
4
• Powstaje w wyniku rozpuszczania się w wodzie tlenku siarki (VI).
• Powoduje kwaśne deszcze, niszczących glebę, lasy, uprawy rolne i
budynki
• Rozcieńczony nie wykazuje tak silnych właściwości utleniających jak
stężony.
• Reaguje z aktywnymi metalami (Mg, Zn, Fe), tworząc sole. W tych
reakcjach wydziela się wodór.
• Rozcieńczony nie reaguje z metalami szlachetnymi (Ag, Au), ani z
półszlachetnymi (Cu)
• Jego sole nazywamy siarczanami. Przeważnie są one dobrze rozpuszczalne
w wodzie.
• Zastosowanie:
Służy do otrzymywania lotnych kwasów (HCl, HNO
3
) i słabych kwasów (H
2
CO
3
) z ich
soli.
Produkcja nawozów sztucznych, farb, detergentów, mydeł, barwników i leków.
W przemyśle petrochemicznym.
Jako elektrolit w akumulatorach ołowiowych.

Stężony kwas siarkowy
(VI)
• Właściwości:
Bezbarwna, oleista ciecz
Dobrze zdysocjowany na jony
Silnie żrący
Chętnie chłonie wodę
Silny utleniacz, reaguje z większością metali i
niektórymi niemetalami
• Pod jego wpływem cukier kolejno żółknie,
brunatnieje i czernieje. Wydziela się też
para, a mieszanina pęcznieje. Jest to
reakcja zwęglania
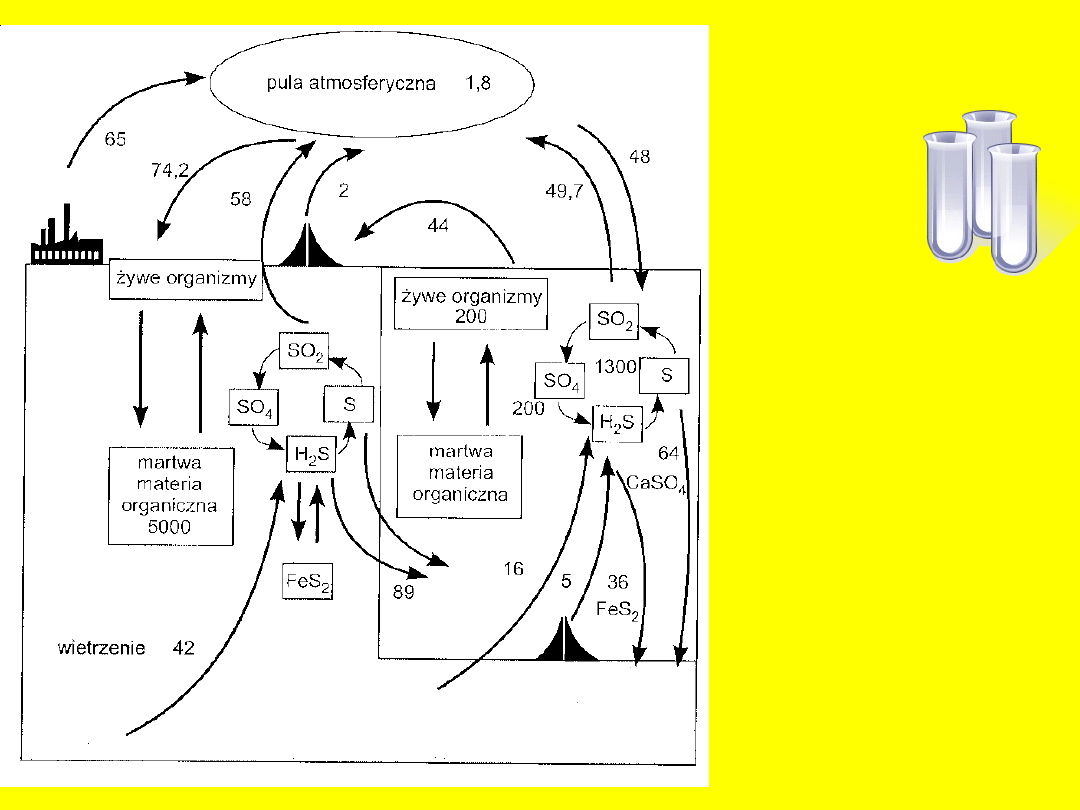
Obieg
siarki

Środowiskowe znaczenie
siarki
1. Anion siarczanowy (VI) jest jednym z
najbardziej rozpowszechnionych w
hydrosferze anionów.
2. Jest on też głównym składnikiem
kwasowości w wodach deszczowych –
udział w wietrzeniu skał.
3. Siarczany należą do najważniejszych
substancji służących jako ośrodki
nukleacji dla kropel deszczu.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
biomechanika 3 sem 1 rev1-wersja 2003, fizjoterapia dokumenty, wseit sem 3
1 rok wersja 2003, 1rok całość 2003, I spotkanie w nowym roku
Odnawialne źródła energii wersja97 2003
2 rok wersja 2003-5, Spis tematów, II Rok Formacji - kl
Współczesna Myśl Polityczna wersja 2003, Skrypty Politologia
1 rok wersja 2003, Przykład konspektu, III Rok Formacji - kl
Systemy wspomagania w pracy kierowcy ciągnika WERSJA 2003
Wytrzymka ściąga laboratorium wersja word? 2003
PUMUNOLOGIA NA EGZAMIN wersja 97 2003
Goalball wersja 97 2003
Dz U 2003 163 1577 wersja 03 10 03
Dz U 2003 131 1219 wersja 09 06 30
II wykład wersja na office 2003
Dz U 2003 121 1137 wersja 09 08 14
Egzamin z mechaniki budowli - V semestr - I termin - wersja 1997-2003, Budownictwo, Mechanika budowl
pytania z żelbetu - V semestr (kilku nadal brak) - wersja 97-2003, Budownictwo, Różne
więcej podobnych podstron