
REGULACJA EKSPRESJI GENÓW
U PROKARIOTA
Iwona Matkiewicz
Joanna Makowska
II rok Ochrona Środowiska
Grupa: IV
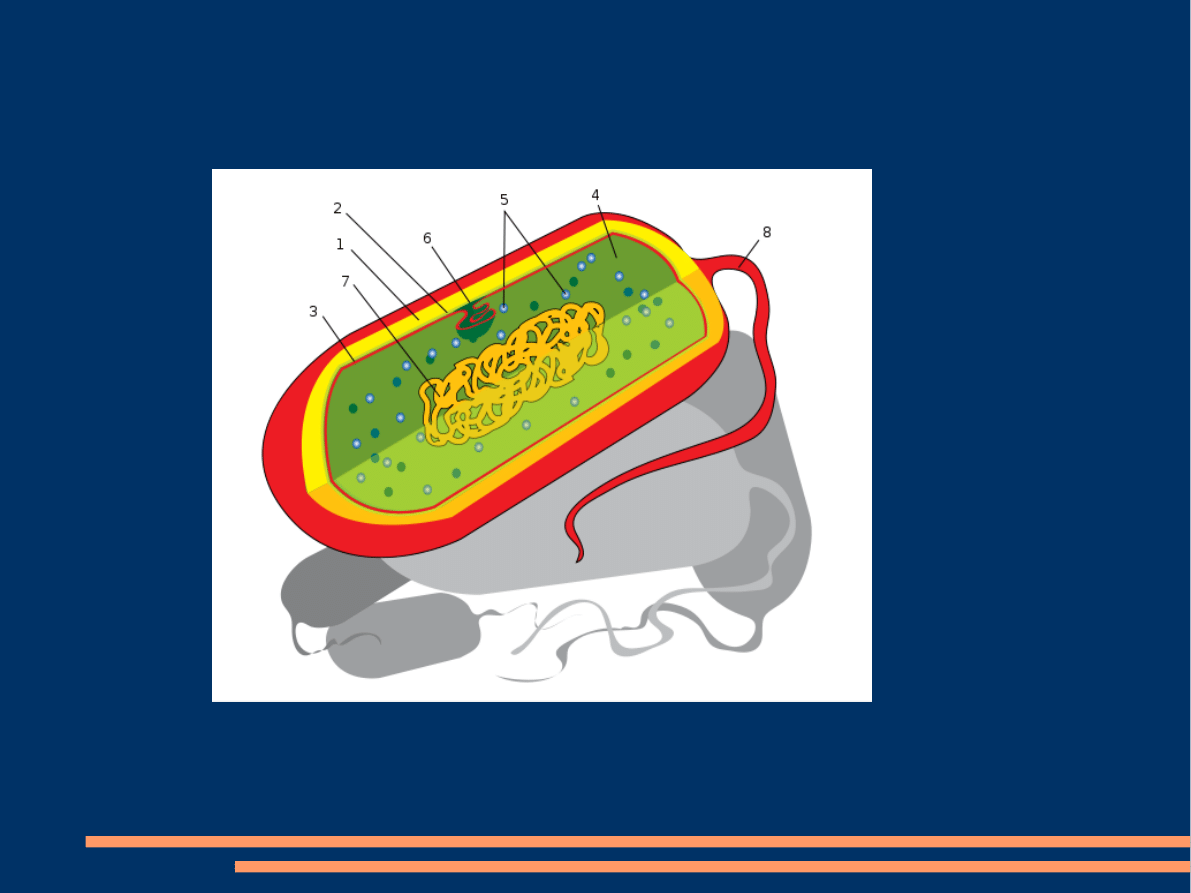
Prokarionty, prokarioty, organizmy prokariotyczne
(Prokaryota, Procaryota) –
w większości
, których komórka nie zawiera
oraz
charakterystycznych dla
1-Kapsuła, 2-Ściana komórkowa, 3-
, 4-
, 5-
, 6-
, 7-DNA, 8-Wić

PODSTAWOWE POJĘCIA
.
KONTROLA EKSPRESJI GENU
PRZEKAZYWANIE INFORMACJI GENETYCZNEJ
Informacja genetyczna - instrukcje kierujące wszystkimi
funkcjami komórki lub organizmu zapisane jako określone,
swoiste sekwencje nukleotydów w
kwasach nukleinowych w postaci kodu genetycznego.
Kod genetyczny: zasady zapisu informacji genetycznej
zawartej w DNA
GEN - fragment cząsteczki DNA stanowiący matrycę dla
syntezy cząsteczki lub podjednostki białka
GEN składa się z:
- sekwencji nietranskrybowanej, regulatorowej – promotora
- sekwencji transkrybowanej

Ekspresja genu (ang. gene expression) – proces, w którym
informacja genetyczna zawarta w genie zostaje odczytana i
przepisana na jego produkty, które są białkami lub różnymi
formami RNA.
Regulacja ekspresji genów to złożony wieloczynnikowy proces.
Na każdym z etapów ekspresja genu może być regulowana za
pomocą różnych mechanizmów. Ekspresja genu zależy od
rodzaju komórki, fazy rozwoju organizmu,
metabolicznego/fizjologicznego stanu komórki.

Przebieg ekspresji genów różni się nieco pomiędzy bakteriami i
eukariotami. U bakterii geny są zwykle zorganizowane w grupy
genów zwane operonami (np. operon laktozowy), które są
regulowane jako grupa i przepisywane na zawierający kilka
genów mRNA
PROKARIOTA
Właściwości genu bakterii
- część nie podlegająca transkrypcji
Promotor zawierający sekwencję regulatorową (operator)
- część podlegająca transkrypcji
część kodująca sekwencję aminokwasów
- kilka genów często ustawionych jest liniowo i tworzy tzw.
operon
- operony mogą być regulowane przez wspólną sekwencję
regulatorową, tworzą wtedy regulony.

Transkrypcja u Prokariotów
Zgodnie z teorią Jacoba i Monoda synteza białka
indukowanego B-galaktozydaza jest pod kontrolą
genu strukturalnego (Z). Ekspresja jednego lub więcej
genów strukturalnych jest pod kontrolą genu
regulatorowego (I). Gen regulatorowy jest
odpowiedzialny za wytworzenie białka zwanego
represorem , który hamuje ekspresje genów
strukturalnych. Represor działa przez wiązanie się z
fragmentem DNA, znanym jako operator (O).

Inicjacja transkrypcji u prokariotów polega więc na związaniu
się polimerazy RNA z odpowiednim odcinkiem pasma
matrycowego DNA - tzw. promotorem. U Prokariota promotor :
* bezpośrednio poprzedza miejsce startu transkrypcji
* składa się z elementu –10 (bogatego w A-T) i elementu –35

(O sile promotora decyduje skład nukleotydowy
sekwencji –10 i –35.) Słabe promotory stają się w pełni
funkcjonalne dzięki
aktywatorom, które, wiążąc się jednocześnie z pobliską
sekwencją DNA i polimerazą RNA, stabilizują wiązanie
polimerazy do promotora i ułatwiają rozpoczęcie
transkrypcji.
Polimerazy RNA składają się z wielu podjednostek.
U bakterii za specyficzne rozpoznawanie elementów –
10 i –35 promotora
odpowiada podjednostka σ. Po połączeniu pierwszych 8-
9 rybonukleotydów
podjednostka σ odłącza się od rdzenia polimerazy, który
przeprowadza
elongację transkrypcji. Komorka bakteryjna jest
wyposażona w kilka
podjednostek σ kodowanych przez odrębne geny i
rozpoznających inne
specyficzne sekwencje nukleotydowe elementów –10 i –
35
.

Ekspresja genów składa się z wielu złożonych etapów,
z których każdy może podlegać regulacji
Kiedy represor jest związany z operatorem, polimeraza RNA
nie może się połączyć z przyległym genem promotorowym (P)
który ułatwia ekspresję genów strukturalnych. Jeśli operator
nie jest związany z represorem polimeraza RNA może się
połączyć z promotorem i transkrypcja a ostatecznie translacja
genu strukturalnego może zachodzić. Komórka E.coli wytwarza
B-galaktozydazę i pozostałe białka kodowane przez operon
laktozowy aż do całkowitego wyczerpania dostępnej laktozy.
Operon tworzą geny strukturalne wraz z promotorem i
operatorem. Miejsca kontroli – promotor i operator- fizycznie
sąsiadują z genami strukturalnymi w sekwencji DNA.
Gdy bakterie E.coli zostają eksponowane na laktozę jako źródło
węgla, B – galaktozydaza nie jest jedynym indukowanym
białkiem. W tym operonie występuje kilka genów
strukturalnych które określono jako operon lac.

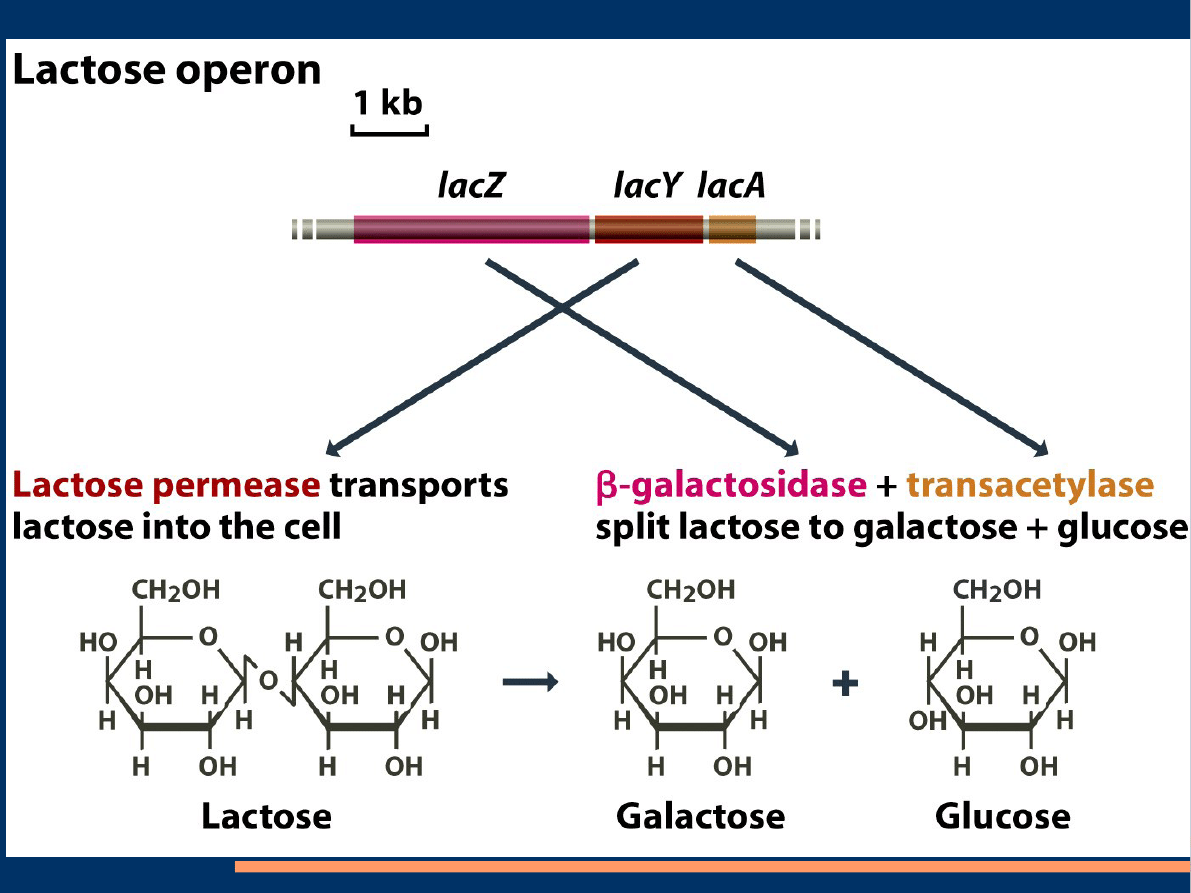
Operon lac. Tworzą geny strukturalne lacZ, lacY,lacA
które kodują odpowiednio :
B- galaktozydazę, B-galaktozydopermeazę i
transacetylazę galaktozydów ( acetylotransferazę
tiogalaktozydową). Permaza uczestniczy w aktywnym
transporcie laktozy z otoczenia przez ścianę komórkową
bakterii do wnętrza komórki. Fizjologicznym induktorem
jest allolaktoza.
Operon lac ulega indukcji, gdy bakterie E.coli
wykorzystują jako źródło węgla laktozę, a nie glukozę. W
obecności obu źródeł, glukozy i laktozy komórki nie
wytwarzają białek lac. Represja syntezy białek lac przez
glukozę jest nazywana represją kataboliczną.

U bakterii regulacja szlaków anabolicznych
(związanych z syntezą różnych cząsteczek :
aminokwasów, nukleotydów itd.) odbywa się normalnie
za pośrednictwem enzymów reprymowalnych. Sygnał
molekularny do regulacji tych genów, to w większości
wypadków końcowy produkt szlaku metabolicznego.
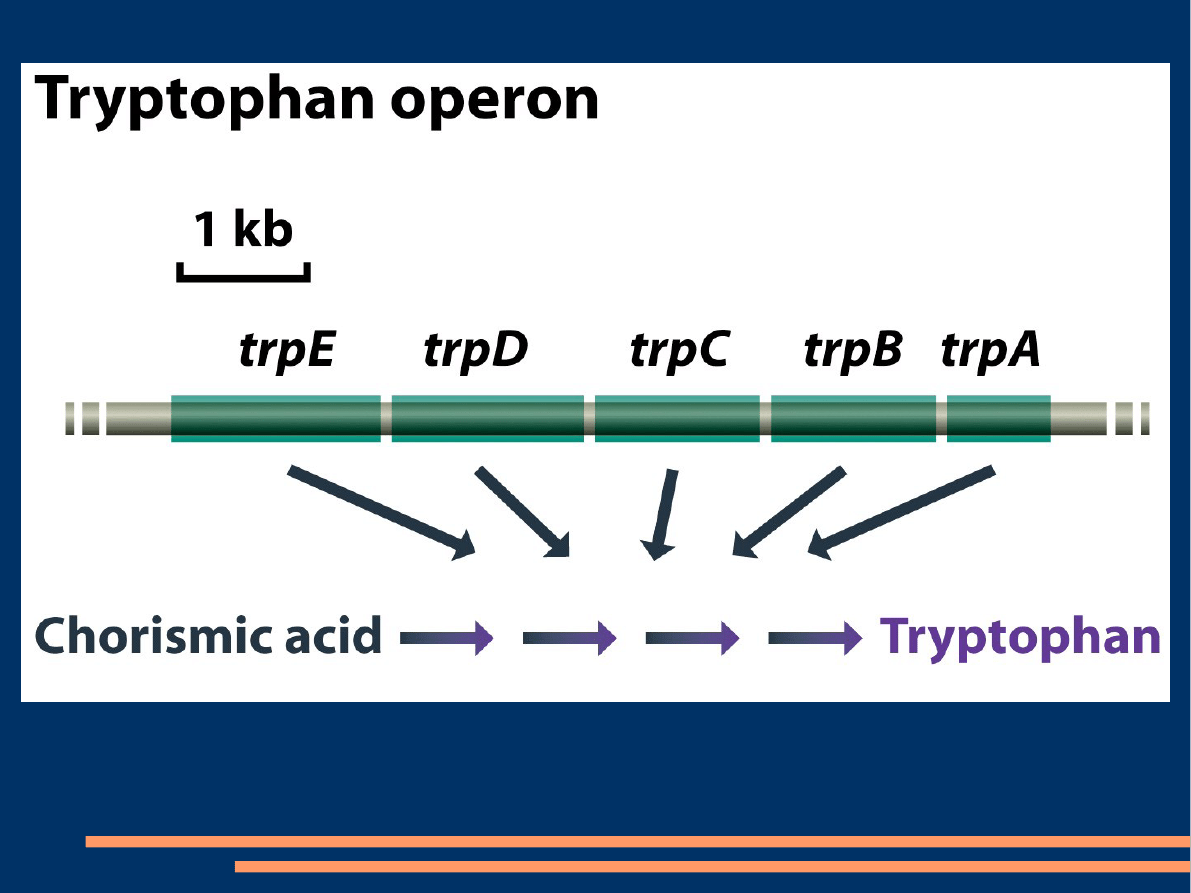
Przykładem systemu reprymowalnego jest operon
tryptofanowy(trp). Operon ten zawiera 5 genów
strukturalnych dla syntezy enzymów, które
przekształcają kwas chorozymowy w tryptofan. Gen
regulatorowy koduje białko represorowe(nie wiąże się
z operatorem). Białko represorowe może przyłączyć się
do operatora, gdy do allosterycznego miejsca represora
przyłączy się korepresor(tryptofan).

Komórkowy poziom tryptofanu decyduje o aktywności
represora
tryptofanowego, który jest białkiem allosterycznym:
przyłączenie tryptofanu powoduje subtelne zmiany w jego
trójwymiarowej strukturze, umożliwiające mu związanie
się z
DNA operatora Otrp i represję operonu. Operon
tryptofanowy jest wyłączony w obecności tryptofanu i
włączony gdy tryptofan jest potrzebny. Jest to więc
sytuacja odwrotna do operonu laktazowego.
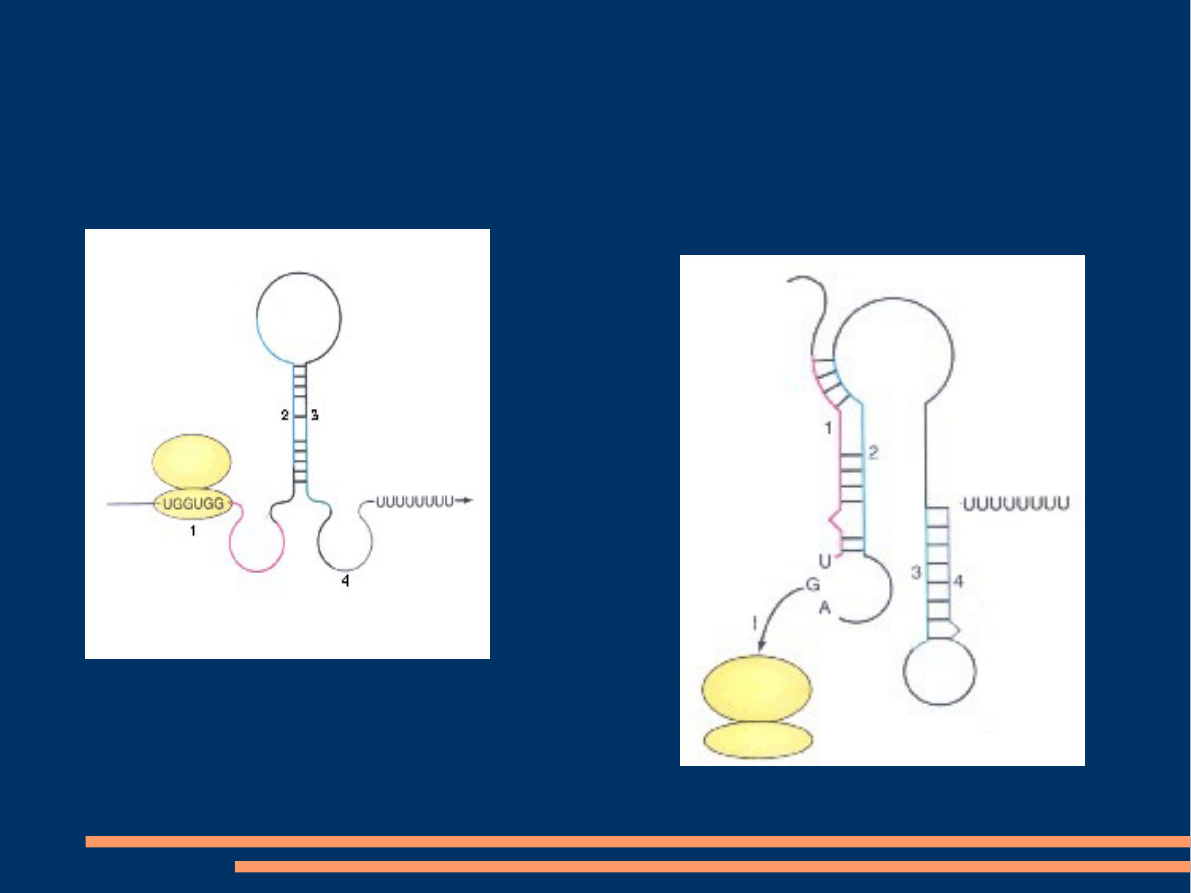
Małe stężenie
tryptofanu
Rybosom
zatrzymuje się
na
kodonach
trp
transkrypcja
jest
kontynuowan
a
Duże stężenie
tryptofanu
rybosom
odłącza
się przy
kodonie
STOP
region liderowy
podlega
całkowitej
translacji
utworzenie struktury
szpilki do włosow przez
regiony 3 i 4, za ktorymi
jest ciąg urydyn
prowadzi
do terminacji
transkrypcji

Zarówno operon laktozowy jak i tryptofanowy są
przykładami regulacji negatywnej.
Występowanie kontroli negatywnej jest związane z
obecnością białka regulatorowego – represora, który
wiąże się z DNA i wyłącza transkrypcję genu.
Znane są też systemy regulacyjne, w których są
wykorzystywane regulatory pozytywne – aktywatory.
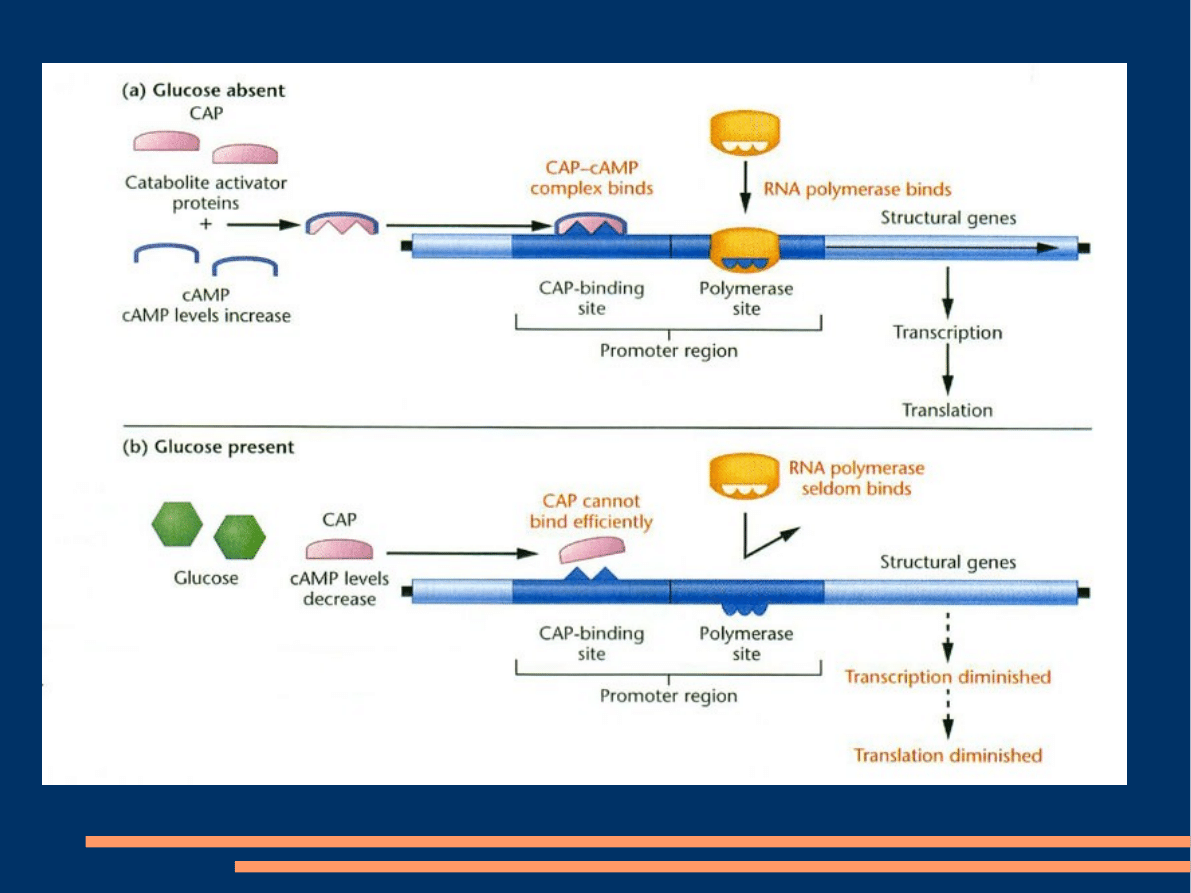
Pozytywna regulacja transkrypcji – białko regulatorowe
łączy się z DNA i uruchamia transkrypcję. Wspomniane
białka są wtedy określane jako aktywatory. Przykładem
aktywatora E.coli jest białko CAP. Jako źródło pokarmu
E.coli wykorzytsuje glukozę. Podczas zmniejszania się
steżenia glukozy wzrasta w komórce stęznie cAMP.
Później cAMP wiąże się z białkiem CAP, które dzięki
temu może łaczyć się z konkretnym odcinkiem DNA-
który znajduje się blisko promotora i uruchamiać
transkrypcję związanych z nim genów struktury.

Operon laktozowy podlega regulacji zarówno
pozytywnej jak i negatywnej. W wypadku zmniejszania
się steżenia glukozy, kompleks cAMP-CAP łączy się z
operonem laktozowym i aktywuje transkrypcję.
Operon laktozowy jest też regulowany przez represor
lac. Pozwala to na uruchomienie transkrypcji genów :
B- galaktozydazy,permeazy i transcetylazy, tylko w
wypadku gdy w otoczeniu nie ma glukozy ale jest
laktoza. Promoto operonu lac ma 2 regiony. Jednym
jest miejsce przyłączania się polimerazy RNA, a
drugim miejsce wiązania innego białka
regulatorowego CAP.W rejonie operatora miejsce
wiązania polimerazy RNA zachodzi na miejsce
wiązania represora(promotor i operator częściowa
zachodzą na siebie.) Asocjacja represora zwiększa
wiązanie polimerazy RNA, lecz wstrzymuje przejście
od kompleksu promotorowego zamkniętego ( w którym
DNA wystepuje w formie podwójnej helisy) do
kompleksu promotorowego otwartego( w którym
fragment DNA jest rozpleciony), co blokuje
transkrypcję.

Operony mogą być kontrolowane za pomocą wspólnego
regulatora. Grupa operonów kontrolowana w ten sposób
za pośrednictwem tego samego regulatora nosi nazwę
regulonu. U E. Coli istnieje co najmniej 40 regulonow,
regulony tworzą np. geny systemu SOS czy geny
indukowane induktorem CAP-cAMP.
Białko CAP różni się od represorów laktozowego i
tryptofanowego tym że może regulować transkrypcję
operonów związanych z metabolizmem różnych
katabolitów(np. Cukrów-laktozy, malatozy, galaktozy,
arabinozy)
Geny konstytutywne(transkrybowane w sposób ciągły)
kodujące białka potrzebne w dużych ilościach są
transkrybowane zwykle szybciej niż geny, których
produkty są potrzebne w niewielkich ilościach. Szybkość
transkrypcji tych genów jest kontrolowana przez ich
sekwencje promotorowe. Z genów które mają „słabe”
promotory powstaje mniej cząsteczek mRNA.

Intensywność syntezy białek w E. Coli jest
regulowana głównie na poziomie transkrypcji.
Niektóre jednak geny mogą być regulowane na
różnych potranskrypcyjnych etapach ekspresji genu.
Stwierdzono, że cząsteczki mRNA mogą ulegać
translacji z różną szybkością- u E. Coli różnica w
szybkości translacji cząsteczek może być 1000-krotna.
Okres trwania cząsteczki mRNA w komórce
bakteryjnej jest bardzo krótki, w związku z czym
cząsteczka, która ulega szybkiej translacji, dostarcza
oczywiście więcej białka. Regulacja szybkości
translacji jest związaną głównie ze zdolnością
rybosomów do łączenia się z mRNA podczas inicjacji
translacji.
Mechanizm dzięki któremu szybkość powstawania
produktów w szlakach metabolicznych zostaje
dostosowana do wymogów komórki, jest hamowany
przez sprzężenie zwrotne. Polega ono na tym, że
produkt końcowy przyłącza się do miejsca
allosterycznego pierwszego enzymu szlaku, co
powoduje, że enzym ten staje się nieaktywny. Czasowa
deaktywacja pierwszego enzymu pozbawia substratów
wszystkie pozostałe enzymy szlaku. Mechanizm ten
jest wykorzystywany w różnych organizmach do
zmiany aktywnośći istniejących enzymów w szlaku
metabolicznym.
Wnioski
Prokariota
Transkrypcja
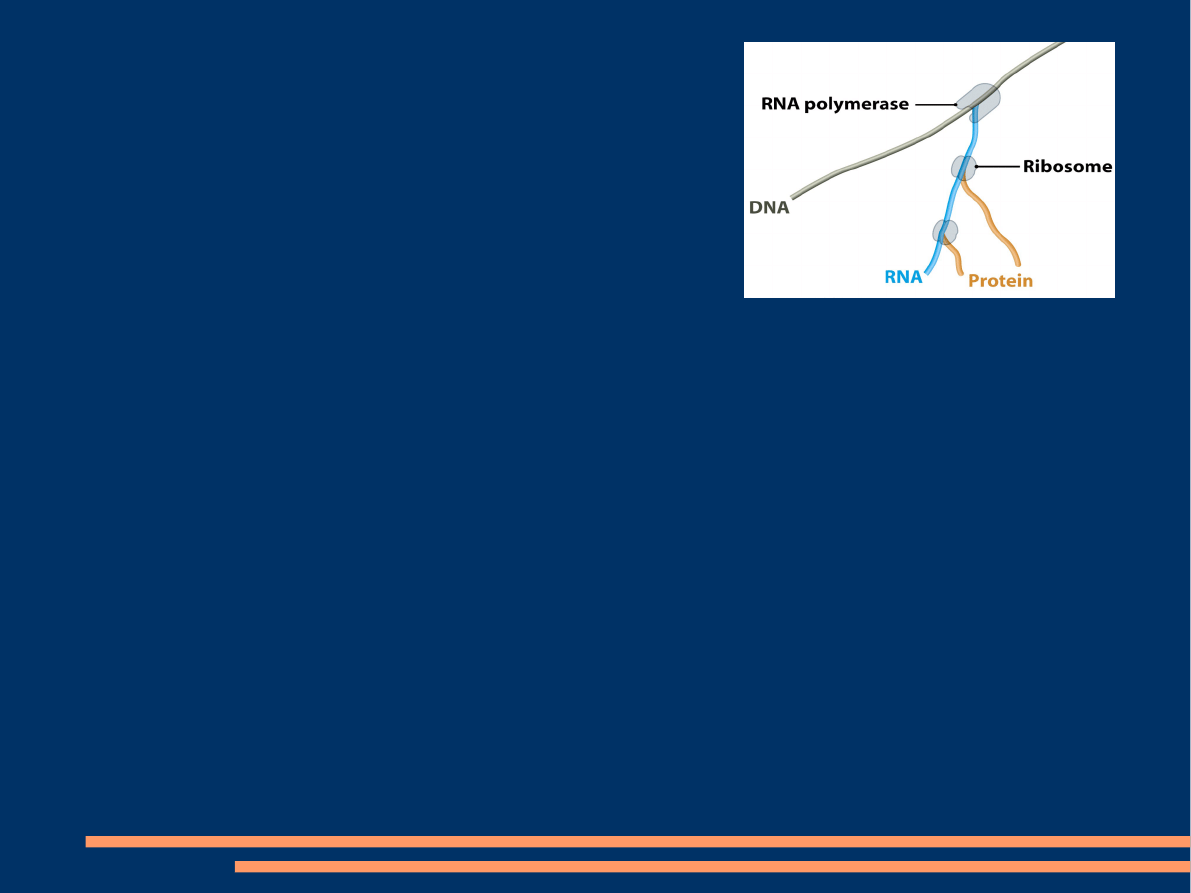
Transkrypcja jest połączona z translacją
Geny transkrybowane są przez jeden rodzaj polimerazy
RNA
Pod kontrolą jednego promotora może znajdować się więcej
niż jeden cistron –taką jednostkę ekspresyjną nazywamy
operonem
dominuje regulacja na poziomie transkrypcji
policistronowe jednostki transkrypcyjne o wspólnej
regulacji
transkrypcyjnej – operony
mRNA szybko degradowane, translacja zachodzi
zasadniczo
równocześnie z transkrypcją

Dziękujemy za
uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
Regulacja ekspresji genow poprawione
Regulacja ekspresji genów u eucaryota
3. Przyklady regulacji ekspresji genow u Eukaryota-ok, Biologia II, Biologia molekularna
Regulacja ekspresji genów, fizjoterapia, biologia medyczna
12 Regulacja ekspresji genow
Regulacja ekspresji genów - materiały teoretyczne
Epigenetyczne mechanizmy regulacji ekspresji genow?
W3 Regulacja ekspresji genów
wd 4 glukoza, lipidy metabolizm, regulatory ekspresji genów
Regulacja ekspresji genów egzamin
Regulacja Ekspresji genow
07) Regulacja ekspresji genów (wyklad 7)
Regulacja ekspresji genów
Regulacja ekspresji genow
Gradient ekspresji genów w regulacji morfogenezy u ssaków, Medycyna ŚUM, Rok 1, Biologia medyczna, T
Gradient ekspresji genów w regulacji morfogenezy u ssaków, Medycyna ŚUM, Rok 1, Biologia medyczna, T
Genetyka regulacja funkcji genow
Ekspresja genów
4 Regulacja ekspresji
więcej podobnych podstron