Zagadnienia obowiązujące na zaliczenie przedmiotu Techniki Laboratoryjne w roku
akademickim 2014/2015
1.
Zastosowanie i przykłady białek biologicznie aktywnych
Białka biologicznie aktywne odpowiedzialne są za prawidłową
budowę
tkanek, ułatwienie
przyswajalności niektórych składników, biorą one również udział w regulacji procesów
metabolicznych.
Najbardziej znane są karnityna, tauryna, glutation, oksytocyna, czy wazopresyna.
–
karnityna – pochodna kwasu γ-amino-β-hydroksymasłowego obficie występująca w mięśniach.
Pełni funkcje transportowe wobec kwasów tłuszczowych o długich łańcuchach, które
przekazywane są do mitochondriów, gdzie ulegają przemianom, w wyniku których powstaje
energia niezbędna do prawidłowego funkcjonowania komórek organizmu. Reguluje stosunki
między acetylo-CoA i CoA.
–
tauryna – jej funkcją biochemiczną jest sprzęganie kwasów żółciowych przed wydaleniem ich z
wątroby. Tauryna wpływa na ośrodkowy układ nerwowy. Przypisuje się jej funkcje
neuroprzekaźnika. Jest m.in. agonistą receptorów GABA(A). Działa jak transmiter metaboliczny i
ma dodatkowo efekt detoksykujący oraz wzmacniający siłę skurczu serca.
–
glutation – niewielkie białko pełniące w organizmie funkcje antyoksydacyjne, detoksykacyjne i
odpornościowe (aktywność limfocytów).
–
oksytocyna i wazopresyna – cykliczne nonapeptydy (zbudowane z 9 aminokwasów) wytwarzane
w podwzgórzu i magazynowane w przysadce; należą do neuropeptydów, czyli hormonów
peptydowych wydziela-nych przez tkankę nerwową. Nazywane są też a hormonami tylnego płata
przysadki mózgowej.
2.
Biochemiczne właściwości białek
•
budowa chemiczna (wiązanie peptydowe, aminokwasy)
Aminokwasy – grupa organicznych związków chemicznych zawierających zasadową grupę
aminową oraz zasadniczo kwasową grupę karboksylową -COOH, lub w ujęciu ogólniejszym,
dowolną grupę kwasową.
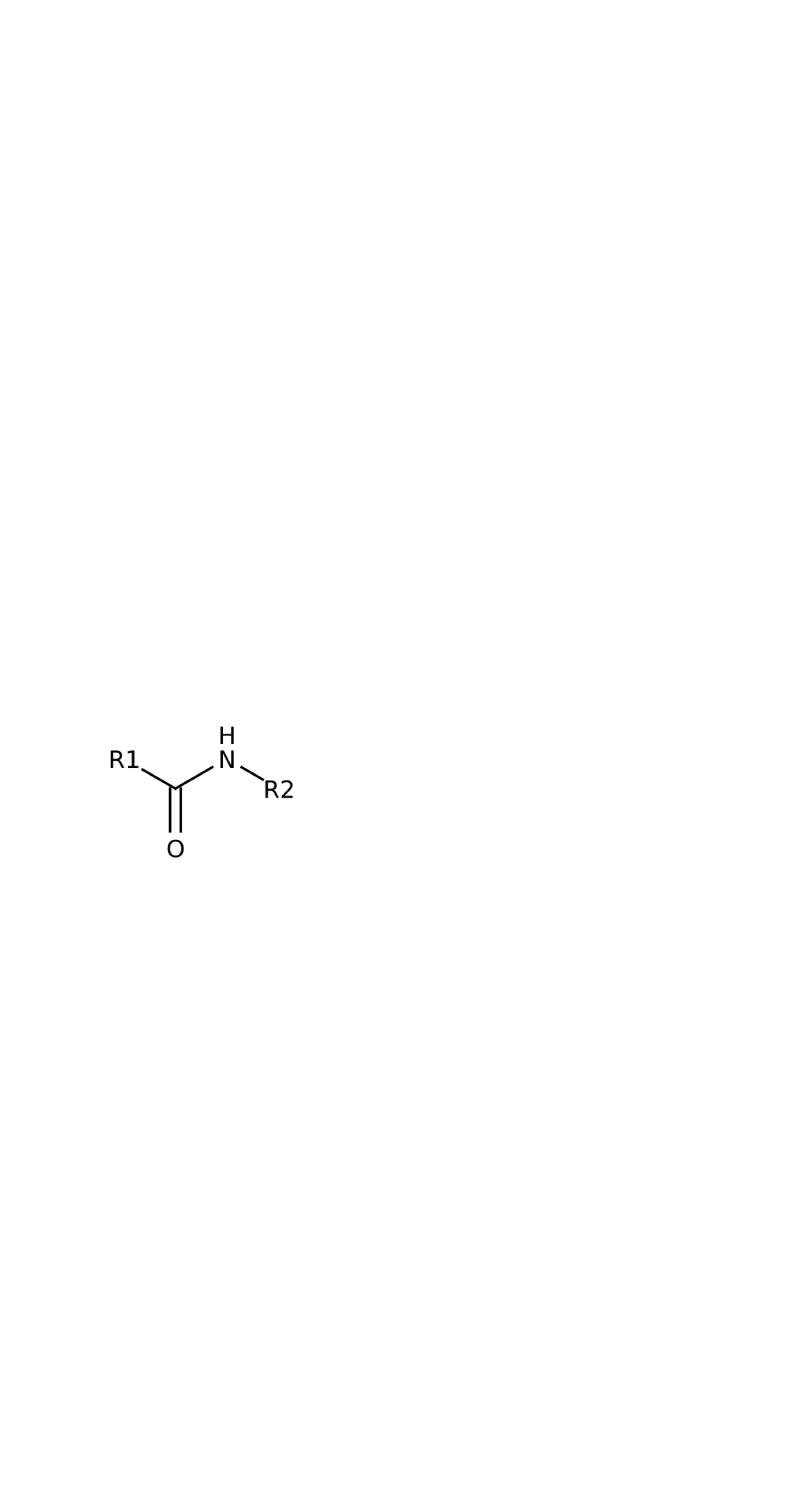
Wiązanie peptydowe - umowna nazwa wiązania
amidowego
występującego
między
aminokwasami
peptydów i białek. Wiązanie peptydowe łączy grupę
α aminową jednego aminokwasu z grupą α-karboksylową
‑
drugiego aminokwasu.
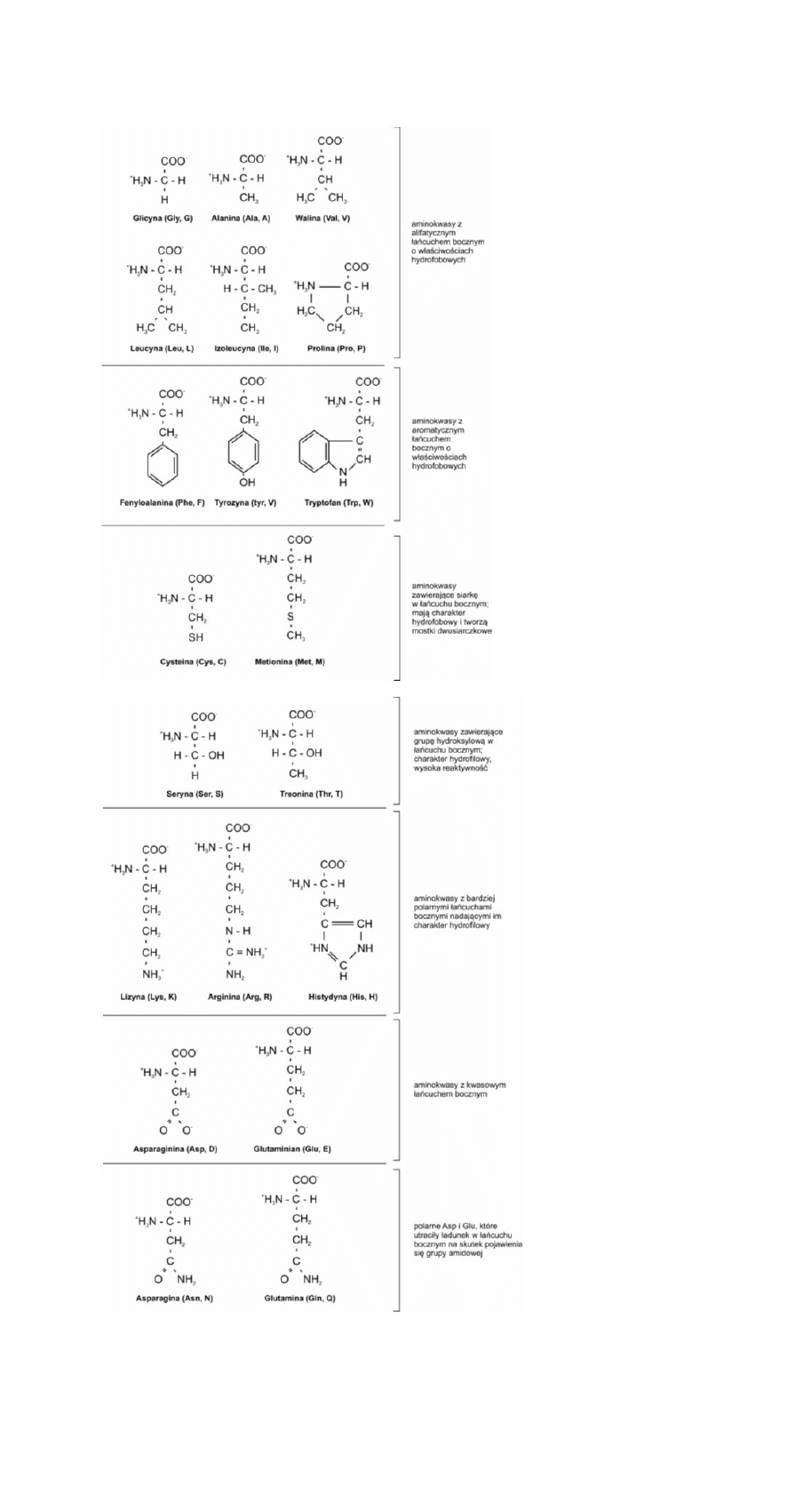
Grupa aminokwasów biogennych:

•
struktura białka - I, II, III i IV rzędowa - wiązania stabilizujące te struktury, rodzaj struktur i
ich charakterystyka
Pierwszorzędowa: sekwencja, czyli kolejność aminokwasów w łańcuchu białkowym. Struktura ta
jest najtrwalsza, gdyż dopiero działanie enzymów lub kwasów może spowodować hydrolizę
wiązania peptydowego. Sekwencja aminokwasów w łańcuchu białkowym jest zapisana w genie
kodującym dane białko.
Drugorzędowa: łańcuch białkowy w układzie helisy α lub arkusza β (β harmonijka). Struktura ta jest
stabilizowana wiązaniami wodorowymi.
Trzeciorzędowa: ułożenie łańcucha aminokwasowego w przestrzeni stabilizowane przez wiązania
wodorowe, disiarczkowe, estrowe, tioestrowe i jonowe (tzw.mostki solne).
Czwartorzędowa: asocjacja podjednostek białka o określonej strukturze trzeciorzędowej w większe
agregaty.

•
fałdowanie białek - uwarunkowania energetyczne, molekularne modele procesu
fałdowania, komórkowa maszyneria wspomagająca proces fałdowania
Fałdowanie białek jest procesem polegającym na postępującym stabilizowaniu stadiów pośrednich,
częściowo podobnych do stanu ostatecznej konformacji. Prawidłowa struktura przestrzenna jest zwykle
konieczna do pełnnienia roli fizjologicznej. Natywna forma białka (czyli forma najstabilniejsza, o
najmniejszej energii kinetycznej) jest konsekwencją wielu wzajemnie na siebie wpływających
oddziaływań. Główną rolę w procesie tworzenia się struktur II- i III-rzędowych odgrywają wiązania
hydrofobowe. Możliwości konformacyjne określa diagram Ramachandrana. II-rzędowe struktury
białkowe mają skonność do łączenia się w motywy strukturalne, pozwalające na stworzenie
funkcjonalnej domeny.
Białko w stanie rozwiniętym (zdenaturowanym) utrzymuje wiele niekowalencyjnych
oddziaływań z rozpuszczalnikiem. Kiedy fałduje się, zamienia wiele z tych oddziaływań na inne,
wewnątrzcząsteczkowe: hydrofobowe łańcuchy boczne mają tendencję do agregacji, a wiele
innych aminokwasów paruje się na zadzie tworzenia np. wiązań dwusiarczkowych. Energetyczne
oddziaływania wewnątrzcząsteczkowe są niewielkie, ale dzięki temu iż jest ich bardzo wiele ich
suma jest ogromna.
Z tych pobieżnych i uproszczonych wyliczeń wynika, iż musi istnieć jakiś "szlak", który
minimalizuje losowość tego procesu. Rozwinięte zostały teorie dotyczące trzech możliwych
dróg, po których białko zmierza "do celu". Uprościły one proces rozdzielając tworzenie struktur
drugo- i trzeciorzędowych i zlikwidowały konieczność równoczesnego ich zachodzenia, tzn.
dopuściły ich sekwencyjne powstawanie. Pierwsze dwa zakładają równoczesne powstawanie
lokalnych elementów natywnych struktur drugorzędowych. Elementy te mogą następnie
dyfundować do momentu spotkania się ich w odpowiednich konformacjach jak to się dzieje w
modelu dyfuzyjno-kolizyjnym (ang. diffusion-collision model) lub ich struktura może być niejako
"propagowana" na cały łańcuch (ang. nucleation model). Model nukleacyjny postuluje, iż
pewne sąsiadujące aminokwasy mogą spontanicznie tworzyć elementy struktur
drugorzędowych, które w późniejszych etapach będą tworzyć tzw. "jądra" lub "centra", od
których natywna struktura będzie się rozszerzać na cały łańcuch - trzeciorzędowa struktura
powstanie więc jako konsekwencja struktur drugorzędowych. Trzecim - odmiennym modelem
fałdowania jest tzw. model hydrofobowego kolapsu (ang. hydrophobic collapse model).
Postuluje on iż cząsteczka bardzo szybko "zapada się" dzięki oddziaływaniom hydrofobowych
łańcuchów bocznych tworząc półpłynną strukturę, która następnie musi ulec rearanżacji do
struktury natywnej. W tym modelu struktura drugorzędowa tworzy się dzięki oddziaływaniom
trzeciorzędowym.
Fałdowanie białek w komórce jest wspomagane katalitycznie na kilka sposobów.
–
disulfidoizomeraza białek (PDI) kilka tysięcy razy przyspiesza reakcję wymiany mostków
disiarczkowych
–
izomeraza peptydoprolilowa (PPIaza) znacznie przyspiesza izomeryzację wiązań
peptydowych X-Pro, które mogą być cis- lub trans- (pozostałe z reguły są w izomerii
trans)
–
tendencja do agregacji występuje w dużych stężeniach białek
–
chaperony – mają zdolność do rozpoznawania i wiązania białek "nie natywnych".
Wspomagają one fałdowanie poprzez: zapobieganie agregacji niesfałdowanych białek
oraz oddziaływanie z nimi, by dać im "jeszcze jedną szansę"
Polecana literatura:
Bregier C. i in., Białka opiekuńcze - „molekularne przyzwoitki” w fałdowaniu białek, 2007
3. Systemy heterologicznej ekspresji białek rekombinowanych
•
bakteryjny system pET - zasada funkcjonowania, zalety i ograniczenia, metodyka
eksperymentu, charakterystyka szczepów ekspresyjnych*, optymalizacja procesy
nadekspresjii
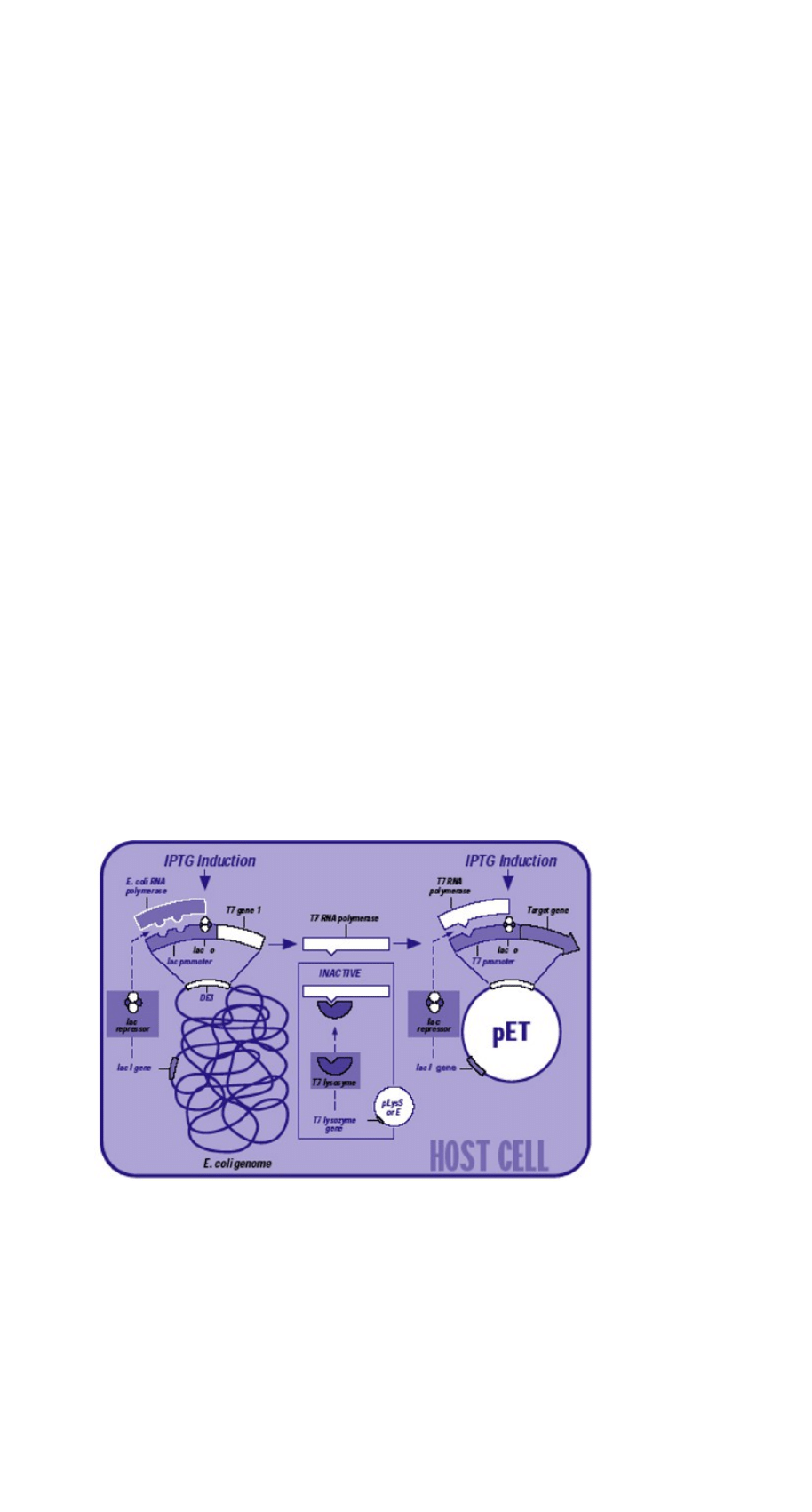
Bakteryjny system pET jest najczęściej wybieranym systemem do produkcji białek
rekombinantowych ze względu na
dobrze zbadaną genetykę
,
łatwą i tanią hodowlę
oraz
dużą
tolerancję dla produkcji obcych białek
, nawet w dużych ilościach. Wadą tego systemu jest
produkcja wielu białek tylko w postaci ciałek inkluzyjnych
oraz
niemożność otrzymywania
białek
wymagających modyfikacji potranslacyjnych
, co jest możliwe w innych systemach np.
system drożdżowy, komórki owadzie czy też ssacze.
W celu uzyskania ekspresji pożądanego białka, kompetentne komórki E. coli należy
stransformować plazmidem, w który uprzednio wklonowano odpowiedni gen. Gen ten musi być
kontrolowany przez odpowiedni promotor. Silnym promotorem najczęściej stosowanym w
plazmidach jest promotor T7 z bakteriofaga T7.
[pobrane z http://bioenergy.asu.edu/photosyn/courses/bio_343/lab/experiment-i.html]
[opis eksperymentu tamże]
Większość wektorów serii pET poza typowym ori replikacyjnym zawiera również sekwencję
origin replikacji faga f1 umożliwiającą uzyskanie jednoniciowej formy DNA tych plazmidów np. w
celu przeprowadzenia mutagenezy ukierunkowanej w obrębie ich sekwencji. Wyróżniamy trzy
podstawowe kryteria wyboru wektora ekspresyjnego:
–
ilość białka, którą chcemy wyprodukować:
„małe” ilości białka (techniki badania aktywności białek, badania oddziaływania uzyskanego
białka z wybranymi ligandami,uzyskiwanie przeciwciał przeciwko tym białkom)
„duże” ilości białka (uzyskanie stężonych lub wysoce aktywnych preparatów - badania
strukturalne, zastosowania przemysłowe)
–
Możliwość lub konieczność uzyskania białka w postaci fuzji z wybranymi domenami fuzyjnymi
mającemu na celu np.: ułatwienie procedury oczyszczania eksprymowanego białka, zwiększenie
rozpuszczalności uzyskanego białka w cytozolu E. coli, lub transport eksprymowanego białka do
przestrzeni periplazmatycznej E. coli
–
Strategia klonowania czyli wybór wektora pod względem miejsc restrykcyjnych obecnych w MCS
oraz pod względem wyboru jednej z trzech możliwych ramek odczytu
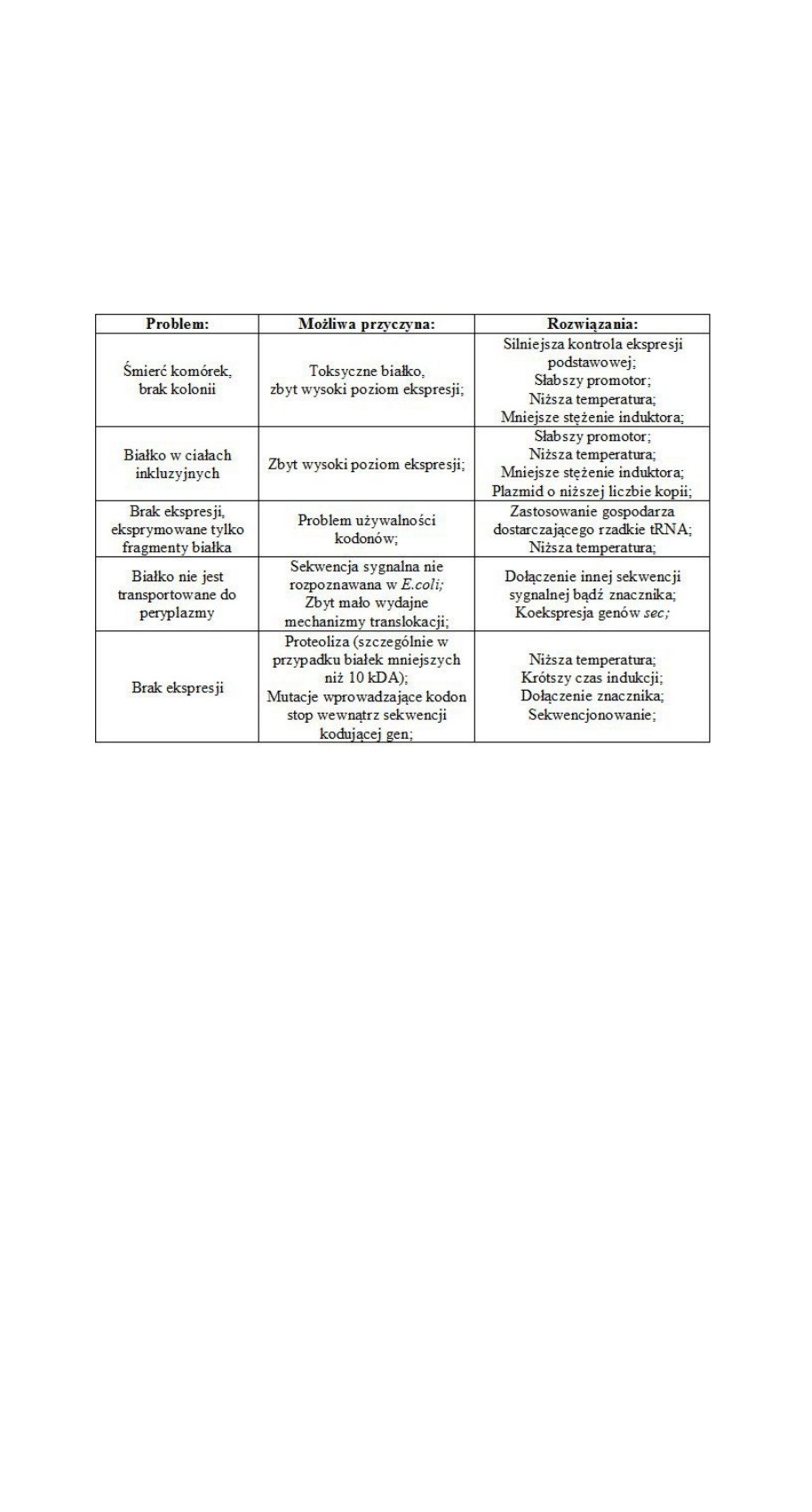
Problemy nadekspresji:
* Polecana publikacja pt. „Wybór systemu ekspresyjnego” [dostępna na stronie
http://www.pg.gda.pl/chem/pl/zamawiane/images/stories/Nowoczesne3_4.pdf]
•
drożdżowy układ Pichia pastoris - ogólna zasada funkcjonowania, selekcja oparta o
zjawisko auksotrofii, warunki hodowli i nadekspresjii białka, zalety i wady w stosunku do
układu pET.
Produkcję białek rekombinowanych w Pichia pastoris powinno prowadzić się w odpowiednich
bioreaktorach. Umożliwia to pełne wykorzystanie potencjału ekspresyjnego drożdży. Jest to
proces
kosztowny
, a drożdże mimo to są
mniej wydajne
i dodatkowo mogący ulec
kontaminacji
. Zaletami tego systemu ekspresyjnego jest zaś możliwość
modyfikacji
posttranslacyjnych
, możliwość
adresowania białek
, obecność
chaperonów
, czy lepsze
przystosowanie do produkcji genów eukariotycznych
.
Auksotrofy – organizmy żywe, pozbawione zdolności syntezy określonych, niezbędnych do ich
wzrostu, skomplikowanych związków organicznych, takich jak witaminy, zasady purynowe czy
aminokwasy. Organizm auksotroficzny musi pobierać ten związek z otoczenia, jako składnik
swojego pożywienia. Pichia pastoris nie potrafi syntetyzować histydyny. Indukcja następuje po
zmianie źródła węgla np. z glukozy na metanol. Pichia pastoris to bakterie metylotroficzne,
mające zdolność do wykorzystywania węgla zakumulowanego w tej postaci (posiadają geny
kodujące oksydazę alkoholową AOX1 i AOX2).
•
bakulowirusowy system oparty o komórki owadzie - ogólna zasada funkcjonowania
Bakulowirusy umożliwiają powielanie w komórkach owadzich. Główną zaletą jest możliwość modyfikacji
białek, jak w wyższych organizmach eukariotycznych. Promotory bakulowirusowe są nieaktywne w
komórkach ssaczych. Wysoki poziom ekspresji białek rekombinantowych z wektora bakulowirusowego w
postaci fuzji umożliwia detekcje i oczyszczanie tych białek. Opcjonalnie przy zastosowaniu wektorów
pBACgus, ułatwiają selekcję rekombinantowych komórek dzięki obecności genu gus kodującego enzym –
glukuronidazę. Białka oczyszczamy z zastosowaniem klasycznych technik takich jak, precypitacja
siarczanem amonu, chromatografia jonowymienna, chromatografia powinowactwa etc.
Polecana książka: King L. A., Possee R. D., The Baculovirus Expression System: A Laboratory
Guide, Springer, 1992

4.
Metody dezintegracji komórek po nadekspresji i frakcjonowania lizatu komórkowego -
•
wirowanie S-30 i S-100;
Wirowanie S-30: 12 tys. rpm, 10 min.
Wirowanie S-100: 80 tys. rpm, 30-45 min. (dodanie 1% trytonu)
•
frakcje białek rozpuszczalnych i nierozpuszczalnych
Dezintegat (wirowanie oczyszczające: 5 tys. rpm, 5 min. x3)
→ supernatant I
Supernatant I (wirowanie S-30)
→ supernatant II (białka rozpuszczalne) + osad I (białka
nierozpuszczalne – ciałka inkluzyjne)
Supernatant II (wirowanie S-100)
→ supernatant III (białka pozarybosomalne) + osad II (białka
rybosomalne)
5.
Chromatografia powinowactwa -
•
przykłady i charakterystyka etykiet białkowych;
Chromatografia powinowactwa jest jedną z odmian chromatografii cieczowej. W najszerszej definicji
chromatografia jest to technika separacji cząsteczek chemicznych (m.in. białek) wykorzystująca różnice w
oddziaływaniu poszczególnych składników mieszaniny ze złożem chromatograficznym. Oczyszczanie
białek poprzez chromatografię powinowactwa opiera się na zjawisku naturalnego powinowactwa
etykiety, jaka dołączona jest do białka rekombinowanego, do specyficznego liganda zimmobilizowanego
na złożu chromatograficznym.
Etykiety, domeny fuzyjne (ang. tag) umożliwiają ekspresję tego samego genu w postaci białek fuzyjnych
różniących się właściwościami wynikającymi z ich sekwencji. Domeny fuzyjne mogą składać się z kilku
reszt aminokwasowych np. 6 reszt aminokwasowych His-Tag lub mogą być to sekwencje reszt
aminokwasowych białek np. 495 reszt aa. białka NusA z Nus-Tag
•
różnice we właściwościach i zastosowaniu etykiety 6xHis i GST;
Etykieta histydynowa jest krótkim homopeptydem zbudowanym z 6 reszt histydynowych dołączonych
do C- lub N- końca białka rekombinowanego. Przyłączenie etykiety odbywa się na etapie konstrukcji
wektora ekspresyjnego, kiedy to do sekwencji DNA kodującej białko poddawane heterologicznej
ekspresji dołącza się fragment DNA kodujący 6 reszt histydyny.
Etykieta GST (transferaza S-glutationu) ma zdolność stymulacji prawidłowego fałdowania białka.
Podobnie jak poprzednik
elucja
zachodzi
w łagodnych warunkach
. W przeciwieństwie do 6xHis-tag
nie
wykazuje powinowactwa do jonów dwuwartościowych
(Ni, Cu, Zn).
Polecane artykuły: Porowińska D. i in., Prokariotyczne systemy ekspresyjne, 2013
Wawiórka L., Rybosomalne białka P Plasmodium falciparum jako potencjalny składnik szczepionki
przeciwko malarii [dostępne na stronie
http://www.rsi2004.lubelskie.pl/doc/sty6/opis/Wawiorka_opis.pdf]

•
oczyszczanie w warunkach natywnych vs oczyszczanie w warunkach denaturujących
Procedura oczyszczania w warunkach natywnych:
Literatura:
1. Treści omawiane w trakcie poszczególnych zajęć
2. „Genomy” Browna
3. „Krótkie wykłady z biologii molekularnej”
4. „ Cytobiochemia” prof. Leokadia Kłyszejko-Stefanowicz
[opracowanie internetowe]
Wykonał Jakub Knurek
Wyszukiwarka
Podobne podstrony:
Socjologia mikrostruktury społeczne opracowane zagadnienia egzaminacyjne II semestr, pliki zamawiane
Opracowane zagadnienia techniki
temp krytyczna, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane, za
opracowane zagadnienia na dyplomację opcja II
ZAGADNIENIA NA EGZAMIN Z MECHANIKI TECHNICZNEJ II DLA SEMESTRU III, sem III, +Mechanika Techniczna I
Postęp techniczny i jego typy w XIX i XX wieku, Opracowane zagadnienia
Gospodarka krajów socjalistycznych po II wojnie światowej, Opracowane zagadnienia
Opracowane Zagadnienia z Dydaktyki Języka Polskiego, 19 POJECIA.strategia, metoda, technika nauczani
MECHANIKA TECHNICZNA II - ZAGADNIENIA NA EGZAMIN, +Mechanika Techniczna II - Wykład.Ćwiczenia.Labora
Pracownia Paliw Stałych - KOLOKWIUM1, Energetyka AGH, semestr 4, IV Semestr, Technika Cieplna, LAB
Poetyka zagadnienia na II kolokwium (inne opracowanie)
II cykl Kondratiewa 1850, Opracowane zagadnienia
Zjawisko dopplera, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane,
Opracowane zagadnienia pedagogika ogólna, studia, II stopień Pedagogika wspierająca z profilaktyką n
opracowane zagadnienia, Studia, studia mgr I semestr, I sem, 1 semestr II stopien, brylska
ZAGADNIENIA i opracowanie, pedagogika UAM II SUM, Antropologia kulturowa
więcej podobnych podstron