
CHEM:Analiza wody
1
CHEM:Analiza wody
Wstęp
Twardość wody
Analiza wody obejmuje źródła naturalne (rzeki, jeziora, studnie), wodę z sieci wodociągowej oraz wodę
przeznaczona do różnych potrzeb przemysłowych. W zależności od przeznaczenia woda musi spełniać określone
wymagania. Woda używana do celów spożywczych, a także w przemyśle farmaceutycznym i kosmetycznym musi
spełniać określone wymagania sanitarno-epidemiologiczne oraz posiadać odpowiednie walory smakowe. Powinna
być bezbarwna, klarowna, bezwonna, bez nadmiaru związków żelaza, magnezu, wapnia i manganu, wolna od
związków organicznych oraz bakterii chorobotwórczych. Woda do picia powinna zawierać minimalne ilości
mikroelementów niezbędnych dla organizmu ludzkiego, takich jak jod czy fluor. W wodach przemysłowych istotne
znaczenie ma twardość wody, zawartość glinu, siarczanów, krzemionki i innych substancji mineralnych
powodujących tworzenie się kamienia kotłowego lub korozję.
Pełna analiza wody obejmuje badania jakościowe (barwa, zapach, smak, przezroczystość) oraz ilościowe (pH,
twardość węglanowa i ogólna, utlenialność, zawartość kationów i anionów). Twardość wody podaje się w stopniach
twardości a wyniki oznaczeń kationów i anionów w milimolach/dm
3
lub mg/dm
3
.
Twardość wody jest wynikiem rozpuszczonych w niej soli wapnia, magnezu oraz innych metali. Składają się one na
tzw. twardość całkowitą (lub ogólną). Wapń i magnez występujące w wodzie w postaci wodorowęglanów tworzą
tzw. twardość węglanową, która stanowi część twardości całkowitej. Twardość niewęglanową tworzą chlorki,
siarczany oraz azotany wapnia i magnezu.
Twardość węglanowa nazywana jest twardością przemijającą, ponieważ w czasie gotowania wody następuje rozkład
wodorowęglanów i strącanie osadów trudno rozpuszczalnych węglanów:
Ca(HCO
3
)
2
→ CaCO
3
↓ + CO
2
↑ + H
2
O
Mg(HCO
3
)
2
→ MgCO
3
↓ + CO
2
↑ + H
2
O
Najprostszy sposób usuwania twardości wody polega na jej gotowaniu. Chemiczne „zmiękczanie” polega na
strącaniu wapnia w postaci węglanu lub fosforanu, a magnezu w postaci wodorotlenku lub fosforanu.
Najskuteczniejszą metodą usuwania twardości wody jest jej dejonizacja na wymieniaczach jonowych (kationicie i
anionicie). Metoda ta jest szeroko stosowana na skalę przemysłową. W warunkach laboratoryjnych twardość wody
można także usunąć przeprowadzając wapń i magnez w rozpuszczalne, trwałe kompleksy (np. z EDTA).
Skala stopni twardości wód.
Stopień twardości wody określa się na
podstawie zawartości CaO lub MgO.
Jednemu stopniowi twardości wody
odpowiada 0,1783 milimola tlenku
wapnia lub magnezu. Twardość wód
naturalnych na ogół nie przekracza 20
stopni. Twardość węglanowa jest
zazwyczaj większa niż twardość
niewęglanowa.

CHEM:Analiza wody
2
Oznaczanie twardości wody
Twardość węglanową oznacza się najczęściej metodą miareczkowania alkacymetrycznego wobec oranżu
metylowego jako wskaźnika zmiany pH. Miareczkowanie próbki wody za pomocą HCl wobec oranżu do momentu
zmiany jego zabarwienia (z pomarańczowej na żółtą) odpowiada zawartości jonów wodorowęglanowych:
Me(HCO
3
)
2
+ HCl → MeCl
2
+ 2CO
2
↑ + H
2
O
(Me oznacza jon wapnia lub magnezu). Oznaczenie zawartości wodorowęglanów w wodzie pozwala na określenie
stopnia twardości węglanowej.
Twardość całkowitą wody oznacza się przy pomocy miareczkowania kompleksometrycznego roztworem EDTA
wobec czerni eriochromowej T jako wskaźnika. W celu uzyskania wyraźnego punktu końcowego przed
miareczkowaniem należy usunąć z roztworu węglany przez zagotowanie próbki.
Oznaczanie utlenialności
Utlenialnością wody nazywa się zdolność do redukowania jonów MnO
4
¯ przez obecne w wodzie substancje
organiczne. Niektóre jony nieorganiczne (Fe
2+
czy NO
2
¯) są także utleniane przez nadmanganian. Wyniki
oznaczenia zależą od sposobu przeprowadzenia reakcji. Badaną próbkę wody ogrzewa się ze znaną ilością
mianowanego roztworu KMnO
4
w środowisku kwaśnym. Część jonów MnO
4
¯ zostaje zredukowana przez obecne w
roztworze związki ulegające utlenieniu. Pozostały nadmiar nadmanganianu odmiareczkowuje się za pomocą
szczawianu sodowego. Metoda oznaczania utlenialności pozwala określić sumaryczną zawartość związków
organicznych, natomiast ich identyfikacja wymaga dodatkowych analiz.
Oznaczanie jonów metali
Zawartość jonów metali w wodzie jest na ogół bardzo mała, nie przekraczająca kilku miligramów w dm
3
. Z tego
względu najczęściej wykorzystuje się ich do oznaczania metody spektrofotometryczne oparte na pomiarze natężenia
promieniowania po jego przejściu przez próbkę roztworu zawierającego badany związek. W analizie nieorganicznej
znajduje zastosowanie spektrofotometria UV/VIS, w zakresie bliskiego nadfioletu i promieniowania widzialnego
(200-700 nm). Wielkością mierzoną w metodzie spektrofotometrycznej jest absorbancja (A) proporcjonalna do
liczby cząsteczek absorbujących promieniowanie, wyrażona za pomocą iloczynu grubości warstwy roztworu (l) oraz
jego stężenia (c). Zależność pomiędzy promieniowaniem padającym na próbkę, promieniowaniem przechodzącym
przez próbkę oraz stężeniem roztworu i grubością warstwy, określa prawo Lamberta-Beera:
gdzie jest natężeniem promieniowania padającego na próbkę, I — natężeniem promieniowania po przejściu
przez próbkę, c — stężeniem molowym badanego związku, l — grubością warstwy roztworu, ε — molowym
współczynnikiem absorpcji.
Prawo Lamberta-Beera jest podstawą ilościowych oznaczeń wykonywanych metodą spektroskopii absorpcyjnej w
nadfiolecie i zakresie widzialnym. Grubość warstwy jest w pomiarach stała (wynosi zazwyczaj 10 mm) a molowy
współczynnik absorpcji jest wielkością charakterystyczną dla danej substancji (dla wielu substancji wartość ε można
znaleźć w odpowiednich tablicach). Jeśli układ spełnia prawo Lamberta-Beera, to wykres zależności
jest
linią prostą. W praktyce analitycznej wystarczy, aby roztwór spełniał tę zależność dla stężeń odpowiadających
wartościom absorbancji nie większym niż 1. Odchylenia od prawa Lamberta-Beera są wynikiem reakcji
chemicznych zachodzących w badanych roztworach o różnych stężeniach (np. dysocjacja kompleksów w miarę
rozcieńczania roztworów) lub też efektem nieodpowiednio ustawionych parametrów pomiarowych (niedostateczna
monochromatyzacja promieniowania, nieodpowiednia szerokość wiązki spektralnej).
CHEM:Analiza wody
3
Najczęściej stosowaną techniką wykonywania oznaczeń spektrofotometrycznych jest metoda krzywej wzorcowej.
Polega ona na ustaleniu zależności między stężeniem oznaczanej substancji i wartością absorbancji wyznaczoną
spektrofotometrycznie. Z krzywej wzorcowej odczytuje się wartość stężenia badanej substancji.
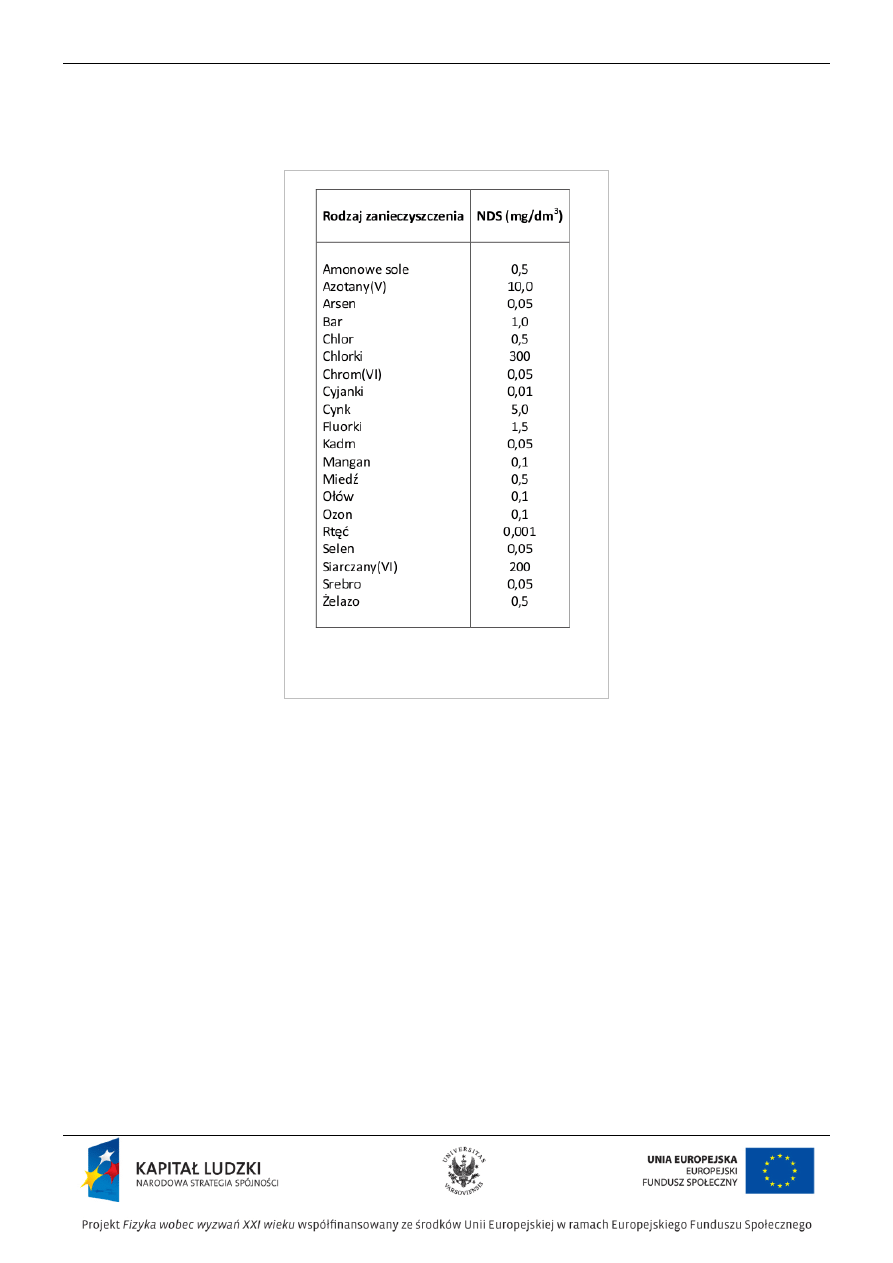
Najwyższe dopuszczalne stężenia (NDS) głównych
nieorganicznych zanieczyszczeń w wodzie pitnej
Część doświadczalna
Cel ćwiczenia
• Ilościowe oznaczanie twardości węglanowej wody przy pomocy miareczkowania alkacymetrycznego.
• Oznaczanie jonów żelaza w postaci kompleksu rodankowego metodą spektrofotometryczną.
Zagadnienia do przygotowania
• Rodzaje twardości wody.
• Metody oznaczania i usuwania twardości wody.
• Stopień twardości wody.
• Miareczkowanie alkacymetryczne.
• Prawo Lamberta-Beera.
• Spektrofotometryczne oznaczanie kompleksów metali.
• Metoda krzywej wzorcowej.

CHEM:Analiza wody
4
Odczynniki
• Woda zawierająca jony Fe3+ oraz wodorowęglany Ca
2+
i Mg
2+
(np. woda z kranu).
• 0.2 M roztwór HCl i H
2
SO
4
, oranż metylowy, 0,1 M roztwór żelaza(III) , roztwór KSCN.
Wykonanie ćwiczenia
• Oznaczyć twardość węglanową próbki wody metodą miareczkowania alkacymetrycznego. W tym celu odmierzyć
100 ml wody do kolby stożkowej o pojemności 250 ml, dodać 2-3 krople 0,1% oranżu metylowego i
miareczkować 0,2 M roztworem HCl do momentu zmiany barwy wskaźnika z żółtej na pomarańczową.
Zawartość wodorowęglanów w roztworze (w gramach) obliczyć ze wzoru:
gdzie v oznacza objętość roztworu HCl zużytą na miareczkowanie,
— stężenie roztworu HCl,
—
masę molową wodorowęglanu (61 g/mol).
• Napisać w formie jonowej reakcję zachodzącą podczas miareczkowania wodorowęglanów.
• Wykonać oznaczenie żelaza(III) metodą spektrofotometryczną, wykorzystując krzywą wzorcową. W tym celu
należy przygotować 5 roztworów wzorcowych żelaza(III) (objętość każdej próbki 10 ml) o różnych stężeniach, w
zakresie
, poprzez rozcieńczenie roztworu podstawowego o stężeniu 0.1 mol/dm
3
.
Rozcieńczenia wykonać przy pomocy 0,01 molowego roztworu H
2
SO
4
. Do każdego roztworu wzorcowego dodać
1 ml roztworu KSCN i wykonać pomiar absorbancji utworzonego kompleksu rodanowego przy długości fali 480
nm.
• Na podstawie pomiarów spektrofotometrycznych wykonać krzywą wzorcową do oznaczania żelaza(III) w postaci
kompleksu rodanowego.
• Przygotować próbkę 10 ml wody zawierającą jony żelaza w 0.01 molowym H
2
SO4, dodać 1 ml KSCN i wykonać
pomiar spektrofotometryczny (odczytać absorbancję w 480 nm).
• Na podstawie krzywej wzorcowej oraz wartości absorbancji badanego roztworu określić ilość zawartego w nim
żelaza.
Literatura
J. Minczewski, Z. Marczenko, „Chemia analityczna”, Wydawnictwo Naukowe PWN

Źródła i autorzy artykułu
5
Źródła i autorzy artykułu
CHEM:Analiza wody Źródło: https://brain.fuw.edu.pl/edu-wiki/index.php5?oldid=13784 Autorzy: Asia
Źródła, licencje i autorzy grafik
Plik:Skala stopni twardości wód.png Źródło: https://brain.fuw.edu.pl/edu-wiki/index.php5?title=Plik:Skala_stopni_twardości_wód.png Licencja: nieznany Autorzy: -
Plik:nds_w_wodzie_pitnej.png Źródło: https://brain.fuw.edu.pl/edu-wiki/index.php5?title=Plik:Nds_w_wodzie_pitnej.png Licencja: nieznany Autorzy: -
Licencja
Attribution-Share Alike 3.0 PL
http:/
Document Outline
Wyszukiwarka
Podobne podstrony:
analiza wody, technologia wody i sciekow Jachimko
analiza wody sprawozdanie chemia analityczna analiza wody teoria
analiza wody
laborki, ANALIZA WODY
Ćwiczenie 4 Analiza Wody
2 Analiza?kteriologiczna wody do?lów sanitarnych 2
Cwiczenie nr 14 Woda w przemysle Analiza wody zarobowej
analiza wody sprawozdanie chemia analityczna SPRAWOZDANIE Analiza wody część 1
kompleksowa analiza wody
GIge zal 11 Analiza wody
Analiza Wody Sprawozdanie
Analiza Wody Sprawozdanie (1)
Spr 1 - analiza wody, Sprawozdania, oczyszczanie wody
Analiza wody do picia
Analiza wody-hydro, Uczelnia - Politechnika Slaska, Hydrologia
Superfosfat, ANALIZA WODY, CZĘŚĆ III
WartoŠ opa-owa, ANALIZA WODY, CZĘŚĆ III
analiza wody sprawozdanie chemia analityczna SPRAWOZDANIE Analiza wody
awiś1, OŚ, sem 6 SOWiG, Analiza Wody i Ścieków
więcej podobnych podstron