
186
Pediatria Współczesna. Gastroenterologia, Hepatologia i Żywienie Dziecka 2010, 12, 4, 186-190
ISSN 1507-5532
Copyright © 2010 Almamedia Press
Pra ce ory gi nal ne
(Ori gi nal articles)
Czy możliwe jest wyleczenie z celiakii? Badania wstępne
Is there a possibility to recover from coeliac disease? Preliminary report
Anna Szaflarska-Popławska
Katedra i Klinika Pediatrii, Alergologii i Gastroenterologii Collegium Medicum im. Ludwika Rydygiera w Bydgoszczy, Uniwersytetu Mikołaja
Kopernika w Toruniu
ADRES DO KORESPONDENCJI:
dr hab. n. med. Anna Szaflarska-Popławska
Katedra i Klinika Pediatrii, Alergologii i Gastroenterologii
Collegium Medicum im. L. Rydygiera w Bydgoszczy
Uniwersytet Mikołaja Kopernika w Toruniu
ul. Marii Skłodowskiej-Curie 9; 85-094 Bydgoszcz
tel. (52) 585 48 50, faks. (52) 585 40 86; e-mail: klped@cm.umk.pl
STRESZCZENIE
Wprowadzenie: Do tej pory u pacjentów z histopatologicznie potwierdzoną celiakią zalecano stosowanie ścisłej diety bezglutenowej do końca życia.
W ostatnio opublikowanych badaniach sugeruje się możliwość utrzymywania się remisji histologicznej u około 20% pacjentów, u których pomimo ponow-
nego wprowadzenia glutenu do diety na okres ponad 2 lat nie wystąpiły objawy kliniczne.
Cel pracy: Kliniczna, serologiczna i histologiczna ocena pacjentów z celiakią rozpoznaną w dzieciństwie w trakcie prowokacji glutenem.
Materiał i metodyka: Do prospektywnej analizy zakwalifikowano 11 dorosłych pacjentów, w tym 7 kobiet i 4 mężczyzn w wieku od 19 do 28 lat (średnia
wieku 22,6 roku) z celiakią rozpoznaną w okresie wczesnego dzieciństwa (między 10 mies.ż. a 6 rokiem życia, średnio w 19,7 mies.ż.), u których po wielolet-
nim stosowaniu ścisłej diety bezglutenowej (od 12 do 25 lat, średnio 18,4 roku) wykonano test prowokacji glutenem. Test prowokacji glutenem rozpoczę-
to pomiędzy 18 a 26 rokiem życia. W czasie prowokacji pacjentów monitorowano klinicznie, serologicznie (badanie przeciwciał antyendomyzjalnych EmA
metodą immunofluorescencji pośredniej co 6 tygodni-6 miesięcy) oraz histopatologicznie. Biopsję jelita cienkiego wykonywano z chwilą pojawienia się
dodatnich testów serologicznych. Oceny histopatologicznej endoskopowo pobranych bioptatów błony śluzowej jelita cienkiego dokonywano przy użyciu
zmodyfikowanej klasyfikacji Marsha.
Wyniki: U 7 pacjentów w trakcie prowokacji glutenem nie obserwowano żadnych objawów klinicznych. U pozostałych 4 pacjentów bezpośrednio po
wprowadzeniu glutenu do diety (u 2) lub po kilku tygodniach-miesiącach wystąpiły okresowe silne bóle brzucha, nawracająca biegunka oraz spadek
masy ciała. U jednego pacjenta z opryszczkowatym zapaleniem skóry rozpoznanym w 6 r.ż. w trakcie prowokacji glutenem ponownie pojawiły się
typowe zmiany skórne. U wszystkich pacjentów w czasie prowokacji glutenem pojawiły się EmA: najczęściej w ciągu pierwszych 3-6 miesięcy obser-
wacji (u 6), po 6-12 miesiącach prowokacji (u 3) lub później (u 2). U 9 pacjentów w trakcie prowokacji glutenem stwierdzono obecność typowych dla
celiakii zmian mikroskopowych w błonie śluzowej jelita cienkiego: typu M3c (u 4), M3b (u 3) lub M3a (u 2). W jednym przypadku biopsję jelita cienkie-
go wykonywano dwukrotnie – w 4. miesiącu (zmiany typu M0) i w 19. miesiącu prowokacji glutenem (M3c). W dwóch przypadkach nie stwierdzono
zmian histopatologicznych (w jednym przypadku – w dwukrotnie wykonanym badaniu po 4 i 10 miesiącach tpg, w jednym przypadku – po 10 mie-
siącach tpg).
Wnioski: U dorosłych pacjentów z celiakią rozpoznaną we wczesnym dzieciństwie w trakcie prowokacji glutenem dochodzi do ponownego pojawienia się
dodatnich testów serologicznych oraz u większości – zmian mikroskopowych w błonie śluzowej jelita cienkiego. Prowokacja glutenem u większości pacjen-
tów przebiega bezobjawowo. Obserwacja ta wymaga potwierdzenia na większej grupie pacjentów.
Słowa kluczowe: celiaklia, dzieci, tolerancja glutenu
ABSTRACT
Introduction: According to ESPGHAN criteria, histologically confirmed coeliac disease requires a life-long gluten-free diet. Recently published
results indicate that in about 20% of patients who remained symptom free after gluten reintroduction for at least 2 years no histological relapse
occurred.
Aim of the study: Clinical, serological and histological analysis of patients with coeliac disease diagnosed in childhood after gluten challenge.
Material and methods: 11 adult patients, including 7 females and 4 males aged from 19 to 28 years (mean age 22.6 years) with coeliac disease diagnosed
in childhood (range from 10 month of age to 6 year of age, mean 19.7 months) after gluten challenge were prospectively studied. Gluten was reintroduced
to the diet between 18 and 26 year of age. During gluten challenge patients were followed-up clinically, serologically (detection of serum IgA antiendo-
mysial antibodies by indirect immunofluorescence every 6 weeks to 6 months) and histologically. Duodenal biopsies obtained during upper endoscopy
were assessed according to modified Marsh classification.
Results: Seven of the 11 patients during gluten challenge were asymptomatic. In 4 patients shortly after gluten reintroduction (in 2) or on a normal diet for
at least a few months recurrent abdominal pain, diarrhoea or weight loss occurred. In one patient with dermatitis herpetiformis diagnosed in age of 6 years
after gluten challenge typical skin changes were observed.
In all 11 patients during gluten reintroduction serum autoantibodies were found: in 6 of patients during the first 3-6 months of follow-up, in 3 of patients
during 6-12 months of follow-up and in 2 of patients after 12 months of gluten reintroduction. In 9 of patients typical histological changes in duodenal
biopsies were confirmed: 4 had total atrophy (M3c), 3 had subtotal atrophy (M3b), while 2 had partial atrophy (M3a). In one case duodenal biopsy was
obtained twice: after 4 months of gluten challenge (M0) and after 19 months of gluten challenge (M3c). Two patients had a normal mucosal architecture (in
1 case – duodenal biopsy was obtained twice – after 4 and 10 months of gluten challenge, in 1 case – after 10 months of gluten challenge).
Conclusions: Adult patients with coeliac disease diagnosed in childhood after gluten reintroduction relapsed serologically and the majority of them – his-
tologically. The majority of them remained symptom free after resuming a normal diet.
Key words: coeliac disease, children, gluten tolerance

187
Szaflarska-Popławska A.
Czy możliwe jest wyleczenie z celiakii? Badania wstępne
Pediatr. Współcz. Gastroenterol. Hepatol. Żywienie Dziecka 2010, 12, 4, 186-190
Wprowadzenie
Celiakia jest przewlekłą chorobą zapalną jelita cien-
kiego, występującą u osób predysponowanych genetycz-
nie pod wpływem bogatych w prolinę i glutaminę białek,
zawartych w pszenicy, życie i jęczmieniu (1). Opierając się
na wynikach badań populacyjnych prowadzonych w wielu
krajach europejskich i Stanach Zjednoczonych, częstość
występowania choroby wynosi 1:80 do 1:300 dzieci (2).
Typowo celiakia manifestuje się przewlekłą biegunką, bóla-
mi brzucha, spadkiem masy ciała oraz niedokrwistością.
Częstsza obecnie nietypowa postać choroby – rozpozna-
wana u starszych dzieci, dorosłych, a nawet osób w pode-
szłym wieku – objawia się najczęściej objawami spoza
przewodu pokarmowego, np. bólami stawowymi, polineu-
ropatią, aftowym zapaleniem jamy ustnej czy samoistnymi
poronieniami (3).
Zgodnie z obecnie obowiązującymi zaleceniami Euro-
pejskiego Towarzystwa Gastroenterologii i Żywienia Dzie-
ci ESPGAN rozpoznanie celiakii wymaga ścisłego przestrze-
gania diety bezglutenowej do końca życia (4). Stosowanie
diety bezglutenowej istotnie poprawia jakość życia cho-
rych na celiakię, zapobiega występowaniu zaburzeń meta-
bolicznych (niedobory mikro- i makroelementów, osteopo-
roza), zmniejsza ryzyko rozwoju powikłań autoimmuno-
logicznych i rozwoju nowotworów (5, 6). Po całkowitym
wyeliminowaniu z diety produktów z zawartością glute-
nu poprawę stanu klinicznego uzyskuje się najczęściej po
upływie kilku tygodni. Normalizacja obrazu histologiczne-
go błony śluzowej jelita cienkiego następuje później, nie-
rzadko dopiero po kilku-kilkunastu miesiącach i nie doty-
czy wszystkich pacjentów (7 ,8).
Ścisłe przestrzeganie diety bezglutenowej jest trudne,
zwłaszcza w okresie dojrzewania, z powodu często wystę-
pującego w tym wieku buntu przeciwko narzucanym ogra-
niczeniom i chęci dostosowania się do wzorców panują-
cych w grupie rówieśniczej. Według statystyk tylko 56-83%
nastolatków i 17-45% chorych dorosłych ściśle przestrze-
ga diety bezglutenowej. Przestrzeganie diety bezglute-
nowej jest lepsze w grupie pacjentów z klasyczną posta-
cią choroby, rozpoznaną we wczesnym dzieciństwie, ani-
żeli w grupie chorych wykrytych w toku badań przesiewo-
wych, wśród których tylko co czwarty pacjent ściśle prze-
strzega zaleceń dietetycznych (9).
W latach 90. XX wieku opublikowane zostały pojedyn-
cze prace podważające zasadność stosowania ścisłej diety
bezglutenowej przez całe życie u wszystkich pacjentów
z celiakią. Wskazywały one na możliwość występowania
znaczącego odsetka pacjentów z celiakią, u których wpro-
wadzenie diety zawierającej gluten nie powoduje nawrotu
objawów klinicznych ani zmian histopatologicznych w bło-
nie śluzowej jelita cienkiego (10, 11). Dyskusja na ten temat
ożyła ponownie po opublikowaniu w 2007 roku wyników
badań Matysiak-Budnik i wsp. (12), na podstawie których
odsetek pacjentów bez zmian mikroskopowych w obrę-
bie jelita cienkiego w grupie bezobjawowych osób z celia-
kią rozpoznaną we wczesnym dzieciństwie, pozostających
przez ponad 2 lata na zwykłej diecie, oszacowano na około
20%.
Cel pracy
Celem pracy była kliniczna, serologiczna i histologiczna
ocena pacjentów z celiakią rozpoznaną we wczesnym dzie-
ciństwie w trakcie prowokacji glutenem.
Materiał i metodyka
Do prospektywnej analizy zakwalifikowano 11 doro-
słych pacjentów z celiakią rozpoznaną w okresie wczesne-
go dzieciństwa, u których po wieloletnim stosowaniu ści-
słej diety bezglutenowej wykonano test prowokacji glute-
nem. Grupę stanowiło 7 kobiet i 4 mężczyzn w wieku od
19 do 28 lat (średnia wieku 22,6 roku) z celiakią rozpozna-
ną pomiędzy 10. miesiącem życia a 6. rokiem życia (średnio
w 19,7 mies. życia). Czas stosowania ścisłej diety bezglute-
nowej wynosił od 12 do 25 lat (średnio 18,4 roku). Test pro-
wokacji glutenem rozpoczęto pomiędzy 18. a 26. rokiem
życia. Czas prowokacji glutenem wyniósł od 4 miesięcy do
3 lat.
W czasie prowokacji glutenem co 3 miesiące pacjentów
monitorowano klinicznie oraz serologicznie. Biopsję jeli-
ta cienkiego wykonywano z chwilą pojawienia się dodat-
nich testów serologicznych. Ocena serologiczna polega-
ła na badaniu przeciwciał antyendomyzjalnych w klasie
IgA metodą immunofluorescencji pośredniej (u wszystkich
pacjentów poziom surowiczych przeciwciał IgA był prawi-
dłowy). Oceny histopatologicznej endoskopowo pobra-
nych bioptatów błony śluzowej jelita cienkiego dokonywa-
no przy użyciu zmodyfikowanej klasyfikacji Marsha. W każ-
dym przypadku pobierano co najmniej 3 bioptaty z róż-
nych miejsc części zstępującej dwunastnicy.
Wyniki
Analiza kliniczna: U 7 pacjentów w trakcie prowoka-
cji glutenem nie obserwowano żadnych objawów klinicz-
nych. U pozostałych 4 pacjentów bezpośrednio po wpro-
wadzeniu glutenu do diety (u 2) lub po kilku tygodniach
bądź miesiącach wystąpiły okresowe silne bóle brzucha,
nawracająca biegunka oraz spadek masy ciała. U 1 pacjen-
ta z opryszczkowatym zapaleniem skóry rozpoznanym w 6.
roku życia w trakcie prowokacji glutenem ponownie poja-
wiły się typowe zmiany skórne.
Analiza serologiczna: U wszystkich pacjentów w cza-
sie prowokacji glutenem pojawiły się surowicze przeciwcia-
ła antyendomyzjalne; najczęściej w ciągu pierwszych 3-6
miesięcy obserwacji (u sześcioro), po 6-12 miesiącach pro-
wokacji (u trojga) lub później (u 2).
Analiza histopatologiczna: U 9 pacjentów w trak-
cie prowokacji glutenem stwierdzono obecność typowych
dla celiakii zmian mikroskopowych w błonie śluzowej jelita
cienkiego: typu M3c (u 4), M3b (u 3) lub M3a (u 2). W jed-
nym przypadku biopsję jelita cienkiego wykonywano dwu-
krotnie – w 4. miesiącu (zmiany typu M0) i w 19. miesiącu
prowokacji glutenem (M3c).
W dwóch przypadkach nie stwierdzono zmian histopa-
tologicznych (w jednym przypadku – w dwukrotnie wyko-
nanym badaniu po 4 i 10 miesiącach tpg, w jednym przy-
padku – po 10 miesiącach tpg).
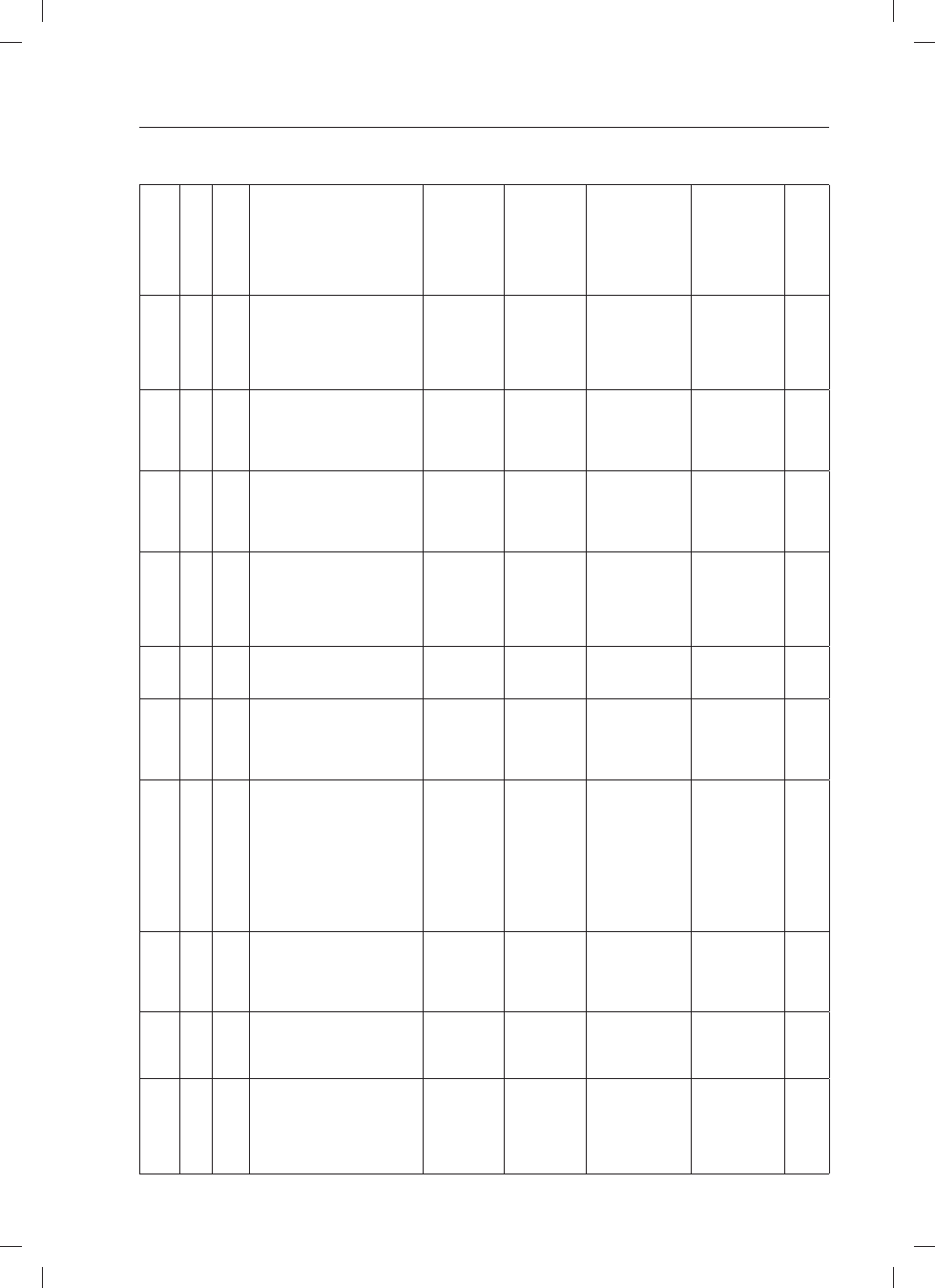
Charakterystykę pacjentów z celiakią rozpoznaną we
wczesnym dzieciństwie w trakcie prowokacji glutenem
przedstawiono w tabeli I.
Omówienie
W badaniach własnych podjęto próbę oceny klinicz-
nej, serologicznej i histopatologicznej dorosłych pacjen-
tów z celiakią, u których po długim okresie stosowania ści-
słej diety bezglutenowej przeprowadzono prowokację glu-
tenem. W grupie 11 dorosłych pacjentów z celiakią rozpo-
znaną we wczesnym dzieciństwie u 9 po okresie prowoka-
188
Pediatr. Współcz. Gastroenterol. Hepatol. Żywienie Dziecka 2010, 12, 4, 186-190
Szaflarska-Popławska A.
Is there a possibility to recover from coeliac disease?
TABELA I:
Charakterystyka pacjentów z celiakią rozpoznaną we wczesnym dzieciństwie, u których po okresie stosowania ścisłej diety bezglutenowej wprowadzo-
no gluten do diety
TABLE I:
History of patients with coeliac disease diagnosed in childhood after gluten reintroduction
Inicjały
Initials
Płeć
Sex
Wiek
(lata)
Age
(Years)
Czas rozpoznania i postać celiakii
Time of diagnosis and form of the disease
Czas stosowania
diety bez-
glutenowej (lata)
History of gluten-
free diet
(years)
Czas stosowania
diety ogólnej
History of gluten-
containing diet
Objawy kliniczne
podczas prowokacji
glutenem
Symptoms during
gluten reintroduction
Wynik biopsji jelita
cienkiego wg
Marsha
Duodenal histology
according to Marsh
classification
Wynik
badania
IgAEmA
Analysis
result
IgAEmA
result
GJ
Ż/F
22
14 mies.ż. – celiakia klasyczna
(IVº zaniku wg Shmerlinga, IgAEmA
1:640 IF)
14 month of age – classical form (IVº
according to Shmerling classification,
IgAEmA positive)
17 17
mies.
17 months
bez dolegliwości
symptom free
3c
1:40 IF
JN
Ż/F
19
10 mies.ż. – celiakia klasyczna
(brak dokumentacji)
(5 rok życia – IgAEmA 1:640 IF)
10 month of age – classical form (5 year of
age – IgAEmA positive)
17 4
mies.
4 months
bez dolegliwości
symptom free
3b
1:640 IF
WP
M
22
10 mies.ż. – celiakia klasyczna
(nieprawidłowy test z D-ksylozą, IgAEmA
1:80 IF)
10 month of age – classical form (IgAEmA
positive)
17
3-4 lata – dieta
mieszana
3-4 years – diet
with restricted
amount of gluten
bez dolegliwości
symptom free
3a 1:40
IF
SE
Ż/F
26
10 mies.ż. – celiakia klasyczna
(IV° zaniku wg Shmerlinga, IgAEmA
1:5120 IF)
10 month of age – classical form (IVº
according to Shmerling classification,
IgAEmA positive)
20
2 lata – dieta
mieszana
2 years –
diet with
restricted amount
of gluten
bóle brzucha
abdominal pain
3b
1:40IF
KŁ
M
28
12 mies.ż. – celiakia klasyczna
(IgAEmA 1:5120IF) / 12 month of age -
classical form (IgAEmA positive)
25 10
mies.
10 months
bez dolegliwości
symptom free
3c
1:100 IF
KA
Ż/F
25
14 mies.ż. – celiakia klasyczna (IVºzaniku
wg Shmerlinga, IgAEmA 1:80 IF)
14 month of age – classical form (IVº
according to Shmerling classification,
IgAEmA positive)
23 6
mies.
6 months
bez dolegliwości
symptom free
3c
1:200 IF
PI
Ż/F
22
12 mies.ż. – celiakia klasyczna
(IgAEmA 1:1280 IF)
12 month of age – classical coeliac disease
(IgAEmA positive)
17 19
mies.
19 months
bez dolegliwości
symptom free
I biopsja (po 4 mies.
tpg ) - M0
II biopsja
(po 19 mies. tpg) - 3c
I biopsy (after
4 months of gluten
challenge) – M0
II biopsy (after
19 months of gluten
challenge) – M3c
1:160 IF
CS
Ż/F
23
15 mies.ż. – celiakia klasyczna
(IgAEmA 1:1280 IF)
15 month of age – classical form (IgAEmA
positive)
18 9
mies.
9 months
bóle brzucha,
chudnięcie, okresowo
luźne stolce
abdominal pain, weight
loss, reccurent diarrhoea
3b 1:2.5
IF
SK
M
20
6 r.ż. – celiakia atypowa – ch. Dűhringa
(IgAEmA 1:160 IF)
6 year of age – atypical form – Dűhring
disease – (IgAEmA positive)
12 11
mies.
11 months
zmiany skórne
skin changes
3a
1:320 IF
BN
Ż/F
23
12 mies.ż. – celiakia klasyczna
(IVº zaniku wg Shmerlinga, w 4. roku
życia – po tpg IIIºzaniku wg Shmerlinga)
12 month of age (IVº according to
Shmerling classification, 4 year of age IIIº
according to Shmerling) classification
21 10
mies.
10 months
bez dolegliwości
symptom free
M0
1:640 IF
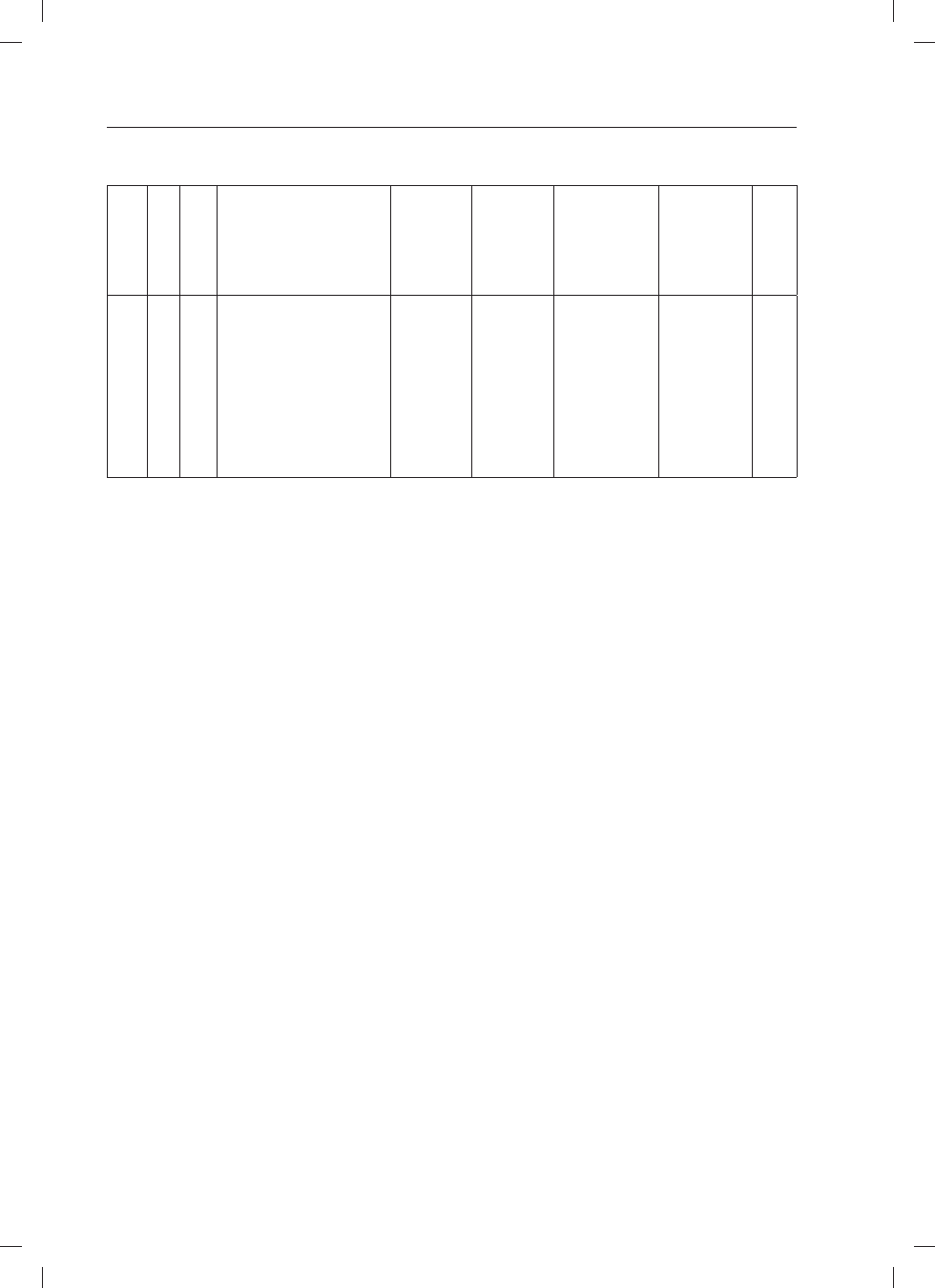
189
Szaflarska-Popławska A.
Czy możliwe jest wyleczenie z celiakii? Badania wstępne
Pediatr. Współcz. Gastroenterol. Hepatol. Żywienie Dziecka 2010, 12, 4, 186-190
cji glutenem, trwającej od 4 miesięcy do 3 lat, stwierdzono
typowe dla celiakii zmiany zanikowe kosmków błony śluzo-
wej jelita cienkiego z limfocytozą śródnabłonkową i prze-
rostem krypt. Stopień zaniku kosmków jelitowych był róż-
nie nasilony – od częściowego (u 2 pacjentów) do całko-
witego (u 4 pacjentów) i nie był zależny od czasu prowo-
kacji glutenem. U 2 pacjentów po trwającej około 10 mie-
sięcy prowokacji glutenem nie stwierdzono żadnych zmian
mikroskopowych. Pacjenci ci wymagają dalszej obserwacji
klinicznej i powtórzenia biopsji jelita cienkiego, ponieważ
do zmian histopatologicznych może u nich dojść w przy-
szłości.
Bez wątpienia czynnikiem wskazującym na duże praw-
dopodobieństwo pojawienia się zmian mikroskopowych
błony śluzowej jelita cienkiego u tych pacjentów jest
potwierdzona kilkakrotnie w trakcie obserwacji obecność
surowiczych przeciwciał antyendomyzjalnych. Swoistość
badania przeciwciał antyendomyzjalnych w klasie IgA (u
pacjentów bez niedoboru IgA), mierzonych metodą immu-
nofluorescencji pośredniej z użyciem przełyku małpy (jak
badaniach własnych) lub ludzkiej pępowiny jako antyge-
nu, a także przeciwciał przeciwko transglutaminazie tkan-
kowej metodą ELISA z wykorzystaniem ludzkiej rekombi-
nowanej transglutaminazy tkankowej, jest – jak wskazują
wyniki systematycznego przeglądu piśmiennictwa – bliska
100% (13). Podkreśla się, że obecność surowiczych prze-
ciwciał antyendomyzjalnych u pacjentów bez zmian zani-
kowych kosmków jelitowych zazwyczaj nie jest wynikiem
fałszywie ujemnym, ale zapowiada rozwój takich zmian
w przyszłości (14).
Z badań Matysiak-Budnik i wsp. wynika, że u około 20%
pacjentów z celiakią rozpoznaną we wczesnym dzieciń-
stwie, którzy pozostawali bezobjawowi w czasie conajm-
niej 2-letniej prowokacji glutenem, nie obserwuje się
zmian zanikowych kosmków błony śluzowej jelita cienkie-
go (12). U pacjentów tych istotnie rzadziej aniżeli u chorych
z celiakią niemą, a więc bezobjawowych pomimo typo-
wych dla celiakii zmian histopatologicznych, nie stwierdza
się zaburzeń gospodarki kostnej pod postacią osteoporo-
zy lub osteopenii (p<0,001), a liczba limfocytów śródna-
błonkowych z receptorem TCR αβ+ jest również znaczą-
co niższa (p<0,01). Należy jednak podkreślić, że w grupie
13 pacjentów z celiakią latentną w pracy badaczy francu-
skich u 2 w trakcie dalszej obserwacji doszło do nawrotu
objawów klinicznych oraz histopatologicznych. Na koniecz-
ność długofalowego monitorowania klinicznego, serolo-
gicznego i histopatologicznego pacjentów z celiakią bez
zmian mikroskopowych w obrębie jelita cienkiego pomi-
mo ponad 2-letniej prowokacji glutenem wskazują obser-
wacje kazuistyczne, sugerujące możliwość nawrotu zmian
po 9-14 latach spożywania glutenu (15, 16).
W badaniach autorów fińskich odsetek pacjentów
z celiakią rozpoznaną w okresie wczesnego dzieciństwa,
u których po okresie dojrzewania włączono dietę zawie-
rającą gluten i po ponad dwuletniej prowokacji nie obser-
wowano zmian mikroskopowych w obrębie jelita cien-
kiego, wyniósł 11%. Według badaczy chorzy ci wymagają
powtarzania oznaczeń przeciwciał antyretikulinowych jako
dobrego czynnika predykcyjnego nawrotu zmian histolo-
gicznych oraz biopsji jelita cienkiego (10). Shmerling i wsp.
uważają, że rutynowa prowokacja glutenem u pacjentów
z celiakią jest nieuzasadniona, ponieważ u przeważającej
większości po wprowadzeniu glutenu do diety dochodzi
do nawrotu zmian w obrębie jelita cienkiego, choć u części
z nich (12%) zmiany te pojawiają się z opóźnieniem – po
0,5-6,67 roku od przerwania stosowania diety bezgluteno-
wej (17).
W piśmiennictwie podkreśla się również fakt, że u wielu
pacjentów z celiakią z dodatnimi testami serologiczny-
mi stwierdza się różne nieprawidłowości immunohisto-
chemiczne w obrębie mikroskopowo prawidłowego jelita
cienkiego. Według Paparo i wsp. u prawie połowy z nich
obserwuje się zwiększoną liczbę limfocytów śródnabłon-
kowych CD3+, u ponad 70% – zwiększoną gęstość limfocy-
tów śródnabłonkowych γδ+, liczbę limfocytów CD25+ oraz
ekspresję ICAM-1 (18). U 85% dzieci z dodatnimi autoprze-
ciwciałami i prawidłowym obrazem histologicznym błony
śluzowej jelita cienkiego stwierdza się obecność depozy-
tów autoprzeciwciał IgA reagujących z transglutamina-
zą tkankową w błonie śluzowej przewodu pokarmowego
(19). W ocenie badaczy depozyty te stanowią wczesny mar-
ker celiakii, poprzedzający pojawienie się typowych zmian
morfologicznych. Wykonanie tego badania jest obecnie
możliwe w Pracowni Immunopatologii IPCZD w Warszawie
i należy je rozważyć u 2 pacjentów, jeśli prawidłowy obraz
histopatologiczny błony śluzowej jelita cienkiego będzie
Inicjały
Initials
Płeć
Sex
Wiek
(lata)
Age
(Years)
Czas rozpoznania i postać celiakii
Time of diagnosis and form of the disease
Czas stosowania
diety bez-
glutenowej (lata)
History of gluten-
free diet
(years)
Czas stosowania
diety ogólnej
History of gluten-
containing diet
Objawy kliniczne
podczas prowokacji
glutenem
Symptoms during
gluten reintroduction
Wynik biopsji jelita
cienkiego wg
Marsha
Duodenal histology
according to Marsh
classification
Wynik
badania
IgAEmA
Analysis
result
IgAEmA
result
WP
M
19
3 r.ż. – celiakia klasyczna
(IgAEmA 1:320 IF)
3 year of age - classical coeliac disease
(IgAEmA positive)
15 10
mies.
10 months
chudnięcie
weight loss
I biopsja
(po 4 mies. tpg) –
M0
II biopsja
(po 10 mies. tpg)
– M0
I biopsy (after
4 months of gluten
challenge) – M0
II biopsy (after
10 months of gluten
challenge) – M0
1:640 IF
TABELA I:
Cd.
TABLE I:
Cont.

190
Pediatr. Współcz. Gastroenterol. Hepatol. Żywienie Dziecka 2010, 12, 4, 186-190
Szaflarska-Popławska A.
Is there a possibility to recover from coeliac disease?
się utrzymywał nadal pomimo ponad 2-letniej prowokacji
glutenem.
Czynnikiem wpływającym na wartość endoskopowej
biopsji jelita cienkiego w rozpoznawaniu celiakii jest ilość
i miejsce pobrania bioptatów. Ze względu na możliwość
nieciągłego występowania zmian mikroskopowych (pat-
chy villous atrophy) u większości obecnie diagnozowa-
nych pacjentów, na co wskazują wyniki badań przy użyciu
kapsułki endoskopowej przeprowadzonych przez Murray-
’a i wsp., konieczne jest pobranie minimum 3-4, a według
niektórych autorów nawet 6 bioptatów z drugiej i trzeciej
części dwunastnicy (20-22). Zaleca się pobieranie przynaj-
mniej jednego bioptatu z opuszki dwunastnicy ze wzglę-
du na postać celiakii ograniczoną do pierwszej części dwu-
nastnicy u części, zwłaszcza pediatrycznych pacjentów (23).
W badaniach własnych w każdym przypadku pobierano
minimum 3 bioptaty z różnych części dwunastnicy, dlate-
go jest mało prawdopodobne, aby powodem braku zmian
mikroskopowych w obrębie jelita cienkiego u 2 pacjentów
były zmiany o charakterze ogniskowym.
Jednocześnie należy zwrócić uwagę na bezobjawo-
wy przebieg prowokacji glutenem u większości pacjentów
z celiakią rozpoznaną we wczesnym dzieciństwie, co zresz-
tą sprzyja świadomemu nieprzestrzeganiu diety u wielu
nastolatków. W badaniach własnych tylko u 4 spośród
11 pacjentów w trakcie włączenia glutenu do diety wystą-
piły okresowe niezbyt nasilone dolegliwości. Obserwowa-
ny u jednego z pacjentów bez zmian zanikowych kosm-
ków błony śluzowej jelita cienkiego przejściowy spadek
masy ciała mógł być spowodowany okresowym brakiem
apetytu, stwierdzanym u niektórych chorych przechodzą-
cych na dietę zawierającą gluten, którzy byli przyzwycza-
jeni do smaku bezglutenowych wyrobów, zwłaszcza pie-
karniczych. Brak objawów klinicznych w trakcie prowokacji
glutenem u pacjentów z rozpoznaną celiakią nie może być
wskaźnikiem „dobrostanu” jelita cienkiego.
Wnioski
U dorosłych pacjentów z celiakią rozpoznaną we wcze-
snym dzieciństwie w trakcie prowokacji glutenem docho-
dzi do ponownego pojawienia się dodatnich testów sero-
logicznych oraz u większości z nich – zmian mikroskopo-
wych w błonie śluzowej jelita cienkiego, chociaż u przewa-
żającej liczby chorych nie towarzyszą temu żadne dolegli-
wości. Obserwacja ta wymaga potwierdzenia na większej
grupie pacjentów oraz po dłuższym czasie prowokacji glu-
tenem.
Piśmiennictwo
1. DiSabatino A, Corazzi G.R.: Coeliac disease. Lancet, 2009, 373, 1480-
-1493.
2. Hill I.D., Dirks M.H., Liptak G.S. i wsp.: Guideline for the diagnosis and
treatment of celiac disease in children: recommendations of the North
American Society for Pediatric Gastroenterology, Hepatology and
Nutrition. J. Ped. Gastroenterol. Nutr., 2005, 40, 1 -19.
3. Nejad M.R., Rostami K., Pourhoseingholi M.A. i wsp.: Atypical presen-
tation is dominant and typical for coeliac disease. J. Gastrointestinal.
Liver Dis., 2009, 18, 285 -291.
4. Working Group of the European Society of Paediatric Gastroentero-
logy and Nutrition: Revised criteria for diagnosis of coeliac disease.
Arch. Dis. Child., 1990, 65, 909 -911.
5. Casellas F., Rodrigo L., López Vivancos J. i wsp.: Factors that impact
health -related quality of life in adults with celiac disease: a multicenter
study. World J. Gastroenterol., 2008, 14, 46 -52.
6. Catassi C., Rätsch I.M., Fabiani E. i wsp.: Coeliac disease on the year
2000: exploring the iceberg. Lancet, 1994, 22, 200 -203.
7. Kaniewska M., Rydzewska G.: Choroba trzewna u dorosłych – patoge-
neza, manifestacje kliniczne, współistnienie z nieswoistymi zapalenia-
mi jelit i innymi chorobami o podlożu autoimmunologicznym. Przegl.
Gastroenterol., 2009, 4, 173 -177.
8. Bardella M.T., Velio P., Cesana B.M. i wsp.: Coeliac disease: a histologi-
cal follow -up. Histopathology, 2007, 50, 465 -471.
9. Pietzak
M.M.:
Follow -up of patients with celiac disease: achieving com-
pliance with treatment. Gastroenterology, 2005, 128, 135 -141.
10. Mäki M., Lähdeaho M.L., Hällstrőm O. i wsp.: Postpubertal gluten
challenge in coeliac disease. Arch. Dis. Child., 1989, 64, 1604 -1607.
11. Shmerling D.H., Franckx J.: Childhood celiac disease: a long -term
analysis of relapses in 91 patients. J. Ped. Gastroenterol. Nutr., 1986,
5, 565 -569.
12. Matysiak -Budnik T., Malamut G., Patey -Mariaud de Serre N. i wsp.:
Long -term follow -up of 61 coeliac patients diagnosed in childhood:
evolution toward latency is possible on a normal diet. Gut, 2007, 56,
1379 -1386.
13. Rostom A., Dubé C., Cranney A. i wsp.: The diagnostic accuracy of
serologic tests for celiac disease: a systematic review. Gastroentero-
logy, 2005, 128, supl. 1, 38 -46.
14. Dickey W., Hughes D.F., McMillan S.A.: Patients with serum IgA endo-
mysial antibodies and intact duodenal villi: clinical characteristics and
management options. Scand. J. Gastroentero.l, 2005, 40, 1240 -1243.
15. Hőgberg L., Stenhammar L., Wägermark J.: Very late mucosal relapse
in a girl with coeliac disease. Acta Paediatr., 1993, 82, 887 -889.
16. Kuitunen P., Savilahti E., Verkasalo M.: Late mucosal relapse in a boy
with coeliac disease and cow’s milk allergy. Acta Paediatr. Scand.,
1986, 75, 340 -342.
17. Shmerling D.H., Franckx J.: Childhood celiac disease: a long -term
analysis of relapses in 91 patients. J. Ped. Gastroenterol. Nutr., 1986,
5, 565 -569.
18. Paparo F., Petrone P., Tosco A. i wsp.: Clinical, HLA, and small bowel
immunohistochemical features of children with positive serum anti-
endomysium antibodies and architecturally normal small intestinal
mucosa. Am. J. Gastroenterol., 2005, 100, 2294 -2298.
19. Tosco A., Maglio M., Paparo F. i wsp.: Immunoglobulin A anti -tissue
transglutaminase antibody deposits in the small intestinal mucosa of
children with no villous atrophy. J. Pediatr. Gastroenterol. Nutr., 2008,
47, 293 -298.
20. Murray J.A., Rubio -Tapia A., van Dyke C.T. i wsp.: Mucosal atrophy in
celiac disease: extend of involvement, correlation with clinical presen-
tation, and response to treatment. Clin. Gastroenterol. Hepatol., 2008,
6, 186 -193.
21. Sollid L.M., Lundin K.E.A.: Diagnosis and treatment of celiac disease.
Muc. Immunol., 2009, 2, 3 -7.
22. Cammarota G., Fedeli P., Gasbarrini A.: Emerging technologies in
upper gastrointestinal endoscopy and celiac disease. Nat. Clin. Pract.
Gastroenterol. Hepatol., 2009, 6, 47 -56.
23. Hopper A.D., Chew T.S., Lewis A., Sanders D.S.: Is there a case for rou-
tine duodenal biopsy at gastroscopy or is a targeted approach ade-
quate? Endoscopy, 2008, 40, 727 -730.
Praca wpłynęła do Redakcji: 2010-08-23
Zaakceptowano do druku: 2010-10-11
Konflikt interesów: nie zgłoszono
Wyszukiwarka
Podobne podstrony:
Czy możliwe jest życie w kosmosie
czy możliwa jest poezja po Oświęcimiu, WYPRACOWANIA, GIMNAZJUM
7.Czy możliwa jest rejestracja czystych widm elektronowych, BIO, Diagnostyka Laboratoryjna, analiza
Czy możliwe jest stać się lepszym w ciągu jednej nocy, ! PSYCHOLOGIA PSYCHIATRIA, 0 0 NA DOBRY POCZĄ
Ide Pascal - Czy możliwe jest przebaczenie (rozdz.1, SATORI GRA, Wybaczanie
Maciej Magoński Czy możliwy jest estetyczny (Nietzsche, Kierkegaard)
Czy mozliwe jest zycie bez elektrycznosci
Michał Paweł Markowski Czy możliwa jest poetyka eseju
CZY DZIESIECINA JEST OBOWIAZKOW Nieznany
Czy w świecie sowieckich łagrów możliwe jest zachowanie człowieczeństwa (2)
Czy metafizyka jest w ogóle możliwa, Czy metafizyka jest w ogóle możliwa
czy patriotyzm jest cnota id 12 Nieznany
16 luty Czy i jak możliwe jest poznanie Boga(cw 3)id 16775 ppt
Czy dzisiaj możliwe jest bycie świętym, duchowość
Czy i jak możliwe jest poznanie Boga(cw 3)
Czy kultura jest jeszcze możliwa socjologia, Studia Transport UP Lublin
więcej podobnych podstron