1
Wydział Chemii UJ Podstawy chemii - wykład 13/1
dr hab. W. Makowski
Wyk
Wyk
ł
ł
ad 13: Analiza jako
ad 13: Analiza jako
ś
ś
ciowa
ciowa
kation
kation
ó
ó
w i anion
w i anion
ó
ó
w
w
Podzia
Podzia
ł
ł
kation
kation
ó
ó
w na grupy analityczne
w na grupy analityczne
Odczynniki grupowe
Odczynniki grupowe
Reakcje charakterystyczne kation
Reakcje charakterystyczne kation
ó
ó
w
w
Analiza anion
Analiza anion
ó
ó
w
w
Reakcje charakterystyczne anion
Reakcje charakterystyczne anion
ó
ó
w
w
Ć
Ć
wiczenia laboratoryjne z podstaw chemii i analizy jako
wiczenia laboratoryjne z podstaw chemii i analizy jako
ś
ś
ciowej
ciowej
red. A.
red. A.
Reizer
Reizer
, Wydawnictwo UJ, 2000
, Wydawnictwo UJ, 2000
Wydział Chemii UJ Podstawy chemii - wykład 13/2
dr hab. W. Makowski
Podzia
Podzia
ł
ł
kation
kation
ó
ó
w na grupy analityczne
w na grupy analityczne
brak
brak
odczynnika
odczynnika
grupowego
grupowego
K
K
+
+
, Na
, Na
+
+
, NH
, NH
4
4
+
+
, Mg
, Mg
2+
2+
V
V
CaCO
CaCO
3
3
, SrC
, SrC
O
O
3
3
,
,
BaCO
BaCO
3
3
(NH
(NH
4
4
)
)
2
2
CO
CO
3
3
w
w
NH
NH
3
3
aq
aq
i NH
i NH
4
4
C
C
l
l
Ca
Ca
2+
2+
, Sr
, Sr
2+
2+
, Ba
, Ba
2+
2+
IV
IV
A
A
l
l
(OH)
(OH)
3
3
, Cr(OH)
, Cr(OH)
3
3
Fe
Fe
2
2
S
S
3
3
,
,
FeS, NiS
FeS, NiS
,
,
CoS, ZnS, MnS
CoS, ZnS, MnS
(NH
(NH
4
4
)
)
2
2
S
S
w
w
NH
NH
3
3
aq
aq
i NH
i NH
4
4
C
C
l
l
A
A
l
l
3+
3+
,
,
Cr
Cr
3+
3+
, Fe
, Fe
2+
2+
,
,
Fe
Fe
3+
3+
,
,
Mn
Mn
2+
2+
, Zn
, Zn
2+
2+
,
,
Ni
Ni
2+
2+
, Co
, Co
2+
2+
III
III
SnS
SnS
, SnS
, SnS
2
2
, As
, As
2
2
S
S
3
3
,
,
As
As
2
2
S
S
5
5
,
,
Sb
Sb
2
2
S
S
3
3
, Sb
, Sb
2
2
S
S
5
5
IIB
IIB
:
:
Sn
Sn
2+
2+
, Sn
, Sn
4+
4+
, As
, As
3+
3+
,
,
As
As
5+
5+
,
,
Sb
Sb
3+
3+
, Sb
, Sb
5+
5+
HgS
HgS
,
,
PbS
PbS
, Bi
, Bi
2
2
S
S
3
3
,
,
CuS
CuS
,
,
CdS
CdS
H
H
2
2
S
S
w
w
0,3 M
0,3 M
HC
HC
l
l
zamiast H
zamiast H
2
2
S
S
–
–
tioacetamid
tioacetamid
(AKT, CH
(AKT, CH
3
3
CSNH
CSNH
2
2
)
)
IIA
IIA
:
:
Hg
Hg
2+
2+
, Pb
, Pb
2+
2+
, Bi
, Bi
3+
3+
Cu
Cu
2+
2+
, Cd
, Cd
2+
2+
II
II
AgCl
AgCl
, PbCl
, PbCl
2
2
, Hg
, Hg
2
2
Cl
Cl
2
2
2 M
2 M
HC
HC
l
l
Ag
Ag
+
+
,
,
Pb
Pb
2+
2+
, Hg
, Hg
2
2
2
2
+
+
I
I
P
P
owsta
owsta
j
j
ą
ą
cy
cy
o
o
sad
sad
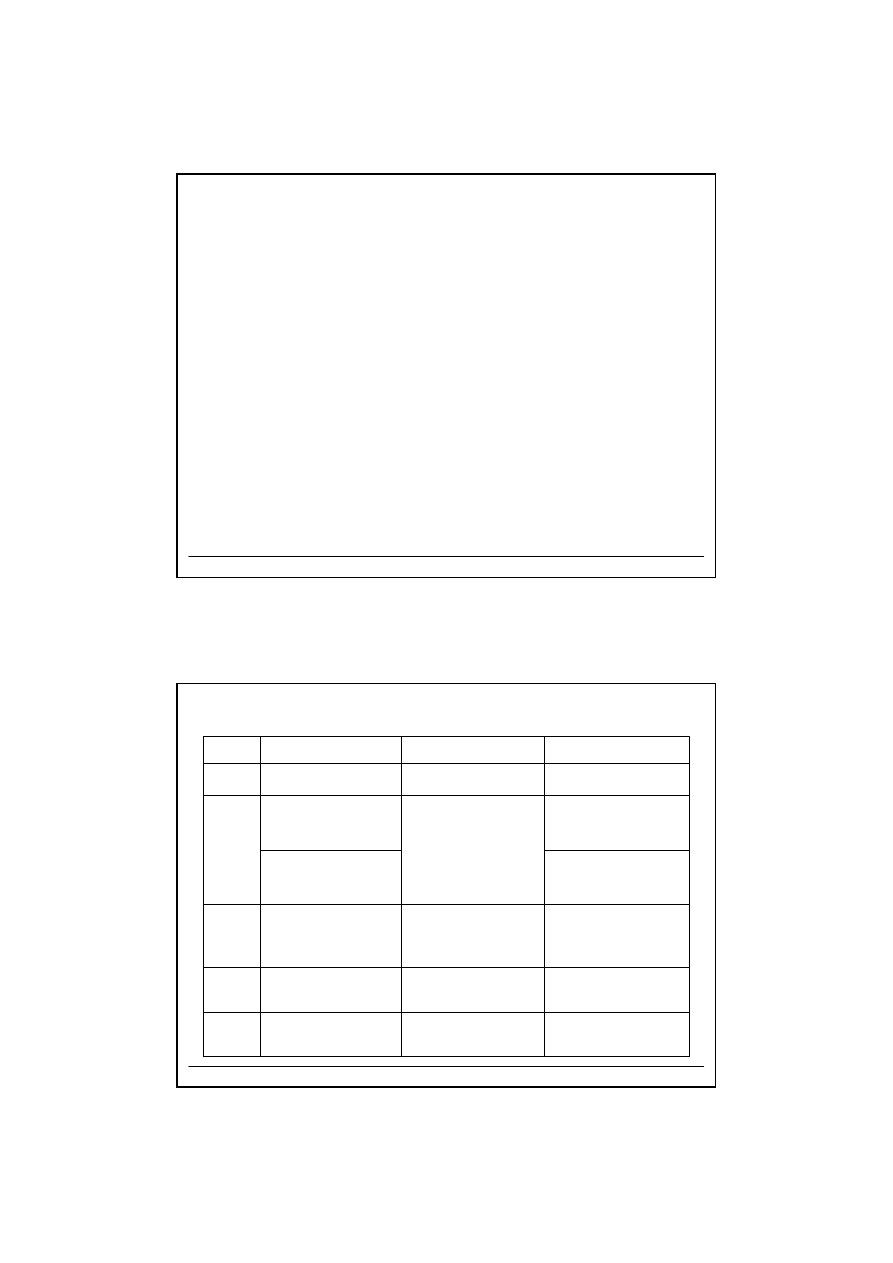
Odczynnik grupowy
Odczynnik grupowy
Kationy
Kationy
G
G
rup
rup
a
a
2
Wydział Chemii UJ Podstawy chemii - wykład 13/3
dr hab. W. Makowski
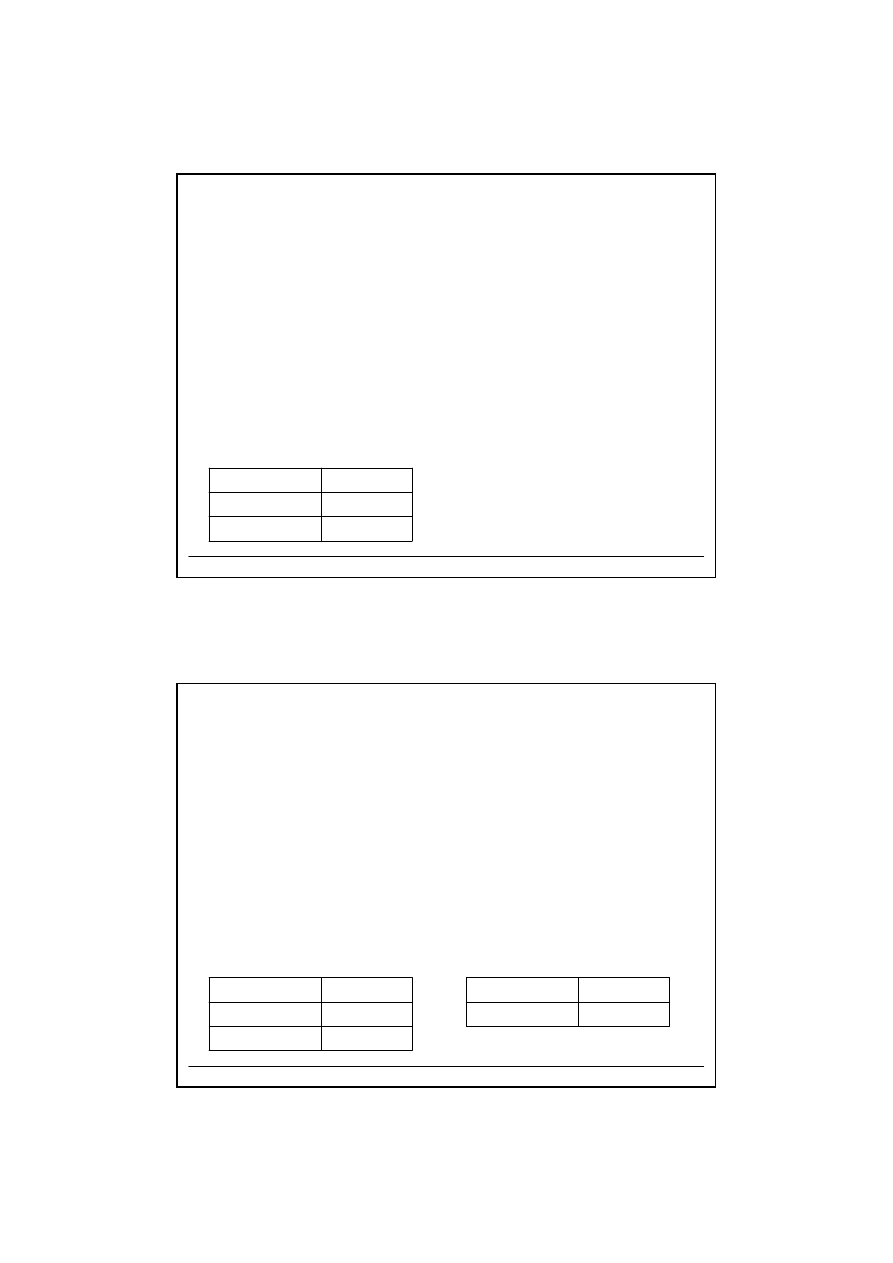
Odczynniki grupowe
Odczynniki grupowe
1,7·10
–5
PbCl
2
1,6·10
–10
AgCl
10
–18
Hg
2
Cl
2
]
][
[
−
+
=
Cl
Ag
K
AgCl
s
Hg
Hg
2
2
2+
2+
+ 2 Cl
+ 2 Cl
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
Hg
Hg
2
2
Cl
Cl
2 (s)
2 (s)
wytr
wytr
ą
ą
canie
canie
Grupa I
Grupa I
HCl
HCl
+ H
+ H
2
2
O
O
→
→
H
H
3
3
O
O
+
+
+ Cl
+ Cl
-
-
2 M, ca
2 M, ca
ł
ł
kowita dysocjacja
kowita dysocjacja
Ag
Ag
+
+
+ Cl
+ Cl
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
AgCl
AgCl
(s)
(s)
Pb
Pb
2+
2+
+ 2 Cl
+ 2 Cl
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
PbCl
PbCl
2 (s)
2 (s)
2
2
2
]
][
[
2
2
−
+
=
Cl
Hg
K
Cl
Hg
s
2
2
]
][
[
2
−
+
=
Cl
Pb
K
PbCl
s
warto
warto
ś
ś
ci
ci
K
K
s
s
nieca
nieca
ł
ł
kowite wytr
kowite wytr
ą
ą
cenie PbCl
cenie PbCl
2
2
Wydział Chemii UJ Podstawy chemii - wykład 13/4
dr hab. W. Makowski
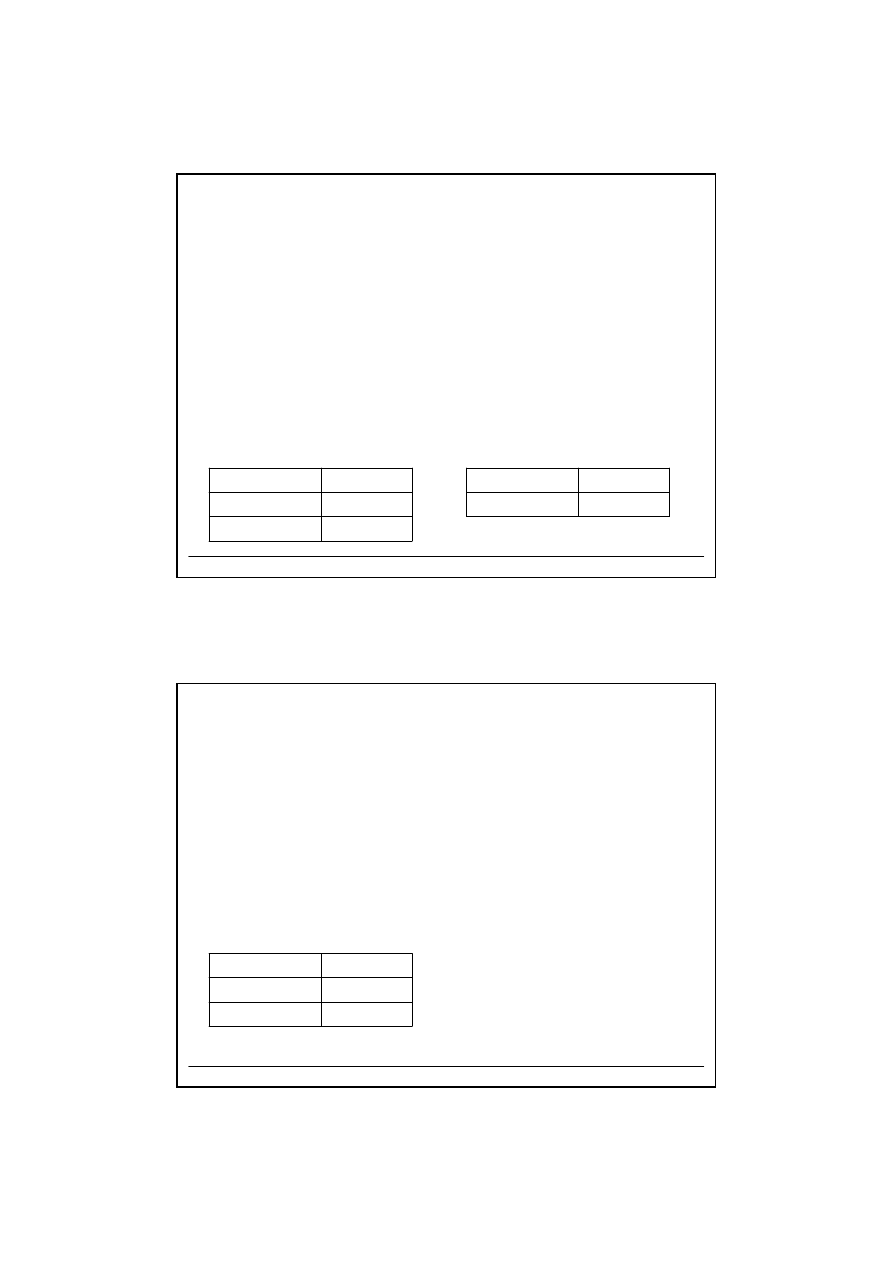
Odczynniki grupowe
Odczynniki grupowe
10
–27
PbS
4·10
–53
HgS
2·10
–93
Sb
3
S
2
2 Sb
2 Sb
3+
3+
+ 3 S
+ 3 S
2
2
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
Sb
Sb
2
2
S
S
3 (s)
3 (s)
wytr
wytr
ą
ą
caj
caj
ą
ą
si
si
ę
ę
tylko bardzo
tylko bardzo
trudnorozpuszcalne
trudnorozpuszcalne
siarczki
siarczki
Grupa II
Grupa II
CH
CH
3
3
CSNH
CSNH
2
2
+ 2 H
+ 2 H
2
2
O
O
→
→
CH
CH
3
3
COONH
COONH
4
4
+ H
+ H
2
2
S
S
H
H
2
2
S + H
S + H
2
2
O
O
⇄
⇄
H
H
3
3
O
O
+
+
+ HS
+ HS
-
-
HS
HS
-
-
+ H
+ H
2
2
O
O
⇄
⇄
H
H
3
3
O
O
+
+
+ S
+ S
2
2
-
-
obecno
obecno
ść
ść
0.3 M
0.3 M
HCl
HCl
ogranicza
ogranicza
dysocjacj
dysocjacj
ę
ę
H
H
2
2
S, [S
S, [S
2
2
-
-
] b. ma
] b. ma
ł
ł
e
e
3
2
2
3
]
[
]
[
3
2
−
+
=
S
Sb
K
S
Sb
s
warto
warto
ś
ś
ci
ci
K
K
s
s
ZnS
ZnS
si
si
ę
ę
nie wytr
nie wytr
ą
ą
ca
ca
Cd
Cd
2+
2+
+ S
+ S
2
2
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
CdS
CdS
(s)
(s)
]
][
[
2
2
−
+
=
S
Cd
K
CdS
s
10
–24
ZnS
10
–28
CdS
3
Wydział Chemii UJ Podstawy chemii - wykład 13/5
dr hab. W. Makowski
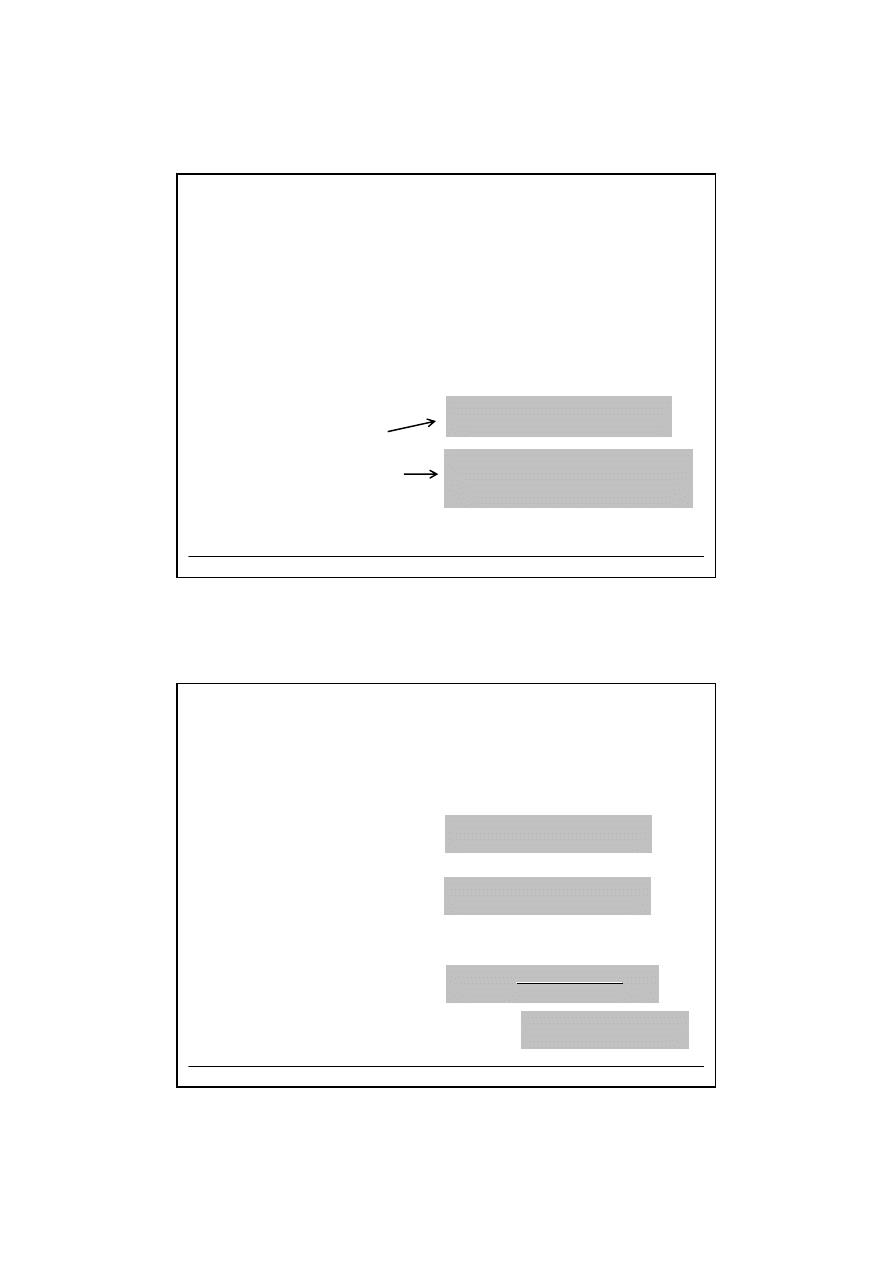
Odczynniki grupowe
Odczynniki grupowe
2,5·10
–12
MnS
5·10
–18
FeS
10
–23
CoS
wytr
wytr
ą
ą
caj
caj
ą
ą
si
si
ę
ę
trudnorozpuszczalne
trudnorozpuszczalne
siarczki i wodorotlenki
siarczki i wodorotlenki
Grupa III
Grupa III
NH
NH
3
3
aq
aq
i NH
i NH
4
4
Cl
Cl
-
-
bufor amonowy
bufor amonowy
obecno
obecno
ść
ść
buforu ogranicza
buforu ogranicza
hydroliz
hydroliz
ę
ę
S
S
2
2
-
-
, [S
, [S
2
2
-
-
] du
] du
ż
ż
e
e
warto
warto
ś
ś
ci
ci
K
K
s
s
Mg(OH)
Mg(OH)
2
2
si
si
ę
ę
nie wytr
nie wytr
ą
ą
ca
ca
Zn
Zn
2+
2+
+ S
+ S
2
2
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
ZnS
ZnS
(s)
(s)
]
][
[
2
2
−
+
=
S
Zn
K
ZnS
s
5,5·10
–12
Mg(OH)
2
1,9·10
–33
Al(OH)
3
pH
pH
≈
≈
9.25, [OH
9.25, [OH
-
-
] znaczne
] znaczne
(NH
(NH
4
4
)
)
2
2
S
S
→
→
2 NH
2 NH
4
4
+
+
+ S
+ S
2
2
-
-
S
S
2
2
-
-
+ H
+ H
2
2
O
O
⇄
⇄
HS
HS
-
-
+ OH
+ OH
-
-
Al
Al
3+
3+
+ 3 OH
+ 3 OH
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
Al(OH)
Al(OH)
3 (s)
3 (s)
3
3
)
(
]
][
[
3
−
+
=
OH
Al
K
OH
Al
s
Wydział Chemii UJ Podstawy chemii - wykład 13/6
dr hab. W. Makowski
Odczynniki grupowe
Odczynniki grupowe
1,0·10
–5
MgCO
MgCO
3
3
8,1·10
–9
BaCO
BaCO
3
3
4,8·10
–9
CaCO
CaCO
3
3
wytr
wytr
ą
ą
caj
caj
ą
ą
si
si
ę
ę
trudnorozpuszczalne
trudnorozpuszczalne
w
w
ę
ę
glany
glany
Grupa IV
Grupa IV
NH
NH
3
3
aq
aq
i NH
i NH
4
4
Cl
Cl
-
-
bufor amonowy
bufor amonowy
obecno
obecno
ść
ść
buforu ogranicza
buforu ogranicza
hydroliz
hydroliz
ę
ę
CO
CO
3
3
2
2
-
-
, [CO
, [CO
3
3
2
2
-
-
] du
] du
ż
ż
e
e
warto
warto
ś
ś
ci
ci
K
K
s
s
Ca
Ca
2+
2+
+ CO
+ CO
3
3
2
2
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
CaCO
CaCO
3 (s)
3 (s)
]
][
[
2
3
2
3
−
+
=
CO
Ca
K
CaCO
s
pH
pH
≈
≈
9.25, [OH
9.25, [OH
-
-
] znaczne
] znaczne
(NH
(NH
4
4
)
)
2
2
CO
CO
3
3
→
→
2 NH
2 NH
4
4
+
+
+ CO
+ CO
3
3
2
2
-
-
CO
CO
3
3
2
2
-
-
+ H
+ H
2
2
O
O
⇄
⇄
HCO
HCO
3
3
-
-
+ OH
+ OH
-
-
MgCO
MgCO
3
3
si
si
ę
ę
nie wytr
nie wytr
ą
ą
ca
ca
4
Wydział Chemii UJ Podstawy chemii - wykład 13/7
dr hab. W. Makowski
Reakcje charakterystyczne kation
Reakcje charakterystyczne kation
ó
ó
w
w
•
•
str
str
ą
ą
canie i roztwarzanie osad
canie i roztwarzanie osad
ó
ó
w
w
Sn
Sn
2+
2+
+ S
+ S
2
2
-
-
⇄
⇄
SnS
SnS
(s)
(s)
brunatny osad rozpuszczalny w (NH
brunatny osad rozpuszczalny w (NH
4
4
)
)
2
2
S
S
2
2
SnS
SnS
(s)
(s)
+ (NH
+ (NH
4
4
)
)
2
2
S
S
2
2
⇄
⇄
(NH
(NH
4
4
)
)
2
2
SnS
SnS
3
3
powstaje rozpuszczalny
powstaje rozpuszczalny
tritiocynian(IV
tritiocynian(IV
) amonu
) amonu
Ba
Ba
2+
2+
+ SO
+ SO
4
4
2
2
-
-
⇄
⇄
BaSO
BaSO
4
4
(s)
(s)
SO
SO
4
4
2
2
-
-
+ H
+ H
3
3
O
O
+
+
⇄
⇄
HSO
HSO
4
4
-
-
+ H
+ H
2
2
O
O
bia
bia
ł
ł
y osad, rozpuszczalny tylko
y osad, rozpuszczalny tylko
w st
w st
ęż
ęż
onym H
onym H
2
2
SO
SO
4
4
Ca
Ca
2+
2+
+ SO
+ SO
4
4
2
2
-
-
⇄
⇄
CaSO
CaSO
4
4
(s)
(s)
bia
bia
ł
ł
y osad, str
y osad, str
ą
ą
ca si
ca si
ę
ę
tylko ze
tylko ze
st
st
ęż
ęż
onych roztwor
onych roztwor
ó
ó
w, rozpuszczalny
w, rozpuszczalny
w rozcie
w rozcie
ń
ń
czonych kwasach
czonych kwasach
K
K
s
s
= 10
= 10
–
–
10
10
K
K
s
s
= 6
= 6
·
·
10
10
–
–
5
5
Cu
Cu
2+
2+
+ S
+ S
2
2
-
-
⇄
⇄
CuS
CuS
(s)
(s)
czarny osad nierozpuszczalny w (NH
czarny osad nierozpuszczalny w (NH
4
4
)
)
2
2
S
S
2
2
-
-
odr
odr
ó
ó
ż
ż
nianie Cu
nianie Cu
2+
2+
od Sn
od Sn
2+
2+
(
(
rozdzia
rozdzia
ł
ł
grup IIA i IIB)
grup IIA i IIB)
-
-
odr
odr
ó
ó
ż
ż
nianie Ba
nianie Ba
2+
2+
od Ca
od Ca
2+
2+
powstaj
powstaj
ą
ą
rozpuszczalne wodorosiarczany
rozpuszczalne wodorosiarczany
Wydział Chemii UJ Podstawy chemii - wykład 13/8
dr hab. W. Makowski
Reakcje charakterystyczne kation
Reakcje charakterystyczne kation
ó
ó
w
w
Al
Al
3+
3+
+ 3 OH
+ 3 OH
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
Al(OH)
Al(OH)
3 (s)
3 (s)
•
•
wodorotlenki,
wodorotlenki,
hydroksokompleksy
hydroksokompleksy
i
i
aminakompleksy
aminakompleksy
-
-
odr
odr
ó
ó
ż
ż
nianie Al
nianie Al
3+
3+
od Zn
od Zn
2+
2+
a) reakcja z
a) reakcja z
NaOH
NaOH
Al(OH)
Al(OH)
3 (s)
3 (s)
+ OH
+ OH
-
-
⇄
⇄
[Al(OH)
[Al(OH)
4
4
]
]
-
-
bia
bia
ł
ł
y osad rozpuszczalny
y osad rozpuszczalny
w nadmiarze odczynnika
w nadmiarze odczynnika
Al
Al
3+
3+
+ 3 OH
+ 3 OH
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
Al(OH)
Al(OH)
3 (s)
3 (s)
b) reakcja z NH
b) reakcja z NH
3
3
aq
aq
bia
bia
ł
ł
y osad
y osad
nierozpuszczalny
nierozpuszczalny
w nadmiarze odczynnika
w nadmiarze odczynnika
[OH
[OH
-
-
] zbyt ma
] zbyt ma
ł
ł
e, by powsta
e, by powsta
ł
ł
[Al(OH)
[Al(OH)
4
4
]
]
-
-
Al
Al
3+
3+
nie tworzy
nie tworzy
aminakompleks
aminakompleks
ó
ó
w
w
Zn
Zn
2+
2+
+ 2 OH
+ 2 OH
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
Zn(OH)
Zn(OH)
2 (s)
2 (s)
Zn(OH)
Zn(OH)
2 (s)
2 (s)
+ 2 OH
+ 2 OH
-
-
⇄
⇄
[Zn(OH)
[Zn(OH)
4
4
]
]
2
2
-
-
bia
bia
ł
ł
y osad rozpuszczalny
y osad rozpuszczalny
w nadmiarze odczynnika
w nadmiarze odczynnika
Zn
Zn
2+
2+
+ 2 OH
+ 2 OH
-
-
⇄
⇄
⇄
⇄
⇄
⇄
⇄
⇄
Zn(OH)
Zn(OH)
2 (s)
2 (s)
Zn(OH)
Zn(OH)
2 (s)
2 (s)
+ 4 NH
+ 4 NH
3
3
⇄
⇄
[Zn(NH
[Zn(NH
3
3
)
)
4
4
]
]
2+
2+
+ 2 OH
+ 2 OH
-
-
bia
bia
ł
ł
y osad rozpuszczalny
y osad rozpuszczalny
w nadmiarze odczynnika
w nadmiarze odczynnika
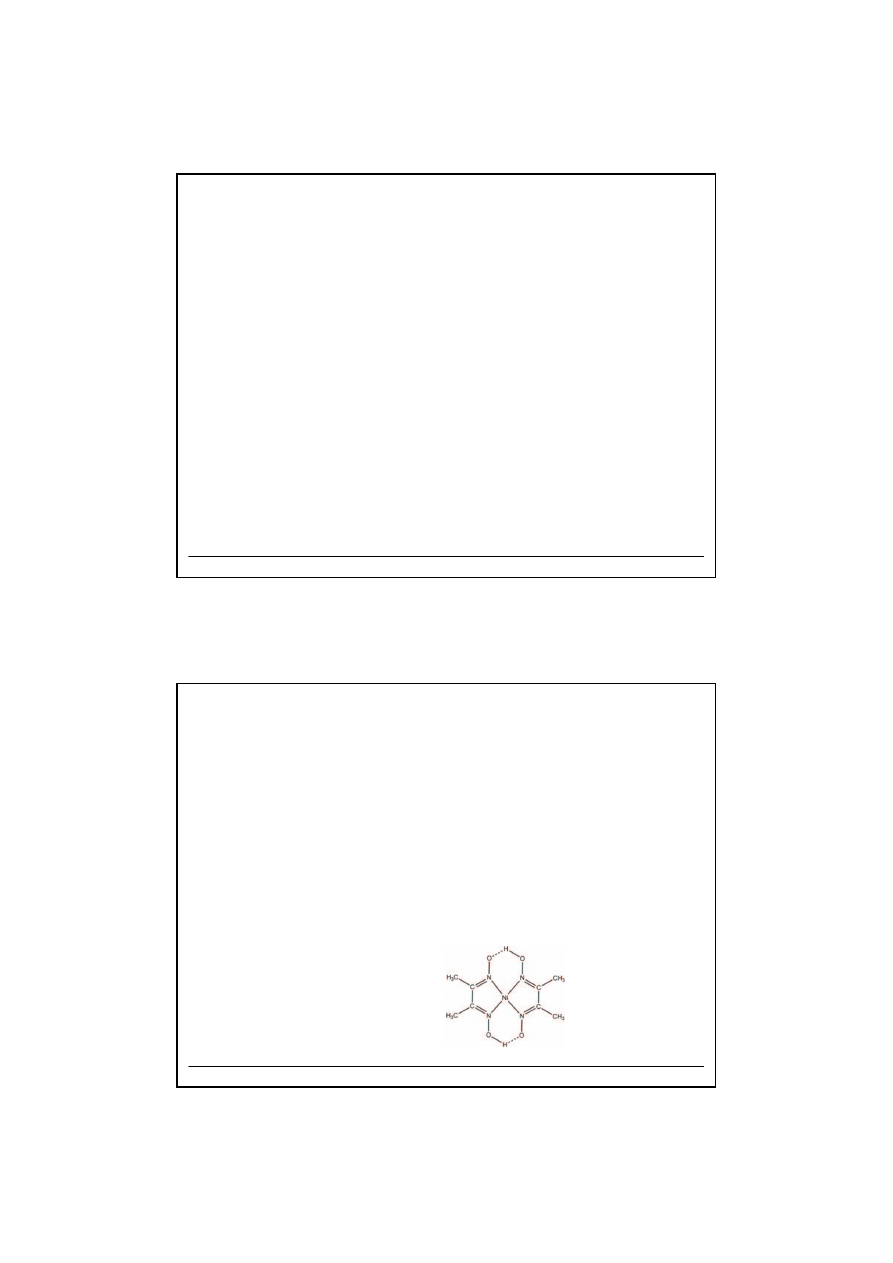
5
Wydział Chemii UJ Podstawy chemii - wykład 13/9
dr hab. W. Makowski
Reakcje charakterystyczne kation
Reakcje charakterystyczne kation
ó
ó
w
w
•
•
wodorotlenki,
wodorotlenki,
hydroksosole
hydroksosole
i
i
aminakompleksy
aminakompleksy
Cu
Cu
2+
2+
+ 2 OH
+ 2 OH
-
-
⇄
⇄
Cu(OH)
Cu(OH)
2 (s)
2 (s)
reakcje z NH
reakcje z NH
3
3
aq
aq
niebieski osad, rozpuszczalny w nadmiarze
niebieski osad, rozpuszczalny w nadmiarze
Cu(OH)
Cu(OH)
2 (s)
2 (s)
+ 4 NH
+ 4 NH
3
3
⇄
⇄
[Cu(NH
[Cu(NH
3
3
)
)
4
4
]
]
2+
2+
+ 2 OH
+ 2 OH
-
-
intensywne ciemnofio
intensywne ciemnofio
ł
ł
kowe
kowe
zabarwienie
zabarwienie
Co
Co
2+
2+
+ OH
+ OH
-
-
+ Cl
+ Cl
-
-
⇄
⇄
Co(OH)Cl
Co(OH)Cl
(s)
(s)
niebieski osad , rozpuszczalny w nadmiarze
niebieski osad , rozpuszczalny w nadmiarze
Co(OH)Cl
Co(OH)Cl
(s)
(s)
+ 6 NH
+ 6 NH
3
3
⇄
⇄
[Co(NH
[Co(NH
3
3
)
)
6
6
]
]
2+
2+
+ OH
+ OH
-
-
+ Cl
+ Cl
-
-
r
r
ó
ó
ż
ż
owe zabarwienie
owe zabarwienie
Ni
Ni
2+
2+
+ OH
+ OH
-
-
+ Cl
+ Cl
-
-
⇄
⇄
Ni(OH)Cl
Ni(OH)Cl
(s)
(s)
zielony osad , rozpuszczalny w nadmiarze
zielony osad , rozpuszczalny w nadmiarze
Ni(OH)Cl
Ni(OH)Cl
(s)
(s)
+ 6 NH
+ 6 NH
3
3
⇄
⇄
[Ni(NH
[Ni(NH
3
3
)
)
6
6
]
]
2+
2+
+ OH
+ OH
-
-
+ Cl
+ Cl
-
-
niebieskozielone zabarwienie
niebieskozielone zabarwienie
Wydział Chemii UJ Podstawy chemii - wykład 13/10
dr hab. W. Makowski
Reakcje charakterystyczne kation
Reakcje charakterystyczne kation
ó
ó
w
w
•
•
tworzenie barwnych zwi
tworzenie barwnych zwi
ą
ą
zk
zk
ó
ó
w kompleksowych
w kompleksowych
Fe
Fe
3+
3+
+ 6 SCN
+ 6 SCN
-
-
⇄
⇄
[Fe(SCN)
[Fe(SCN)
6
6
]
]
3
3
-
-
wykrywanie Fe
wykrywanie Fe
3+
3+
intensywne krwistoczerwone zabarwienie
intensywne krwistoczerwone zabarwienie
4 Fe
4 Fe
3+
3+
+ 3 [Fe(CN)
+ 3 [Fe(CN)
6
6
]
]
4
4
-
-
⇄
⇄
Fe
Fe
4
4
[Fe(CN)
[Fe(CN)
6
6
]
]
3 (s)
3 (s)
ciemnoniebieski osad
ciemnoniebieski osad
(
(
„
„
b
b
łę
łę
kit pruski
kit pruski
”
”
)
)
wykrywanie Fe
wykrywanie Fe
2+
2+
3 Fe
3 Fe
2+
2+
+ 2 [Fe(CN)
+ 2 [Fe(CN)
6
6
]
]
3
3
-
-
⇄
⇄
Fe
Fe
3
3
[Fe(CN)
[Fe(CN)
6
6
]
]
2 (s)
2 (s)
ciemnoniebieski osad
ciemnoniebieski osad
wykrywanie Ni
wykrywanie Ni
2+
2+
Ni
Ni
2+
2+
+ 2
+ 2
dmgH
dmgH
-
-
⇄
⇄
[Ni(
[Ni(
dmgH)
dmgH)
2
2
]
]
(s)
(s)
czerwony
czerwony
osad
osad
dmgH
dmgH
2
2
-
-
dimetyloglioksym
dimetyloglioksym
6
Wydział Chemii UJ Podstawy chemii - wykład 13/11
dr hab. W. Makowski
Reakcje charakterystyczne kation
Reakcje charakterystyczne kation
ó
ó
w
w
•
•
reakcje
reakcje
redoks
redoks
2 Cr
2 Cr
3+
3+
+ 3 H
+ 3 H
2
2
O
O
2
2
+ 10 OH
+ 10 OH
-
-
→
→
2 CrO
2 CrO
4
4
2
2
-
-
+ 8 H
+ 8 H
2
2
O
O
utlenianie Cr
utlenianie Cr
3+
3+
ż
ż
ó
ó
ł
ł
te zabarwienie
te zabarwienie
2 Cr
2 Cr
3+
3+
+ 3 S
+ 3 S
2
2
O
O
8
8
2
2
-
-
+ 7 H
+ 7 H
2
2
O
O
→
→
2 Cr
2 Cr
2
2
O
O
7
7
2
2
-
-
+ 6 SO
+ 6 SO
4
4
2
2
-
-
+ 14 H
+ 14 H
+
+
pomara
pomara
ń
ń
czowe
czowe
zabarwienie
zabarwienie
utlenianie Mn
utlenianie Mn
2+
2+
Mn
Mn
2+
2+
+ 5 PbO
+ 5 PbO
2
2
+ 4 H+
+ 4 H+
→
→
2 MnO
2 MnO
4
4
-
-
+ 5 Pb
+ 5 Pb
2+
2+
+ 2 H
+ 2 H
2
2
O
O
fioletowe zabarwienie
fioletowe zabarwienie
redukcja Sn
redukcja Sn
2+
2+
i
i
Sn
Sn
4+
4+
[SnCl
[SnCl
6
6
]
]
2
2
-
-
+
+
4 Zn
4 Zn
+ 4 H
+ 4 H
+
+
→
→
SnH
SnH
4 (g)
4 (g)
+
+
4
4
Zn
Zn
2+
2+
+
+
6
6
Cl
Cl
-
-
b
b
łę
łę
kitne zabarwienie
kitne zabarwienie
p
p
ł
ł
omienia podczas
omienia podczas
spalania
spalania
SnH
SnH
4
4
Wydział Chemii UJ Podstawy chemii - wykład 13/12
dr hab. W. Makowski
Analiza anion
Analiza anion
ó
ó
w
w
CrO
CrO
4
4
2
2
-
-
i
i
Cr
Cr
2
2
O
O
7
7
2
2
-
-
(
(ż
ż
ó
ó
ł
ł
t
t
e
e
)
)
osad
osad
barwny
barwny
F
F
-
-
, S
, S
O
O
4
4
2
2
-
-
, SO
, SO
3
3
2
2
-
-
, P
, P
O
O
4
4
3
3
-
-
,
,
C
C
O
O
3
3
2
2
-
-
, C
, C
2
2
O
O
4
4
2
2
-
-
, AsO
, AsO
3
3
3
3
-
-
,
,
AsO
AsO
4
4
3
3
-
-
,
,
S
S
2
2
O
O
3
3
2
2
-
-
, C
, C
4
4
H
H
4
4
O
O
6
6
2
2
-
-
osad
osad
bia
bia
ł
ł
y
y
Aniony
Aniony
str
str
ą
ą
cane
cane
przez Ba
przez Ba
2+
2+
SiO
SiO
3
3
2
2
-
-
(
(ż
ż
ó
ó
ł
ł
ty
ty
)
)
,
,
PO
PO
4
4
3
3
-
-
(
(ż
ż
ó
ó
ł
ł
ty
ty
)
)
,
,
As
As
O
O
3
3
3
3
-
-
(
(ż
ż
ó
ó
ł
ł
ty
ty
)
)
,
,
AsO
AsO
4
4
3
3
-
-
(
(br
br
ą
ą
zowy
zowy
)
)
,
,
CrO
CrO
4
4
2
2
-
-
i
i
Cr
Cr
2
2
O
O
7
7
2
2
-
-
(
(czerwonobrunatn
czerwonobrunatn
e
e
)
)
barwny
barwny
S
S
O
O
3
3
2
2
-
-
,
,
S
S
2
2
O
O
3
3
2
2
-
-
,
,
N
N
O
O
2
2
-
-
, CO
, CO
3
3
2
2
,
,
C
C
2
2
O
O
4
4
2
2
-
-
, CH
, CH
3
3
COO
COO
-
-
,
,
C
C
4
4
H
H
4
4
O
O
6
6
2
2
-
-
bia
bia
ł
ł
y
y
osad rozpuszczalny
osad rozpuszczalny
w
w
HNO
HNO
3
3
Br
Br
-
-
(
(ż
ż
ó
ó
ł
ł
tawy
tawy
)
)
,
,
I
I
-
-
(
(ż
ż
ó
ó
ł
ł
ty
ty
)
)
,
,
S
S
2
2
-
-
(czarny)
(czarny)
barwny
barwny
Cl
Cl
-
-
,
,
CN
CN
-
-
,
,
SCN
SCN
-
-
bia
bia
ł
ł
y
y
osad nierozpuszczalny
osad nierozpuszczalny
w
w
HNO
HNO
3
3
Aniony
Aniony
str
str
ą
ą
cane
cane
przez Ag
przez Ag
+
+

7
Wydział Chemii UJ Podstawy chemii - wykład 13/13
dr hab. W. Makowski
Analiza anion
Analiza anion
ó
ó
w
w
Aniony o
Aniony o
w
w
ł
ł
a
a
ś
ś
ciwo
ciwo
ś
ś
ciach
ciach
utleniaj
utleniaj
ą
ą
cych
cych
(reakcja z
(reakcja z
KI
KI
w obecno
w obecno
ś
ś
ci
ci
H
H
2
2
SO
SO
4
4
i
i
skrobi
skrobi
)
)
Aniony lotnych kwas
Aniony lotnych kwas
ó
ó
w
w
(reakcja z
(reakcja z
HC
HC
l
l
lub H
lub H
2
2
SO
SO
4
4
)
)
Cl
Cl
-
-
, C
, C
2
2
O
O
4
4
2
2
-
-
, As
, As
O
O
3
3
3
3
-
-
,
,
CN
CN
-
-
, C
, C
4
4
H
H
4
4
O
O
6
6
2
2
-
-
odbarwienie rozt
odbarwienie rozt
woru
woru
KMnO
KMnO
4
4
po ogrzaniu
po ogrzaniu
Br
Br
-
-
,
,
I
I
-
-
,
,
N
N
O
O
2
2
-
-
, S
, S
O
O
3
3
2
2
-
-
,
,
S
S
2
2
O
O
3
3
2
2
-
-
,
,
S
S
2
2
-
-
, SCN
, SCN
-
-
natychmiastowe
natychmiastowe
odbarwienie rozt
odbarwienie rozt
woru
woru
KMnO
KMnO
4
4
Aniony o w
Aniony o w
ł
ł
a
a
ś
ś
ciwo
ciwo
ś
ś
ciach
ciach
redukuj
redukuj
ą
ą
cych
cych
(reakcja z
(reakcja z
KMnO
KMnO
4
4
w
w
obecno
obecno
ś
ś
ci
ci
H
H
2
2
SO
SO
4
4
)
)
ClO
ClO
4
4
-
-
, ClO
, ClO
3
3
-
-
,
,
N
N
O
O
3
3
-
-
,
,
N
N
O
O
2
2
-
-
, AsO
, AsO
4
4
3
3
-
-
,
,
CrO
CrO
4
4
2
2
-
-
Cr
Cr
2
2
O
O
7
7
2
2
-
-
, MnO
, MnO
4
4
-
-
granatowe
granatowe
zabarwienie roztworu
zabarwienie roztworu
od
od
I
I
2
2
CN
CN
-
-
, S
, S
2
2
-
-
, CH
, CH
3
3
COO
COO
-
-
charakterystyczny
charakterystyczny
zapach
zapach
S
S
O
O
3
3
2
2
-
-
,
,
S
S
2
2
O
O
3
3
2
2
-
-
,
,
N
N
O
O
2
2
-
-
,
,
CO
CO
3
3
2
2
wydzielanie gazu
wydzielanie gazu
Wydział Chemii UJ Podstawy chemii - wykład 13/14
dr hab. W. Makowski
Reakcje charakterystyczne anion
Reakcje charakterystyczne anion
ó
ó
w
w
SiO
SiO
3
3
2
2
-
-
+ 2 H
+ 2 H
+
+
⇄
⇄
H
H
2
2
SiO
SiO
3 (s)
3 (s)
wykrywanie SiO
wykrywanie SiO
3
3
2
2
-
-
-
-
reakcja z rozcie
reakcja z rozcie
ń
ń
czonymi kwasami lub NH
czonymi kwasami lub NH
4
4
Cl
Cl
bia
bia
ł
ł
y
y
ż
ż
el kwasu krzemowego
el kwasu krzemowego
S
S
2
2
O
O
3
3
2
2
-
-
+ 2 H
+ 2 H
+
+
→
→
S
S
(s)
(s)
+ SO
+ SO
2
2
(g)
(g)
+ H
+ H
2
2
O
O
wykrywanie S
wykrywanie S
2
2
O
O
3
3
2
2
-
-
-
-
reakcja z rozcie
reakcja z rozcie
ń
ń
czonymi kwasami
czonymi kwasami
ż
ż
ó
ó
ł
ł
tobia
tobia
ł
ł
e zm
e zm
ę
ę
tnienie
tnienie
3 Fe
3 Fe
2+
2+
+ 2 H
+ 2 H
+
+
+ NO
+ NO
3
3
-
-
→
→
NO
NO
(g)
(g)
+ 3 Fe
+ 3 Fe
3+
3+
+ 2 H
+ 2 H
2
2
O
O
wykrywanie NO
wykrywanie NO
3
3
-
-
-
-
reakcja obr
reakcja obr
ą
ą
czkowa
czkowa
brunatna obr
brunatna obr
ą
ą
czka
czka
Fe
Fe
2+
2+
+ NO
+ NO
(g)
(g)
+ 5 H
+ 5 H
2
2
O
O
→
→
[Fe(H
[Fe(H
2
2
O)
O)
5
5
(NO)]
(NO)]
2+
2+
[Fe(SCN)
[Fe(SCN)
6
6
]
]
3
3
-
-
+ 6 F
+ 6 F
-
-
⇄
⇄
[FeF
[FeF
6
6
]
]
3
3
-
-
+ 6 SCN
+ 6 SCN
-
-
wykrywanie F
wykrywanie F
-
-
-
-
maskowanie kompleksu [Fe(SCN)6]
maskowanie kompleksu [Fe(SCN)6]
3
3
-
-
odbarwienie
odbarwienie
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
TEMAT 2, TEMAT: BADANIE WŁAŚCIWOŚCI I ANALIZA JAKOŚCIOWA ANIONÓW
ANALIZA JAKOŚCIOWA ANIONÓW, Chemia
analiza jakościowa anionów, Politechnika Śląska ZiIP i inne, Chemia, Chemia notatki
Badanie wlasciwosci i analiza jakosciowa anionow(2), Studia, Chemia, chemia od Ines(1)
Analiza jakościowa kationów i anionów, Analiza jakościowa
Analiza jakościowa kationów i anionów, Energetyka, I rok, chemia
Analiza jakościowa kationów i anionów, Technika Rolnicza i Leśna, Semestr 1, Chemia i Materiałoznaws
Analiza jakościowa kationów i anionów- płyny proste, Analiza jakościowa
Analiza jakościowa Kationów i anionów(1.0 pkt), Mechanika i Budowa Maszyn, Chemia sprawozdania
Analiza jakościowa kationów i anionów, Analiza jakościowa
sprawozdanie elementy analizy jakościowej kationów i anionów
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
analiza jakościowa kationów
4.Analiza jakościowa kationów. Reakcja kationu manganu (Mn2+). NaOH, NH4OH, MnSO4., Państwowa Wyższa
więcej podobnych podstron