
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Maria Norek
Określanie warunków prowadzenia procesów chemicznych
311[31].Z1.01
Poradnik
dla
nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Beata Misiek-Wachowska
mgr inż. Andrzej Wachowski
Opracowanie redakcyjne:
mgr inż. Małgorzata Urbanowicz
Konsultacja:
dr inż. Bożena Zając
Korekta:
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[31].Z1.01
„Określanie warunków prowadzenia procesów chemicznych” zawartego w modułowym
programie nauczania dla zawodu technik technologii chemicznej 311[31].
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Przykładowe scenariusze zajęć
7
5. Ćwiczenia
13
5.1. Klasyfikacja reakcji chemicznych ze względu na stan skupienia reagentów
13
5.1.1. Ćwiczenia 13
5.2. Szybkość reakcji chemicznej, kataliza
16
5.2.1. Ćwiczenia 16
5.3. Równowaga chemiczna
20
5.3.1. Ćwiczenia 20
5.4. Efekty energetyczne przemian chemicznych. Funkcje termodynamiczne
22
5.4.1. Ćwiczenia 22
6. Ewaluacja osiągnięć ucznia
25
7. Literatura
37

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy
Państwu Poradnik dla nauczyciela „Określanie warunków prowadzenia
procesów chemicznych” który będzie pomocny w prowadzeniu zajęć dydaktycznych w szkole
kształcącej w zawodzie technik technologii chemicznej 311[31].
W poradniku zamieszczono:
− wymagania wstępne,
− wykaz umiejętności, jakie uczeń opanuje podczas zajęć,
− przykładowe scenariusze zajęć,
− propozycje ćwiczeń, które mają na celu ukształtowanie umiejętności praktycznych
uczniów,
− wykaz literatury, z jakiej uczniowie mogą korzystać podczas nauki,
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze szczególnym
uwzględnieniem:
− tekstu przewodniego,
− metody projektów,
− ćwiczeń praktycznych.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od samodzielnej
pracy uczniów do pracy zespołowej.
W celu sprawdzenia wiadomości i umiejętności ucznia, nauczyciel może posłużyć się
zamieszczonym w rozdziale 6 zestawem zadań testowych, zawierającym różnego rodzaju
zadania oraz przeprowadzić test praktyczny wysoko symulowany.
W tym rozdziale podano do testu:
− plan testu w formie tabelarycznej,
− punktację zadań,
− propozycje norm wymagań,
− instrukcję dla nauczyciela,
− instrukcję dla ucznia,
− kartę odpowiedzi,
− zestaw zadań testowych.
Test praktyczny wysoko symulowany zawiera:
− plan testu w formie tabelarycznej,
− punktację zadań,
− propozycje norm wymagań,
− instrukcję dla nauczyciela,
− instrukcję dla ucznia,
− kartę pracy,
− kartę oceny.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
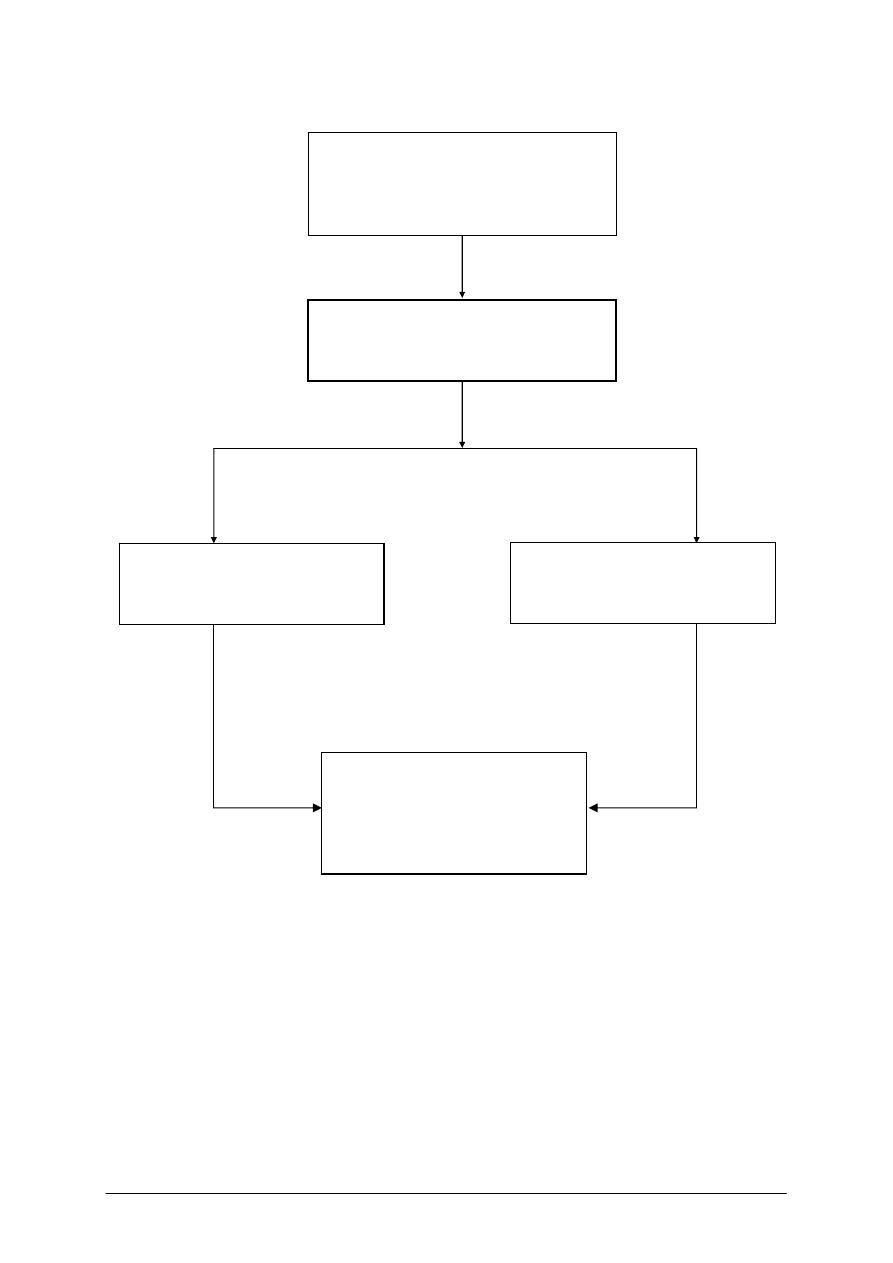
Schemat układu jednostek modułowych
311[31]. Z1. 04
Opracowanie koncepcji
procesów wytwarzania
półproduktów i produktów
przemysłu chemicznego
311[31]. Z1. 01
Określanie warunków prowadzenia
procesów chemicznych
311[31]. Z1
Fizykochemiczne podstawy
wytwarzania półproduktów
i produktów przemysłu chemicznego
311[31]. Z1. 02
Zastosowanie podstawowych
procesów fizycznych
311[31]. Z1. 03
Zastosowanie podstawowych
procesów chemicznych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej, uczeń powinien umieć:
– korzystać z różnych źródeł informacji,
– posługiwać się poprawną nomenklaturą i symboliką chemiczną,
– posługiwać się pojęciami: szybkość reakcji chemicznej, katalizator, stan i stała
równowagi chemicznej, reakcje egzo- i endotermiczne,
– zapisywać wyrażenie na stężeniową stałą równowagi dowolnej reakcji odwracalnej
na podstawie jej równania stechiometrycznego,
– określić jakościowo skład mieszaniny reakcyjnej,
– interpretować schematyczne wykresy zmian energii układu w reakcjach egzo-
i endotermicznych, stosując pojęcie energii aktywacji,
– rozpoznawać podstawowy sprzęt laboratoryjny,
– przestrzegać przepisów bhp w pracowni chemicznej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej, uczeń powinien:
− scharakteryzować podstawowe procesy chemiczne,
− określić warunki prowadzenia podstawowych reakcji chemicznych,
− wykonać obliczenia stechiometryczne dla podstawowych przemian chemicznych
zachodzących w warunkach rzeczywistych,
− obliczyć efekty energetyczne przemian chemicznych,
− określić wpływ zmian temperatury, ciśnienia i stężenia na szybkość reakcji chemicznej,
− określić wpływ katalizatora na szybkość reakcji chemicznej,
− określić wpływ zmian temperatury, ciśnienia i stężenia na stan równowagi chemicznej,
− zinterpretować wyniki badań laboratoryjnych,
− zastosować przepisy bhp oraz ochrony przeciwpożarowej podczas wykonywania prac
laboratoryjnych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca ……………………………………………….
Modułowy program nauczania: Technik technologii chemicznej 311[31]
Moduł:
Fizykochemiczne podstawy wytwarzania
półproduktów i produktów przemysłu
chemicznego
311[31].Z1
Jednostka modułowa:
Określanie warunków prowadzenia
procesów chemicznych
311[31].Z1.01
Temat: Wyznaczanie efektu energetycznego reakcji zobojętniania.
Cel ogólny: kształtowanie umiejętności wyznaczania efektu energetycznego reakcji.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
− przygotować sprzęt laboratoryjny,
− przygotować niezbędne odczynniki,
− zorganizować stanowisko pracy zgodnie z zasadami bezpiecznej pracy,
− zaplanować czynności,
− wyznaczyć efekt energetyczny reakcji zobojętniania,
− zinterpretować wyniki badań.
Metody nauczania–uczenia się:
−
metoda tekstu przewodniego,
−
ćwiczenia praktyczne.
Formy organizacyjne pracy uczniów:
−
indywidualna.
Czas: 90 minut.
Środki dydaktyczne:
− tekst przewodni do wykonania zadania,
− sprzęt laboratoryjny do analizy objętościowej,
− odczynniki,
− badana próbka,
− samodzielne stanowisko przy stole laboratoryjnym.
Przebieg zajęć:
Zadanie dla ucznia:
Wyznacz efekt energetyczny reakcji zobojętniania.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Tekst przewodni do wykonywania zadania
Działania
Lp. Nazwa etapu
nauczyciela uczniów
1. Informacje
1.
2.
3.
Pytania i polecenia wprowadzające:
Jakie reakcje nazywamy egzo-
i endoenergetycznymi?
Wyjaśnij znaczenie zapisów: ∆H>0, ∆H<0.
Do jakich reakcji energetycznych zalicza się
reakcje zobojętniania?
Odpowiadają
na pytania
wprowadzające.
1.
2.
3.
4.
5.
6.
Pytania i polecenia prowadzące:
Zapisz równanie reakcji zobojętniania
zachodzącej między kwasem solnym
i wodorotlenkiem sodu w formie.
cząsteczkowej i jonowej skróconej.
Zapoznaj się z budową i zasadą działania
kalorymetru.
Odszukaj w instrukcji stałą kalorymetru,
zapisz jej wartość.
Zapisz wzór do obliczenia efektu cieplnego
reakcji.
Jakimi zasadami bhp należy kierować się
przy wykonywaniu ćwiczenia?
Zaplanuj kolejność czynności niezbędnych
do wykonania ćwiczenia.
2. Planowanie
Odpowiadają
na pytania
i wykonują
polecenia,
planują kolejność
czynności.
3. Ustalenia
1. Analizuje kolejność czynności
zaplanowanych przez uczniów.
2. Podaje sposób przedstawienia wyników.
3. Wspólne z uczniami ustala kryteria
oceniania zadania.
Dyskutują nad
ustalonym
planem,
wspólnie
z nauczycielem
ustalają kryteria
oceniania
zadania.
4. Wykonanie 1. Zwraca uwagę na bezpieczeństwo pracy
podczas przeprowadzania reakcji.
2. Czuwa nad prawidłowym przebiegiem
wykonywania ćwiczenia.
3. Podaje sposób przedstawienia przebiegu
ćwiczenia w tabelach i na wykresach
Kolejny odczyt – n
Temperatura
T [
0
C]
Kolejny odczyt – n
’
Temperatura
T
’
[
0
C]
Wykonują
ćwiczenie,
sporządzają
wykresy zmian
temperatury
w zależności
od n, obliczają
efekt
energetyczny.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Działania
Lp. Nazwa etapu
nauczyciela uczniów
5. Sprawdzenie 1. Ocenia wykonane zadania zgodnie
z przyjętymi kryteriami.
2. Wskazuje nieprawidłowości wykonania
poszczególnych czynności.
Dokonują
samooceny.
6. Analiza
Zadaje pytania uczniom:
1. Co sprawiło Ci największą trudność przy
wykonywaniu zadania?
2. Gdzie tkwi przyczyna wystąpienia tej
trudności?
Odpowiadają
na pytania.
Kryteria oceny
Lp.
Czynności
Kryterium oceny
Punktacja
1.
Przygotowanie
stanowiska pracy
Poprawne:
- zorganizowanie stanowiska,
- dobranie sprzętu
i odczynników chemicznych.
1
1
2.
Wykonanie zadania
Poprawne:
- zmontowanie zestawu,
- przeprowadzenie reakcji
zobojętniania,
- wykonanie pomiarów temperatury
w czasie,
- wykonanie wykresów,
- zapisanie równań reakcji,
- obliczenie liczby moli wody
powstającej w reakcji
zobojętniania,
- obliczenie efektu energetycznego
reakcji.
1
2
2
2
2
1
2
3. Przestrzeganie przepisów bhp.
1
4. Zachowanie porządku na stanowisku pracy.
1
Razem
16
Punktacja
16 – 14 pkt – bdb
13 – 12 pkt – db
11 – 9 pkt – dst
8 – 7 pkt – dop
poniżej 7 pkt – ndst

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
Zakończenie zajęć
Praca domowa
Określ typy podanych reakcji chemicznych I, II i III ze względu na efekt energetyczny
procesu:
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
sprawdzenie arkuszy tekstu przewodniego.
I 2CuO
+ C
2Cu + CO
2
∆H > 0
II N
2
+ 3H
2
2NH
3
∆H < 0
III CaSiO
3
CaO + SiO
2
∆H > 0

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Scenariusz zajęć 2
Osoba prowadząca ……………………………………………….
Modułowy program nauczania: Technik technologii chemicznej 311[31]
Moduł:
Fizykochemiczne podstawy wytwarzania
półproduktów i produktów przemysłu
chemicznego
311[31].01
Jednostka modułowa:
Określanie warunków prowadzenia
procesów chemicznych
311[31].Z1.01
Temat: Określanie wpływu zmian temperatury i ciśnienia na stan równowagi
chemicznej.
Cel ogólny: kształtowanie umiejętności określenia wpływu zmian temperatury i ciśnienia
na stan równowagi chemicznej.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
− podać regułę przekory Le Chatelier
’
a-Brauna,
− określić wpływ zmian temperatury i ciśnienia na stan równowagi chemicznej,
− zaproponować zmiany prowadzące do zwiększenia wydajności reakcji odwracalnej,
− zapisać wyrażenia na stałą równowagi reakcji.
Metody nauczania – uczenia się:
−
metoda problemowa.
Formy organizacyjne pracy uczniów:
−
indywidualna.
Czas: 45 minut.
Środki dydaktyczne:
− materiał nauczania z punktu 4.3.1. (Poradnik dla ucznia),
− literatura z rozdziału 7.
Przebieg zajęć:
1. Podanie reguły przekory Le Chatelier
’
a-Brauna.
2. Podanie zadań problemowych do rozwiązania przez uczniów.
3. Zapisanie wyrażenia na stałą równowagi reakcji.
4. Określenie wpływu ciśnienia i temperatury na stan równowagi reakcji korzystając z reguły
przekory.
5. Weryfikacja odpowiedzi.
6. Ocena.
7. Zadanie pracy domowej.
Przykładowe zadania problemowe
1. Określ, w którą stronę przesunie się stan równowagi reakcji:
2CO
(g)
+ O
2(g)
2CO
2(g)
∆H= -565, 95 kJ
jeśli nastąpi:
a) wzrost temperatury
b) ochłodzenie układu
c) wzrost ciśnienia
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
2. Zakładając, że reakcja przedstawiona równaniem:
2NO
(g)
+ O
2(g)
2NO
2(g)
jest egzoenergetyczna oraz, że przebiega jednoetapowo, określ:
a) jaki wpływ na położenie stanu równowagi ma ogrzewanie całego układu?
b) jaki wpływ na położenie stanu równowagi będzie miał katalizator?
c) jak wpłynie na stan równowagi wzrost ciśnienia?
3. Podaj co najmniej dwa sposoby, które można zastosować, aby przesunąć w prawo
równowagę reakcji podanej poniżej:
N
2(g)
+ O
2(g)
2NO
(g)
∆H= 181 kJ
Zakończenie zajęć
Praca domowa
Określ, jak przy wzroście ciśnienia przesunie się równowaga następujących reakcji:
2SO
2(g)
+ O
2(g)
2SO
3(g)
CO
2(g)
+ H
2(g)
CO
(g)
+ H
2
O
(g)
2NO
2(g)
2NO
(g)
+ O
2(g)
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
− anonimowa ankieta dotycząca trudności podczas rozwiązywania problemu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
5. ĆWICZENIA
5.1. Klasyfikacja reakcji chemicznych ze względu na stan
skupienia reagentów
5.1.1. Ćwiczenia
Ćwiczenie 1
Oblicz składy mieszanin gazowych w procentach masowych i objętościowych.
Zadania do rozwiązania
− Mieszanina zawiera 70% masowych wodoru i 30% masowych tlenu. Oblicz procentowy
skład objętościowy.
− Oblicz procentowy skład masowy mieszaniny zawierającej 25 % objętościowych tlenku
siarki (IV) oraz tlen.
− Mieszanina zawiera 2 mole tlenku węgla (II) i 3 mole tlenku węgla (IV). Oblicz zawartość
procentową tlenku węgla (II) w procentach masowych i objętościowych.
− Jaki warunek muszą spełniać masy molowe gazów w mieszaninie dwuskładnikowej, aby
stosunek masowy był równy stosunkowi objętościowemu?
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapisać wzory na zawartość procentową (masową i objętościową) składnika
w mieszaninie,
2) podać wartość objętości molowej gazów w warunkach normalnych,
3) zapisać wzór na objętość molową gazu (warunki normalne),
4) zapisać wzory pozwalające na przeliczenie składu molowego mieszaniny gazowej na jej
masę i objętość,
5) wykonać obliczenia,
6) sprawdzić poprawność wykonania ćwiczenia.
Zalecane metody nauczania–uczenia się:
− ćwiczenia obliczeniowe.
Środki dydaktyczne:
− układ okresowy pierwiastków chemicznych,
− kalkulator,
− materiał nauczania z punktu 4.1.1. (Poradnik dla ucznia),
− literatura z rozdziału 7.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Ćwiczenie 2
Oblicz niezbędną ilość surowców z uwzględnieniem wydajności reakcji chemicznej.
Zadania do rozwiązania
− Oblicz, ile kg amoniaku należy użyć do otrzymania 100 m
3
NO (warunki normalne).
Wydajność reakcji utleniania NH
3
do NO wynosi 90%.
− Kwas siarkowy (VI) powstaje w wyniku następujących reakcji:
S + O
2
SO
2
2SO
2
+ O
2
2SO
3
SO
3
+ H
2
O H
2
SO
4
Oblicz całkowitą wydajność reakcji otrzymywania kwasu siarkowego (VI), jeżeli
wiadomo, że z 20 kg siarki powstają 42 kg kwasu siarkowego (VI) o stężeniu 96%.
− Kwas azotowy (V) powstaje w wyniku trzech następujących po sobie reakcji o podanych
obok wydajnościach:
4NH
3
+ 5O
2
4NO + 6H
2
O W
1
= 80%
2NO + O
2
2NO
2
W
2
= 95%
3NO
2
+ H
2
O 2HNO
3
+ NO W
3
= 90%
Oblicz, ile kg NH
3
należy użyć w celu otrzymania 1 t 65% HNO
3
.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapisać wzór na wydajność reakcji,
2) zapisać wzór na wydajność reakcji przebiegających przez szereg etapów o różnych
wydajnościach,
3) wykonać obliczenia,
4) sprawdzić poprawność wykonania ćwiczenia.
Zalecane metody nauczania–uczenia się:
− ćwiczenia obliczeniowe.
Środki dydaktyczne:
− układ okresowy pierwiastków chemicznych,
− kalkulator,
− materiał nauczania z punktu 4.1.1. (Poradnik dla ucznia),
− literatura z rozdziału 7.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Ćwiczenie 3
Oblicz niezbędną ilość surowców z uwzględnieniem ich czystości.
Zadania do rozwiązania.
− Oblicz masę wapienia, zawierającego 75 % węglanu wapnia, który należy wyprażyć
w celu otrzymania 29 kg tlenku wapnia.
− Ile kg żelaza można otrzymać z 500 kg magnetytu (Fe
3
O
4
) zawierającego 10%
zanieczyszczeń?
− 10 g stali spalono w strumieniu tlenu i otrzymano 0,2 g CO
2
. Ile procent węgla zawierała
stal?
− Oblicz ilość koksu, zawierającego 90% węgla, z którego w reakcji z parą wodną można
otrzymać 1500 m
3
wodoru. Produktami reakcji zgazowania węgla są CO i H
2
.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapisać równania reakcji,
2) wykonać obliczenia uwzględniając czystość surowców,
3) sprawdzić poprawność wykonania ćwiczenia.
Zalecane metody nauczania–uczenia się:
− ćwiczenia obliczeniowe.
Środki dydaktyczne:
− układ okresowy pierwiastków chemicznych,
− kalkulator,
− materiał nauczania z punktu 4.1.1. (Poradnik dla ucznia),
− literatura z rozdziału 7.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
5.2. Szybkość reakcji chemicznej, kataliza
5.2.1. Ćwiczenia
Ćwiczenie 1
Oblicz zmiany szybkości reakcji chemicznych wywołanych zmianami stężenia
i temperatury.
Zadania do rozwiązania
1. Jak zmieni się szybkość reakcji
2NO + 2H
2
N
2
+ 2H
2
O
przebiegającej w fazie gazowej, według równania kinetycznego:
υ = k [NO]
2
[H
2
]
jeżeli zwiększy się dwukrotnie stężenia obu substratów?
2. Do dwóch identycznych naczyń wprowadzono: do pierwszego – 1 kg substancji A
i 1 kg substancji B, do drugiego – 0,5 kg substancji A i 0,5 kg substancji B. Reakcja
przebiega według równania: A + B C + D w fazie gazowej, z szybkością
υ = k [A][B]. Czy w obu naczyniach szybkość reakcji w momencie jej rozpoczęcia
będzie jednakowa?
3. Jak zmieni się szybkość reakcji po obniżeniu temperatury o 20
0
?
4. Jak zmieni się szybkość reakcji przebiegającej w fazie gazowej,
2NO + 2H
2
N
2
+ 2H
2
O
według równania kinetycznego:
υ = k [NO]
2
[H
2
]
jeżeli zmniejszy się trzykrotnie objętość przestrzeni reakcyjnej?
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
2) oznaczyć stężenia substratów przed ich zwiększeniem, np. [NO]=x, [H
2
]=y,
3) obliczyć stężenia substratów po ich dwukrotnym zwiększeniu,
4) wyznaczyć szybkości reakcji dla stężeń początkowych i dwukrotnie zwiększonych,
5) porównać υ
1
i υ
2
,
6) udzielić odpowiedzi,
7) sprawdzić poprawność wykonania ćwiczenia.
Zalecane metody nauczania–uczenia się:
− ćwiczenia obliczeniowe.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Środki dydaktyczne:
− kalkulator,
− materiał nauczania z punktu 4.2.1. (Poradnik dla ucznia),
− literatura z rozdziału 7.
Ćwiczenie 2
Zbadaj wpływ zmian temperatury na szybkość reakcji chemicznej.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy,
2) przygotować sprzęt laboratoryjny: 4 zlewki o poj. 250 cm
3
, 4 probówki, termometr
do 150
0
C,
3) przygotować odczynniki: roztwór KMnO
4
o stężeniu c=0,02 mol·dm
-3
, roztwór H
2
C
2
O
4
o stężeniu c=0,05 mol·dm
-3
, roztwór H
2
SO
4
o stężeniu c=1,0 mol·dm
-3
,
4) do zlewek wlać po ok. 200 cm
3
wody i ogrzać w łaźni wodnej do temperatury: pierwszą –
20
0
C, drugą – 50
0
C, trzecią – 70
0
C, czwartą – 90
0
C,
5) do probówek wlać po 2 cm
3
roztworów KMnO
4
i H
2
C
2
O
4
oraz po 1 cm
3
roztworu H
2
SO
4
,
6) zanurzyć probówki jednocześnie każdą w innej zlewce z wodą, o podanych wyżej
temperaturach,
7) obserwować, po jakim czasie nastąpi odbarwienie roztworu w każdej probówce,
8) zapisać czas reakcji przebiegających w probówkach, w różnych temperaturach,
9) zapisać wnioski dotyczące wpływu temperatury na szybkość reakcji,
10) zapisać przebieg ćwiczenia w dzienniczku laboratoryjnym.
Zalecane metody nauczania–uczenia się:
− metoda tekstu przewodniego,
− ćwiczenia praktyczne.
Środki dydaktyczne:
− tekst przewodni do wykonania zadania,
− sprzęt laboratoryjny,
− odczynniki chemiczne,
− stół laboratoryjny,
− łaźnia wodna.
Ćwiczenie 3
Zbadaj wpływ rozdrobnienia i stanu powierzchni ciała stałego na szybkość reakcji
chemicznej.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) zorganizować stanowisko pracy,
2) przygotować sprzęt laboratoryjny: 3 zlewki o poj. 100 cm
3
, cylinder miarowy
o poj. 50 cm
3
,
3) przygotować odczynniki: wstążka magnezowa, roztwór kwasu solnego o stężeniu
c=1,0 mol·dm
-3
,
4) uciąć trzy odcinki wstążki magnezowej o długości 3 cm,
5) jeden kawałek wstążki magnezowej pozostawić w całości – próbka nr 1,
6) drugi kawałek wstążki magnezowej podzielić na cztery części – próbka nr 2,
7) trzeci kawałek wstążki magnezowej podzielić na dziesięć części – próbka nr 3,
8) zlewki oznaczyć numerami 1, 2, 3 i wlać do nich po ok. 30 cm
3
roztworu HCl,
9) przygotowane próbki magnezu wrzucić do oznaczonych zlewek z roztworem HCl,
10) obserwować intensywność wydzielania się gazu w poszczególnych zlewkach,
11) zapisać wnioski dotyczące wpływu rozdrobnienia i stanu powierzchni ciała stałego
na szybkość reakcji,
12) zapisać przebieg ćwiczenia w dzienniczku laboratoryjnym.
Zalecane metody nauczania–uczenia się:
− metoda tekstu przewodniego,
− ćwiczenia praktyczne.
Środki dydaktyczne:
− sprzęt laboratoryjny,
− odczynniki chemiczne,
− stół laboratoryjny,
− nożyczki.
Ćwiczenie 4
Wyznacz wpływ katalizatora na szybkość reakcji chemicznej.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie powinieneś:
1) zorganizować stanowisko pracy,
2) przygotować sprzęt laboratoryjny: 4 kolby stożkowe o poj. 100 cm
3
, 2 kolby stożkowe
o poj. 100 cm
3
z korkiem, 3 pipety (2 cm
3
,
5 cm
3
, 10 cm
3
),
3) przygotować odczynniki: octan etylu, roztwór HCl o stężeniu c=1,5mol·dm
-3
, mianowany
roztwór NaOH o stężeniu c=0,1000 mol·dm
-3
,
4) do dwóch kolb z korkami wlać: 50 cm
3
roztworu HCl i 50 cm
3
wody destylowanej,
5) do kolby zawierającej wodę dodać 2 cm
3
octanu etylu, zanotować czas rozpoczęcia
reakcji,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
6) po upływie ok. 10 minut dodać 2cm
3
octanu etylu do drugiej kolby zawierającej roztwór
HCl, zanotować czas rozpoczęcia reakcji,
7) po 20 minutach od chwili rozpoczęcia reakcji w kolbie pierwszej pobrać z niej 2 cm
3
roztworu, przenieść do pustej kolby, rozcieńczyć wodą do obj. 10 cm
3
i zmiareczkować
roztworem NaOH o stężeniu c=0,1000 mol·dm
-3
, używając fenoloftaleiny jako wskaźnika,
8) zanotować objętość zużytego roztworu NaOH (V
1t
),
9) przeprowadzić czynności analogiczne dla roztworu w drugiej kolbie, zawierającego HCl,
zanotować objętość zużytego roztworu NaOH (V
2t
), której wartość pozwala wyznaczyć
łączną zawartość kwasu solnego i kwasu octowego w danej chwili,
10) wykonać podobne oznaczenia po ok. 60 minutach,
11) oznaczyć objętość NaOH (V
0
) potrzebną do zobojętnienia kwasu solnego obecnego
w roztworze i pełniącego rolę katalizatora: do kolby wlać 50 cm
3
roztworu HCl, dodać
2cm
3
wody, wymieszać, pobrać 2 cm
3
roztworu, rozcieńczyć wodą do 10 cm
3
i zmiareczkować roztworem NaOH,
12) zanotować wartości objętości roztworu NaOH (V
0
),
13) zapisać równanie reakcji hydrolizy estru,
14) wyniki przedstawić w tabeli:
Badane roztwory
Czas
[min]
Objętość NaOH
[cm
3
]
V
tNaOH
–
V
0NaOH
[cm
3
]
Zawartość
kwasu octowego
[mol]
Octan etylu i woda
(kolba nr 1)
t
o
= 0
t
1
= 20
t
2
= 90
V
0
V
1t
V
2t
Octan etylu i kwas
solny
(kolba nr 2)
t
o
= 0
t
1
= 20
t
2
= 90
V
0
V
1t
V
2t
15) podać wnioski,
16) zapisać przebieg ćwiczenia w dzienniczku laboratoryjnym.
Zalecane metody nauczania–uczenia się:
− metoda tekstu przewodniego, ćwiczenia praktyczne.
Środki dydaktyczne:
− sprzęt laboratoryjny, odczynniki chemiczne,
− stół laboratoryjny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
5.3. Równowaga chemiczna
5.3.1. Ćwiczenia
Ćwiczenie 1
Oblicz skład mieszaniny gazowej w stanie równowagi.
Zadania do rozwiązania
1. W zamkniętym naczyniu umieszczono 2 mole CO
2
i 8 moli H
2
. Po ogrzaniu
do temperatury 1100K ustaliła się równowaga:
CO
2(g)
+ H
2(g)
CO
(g)
+ H
2
O
(g)
W tych warunkach K=1. Oblicz liczbę moli każdego gazu w stanie równowagi.
2. Dwutlenek węgla ulega w wysokiej temperaturze dysocjacji termicznej na CO i O
2
.
Oblicz procentowy skład objętościowy mieszaniny gazów w stanie równowagi, jeżeli
20% CO
2
uległo rozkładowi.
3. Oblicz skład mieszaniny reagentów gazowych (w % objętościowych) w stanie
równowagi reakcji:
C
(s)
+ O
2(g)
CO
2(g)
w temperaturze ok. 1500K, jeżeli stała K wynosi 0,298.
4. Równowaga reakcji:
I
2(g)
+ H
2(g)
2HI
(g)
ustaliła się przy następujących stężeniach: [H
2
]=0,25 mol·dm
-3
, [I
2
]=0,05 mol·dm
-3
,
[HI]=0,9 mol·dm
-3
. Oblicz wyjściowe stężenia substratów.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapisać wyrażenie na stałą równowagi reakcji,
2) ułożyć bilans materiałowy reagentów, uwzględniając liczby moli reagentów: początkowe,
które przereagowały i w stanie równowagi,
3) wykonać obliczenia,
4) sprawdzić poprawność wykonania ćwiczenia.
Zalecane metody nauczania–uczenia się:
− ćwiczenia obliczeniowe.
Środki dydaktyczne:
− kalkulator,
− materiał nauczania z punktu 4.3.1. (Poradnik dla ucznia),
− literatura z rozdziału 7.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
Ćwiczenie 2
Określ wpływ zmian temperatury i ciśnienia na stan równowagi chemicznej.
Zadania do rozwiązania
1. Określ, w którą stronę przesunie się stan równowagi reakcji:
2CO
(g)
+ O
2(g)
2CO
2(g)
∆H= -565, 95 kJ
jeśli nastąpi:
a) wzrost temperatury
d) ochłodzenie układu
e) wzrost ciśnienia
2. Zakładając, że reakcja przedstawiona równaniem:
2NO
(g)
+ O
2(g)
2NO
2(g)
jest egzoenergetyczna oraz, że przebiega jednoetapowo, określ:
a) jaki wpływ na położenie stanu równowagi ma ogrzewanie całego układu
b) jaki wpływ na położenie stanu równowagi będzie miał katalizator
c) jak wpłynie na stan równowagi wzrost ciśnienia
3. Podaj co najmniej dwa sposoby, które można zastosować, aby przesunąć w prawo
równowagę reakcji podanej poniżej:
N
2(g)
+ O
2(g)
2NO
(g)
∆H= 181 kJ
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapisać wyrażenie na stałą równowagi reakcji,
2) określić wpływ ciśnienia i temperatury na stan równowagi reakcji korzystając z reguły
przekory,
3) sprawdzić poprawność wykonania ćwiczenia.
Zalecane metody nauczania–uczenia się:
–
ćwiczenia problemowe.
Środki dydaktyczne:
− materiał nauczania z punktu 4.3.1. (Poradnik dla ucznia),
− literatura z rozdziału 7.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
5.4. Efekty energetyczne przemian chemicznych
Funkcje termodynamiczne
5.4.1. Ćwiczenia
Ćwiczenie 1
Oblicz entalpie reakcji.
Zadania do rozwiązania
1. Na podstawie entalpii następujących reakcji:
oblicz entalpię reakcji:
2. Wykorzystując poniżej podane entalpie tworzenia reagentów, oblicz entalpię reakcji:
3. Wykorzystując poniżej podane entalpie spalania reagentów, oblicz entalpię reakcji:
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zastosować prawo Hessa i prawo Lavoisiera-Laplace
’
a,
2) zastosować metodę sumowania równań reakcji (zadanie 1),
1) Mg
(s)
+ C
(grafit)
+ 1,5O
2(g)
MgCO
3(s)
∆H
0
298
= - 1112,9 kJ
2) Mg
(s)
+ 0,5O
2(g)
MgO
(s)
∆H
0
298
= - 601,8 kJ
3) C
(grafit)
+ O
2(g)
CO
2(g)
∆H
0
298
= - 393,5 kJ
MgO
(s)
+ CO
2(g)
MgCO
3(s)
NH
3(g)
+ HCl
(g)
NH
4
Cl
(s)
∆H
0
298tw. NH
3(g)
= - 46,3 kJ · mol
-1
∆H
0
298tw. HCl
(g)
= - 92,5 kJ · mol
-1
∆H
0
298tw. NH
4
Cl
(s)
= - 314,0 kJ · mol
-1
C
2
H
2(g)
+ H
2
O
(c)
CH
3
CHO
(c)
∆H
0
298 H
2
O
(c)
= 0
∆H
0
298tw. C
2
H
2(g)
= - 1300 kJ · mol
-1
∆H
0
298tw. CH
3
CHO
(c)
= - 1199 kJ · mol
-1
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
3) zapisać wzór, na postawie którego można obliczyć entalpię reakcji, korzystając z entalpii
tworzenia reagentów (zadanie 2),
4) zapisać wzór, na postawie którego można obliczyć entalpię reakcji, korzystając z entalpii
spalania reagentów (zadanie 3),
5) wykonać obliczenia,
6) sprawdzić poprawność wykonania ćwiczenia.
Zalecane metody nauczania–uczenia się:
− ćwiczenia obliczeniowe.
Środki dydaktyczne:
− kalkulator,
− materiał nauczania z punktów 4.4.1. (Poradnik dla ucznia),
− literatura z rozdziału 7.
Ćwiczenie 2
Wyznacz efekt energetyczny reakcji zobojętniania.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia z uwzględnieniem przepisów bezpieczeństwa i higieny pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zorganizować stanowisko pracy,
2) przygotować odczynniki: roztwór NaOH o stężeniu 1 mol·dm
-3
, roztwór HCl o stężeniu
1 mol·dm
-3
,
3) przygotować sprzęt: kolba miarowa o poj. 1000 cm
3
, cylinder o poj. 100 cm
3
, kalorymetr
ze zlewką o poj. 1500 cm
3
i termometrem do 50
0
C, mieszadło, pipeta – 10 cm
3
,
4) odmierzyć cylindrem 100 cm
3
roztworu NaOH, wlać do kolby miarowej, uzupełnić wodą
destylowaną,
5) schłodzić kolbę strumieniem zimnej wody i przelać roztwór do suchej zlewki kalorymetru,
6) zanurzyć mieszadło, zamknąć kalorymetr przykrywką, wstawić termometr i przy
włączonym mieszadle wykonać 10 odczytów temperatury w odstępach półminutowych,
7) dodać szybko pipetą 10 cm
3
roztworu HCl przez otwór w przykrywce i wykonać
co najmniej 20 dalszych odczytów w odstępach półminutowych,
8) wyniki pomiarów zapisać w tabeli:
Kolejny
odczyt
–
n
Temperatura
T [
0
C]
9) wykonać takie same pomiary umieszczając w kalorymetrze 1 dm
3
wody destylowanej
w miejsce roztworu NaOH, w celu wyznaczenia poprawki na ciepło rozcieńczania kwasu
solnego, wyniki zapisać w tabeli:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Kolejny odczyt – n
’
Temperatura
T
’
[
0
C]
10) sporządzić wykresy zmian temperatury w zależności od n dla obydwu doświadczeń,
11) zapisać równanie reakcji zobojętniania w formie cząsteczkowej i jonowej skróconej,
12) obliczyć liczbę moli wody powstającej w wyniku reakcji zobojętniania,
13) obliczyć molowe ciepło reakcji zobojętniania Q
p
, przy czym wzrost temperatury
spowodowany wyłącznie efektem cieplnym reakcji wynosi (∆T – ∆T
’
), gdzie ∆T – wzrost
temperatury układu wynikający z reakcji zobojętniania i rozcieńczania kwasu,
∆T
’
- wzrost temperatury wynikającym z rozcieńczenia kwasu, Q
p
= K· n · (∆T – ∆T
’
)
K – stała kalorymetru [kJ· K
-1
], n – liczba moli produktu (wody),
14) zapisać przebieg ćwiczenia w dzienniczku laboratoryjnym.
Zalecane metody nauczania–uczenia się:
– metoda tekstu przewodniego,
– ćwiczenia praktyczne.
Środki dydaktyczne:
− tekst przewodni do wykonania zadania,
− samodzielne stanowisko przy stole laboratoryjnym,
− sprzęt laboratoryjny,
− kalorymetr,
− odczynniki,
− stoper.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
TEST 1
Test do jednostki modułowej „Określanie warunków prowadzenia
procesów chemicznych”
Test składa się z 20 zadań, z których:
− zadania 1, 2, 3, 4, 7, 9, 12, 13, 14, 15, 16, 18, 20 są z poziomu podstawowego,
− zadania 5, 6, 8, 10, 11, 17, 19 są z poziomu ponadpodstawowego.
Punktacja zadań 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące oceny szkolne:
-
dopuszczający – za rozwiązanie co najmniej 8 zadań z poziomu podstawowego,
-
dostateczny – za rozwiązanie co najmniej 11 zadań z poziomu podstawowego,
-
dobry – za rozwiązanie 15 zadań, w tym co najmniej 4 z poziomu ponadpodstawowego,
-
bardzo dobry – za rozwiązanie 17 zadań, w tym co najmniej 6 z poziomu
ponadpodstawowego,
Klucz odpowiedzi: 1. d, 2. c, 3. c, 4. b, 5. c, 6. b, 7. a, 8. d, 9. b, 10. d, 11. a,
12. c, 13. b, 14. a, 15. d, 16. c, 17. a, 18. c, 19. c, 20.
d
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Podać czynnik wpływający na
szybkość reakcji
A P d
2 Wskazać reakcję odwracalną
B
P
c
3
Podać określenie energii aktywacji
reakcji chemicznej
A P c
4
Podać warunki stanu równowagi
dynamicznej reakcji chemicznej
A P b
5
Podać równanie wyrażające prawo
działania mas
A PP c
6
Określić na podstawie równania
kinetycznego wpływ ciśnienia
reagentów na stan równowagi
chemicznej
C PP b
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
7
Określić wpływ ciśnienia na położenie
stanu równowagi na podstawie
równania reakcji
C P a
8
Określić wpływ parametrów na
wydajność reakcji odwracalnej
C PP d
9
Obliczyć procentowy skład
objętościowy mieszaniny gazowej na
podstawie procentowego składu
masowego
C P B
10
Obliczyć objętość surowca gazowego
z uwzględnieniem wydajności reakcji
C PP d
11
Obliczyć wydajność całkowitą procesu
na podstawie wydajności
poszczególnych etapów
C PP a
12
Obliczyć ilość surowca
z uwzględnieniem wydajności reakcji
C P c
13
Podać określenie katalizatora
dodatniego
A P b
14 Podać określenie autokatalizy
A
P
a
15
Podać czynnik wpływający na stan
równowagi
A P d
16 Ustalić, czego dotyczy prawo Hessa
B
P
c
17
Obliczyć entalpię reakcji na podstawie
entalpii pośrednich reakcji
chemicznych
C PP a
18
Wskazać proces przebiegający
ze zmniejszeniem entropii
B P c
19
Obliczyć entalpię reakcji na podstawie
standardowych entalpii tworzenia
reagentów
C PP c
20 Podać warunek samorzutności procesu
A
P
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Przebieg testowania
INSTRUKCJA DLA NAUCZYCIELA
1. Ustal z uczniami termin przeprowadzenia sprawdzianu z co najmniej jednotygodniowym
wyprzedzeniem.
2. Omów z uczniami cel stosowania pomiaru dydaktycznego.
3. Zapoznaj uczniów z rodzajem zadań podanych w zestawie oraz z zasadami punktowania.
4. Przeprowadź z uczniami próbę udzielania odpowiedzi na takie typy zadań testowych,
jakie będą w teście.
5. Omów z uczniami sposób udzielania odpowiedzi (karta odpowiedzi).
6. Zapewnij uczniom możliwość samodzielnej pracy.
7. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi, podaj czas przeznaczony
na udzielanie odpowiedzi.
8. Postaraj się stworzyć odpowiednią atmosferę podczas przeprowadzania pomiaru
dydaktycznego (rozładuj niepokój, zachęć do sprawdzenia swoich możliwości).
9. Kilka minut przed zakończeniem sprawdzianu przypomnij uczniom o zbliżającym się
czasie zakończenia udzielania odpowiedzi.
10. Zbierz karty odpowiedzi oraz zestawy zadań testowych.
11. Sprawdź wyniki i wpisz do arkusza zbiorczego.
12. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
13. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
14. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych – niskie wyniki przeprowadzonego sprawdzianu.
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem pytań testowych.
4. Test zawiera 20 zadań dotyczących określania warunków prowadzenia procesów
chemicznych. Są to zadania wielokrotnego wyboru i tylko jedna odpowiedź jest
prawidłowa.
5. Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi. Prawidłową odpowiedź
zaznacz X (w przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem,
a następnie ponownie zakreślić odpowiedź prawidłową).
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas. Trudności mogą przysporzyć Ci
zadania: 5, 6, 8, 10, 11, 17, 19 gdyż są one na poziomie trudniejszym niż pozostałe.
8. Na rozwiązanie testu masz 60 min.
Powodzenia
Materiały dla ucznia:
-
instrukcja,
-
zestaw zadań testowych,
-
karta odpowiedzi.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
ZESTAW ZADAŃ TESTOWYCH
1. Czynnikiem wpływającym na szybkość reakcji jest:
a) barwa
b) zapach
c) smak
d) stężenie
2. Jeśli w układzie zamkniętym w miarę gromadzenia produktów reakcji, mogą one
reagować ze sobą i odtwarzać substraty, z których powstały, to mamy do czynienia
z reakcją:
a) następczą
b) współbieżną
c) odwracalną
d) nieodwracalną
3. Energię aktywacji reakcji chemicznej można określić jako:
a) liczbę zderzeń w jednostce czasu
b) czas potrzebny, by zaszła reakcja chemiczna
c) energię, jaką muszą posiadać cząsteczki substratów, by zaszła reakcja chemiczna
d) energię, jaka się wydzieli lub zostanie pochłonięta podczas przebiegu reakcji
chemicznej
4. Układ osiągnie stan równowagi dynamicznej, jeśli:
a) szybkość reakcji będzie proporcjonalna do iloczynu stężeń substratów
b) szybkość reakcji biegnącej „w prawo” zrówna się z szybkością reakcji biegnącej
„w lewo”
c) szybkość reakcji biegnącej „w prawo” będzie większa niż szybkość reakcji biegnącej
„w lewo”
d) szybkość reakcji biegnącej „w prawo” będzie mniejsza niż szybkość reakcji biegnącej
„w lewo”
5. Równanie wyrażające prawo działania mas dla reakcji: N
2
+ 3H
2
2NH
3
ma postać:
6. Reakcja 2NO
(g)
+ H
2(g)
N
2
O
(g)
+ H
2
O
(g)
przebiega zgodnie z równaniem
kinetycznym: υ = k [NO]
2
[H
2
]. Jeśli ciśnienie w zbiorniku reakcyjnym zmaleje 3 razy,
to szybkość:
a) zmaleje 3 razy
b) zmaleje 27 razy
c) wzrośnie 3 razy
d) wzrośnie 81 razy
a) K =
[N
2
][H
2
]
[NH
3
]
b) K =
[NH
3
]
[N
2
][H
2
]
c) K =
[NH
3
]
2
[N
2
][H
2
]
3
d) K =
[N
2
][H
2
]
3
[NH
3
]
2

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
7. Spadek ciśnienia powoduje przesunięcie położenia stanu równowagi reakcji
N
2(g)
+ 3H
2(g)
2NH
3(g)
a) w lewo
b) w prawo
c) położenie stanu równowagi nie zmieni się
d) nie można przewidzieć, jak przesunie się położenie stanu równowagi
8. Aby zwiększyć wydajność reakcji N
2(g)
+ O
2(g)
2NO
(g)
∆H= 181 kJ, należy:
a) obniżyć ciśnienie
b) zwiększyć ciśnienie
c) obniżyć temperaturę
d) zwiększyć temperaturę
9. Procentowy skład objętościowy mieszaniny zawierającej 36% masowych wodoru i 64%
masowych tlenu wynosi:
a) 10 % obj. H
2
i 90 % obj. O
2
b) 90 % obj. H
2
i 10 % obj. O
2
c) 18 % obj. H
2
i 82 % obj. O
2
d) 91 % obj. H
2
i 9 % obj. O
2
10. Wydajność reakcji utlenienia SO
2
do SO
3
wynosi 80 %. Do otrzymania 224 m
3
tlenku
siarki (VI) należy użyć:
a) 260 m
3
SO
2
b) 448 m
3
SO
2
c) 224 m
3
SO
2
d) 280 m
3
SO
2
11. Pewien proces przemysłowy przebiega w trzech etapach o wydajności odpowiednio 99%,
80% i 90%. Wydajność całego procesu wynosi:
a) 71,28%
b) 80,00%
c) 89,67%
d) 99,00%
12. Wydajność syntezy jodowodoru z pierwiastków wynosi w danych warunkach ciśnienia
i temperatury 78%. Ilość jodu potrzebnego do otrzymania 500 g jodowodoru wynosi:
a) 318 g
b) 496 g
c) 636 g
d) 718 g
13. Katalizator dodatni to substancja, która:
a) podwyższa energię aktywacji reakcji
b) obniża energię aktywacji reakcji
c) nie wpływa na szybkość reakcji
d) zwiększa wydajność reakcji
14. Autokataliza to zjawisko polegające na:
a) przyspieszaniu reakcji przez produkty
b) przyspieszaniu reakcji przez ogrzanie układu
c) przyspieszaniu reakcji przez jeden z substratów
f) przyspieszaniu reakcji przez dodanie katalizatora
15. Na stałą równowagi ma wpływ:
a) rozdrobnienie reagentów
b) obecność katalizatora
c) stężenie reagentów
d) temperatura

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
16. Prawo Hessa dotyczy:
a) stanu równowagi reakcji
b) zmian szybkości reakcji
c) efektu cieplnego reakcji
d) samorzutności reakcji
17. Obliczona na podstawie entalpii następujących reakcji
a) –117,6 kJ
b) 117, 6 kJ
c) 393,5 kJ
d) –393,5kJ
18. Proces, który wiąże się ze spadkiem entropii układu to:
a) wrzenie wody
b) sublimacja jodu
c) zamarzanie wody
d) rozpuszczanie chlorku sodu w dużej ilości wody
19. Entalpia reakcji 2SO
2(g)
+ O
2(g)
2SO
3(g)
obliczona na podstawie standardowych
entalpii tworzenia reagentów:
∆H
0
298 SO
2(g)
= -296,8
kJ · mol
-1
, ∆H
0
298 O
2(g)
= 0
,
∆H
0
298 SO
3(g)
= -437,8
kJ · mol
-1
, jest równa:
a) 141 kJ
b) –141 kJ
c) –282 kJ
d) 282 kJ
20. Warunkiem samorzutności reakcji jest:
a) ∆G > 0
b) ∆G > 0
c) ∆G = 0
d) ∆G < 0
1) Mg
(s)
+ C
(grafit)
+ 1,5O
2(g)
MgCO
3(s)
∆H
0
298
= - 1112,9 kJ
2) Mg
(s)
+ 0,5O
2(g)
MgO
(s)
∆H
0
298
= - 601,8 kJ
3) C
(grafit)
+ O
2(g)
CO
2(g)
∆H
0
298
= - 393,5 kJ
entalpia reakcji MgO
(s)
+ CO
2(g)
MgCO
3(s)
wynosi:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Określanie warunków prowadzenia procesów chemicznych
Zakreśl poprawną odpowiedź
.
Nr
zadania
Odpowiedź Punktacja
1
a b c d
2
a b c d
3
a b c d
4
a b c d
5
a b c d
6
a b c d
7
a b c d
8
a b c d
9
a b c d
10
a b c d
11
a b c d
12
a b c d
13
a b c d
14
a b c d
15
a b c d
16
a b c d
17
a b c d
18
a b c d
19
a b c d
20
a b c d
Razem:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Test praktyczny wysoko symulowany do jednostki modułowej „Określanie
warunków prowadzenia procesów chemicznych”
Zadanie dla ucznia:
Wykonaj obliczenia dotyczące efektów energetycznych reakcji chemicznych i składu
mieszaniny gazowej w stanie równowagi.
Plan testu
Nr
zadania
Nazwa czynności
Liczba punktów
możliwych do
uzyskania
1.
Zastosowanie prawa Hessa i prawa Lavoisiera-Laplace
’
a.
Zastosowanie metody sumowania równań reakcji,
Obliczenie entalpii podanej reakcji.
Stosowanie odpowiednich jednostek.
1
1
1
1
2.
Zapisanie wzoru, na postawie którego można obliczyć
entalpię reakcji, korzystając z entalpii tworzenia reagentów.
Obliczenie entalpii podanej reakcji.
Stosowanie odpowiednich jednostek.
1
1
1
3.
Zapisanie wyrażenia na stałą równowagi reakcji
Ułożenie bilansu materiałowego reagentów,
uwzględniającego liczby moli reagentów: początkowe, które
przereagowały i w stanie równowagi.
Obliczenie stężeń równowagowych reagentów gazowych.
Stosowanie odpowiednich jednostek.
1
2
2
1
Razem
13
Proponuje się następujące normy wymagań – uczeń otrzyma następujące oceny szkolne:
13 – 12 pkt – bdb
11 – 10 pkt – db
9 – 8 pkt – dst
7 – 6 pkt – dop
poniżej 6 pkt – ndst

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Instrukcja dla nauczyciela
1. Przed rozpoczęciem wykonywania zadania przez uczniów należy:
-
zapewnić warunki do samodzielnej pracy,
-
rozdać karty pracy oraz instrukcje dla ucznia,
-
odczytać uczniom przeznaczoną dla nich instrukcję oraz udzielić odpowiedzi
na pytania.
2. Podczas wykonywania zadania powinny być spełnione następujące warunki:
-
czas trwania testu 60 minut,
-
praca samodzielna, indywidualne stanowiska pracy,
-
maksymalna liczba uczniów w grupie – 16 osób,
-
wykonane zadanie uczeń opisuje na karcie pracy,
-
nauczyciel pełni rolę obserwatora,
-
kilka minut przed zakończeniem sprawdzianu nauczyciel przypomina uczniom
o zbliżającym się czasie zakończenia zadania,
-
po wykonaniu zadania uczeń oddaje kartę pracy nauczycielowi.
3. Po wykonania zadania nauczyciel:
-
wpisuje do karty oceny wyniki przeprowadzonego testowania,
-
przeprowadza analizę wyniku sprawdzianu,
-
opracowuje wnioski do dalszego postępowania, mającego na celu uniknięcie
niepowodzeń dydaktycznych.
Uczeń może otrzymać maksymalnie 13 punktów.
Instrukcja dla ucznia
Zadanie, które będziesz wykonywać, polega na wykonaniu obliczeń dotyczących efektów
energetycznych reakcji i składu mieszanin gazowych w stanie równowagi.
Aby wykonać zadanie, powinieneś w karcie pracy:
1) zastosować prawo Hessa i prawo Lavoisiera-Laplace
’
a,
2) zastosować metodę sumowania równań reakcji,
3) zapisać wzór, na postawie którego można obliczyć entalpię reakcji, korzystając z entalpii
tworzenia reagentów.
4) zapisać wyrażenie na stałą równowagi reakcji,
5) ułożyć bilans materiałowy reagentów, uwzględniając liczby moli reagentów: początkowe,
które przereagowały i w stanie równowagi,
6) wykonać obliczenia,
7) zastosować odpowiednie jednostki.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
KARTA PRACY
Imię i nazwisko..........................................................................................
Test praktyczny wysoko symulowany do jednostki modułowej „Określanie
warunków prowadzenia procesów chemicznych”
Zadanie dla ucznia:
Wykonaj obliczenia dotyczące efektów energetycznych reakcji chemicznych i składu
mieszaniny gazowej w stanie równowagi.
Zadanie 1
Na podstawie entalpii następujących reakcji:
oblicz entalpię reakcji:
1) 2Al
(s)
+ 1,5O
2(g)
Al
2
O
3(s)
∆H
0
298
= - 1645,6 kJ
2) S
(s)
+ 1,5O
2(g)
SO
3(g)
∆H
0
298
= - 395,2 kJ
3) 2Al
(s)
+ 3S
(s)
+ 6O
2(g)
Al
2
(SO
4
)
3(s)
∆H
0
298
= - 3435,1 kJ
Al
2
O
3(s)
+ 3SO
3(g)
Al
2
(SO
4
)
3(s)

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Zadanie 2
Wykorzystując poniżej podane entalpie tworzenia reagentów, oblicz entalpię reakcji:
3. Oblicz stężenia gazowych reagentów układu:
FeO
+ CO Fe + CO
2
w stanie równowagi, w temperaturze ok. 1300K, jeżeli stała K wynosi 0,5, a początkowo
stężenia wynosiły: [CO] = 0,5 mol·dm
-3
, [CO
2
] = 0,1 mol·dm
-3
.
CH
3
OH
(c)
+ 1,5O
2(g)
CO
2(s)
+ 2H
2
O
(c)
∆H
0
298tw. CH
3
OH
(c)
= - 238,9 kJ · mol
-1
∆H
0
298tw. CO
2(g)
= - 393,5 kJ · mol
-1
∆H
0
298tw. H
2
O
(c)
= - 285,8 kJ · mol
-1
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
KARTA OCENY
Imię i nazwisko..........................................................................................
Test praktyczny wysoko symulowany do jednostki modułowej „Określanie
warunków prowadzenia procesów chemicznych”
Zadanie dla ucznia:
Wykonaj obliczenia dotyczące efektów energetycznych reakcji chemicznych i składu
mieszaniny gazowej w stanie równowagi.
Plan testu
Nr
zadania
Nazwa czynności Uzyskana
liczba
punktów
1.
Zastosowanie prawa Hessa i prawa Lavoisiera-Laplace
’
a.
Zastosowanie metody sumowania równań reakcji,
Obliczenie entalpii podanej reakcji.
Stosowanie odpowiednich jednostek.
2.
Zapisanie wzoru, na postawie którego można obliczyć
entalpię reakcji, korzystając z entalpii tworzenia reagentów.
Obliczenie entalpii podanej reakcji.
Stosowanie odpowiednich jednostek.
3.
Zapisanie wyrażenia na stałą równowagi reakcji
Ułożenie bilansu materiałowego reagentów,
uwzględniającego liczby moli reagentów: początkowe, które
przereagowały i w stanie równowagi.
Obliczenie stężeń równowagowych reagentów gazowych.
Stosowanie odpowiednich jednostek.
Razem

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
7. LITERATURA
1. Atkins P. W.: Chemia fizyczna. PWN, Warszawa 2002
2. Hassa R., Mrzigod A., Mrzigod J., Sułkowska W.: Chemia 1. Wydawnictwo M. Rożak
Gdańsk 2002
3. Hejwowska S., Marcinkowski R., Staluszka J.: Chemia 3. WP OPERON, Gdynia 2004
4. Hejwowska S., Marcinkowski R., Staluszka J.: Zbiór zadań 3. WP OPERON,
Gdynia 2004
5. Kufelnicki A.: Ćwiczenia z chemii fizycznej. Akademia Medyczna w Łodzi, Łódź 1994
6. Kupis B., Zewald W.: Chemia – matura 2005. WS OMEGA, Kraków 2004
7. Marcinkowski R., Hejwowska S., Sygniewicz J.: Zbiór zadań z chemii. Wydawnictwo
Edukacyjne Zofii Dobkowskiej, Warszawa 1998
8. Pazdro K.: Zbiór zadań z chemii. WE, Warszawa 1992
9. Praca zbiorowa: Ćwiczenia laboratoryjne z chemii fizycznej. WUŁ, Łódź 2005
Wyszukiwarka
Podobne podstrony:
10 Określanie warunków prowadzenia procesów chemicznych
10 Określanie warunków prowadzenia procesów chemicznych
10 Okreslanie wplywu lekow i su Nieznany (2)
311[10] Z5 01 Prowadzenie dzial Nieznany
311[10] Z3 02 Prowadzenie ewide Nieznany (2)
1996 10 26 praid 18571 Nieznany
4 ROZ w sprawie warunkow techn Nieznany (2)
10 Poslugiwanie sie dokumentacj Nieznany
Cwiczenia nr 10 (z 14) id 98678 Nieznany
16 ROZ w sprawie warunkow tec Nieznany
5 ROZ w sprawie warunkow tech Nieznany (2)
2008 10 06 praid 26459 Nieznany
10 zaburzenia organiczneid 1121 Nieznany
10 Sprawdzenie Konstrukcji Ze W Nieznany (2)
mat bud cwicz 10 11 id 282450 Nieznany
Cw 5 10 Analiza tolerancji i od Nieznany
10 1 1 83 2318id 10401 Nieznany
10 Sporzadzanie i ekspedycja wy Nieznany (2)
więcej podobnych podstron