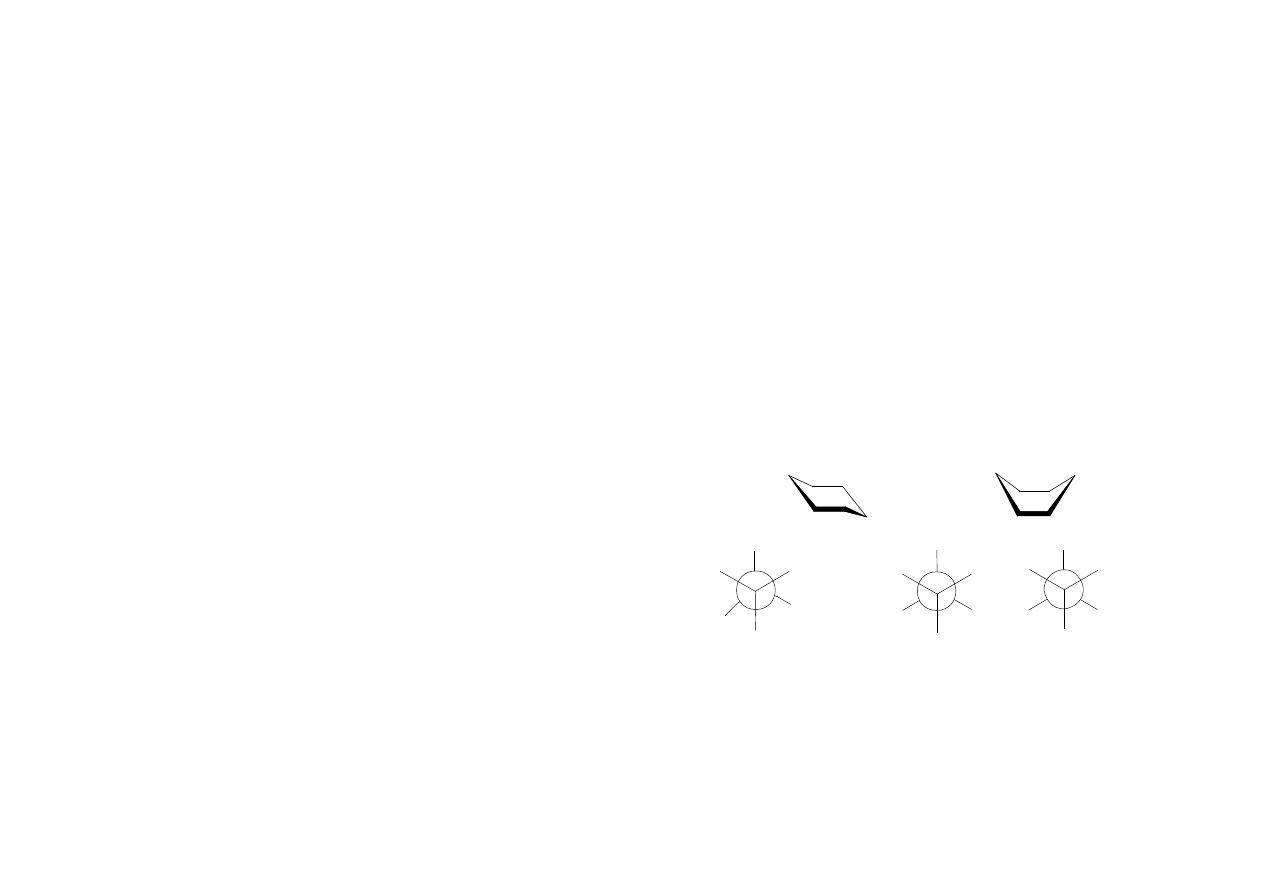
Ćwiczenie nr 5
dr Marta Struga
Analiza jakościowa związków organicznych
Repetytorium
1.
Budowa przestrzenna (stereochemia) związków organicznych
(konformacja,izomeria, tautomeria, metameria i izomeria optyczna).
2.
Jakościowa analiza organiczna:
A/ określenie czystości i jednorodności badanej substancji
B/ oznaczanie pierwiastków wchodzących w skład związku organicznego
C/ badanie rozpuszczalności związku
D/ reakcje charakterystyczne grup funkcyjnych w związkach organicznych
E/ metody fizyczne analizy związków organicznych.
Część praktyczna
1.
Próba Lassaigne’a.
2.
Wykrywanie grup funkcyjnych w związkach organicznych (wiązania
wielokrotne, alkohole i fenole, aldehydy, kwasy karboksylowe, ketony,
aminy – rozróżnianie rzędowości amin).
3. Analiza dwóch substancji organicznych.
Repetytorium
Chemia organiczna jest chemią związków węgla. Dla zakwalifikowania substancji
do związków organicznych należy stwierdzić, czy ulega ona spaleniu lub zwęgleniu.
Związki organiczne są mało odporne na działanie wysokich temperatur. Podczas
ogrzewania w atmosferze beztlenowej rozkładają się na pierwiastki lub proste
związki nieorganiczne (CO, CO
2
, H
2
O itp.). Im bardziej jest złożona budowa
związku organicznego tym łatwiej następuje jego rozkład. Każdy związek
organiczny ogrzewany w tlenie lub powietrzu ulega utlenieniu. Często reakcja ma
gwałtowny przebieg (spalanie). Węgiel zawarty w związku przechodzi wówczas
w CO
2
, wodór w H
2
O.
Nawet w stosunkowo małych cząsteczkach organicznych rozmieszczenie atomów
może być bardzo skomplikowane. Dlatego jednym z głównych problemów chemii
organicznej jest poznanie względnego rozmieszczenia atomów w cząsteczce, czyli
określenie struktury związku.
1. Budowa przestrzenna (stereochemia) związków organicznych
Konformacja to sposób ułożenia atomów i grup atomowych wokół pojedynczego
wiązania. Konformacja jest spowodowana zahamowaniem wolnego obrotu wokół osi
pojedynczego wiązania C-C, wskutek czego w cząsteczce może zaistnieć kilka
rodzajów ułożenia atomów i grup atomowych. Najtrwalsza konformacja odpowiada
najmniejszej energii wewnętrznej cząsteczki. Przykładem konformacji jest postać
łódkowa i krzesłowa cykloheksanu lub konformacja butanu.
H
CH
3
H
CH
3
H
H
CH
3
H
H
H
H
H
3
C
H
H
CH
3
CH
3
H
H
konformacja
antyperiplanarna
n-butanu
konformacje
synklinarne
n-butanu
I
II
III
Izomeria jest to zjawisko istnienia związków chemicznych o identycznym
wzorze sumarycznym lecz różnej strukturze cząsteczek. Związki spełniające ten
warunek noszą nazwę izomerów, różnią się właściwościami chemicznymi
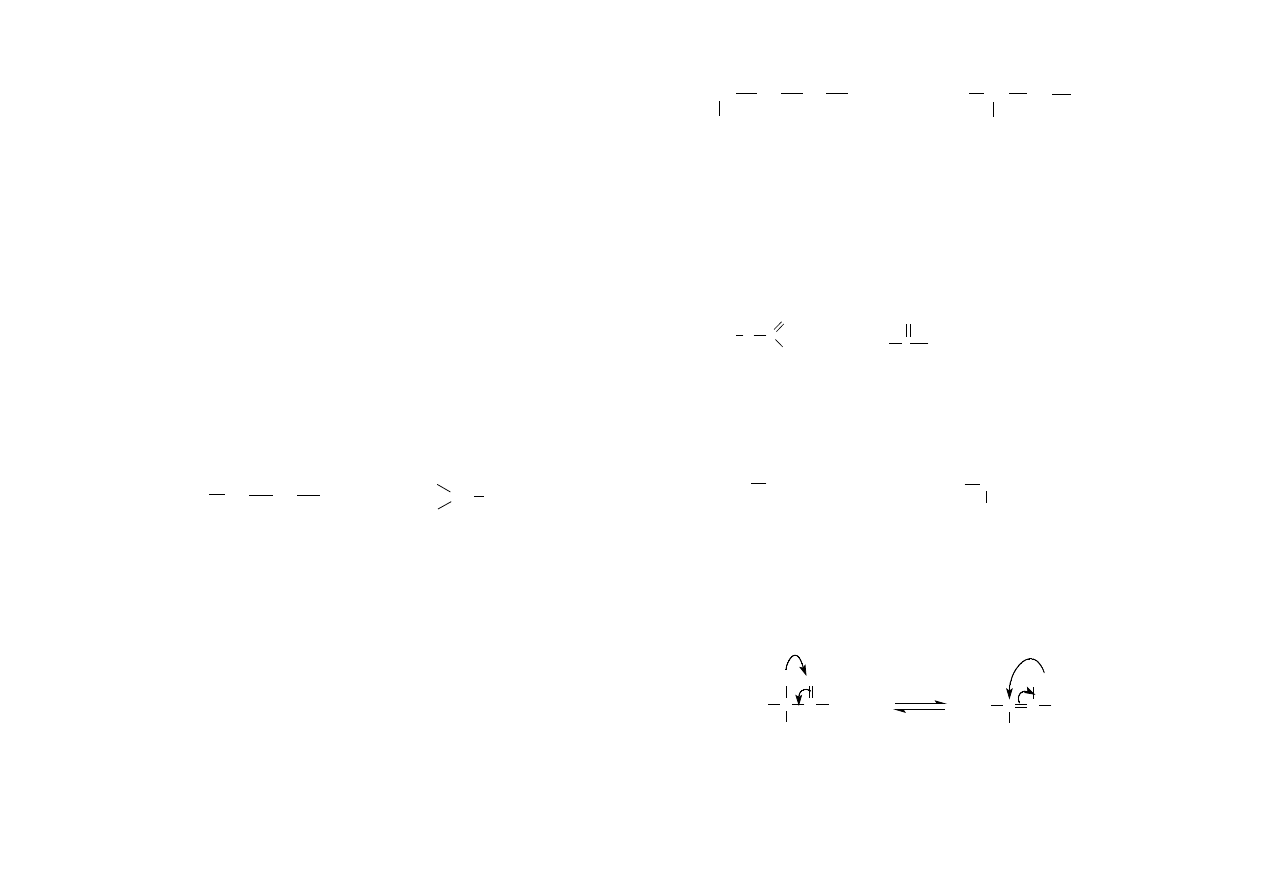
2
i fizycznymi z wyjątkiem masy molowej. Gdy cząsteczki izomerów stanowią odbicia
lustrzane (enancjomery), wówczas różnice właściwości są ograniczone do
skręcalności płaszczyzny światła spolaryzowanego i reaktywności z innymi
związkami optycznie czynnymi.
Rozróżniamy dwa typy izomerii: strukturalną i przestrzenną
Izomeria strukturalna Izomeria przestrzenna (stereoizomeria):
(konstytucyjna):
izomeria łańcuchowa izomeria geometryczna (cis-trans)
izomeria podstawienia (położenia) izomeria optyczna
izomeria funkcyjna (metameria)
tautomeria
Izomeria łańcuchowa – polegająca na odmiennej konstytucji łańcucha,
np. n-butan i izobutan
n-butan izobutan
CH
2
CH
3
CH
2
CH CH
3
C
H
3
C
H
3
C
H
3
Izomeria podstawienia – polegająca na różnej pozycji zajmowanej
przez podstawnik (grupę funkcyjną lub atom inny niż wodór),
np. 1-chlorobutan i 2-chlorobutan:
CH
2
CH
3
CH
2
CH
CH
2
CH
2
Cl
Cl
C
H
3
1-chlorobutan 2-chlorobutan
CH
3
Izomeria funkcyjna (metameria) – spowodowana obecnością różnych grup
funkcyjnych , np. aldehyd i keton
C
H
3
C
H
2
C
O
H
C
H
3
CH
3
C
O
C
3
H
6
O
Aldehyd propionowy Aceton
lub np. propyloamina i N-metlylo-etyloamina
CH
3
CH
2
CH
2
NH
2
CH
3
CH
2
NH
CH
3
propyloamina
N-metylo-etyloamina
Tautomeria – zjawisko wzajemnego przemieszczania się protonu i wiązania
podwójnego w obrębie tego samego związku. np. tautomeria keto-enolowa kwasu
pirogronowego.
H C
H
H
C
O
COOH
H C
H
C COOH
OH
keton
enol
dwie formy kwasu pirogronowego
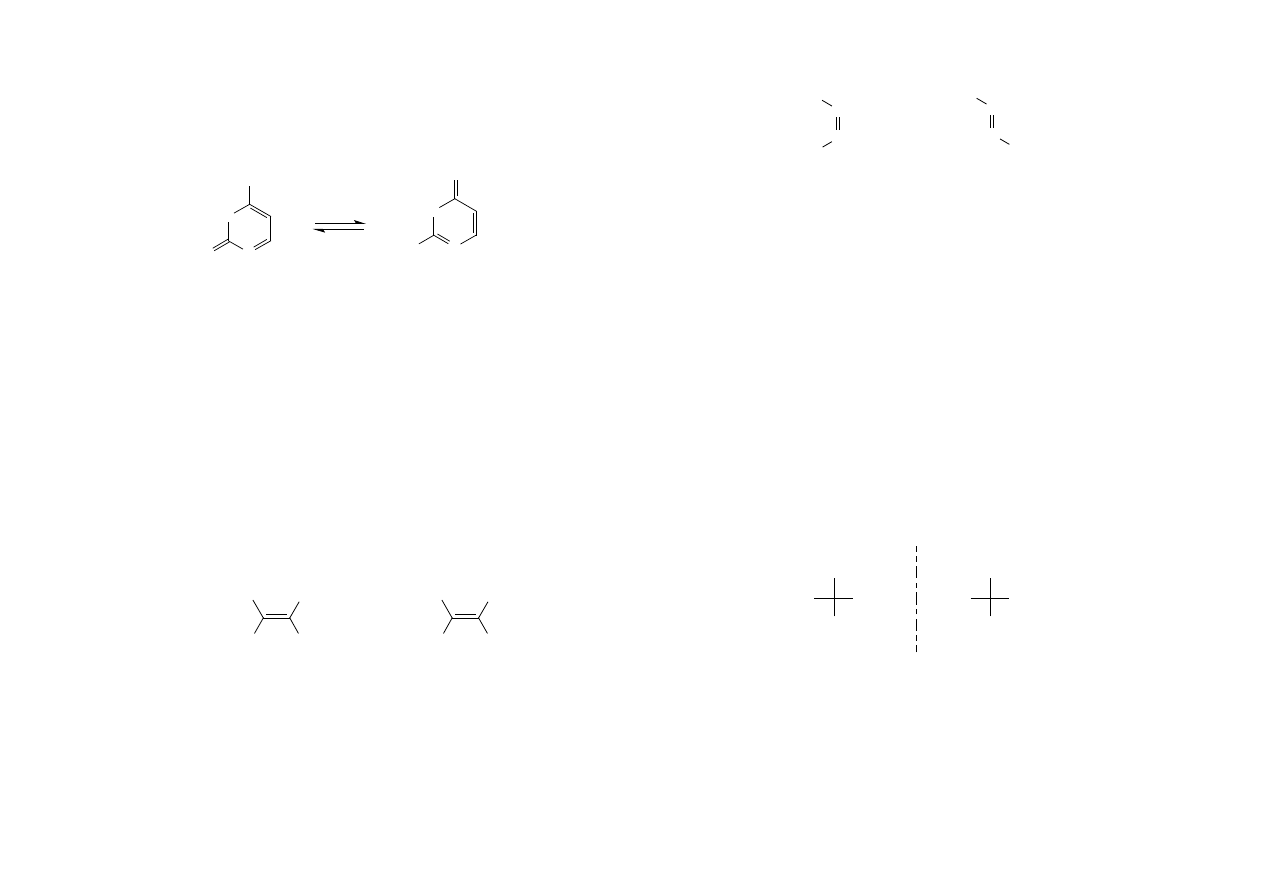
3
Tautomeria amino-iminowa występuje w zasadach pirymidynowych - związkach
heterocyklicznych mających ważne znaczenie biologiczne.
HN
N
NH
2
O
HN
N
NH
OH
cytozyna
forma aminowa
forma iminowa
Izomeria geometryczna jest następstwem występowania wiązania podwójnego
którego sztywność wyklucza obrót wokół niego. Izomery geometryczne charakteryzują
się identyczną strukturą, różnią się konfiguracją (rozmieszczeniem przestrzennym
atomów), co jest przyczyną różnych właściwości fizykochemicznych. Atomy węgla
połączone wiązaniem podwójnym wraz ze związanymi z nimi bezpośrednio
podstawnikami leżą w jednej płaszczyźnie, zaś płaszczyzna wiązania Π jest do niej
prostopadła. Izomer cis zawiera jednakowe podstawniki po jednej stronie płaszczyzny
wiązania Π, zaś izomer trans po przeciwnych.
H
Cl
Cl
H
H
Cl
H
Cl
izomer cis
izomer trans
Szczególnym przypadkiem izomerii cis-trans jest izomeria syn-anti i dotyczy
wiązań typu –C=N- lub też -N=N-, np. dwuazany:
N
N
C
RO
N
N
C
OR
izomer syn
izomer anti
Izomeria optyczna
Jest to rodzaj stereoizomerii spowodowany chiralną budową cząsteczki. Chiralność
jest to nieidentyczność z własnym odbiciem w płaskim zwierciadle. Warunkiem
koniecznym i wystarczającym do wystąpienia izomerii optycznej związków
chemicznych jest obecność centrum chiralności w cząsteczce. Najczęściej centrum
chiralności stanowi asymetryczny atom węgla czyli atom związany z czterema
różnymi podstawnikami. Asymetryczne mogą być także atomy innych pierwiastków,
jak: Si, N, P, As, S. Aktywność optyczną mogą wykazywać także cząsteczki chiralne,
nie zawierające asymetrycznego atomu (tzw. chiralność cząsteczkowa). Przykładem
mogą być ortopodstawione układy bifenylowe.
Związki chemiczne, których cząsteczki stanowią odbicie lustrzane noszą nazwę
enancjomerów. Budowę przestrzenną izomerów tego typu przedstawia się wzorami
przestrzennymi lub wzorami Fischera.
COOH
OH
H
CH
3
COOH
H
HO
CH
3
Odmiany enancjomeryczne kwasu mlekowego (wzory Fischera).
Wszystkie związki o cząsteczkach chiralnych wykazują czynność optyczną
(aktywność optyczną) – cechę polegającą na skręcaniu płaszczyzny polaryzacji
ś
wiatła przechodzącego przez tę substancję. Każdy z enancjomerów skręca
płaszczyznę polaryzacji w przeciwnym kierunku, ale o taki sam kąt. Oprócz
4
skręcalności optycznej, enancjomery różnią się szybkością reakcji ze związkami
optycznie czynnymi. Inne właściwości chemiczne i fizyczne są identyczne.
Równomolowa mieszanina enancjomerów nosi nazwę racematu.
Maksymalna liczba stereoizomerów wynosi 2
n
, gdzie n jest to liczba
asymetrycznych atomów węgla. Jeżeli w cząsteczce są 2 asymetryczne atomy węgla
mogą istnieć 4 izomery.
para enancjomerów para enancjomerów
Ponieważ cząsteczka może mieć tylko jeden obraz lustrzany, zatem wśród czterech
izomerów istnieją dwie pary enancjomeryczne (I i II oraz III i IV), natomiast pary I
– III, I – IV, II – III nie stanowią odbić lustrzanych (nie są enancjomerami) i różnią
się właściwościami chemicznymi i fizycznymi podobnie jak izomery konstytucyjne.
Stereoizomery nie będące enancjomerami noszą nazwę diastereoizomerów.
Gdy trzy grupy związane z pierwszym atomem asymetrycznym są takie same jak
grupy związane z drugim, wówczas liczba izomerów wynosi 3, ponieważ jeden
izomer, zwany odmianą mezo, ma płaszczyznę symetrii i wskutek tego jest achiralny
a więc optycznie nieczynny, pomimo że ma dwa asymetryczne atomy węgla.
Typowym przykładem jest kwas winowy.
COOH
OH
H
OH
H
COOH
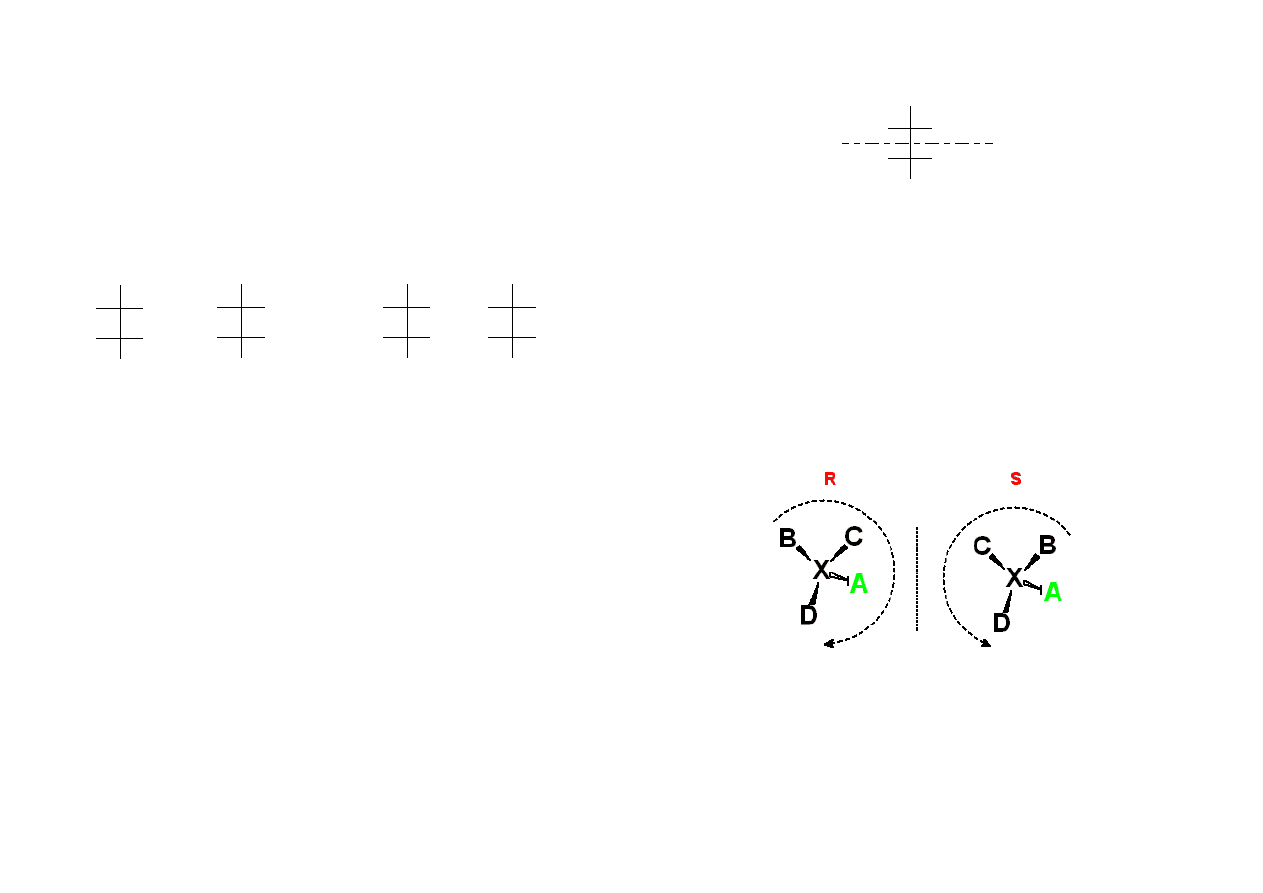
Konfiguracja absolutna R, S (konfiguracja bezwzględna) to jednoznaczny sposób
rozróżniania i nazewnictwa izomerów optycznych, a ściśle biorąc ustalania
rzeczywistej konfiguracji podstawników przy centrach chiralności w enancjomerach i
diastereoizomerach.
Cztery grupy związane z centrum chiralnosci układa się w kolejności pierszeństwa,
ustalonego w sposób opisany poniżej B → C → D → A. Na atom chirany patrzy się
od strony przeciwnej w stosunku do grupy A. Jeżeli pozostałe grupy (D → C → B)
układają się zgodnie z kierunkiem ruchu wskazówek zegara konfigurację określa się
literą R (od łac. rectus – prawy). Jeżeli układają się przeciwnie, konfigurację określa
się literą S (od łac. sinister – lewy).
Zasady ustalania kolejności podstawników:
1. O kolejności decyduje w pierwszej instacji liczba atomowa (l.a) atomu
podstawnika, który jest bezpośrednio przyłączony do centrum chiralności. Oznacza to
np: że w sytuacji, gdy podstawniki są czterema różnymi pojedynczymi atomami (np:
c
a
b
b
a
d
c
b
a
a
b
d
c
a
b
a
b
d
c
b
a
b
a
d

5
jod (I, l.a = 57), brom (Br, l.a = 35), chlor (Cl, l.a= 17), wodór (H, l.a = 1) ich
kolejność jest następująca: I > Br > Cl > H.
2. Jeśli podstawniki łączą się z centrum chiralności tymi samymi atomami, to
należy wziąć pod uwagę kolejne atomy przyłączone bezpośrednio do atomu, którym
cały podstawnik łączy się z centrum chiralności. Jeśli i te mają tę samę liczbę
atomową, należy wziąć pod uwagę kolejne, dalsze atomy, aż w końcu dojdzie się do
takiej pary atomów, z których jeden ma większą liczbę atomową od drugiego.
3. gdy dalsze atomy są połączone wiązaniami wielokrotnymi, liczy się się je
jakby były połączone wiązaniami pojedynczymi, tyle że wiele razy. Oznacza to np.
ż
e gdy mamy dwa podstawniki -A=B i -A-B, podstawnik -A=B będzie pierwszy
gdyż A łączy się z atomem B "dwa razy" podczas gdy podstawnik -A-B tylko "raz".
5. gdy w podstawniku występują ugrupowania cykliczne, a wcześniejsze reguły
nie pozwoliły ustalić kolejności, przed "dotarciem" do układu cyklicznego, stosuje
się zasadę, że o kolejności decyduje "dotarcie" do pary dwóch różnych atomów po
jak najkrótszej drodze (przechodząc przez jak najmniejszą liczbę wiązań
chemicznych).
1. Jakościowa analiza organiczna
Potwierdzenie tożsamości związku organicznego dokonuje się na podstawie danych
fizykochemicznych (temperatura topnienia lub wrzenia, współczynnik załamania
ś
wiatła, analiza procentowej zawartości węgla, wodoru i azotu), analizy spektralnej
i reakcji charakterystycznych. Natomiast identyfikacja nowych związków wymaga
określenia właściwości fizykochemicznych charakteryzujących ten związek oraz
potwierdzenia struktury metodami chemicznymi i instrumentalnymi.
Analizę substancji organicznej rozpoczyna się zwykle od oceny czystości danej
próbki.
Czystość związku oznacza się metodami chromatograficznymi – przy użyciu
chromatografii cienkowarstwowej (TLC), gazowej (GC) lub wysokosprawnej
chromatografii cieczowej (HPLC). Następnie wyznacza się charakterystyczne stałe
fizyczne, takie jak temperatura topnienia lub wrzenia i współczynnik załamania
ś
wiatła.
Kolejnym etapem analizy jest jakościowe oznaczanie azotu, siarki i chlorowców
wchodzących w skład związku organicznego – tzw. próba Lassaigne`a.
Dany związek organiczny poddaje się mineralizacji poprzez stapianie z metalicznym
sodem. Pierwiastki obecne w związku organicznym, niezależnie od tego, na jakim są
stopniu utlenienia, w trakcie reakcji przechodzą odpowiednio: siarka - w jon
siarczkowy S
2-
, chlor - w jon chlorkowy Cl
-
, azot - w jon cyjankowy CN
-
. Obecność
tych jonów stwierdza się przy pomocy reakcji charakterystycznych.
Badanie rozpuszczalności związku. Stwierdzenie, czy analizowana substancja
rozpuszcza się w wodzie, rozpuszczalnikach organicznych, a także roztworach
mocnych i słabych kwasów i zasad dostarcza cennych informacji na temat
polarności, lipofilności i własności kwasowych i zasadowych tego związku.
Wykonanie reakcji charakterystycznych dla grup funkcyjnych pozwala na ich
wykrycie w cząsteczce związku. Wybrane reakcje opisane są w części
eksperymentalnej.
Metody fizyczne analizy związków organicznych
Do końca I połowy XX wieku przy ustalaniu budowy związków organicznych
posługiwano się prawie wyłącznie metodami chemicznymi. Zwykle większe
cząsteczki poddawano degradacji otrzymując mniejsze, których budowa była już
znana lub mogła łatwo być ustalona. Otrzymywano także pochodne, pozwalające na
identyfikację charakterystycznych grup funkcyjnych. Na podstawie budowy
mniejszych fragmentów oraz informacji o grupach funkcyjnych, zawartych
w badanych, większych cząsteczkach, możliwe było postulowanie dla nich struktur,
zgodnych z ich wszystkimi właściwościami. Ostatecznym potwierdzeniem słuszności
postulowanej budowy była synteza badanego związku metodami, których

6
poszczególne etapy były zrozumiałe i nie budziły żadnych wątpliwości. Procedura
taka była wysoce skuteczna, o czym świadczy fakt, że do roku 1950 ustalono w ten
sposób budowę ponad pół miliona związków organicznych, pochodzących ze źródeł
naturalnych lub otrzymanych na drodze syntezy. Było to jednak postępowanie
niesłychanie uciążliwe i pracochłonne. Na przykład ustalenie wszystkich
szczegółów budowy cholesterolu C
27
H
46
O trwało około 150 lat od momentu
wydzielenia tego związku z kamieni żółciowych.
W połowie XX wieku, dzięki rozwojowi elektroniki, rozpoczął się rozwój
instrumentalnych
metod
analizy
strukturalnej,
opartych
głównie
na
spektroskopowych właściwościach substancji. Zastosowanie tych metod tak bardzo
ułatwiło pracę chemików, że już w latach pięćdziesiątych, budowę alkaloidu
rezerpiny C
33
H
35
N
2
O
9
ustalono w ciągu zaledwie czterech lat od chwili
wyodrębnienia tego związku z materiałów roślinnych. Obecnie ustalenie struktury
nowego związku organicznego przy użyciu metod spektroskopowych i analizy
rentgenostrukturalnej jest kwestią dni lub tygodni.
Spektroskopią nazywamy dział fizyki, zajmujący się badaniami budowy
i właściwości atomów, cząsteczek i jąder atomowych na podstawie emitowanego
przez nie lub pochłanianego promieniowania elektromagnetycznego. Do badania
budowy związków organicznych stosuje się promieniowanie o różnych zakresach
długości fal, od ultrafioletu aż do fal radiowych. Ogólny sposób postępowania
polega na tym, ze przez próbkę badanego związku przepuszcza się właściwe dla
danej metody promieniowanie elektromagnetyczne, odczytuje i rejestruje (przy
użyciu spektrofotometru) jego natężenie przy różnych długościach fal, po przejściu
przez badaną próbkę. Otrzymany wykres zależności natężenia promieniowania
przepuszczonego od długości fali nazywamy widmem absorpcyjnym substancji.
W chemii organicznej największe zastosowanie znajduje spektroskopia w zakresie
podczerwieni (IR), widzialnym i nadfioletu (UV-Vis) oraz w zakresie krótkich fal
radiowych (NMR).
Spektroskopia w podczerwieni obejmuje zakres promieniowania od 2,5 do 20
µ
m
(4000 – 500 cm
-1
). Energia kwantów w tym zakresie długości fal wystarcza do
wywołania zmian energii oscylacyjnej cząsteczek. Atomy w cząsteczkach drgają
wokół położeń równowagi. W wyniku absorpcji promieniowania amplituda drgań,
a zatem ich energia może wzrosnąć, i cząsteczka zostaje wzbudzona na wyższy
poziom energetyczny. W widmie absorpcyjnym IR pasma odpowiadające drganiom
poszczególnych wiązań występują zwykle w stałych przedziałach częstości
promieniowania, niezależnych od budowy całej cząsteczki.
I tak, w zakresie najwyższych częstości, 4000 – 2500 cm
-1
, występują pasma
odpowiadające drganiom wiązań O-H, N-H, C-H, a w przedziale 2000 – 1500 cm
-1
pasma wiązań podwójnych C=C i C=O. Obszar od 1500 do 650 cm
-1
jest nazywany
obszarem daktyloskopowym, ponieważ tu widma poszczególnych związków
najbardziej różnią się od siebie. Jest to jakby „odcisk palca” związku organicznego,
wyróżniający go spośród milionów różnych związków. Widmo IR dostarcza więc
informacji o grupach funkcyjnych obecnych w cząsteczce, a poprzez porównanie
z widmem wzorcowym może potwierdzić tożsamość związku.
W spektroskopii UV-Vis (zwanej też elektronową) stosuje się promieniowanie
ultrafioletowe w zakresie od 200 do 400 nm oraz w zakresie widzialnym, tzn. 400 –
750 nm. Światło o tych zakresach długości fal, jeśli jest absorbowane, powoduje
wzbudzenie cząsteczek polegające na przeniesieniu elektronów na wyższe poziomy
energetyczne, zwykle z orbitali wiążących na antywiążące. Spektroskopia
elektronowa zwykle nie pozwala na uzyskanie zbyt wielu informacji o budowie,
ponieważ widma są z reguły ubogie w pasma absorpcyjne, a zatem zawarta w nich
ilość informacji jest niewielka.
Spektroskopia magnetycznego rezonansu jądrowego dostarcza chemikowi organikowi
najwięcej informacji o budowie związku. Magnetycznym rezonansem jądrowym
nazywamy zjawisko absorpcji promieniowania elektromagnetycznego przez jądra
atomowe znajdujące się w przyłożonym z zewnątrz polu magnetycznym. Absorpcja

7
wynika stąd, że jądra, których spin jest różny od zera mają własny moment
magnetyczny, który w zewnętrznym polu może przyjmować różne orientacje,
charakteryzujące się różnymi poziomami energetycznymi. W przypadku
pierwiastków o spinie = ½ , do których należą
1
H,
13
C,
19
F i
31
P, możliwe są dwie
orientacje momentu magnetycznego, a zatem i dwa poziomy energetyczne. Różnica
energii między tymi poziomami zależy od rodzaju jądra i od natężenia
zewnętrznego pola magnetycznego a więc częstość absorbowanego promieniowania
elektromagnetycznego zależy od pola magnetycznego oddziałującego na to jądro
atomowe.
W strukturalnej analizie organicznej największe znaczenie ma protonowa i węglowa
spektroskopia NMR.
W przypadku
1
H NMR rejestrujemy widmo zawierające sygnały pochodzące od
protonów w cząsteczce badanego związku organicznego, znajdujących się
w różnych otoczeniach chemicznych. Protony te bowiem absorbują promieniowanie
o różnych częstościach, ponieważ pole magnetyczne w którym się znajdują jest
wypadkową pola przyłożonego z zewnątrz i pól wewnątrzcząsteczkowych,
wytworzonych przez wirujące w cząsteczkach elektrony. W praktyce, próbkę
związku umieszcza się w polu magnetycznym i naświetla stałą częstością radiową
np. 250 MHz, a zmienia w sposób ciągły zewnętrzne pole magnetyczne. Absorpcja
następuje, gdy poszczególne protony w cząsteczce znajdą się w polu o natężeniu
spełniającym warunek rezonansu. Widmo NMR jest więc wykresem zależności
pomiędzy absorpcją a natężeniem zewnętrznego pola magnetycznego.
Analizując widmo NMR możemy uzyskać następujące informacje: ocenimy ilość
nierównocennych grup protonów która odpowiada ilości sygnałów w widmie,
następnie odczytamy wartości przesunięć chemicznych, czyli położenia sygnałów,
na podstawie których można wnioskować o tym, jakie grupy funkcyjne znajdują się
w badanej cząsteczce. Intensywność sygnałów mówi o ilości protonów, a ich
rozszczepienie o sąsiednich protonach.
Widmo
13
C NMR pozwala ocenić ilość i otoczenie chemiczne atomów węgla
w cząsteczce związku organicznego.
Spektrometria masowa (MS) dostarcza informacji o masie cząsteczkowej substancji,
i udziale izotopów w strukturze badanego związku, a pośrednio o budowie
i wzajemnych rozmieszczeniach grup i podstawników. Umieszczona w spektrometrze
próbka analizowanego związku jest bombardowana strumieniem elektronów.
Powoduje to odszczepienie elektronu z cząsteczki i utworzenie dodatnio
naładowanego jonu macierzystego M
+
, który może ulegać fragmentacji. W widmie
MS obserwujemy sygnały odpowiadające masom M
+
i dodatnio naładowanych
jonów powstałym w wyniku „rozbicia” cząsteczki.
Analiza rentgenostrukturalna jest metodą wykorzystującą zjawisko rozproszenia
promieniowania elektromagnetycznego o długości fali zbliżonej do odległości
międzyatomowych (promieniowanie rentgenowskie, 0,07 – 0,02 nm) poprzez
monokryształ substancji. Wyznacza wszystkie szczegóły budowy cząsteczek łącznie
z kątami między wiązaniami oraz odległościami międzyatomowymi.
Część praktyczna
1. Próba Lassaigne’a.
2. Wykrywanie grup funkcyjnych w związkach organicznych (wiązania
wielokrotne, alkohole i fenole, aldehydy, kwasy karboksylowe, ketony,
aminy – rozróżnianie rzędowości amin).
3.
Analiza dwóch substancji organicznych.
Celem ćwiczenia jest zapoznanie studentów z metodami wykrywania
obecności azotu, siarki i chlorowców oraz niektórych grup funkcyjnych.
8
1. Wykonanie próby Lassaigne’a
Niewielką ilość substancji umieścić w małej próbówce, dodać kawałek sodu.
Ostrożnie ogrzewać w płomieniu palnika do całkowitego zwęglenia się, potem
mocniej do rozżarzenia zawartości, po czym zanurzyć natychmiast w przygotowanej
wcześniej parownicy z wodą destylowaną. Zawartość wymieszać przesączyć przez
karbowany sączek bibułowy i podzielić na trzy części.
- wykrywanie siarki: do pierwszej części przesączu dodać kilka kropli roztworu
octanu ołowiawego, wytrąca się czarny osad PbS.
Na
2
S + Pb(CH
3
COO)
2
→ ↓PbS + 2 CH
3
COONa
- wykrywanie azotu: do drugiej części przesączu dodać kilka kropli roztworu FeSO
4
,
ogrzać do wrzenia, ochłodzić i zakwasić kwasem solnym do odczynu lekko
kwaśnego. Dodać roztworu FeCl
3
– powstaje niebieskie zabarwienie, bądź
w przypadku większego stężenia azotu niebieski osad błękitu pruskiego.
2 NaCN + FeSO
4
→ Fe(CN)
2
+ Na
2
SO
4
Fe(CN)
2
+ 4 NaCN → Na
4
[Fe(CN)
6
]
3 Na
4
[Fe(CN)
6
] + 4 FeCl
3
→ ↓ Fe
4
[Fe(CN)
6
]
3
+ 12 NaCl
- wykrywanie chlorowców: ostatnią część przesączu zdecydowanie zakwasić
stężonym HNO
3
. Jeśli w badanej próbce uprzednio wykryto azot lub siarkę, po
zakwaszeniu należy zagotować i schłodzić w celu ich eliminacji, ponieważ CN
-
i S
2-
dają także osady z solami srebra i mogłyby być powodem zafałszowania wyników
analizy. Następnie dodać roztwór AgNO
3
– wytrąca się osad soli srebrowej (np.
AgCl, AgBr, AgI) .
NaCl + AgNO
3
→ ↓AgCl + NaNO
3
2. Reakcje charakterystyczne grup funkcyjnych w związkach
organicznych
Wykrywanie wiązania podwójnego
- reakcja z roztworem KMnO
4
:
Do około 2 cm
3
roztworu badanego (np. kwasu cynamonowego) dodać parę kropli
roztworu KMnO
4
. Nadmanganian redukuje się w tych warunkach do MnO
2
(wytrąca
się brunatny osad tlenku manganu IV, a początkowo różowy roztwór ulega
odbarwieniu), utleniając przy tym związek nienasycony, w następstwie czego
powstają glikole:
2 KMnO
4
+ 3 C
6
H
5
-CH=CH-COOH + 4 H
2
O → 3 C
6
H
5
-CH—CH-COOH +
| |
OH OH
2 MnO
2
+ 2 KOH
Wykrywanie grupy hydroksylowej
Alkohole można uważać za pochodne wody, w cząsteczce której jeden atom wodoru
został zastąpiony rodnikiem alkilowym lub za pochodne węglowodorów
alifatycznych, w których atom wodoru został zastąpiony grupą hydroksylową.
Ze względu na ilość grup hydroksylowych w cząsteczce alkohole dzielimy na jedno-
lub wielowodorotlenowe. W zależności od tego, czy grupa hydroksylowa związana
jest z atomem węgla I, II lub III rzędowym, alkohole dzielimy odpowiednio na: I, II
lub III rzędowe.
R
1
CH
2
OH
C
OH
R
2
R
1
R
3
CH
OH
R
1
R
2
Najłatwiej odróżnić rzędowość alkoholi poddając je próbie Lucasa. Roztworem
Lucasa jest bezwodny chlorek cynku rozpuszczony w stężonym kwasie solnym.
9
Alkohole III rzędowe z odczynnikiem Lucasa reagują szybko dając chlorki alkilowe,
alkohole II rzędowe reagują wolniej, natomiast alkohole I rzędowe nie reagują
wcale.
- reakcja estryfikacji
Do około 1 cm
3
alkoholu dodać kilka kropli kwasu organicznego (np. octowego)
i stężonego kwasu siarkowego oraz kamyczek wrzenny. Ogrzać ostrożnie do
wrzenia, zbadać charakterystyczny dla estrów zapach. Z uwagi na odwracalny
charakter reakcji próba słabo wychodzi w środowisku wodnym. Kwas siarkowy ma
silne właściwości higroskopijne, wiąże wytwarzającą się w reakcji wodę, jak
również dostarcza jonów wodorowych, które katalizują reakcję.
CH
3
COOH + C
2
H
5
OH → CH
3
COOC
2
H
5
+ H
2
O
-reakcja jodoformowa:
Reakcja ta zachodzi tylko dla alkoholi o wzorze R-CH (OH)-CH
3
(np. etanolu):
Do 1 cm
3
alkoholu dodać około 2 cm
3
5% NaOH, wymieszać, dodać 1-1,5 cm
3
płynu Lugola (roztwór jodu w wodnym roztworze KI) aż do powstania trwałego,
brunatnego zabarwienia roztworu. Po kilku minutach powinien wydzielić się
ż
ółtawy osad jodoformu. Jeżeli próba wypada ujemnie, badany roztwór ogrzewamy
do temperatury około 60
o
C, nadmiar jodu usuwamy przez alkalizowanie mieszaniny
roztworem NaOH, następnie próbę rozcieńczamy wodą. Po 15 minutach wytrąca się
ż
ółty, krystaliczny osad o charakterystycznym zapachu.
C
2
H
5
OH + NaIO → CH
3
CHO + NaI + H
2
O
CH
3
CHO + 3 NaIO → CI
3
CHO + 3 NaOH
CI
3
CHO + NaOH → ↓CHI
3
+ HCOONa
Wykrywanie grupy fenolowej:
Fenole
to
związki
powstające
przez
podstawienie
w
pierścieniu
homoaromatycznym jednego lub wielu atomów wodoru grupami hydroksylowymi.
W zależności od liczby tych grup fenole dzielimy na jedno- i wielowodorotlenowe.
Związki te ulegają w niewielkim stopniu dysocjacji w roztworach wodnych i mają
charakter bardzo słabych kwasów. Tworzą fenolany zarówno w reakcji z metalicznym
sodem jak i wodorotlenkiem sodowym (odróżnienie od alkoholi).
- reakcja z FeCl
3
:
Do około 1 cm
3
roztworu badanego związku dodać kilka kropli roztworu FeCl
3
.
Powstaje związek kompleksowy o intensywnym fioletowym zabarwieniu.
OH
3
FeCl
3
O
O
O
Fe
3+
+ 3HCl
Wykrywanie alkoholi wielowodorotlenowych
Reakcją charakterystyczną pozwalającą odróżnić alkohole polihydroksylowe od
monohydroksylowych jest reakcja ze świeżo strąconym wodorotlenkiem miedzi (II).
Alkohole tworzą z tym wodorotlenkiem związek kompleksowy, w wyniku czego
roztwór staje się klarowny i przybiera barwę szafirową.
Reakcja np. glicerolu z wodorotlenkiem miedzi(II) świadczy o tym, że alkohole
polihydroksylowe mają większą kwasowość niż alkohole monohydroksylowe.
Glicerol, podobnie jak kwas, reaguje nie tylko z metalami, ale też z wodorotlenkami
metali.
10
Wykonanie:
Do probówki odmierzyć około 0,5 cm
3
10 % roztworu CuSO
4
następnie dodać około
1,0 cm
3
2 M NaOH. Do świeżo sporządzonego strąconego roztworu wodorotlenku
miedzi (II) dodać około 0,5 cm
3
roztworu glikolu etylenowego.
Zaobserwować i
zanotować zmiany.
2 NaOH + CuSO
4
→ ↓Cu(OH)
2
+ Na
2
SO
4
OH
OH
C
H
2
C
H
2
+ Cu(OH)
2
H
H
O
O
C
H
2
C
H
2
OH
OH
Cu
_
_
Wykrywanie grupy aldehydowej
Aldehydy zawierają jednowartościową, aktywną chemicznie grupę
aldehydową
C
O
H
W skład grupy aldehydowej wchodzi grupa karbonylowa (ketonowa),
dlatego aldehydy i ketony dają wiele wspólnych reakcji.
Aldehydy są związkami nietrwałymi Łatwo ulegają utlenieniu do odpowiednich
kwasów, redukcji do odpowiednich alkoholi oraz polimeryzacji, kondensacji oraz
reakcji przyłączania.
- próba Tollensa:
Do próbówki z roztworem badanej substancji około 0,5-1,0 cm
3
dodać taką samą
objętość odczynnika Tollensa, po kilku minutach lub lekkim ogrzaniu na ściankach
osadza się tzw. lustro srebrne, powstające wskutek redukcji jonów diamosrebrowych
do metalicznego srebra. W skład odczynnika Tollensa wchodzą: 5% AgNO
3
, 15%
NaOH, 25% wodnego NH
3
. W wyniku dwuetapowej reakcji powstaje wodorotlenek
diamosrebrowy:
I etap: 2AgNO
3
+ 2NaOH → ↓Ag
2
O
+ 2NaNO
3
+ H
2
O
II etap: Ag
2
O + 4NH
3
+ H
2
O → 2[Ag(NH
3
)
2
]OH
2[Ag(NH
3
)
2
]OH + HCOH → 2Ag ↓ + HCOO
-
+ 3NH
3
+ H
2
O + NH
4
+
- próba Trommera
Do próbówki z około 1 cm
3
2% roztworu CuSO
4
dodajemy 2M NaOH, aż do
całkowitego wytrącenia się osadu Cu(OH)
2
. Następnie dodajemy 1-2 cm
3
badanego
roztworu i ogrzewamy.
Aldehyd redukuje Cu(OH)
2
do ceglastego Cu
2
O (odcień zależny od warunków
reakcji).
Jeśli badana substancja nie jest aldehydem, bądź występuje w znikomym stężeniu,
wówczas zawartość próbówki czernieje po dłuższym ogrzewaniu na skutek
termicznego rozkładu Cu(OH)
2
do CuO (czarny osad).
2 Cu(OH)
2
+ R-CHO → ↓Cu
2
O + R-COOH + 2 H
2
O
- reakcja z KMnO
4
Do próbówki z badanym roztworem wkraplamy powoli, mieszając, rozcieńczony
roztwór KMnO
4.
Roztwór ulega odbarwieniu i wytrąca się brunatny osad MnO
2
.
2 MnO
4
-
+ 3 R-CHO + H
2
O → 3 R-COO
-
+ ↓ 2 MnO
2
+ 2OH
-
Wykrywanie grupy ketonowej
Ketony są związkami zawierającymi grupę karbonylową C=O. Powoduje ona,
że związki te są pod wieloma względami podobne do aldehydów. Jednak reakcja
utleniania ketonów zachodzi tylko pod wpływem silnych środków utleniających.
Dlatego ketony nie dają reakcji lustra srebrnego, reakcji Trommera ani reakcji
Fehlinga. Metyloketony (np. aceton) tworzą charakterystyczne zabarwienie

11
z nitroprusydkiem sodowym. Jest to reakcja Legala odznaczająca się dużą czułością
i znajdująca zastosowanie do wykrywania związków ketonowych w moczu,
w przypadku cukrzycy.
Prusydki są to związki kompleksowe żelaza (II) lub (III), w których ligandami są
jony CN
-
i jeden jon jak : NO
2
-
, As
2
O
3
-
, SO
3
2-
lub cząsteczki obojętne, np.: NO, CO,
NH
3
, H
2
O. Zależnie od ładunku atomu centralnego i grupy atomów zastępujących
szósty jon cyjankowy, wartościowość ogólna anionu prusydku waha się od dwóch
do pięciu. Praktyczne znaczenie w medycynie ma nitroprusydek sodowy
Na
2
[Fe(CN)
5
NO]
*
2H
2
O.
-reakcja Legala
Do roztworu metyloketonu dodajemy kilka kropli roztworu nitroprusydku
sodowego, następnie alkalizujemy rozcieńczonym roztworem NaOH. W obecności
metyloketonów występuje czerwone zabarwienie przechodzące w żółte. Zabarwienie
po zakwaszeniu stężonym kwasem octowym przechodzi w fioletowoczerwone.
Przebieg reakcji nie jest dokładnie znany, ale odznacza się dużą czułością.
- reakcja z chlorowodorkiem hydroksyloaminy
Do próbówki zawierającej NH
2
OH
.
HCl (około 1 cm
3
, 5% roztwór) dodać 2-3 krople
oranżu metylowego, a następnie mieszając 0,1 M NaOH aż do zmiany barwy
z czerwonej na cebulkową. Następnie dodać kilka kropli badanego roztworu. Jeśli
czerwone zabarwienie powróci, świadczy to o obecności grupy karbonylowej.
W powyższej reakcji na skutek kondensacji grupy karbonylowej ze słabo zasadową
hydroksyloaminą powstaje oksym nie posiadający własności zasadowych.
R
2
C=O + (NH
3
OH)
+
Cl
-
→
R
2
C=NOH + H
2
O + H
+
+ Cl
-
UWAGA! 1.Należy wystrzegać się nadmiaru wodorotlenku
2. Badany związek musi mieć odczyn obojętny
- reakcja jodoformowa
Zachodzi tylko dla metyloketonów. Wykonanie opisane przy wykrywaniu alkoholi.
CH
3
COCH
3
+ 3 NaIO → CI
3
COCH
3
+ 3 NaOH
CI
3
COCH
3
+ NaOH → ↓CHI
3
+ CH
3
COONa
Wykrywanie grupy karboksylowej
Kwasy organiczne charakteryzują się obecnością jednowartościowej grupy kwasowej
zwaną karboksylową.
C
O
OH
W roztworach wodnych związki te ulegają dysocjacji elektrolitycznej. Są to słabsze
kwasy od większości kwasów nieorganicznych.
- reakcja z roztworem wodorowęglanu
Do próbówki z 1-2 cm
3
wodorowęglanu (5% roztwór) dodać niewielką ilość badanej
substancji i uważnie obserwować roztwór. Substancja rozpuszcza się z wydzieleniem
pęcherzyków CO
2
.
R-COOH + NaHCO
3
→ R-COO
-
+ Na
+
+ ↑CO
2
+ H
2
O
- reakcja estryfikacji
Wykonanie opisane przy wykrywaniu alkoholi.
Wykrywanie grupy aminowej
Aminy możemy uważać za pochodne amoniaku, w którym atomy wodoru zostały
podstawione rodnikami alkilowymi lub arylowymi. W zależności od liczby
podstawionych wodorów w cząsteczce amoniaku aminy dzielimy na: I, II i III
rzędowe. Związki te w roztworach wodnych mają charakter zasadowy. Cząsteczki
amin wskutek obecności wolnej pary elektronów przy atomie azotu przyłączają
proton z wody. Pozostaje jon OH
-
co prowadzi do powstania wodorotlenku
alkiloamoniowego, który ulega dysocjacji elektrolitycznej. Rzędowość amin można
określić na podstawie reakcji z kwasem azotowym III.
12
Alifatyczne aminy I - rzędowe w reakcji z kwasem azotowym (III) tworzą
mieszaninę odpowiednich alkoholi, alkenów i wydziela się azot.
R-CH
2
-NH
2
+ NaNO
2
+ HCl → mieszanina alkoholi i alkenów + N
2
Alifatyczne aminy II-go rzędowe z kwasem azotowym III tworzą trudno
rozpuszczalne, toksyczne N-nitrozoaminy.
III-cio rzędowe aminy alifatyczne z kwasem azotowym III nie reagują.
Aromatyczne aminy I-szo rzędowe z kwasem azotowym III tworzą nietrwałe
połączenia dwuazoniowe a następnie dwuazowe, które wykrywamy przez
sprzęganie ich w zasadowym środowisku z ß-naftolem. W wyniku reakcji powstają
pomarańczowe lub czerwone barwniki azowe. Gdy reakcję prowadzimy w
wyższych temperaturach powstają fenole i wydziela się azot, podobnie jak w
przypadku amin alifatycznych.
II- rzędowe aminy aromatyczne z kwasem azotowym III tworzą trudno
rozpuszczalne N-nitrozoaminy, związki toksyczne i rakotwórcze.
N
CH
3
H
NaNO
2
+ HCl
N
CH
3
N
O
H
2
O
III-rzędowe aminy aromatyczne z kwasem azotowym III nie reagują.
- reakcja diazowania i sprzęgania z ß-naftolem.
Do około 1 cm
3
roztworu aminy aromatycznej I-rzędowej dodać około 2 cm
3
2M HCl, ochłodzić i dodać około 1 cm
3
7 % roztworu NaNO
2
. Wymieszać i
podzielić na dwie części. Pierwszą część ogrzać - wydziela się azot, w roztworze
pozostaje fenol, który można zidentyfikować po charakterystycznym zapachu. Do
drugiej części dodać 3-4 cm
3
roztworu ß-naftolu w 5% NaOH. Powstaje
jaskrawoczerwony barwnik azowy.
N
+
+
O
H
N N
O
H
N
-wykrywanie wiązania peptydowego – reakcja biuretowa
Biuret powstaje podczas ogrzewania mocznika. Roztwór biuretu z rozcieńczonym
roztworem siarczanu miedzi II daje niebieskofioletowe zabarwienie.
2NH
3
NH
2
C
NH
2
O
temperatura
NH
2
C
NH
O
C
O
NH
2
Cu SO
4
mocznik
biuret
niebieskofioletowy kompleks
2
Podobne reakcje dają białka. Reakcja jest typowa dla związków mających co
najmniej dwa wiązania peptydowe – czyli można ją wykonać dla polipeptydów
począwszy od tripeptydu i dla białek.
C
O
NH
Wykonanie oznaczenia:
Ogrzać nad palnikiem 2-3 łopatki mocznika w suchej probówce. Mocznik
początkowo topi się a następnie zaczyna wydzielać się amoniak, któremu towarzyszy
zestalanie się zawartości probówki. Probówkę ochłodzić i dodać 5 cm
3
wody.
2 cm
3
tak otrzymanego roztworu przenieść do probówki, dodać kilkanaście kropel
NaOH a następnie kilka kropel roztworu CuSO
4
. Roztwór barwi się na kolor

13
czerwonofioletowy. Powtórzyć reakcję używając zamiast biuretu roztworu białka,
porównać zabarwienia.
3. Analiza jakościowa związków organicznych.
Wykorzystując wykonane poprzednio charakterystyczne reakcje związków
organicznych proszę określić, jakie grupy funkcyjne występują w dwóch
otrzymanych substancjach.
.
Wyszukiwarka
Podobne podstrony:
Analiza jakościowa związków organicznych
Analiza jakościowa związków organicznych, STUDIA IŚ, semestr III, Chemia
analiza jakościowa związków organicznych(1)
Elementarna analiza jakościowa związków organicznych
Analiza jakościowa związków organicznych
Jakościowa analiza elementarna związków organicznych
Analiza klasyczna związku organicznego I 2012
Analiza klasyczna związku organicznego II 2012
cwiczenie 4 Analiza jakosciowa zwiazkow org
Analiza klasyczna związku organicznego II
Analiza jakościowa, Chemia organiczna
Analiza klasyczna związku organicznego
Analiza klasyczna związku organicznego I 2012
analiza zwiazkow organiczna id Nieznany (2)
więcej podobnych podstron