
XIII. ANALIZA KATIONÓW
XIII.1. I grupa kationów
Do I grupy należą kationy: Pb
2+
, Ag
+
i Hg
2
2+
. Odczynnikiem
grupowym jest rozcieńczony ( 3 molowy ) kwas chlorowodorowy , który
wytrąca na zimno białe osady chlorków.
Chlorki kationów I grupy należy wytrącać rozcieńczonym kwasem,
ponieważ pod wpływem stężonego kwasu rozpuszczają się one, tworząc
związki koordynacyjne ( kompleksowe ) :
PbCl
2
+ HCl
D H[PbCl
3
]
AgCl
+ HCl
D H[AgCl
2
]
Hg
2
Cl
2
+ 2HCl
D H
2
[HgCl
4
] + Hg
↓
Wytrącane chlorki charakteryzują się zróżnicowaną rozpuszczalnością w
wodzie, która maleje od najłatwiej rozpuszczalnego PbCl
2
( K
sO
1,7·10
-5
),
poprzez AgCl ( K
sO
1,7·10
-10
) do Hg
2
Cl
2
( K
sO
1,6·10
-18
).
Ze względu na pewną rozpuszczalność PbCl
2
w zimnej wodzie ( w
temperaturze 298 K wynosi ona ok. 40 mg/L ), jego wytrącenie w I grupie
kationów jest niecałkowite i dlatego wchodzi on również w skład II grupy
kationów.
XIII.1.1. Ogólna charakterystyka kationów I grupy
Reakcje z wybranymi odczynnikami
Mocne zasady NaOH, KOH Mocne zasady wytrącają wodorotlenki,
a w przypadku jonów Hg
2
2+
i Ag
+
- tlenki, na skutek szybkiej dehydratacji
powstałych wodorotlenków. Są to: biały Pb(OH)
2
, ciemnobrunatny Ag
2
O
( 2AgOH = Ag
2
O + H
2
O ) i żółty HgO z domieszką czarnej rtęci metalicznej.
Wszystkie rozpuszczają się w kwasie azotowym(V). Nadmiar mocnej zasady
rozpuszcza tylko amfoteryczny Pb(OH)
2
:
Pb(OH)
2
+ 2OH
-
D [Pb(OH)
4
]
2-
tetrahydroksoołowian(II)
63

Amoniak
Rozcieńczony roztwór amoniaku w reakcji z kationami I grupy
wytrąca osady o zróżnicowanym charakterze chemicznym:
Pb
2+
+ 2NH
3
·H
2
O = Pb(OH)
2
↓
+ 2NH
4
+
biały
2Ag
+
+ 2NH
3
+ H
2
O = Ag
2
O
↓
+ 2NH
4
+
ciemnobrunatny
azotan(V) amidooksortęci(II)
W nadmiarze amoniaku rozpuszcza się tylko Ag
2
O, tworząc związek
kompleksowy będący mocniejszą zasadą niż AgOH:
Ag
2
O + 4NH
3
+ H
2
O = 2[Ag(NH
3
)
2
]OH
wodorotlenek diaminasrebra(I)
Jodki
Rozpuszczalne w wodzie jodki wytrącają barwne osady: PbI
2
( żółty ), AgI ( jasnożółty ) i Hg
2
I
2
(żółtozielony). W obecności nadmiaru jodku
tworzą rozpuszczalne związki koordynacyjne, przy czym AgI rozpuszcza się
tylko w stężonych roztworach jodków:
PbI
2
+ 2I
-
= [PbI
4
]
2-
AgI + I
-
= [AgI
2
]
-
Hg
2
I
2
+ 2I
-
= [HgI
4
]
2-
+ Hg
↓
64
2 Hg
2
(NO
3
)
2
+4 NH
3
+ H
2
O = O
Hg
Hg
NH
2
NO
3
+ 2Hg + 3 NH
4
NO
3

XIII.1.2. Opis wykonania analizy systematycznej I grupy kationów
według schematu na rys. 2, str. 68
Z roztworu zawierającego kationy wszystkich grup ( I - V ) wytrąca
się 3 molowym kwasem chlorowodorowym kationy I grupy w postaci
chlorków. W tym celu, do ok. 1/3 objętości analizowanego roztworu dodaje się
kroplami 3 molowy roztwór kwasu chlorowodorowego, wytrącając biały osad
chlorków PbCl
2
, AgCl i Hg
2
Cl
2
( Osad I ). Osad ten należy odwirować,
sprawdzić całkowitość wytrącenia przez dodanie kropli 3 molowego HCl i
oddzielić od roztworu. Z kolei osad przemywa się rozcieńczonym kwasem ( 1
kropla 3 molowego HCl + 10 kropel wody ), odwirowuje i ciecz znad osadu
dołącza do roztworu ( Roztwór I ). Roztwór ten zachowuje się do analizy
kationów grup II - V.
Oddzielanie i identyfikacja jonu Pb
2+
Do osadu I dodaje się wody destylowanej, ogrzewa przez kilka minut
na łaźni wodnej, odwirowuje i osad przemywa lekko zakwaszoną (HCl) wodą.
W gorącym roztworze znajduje się PbCl
2
a AgCl i Hg
2
Cl
2
pozostają w osadzie
(Osad II). Zamiast ogrzewania z wodą, PbCl
2
można rozpuścić przemywając
osad I dwukrotnie 1 molowym roztworem octanu sodu, a następnie lekko
zakwaszoną wodą.
Gorący roztwór II (lub zimny w przypadku przemywania roztworem octanu
sodu) dzieli się na trzy części i przeprowadza reakcje charakterystyczne na jon
Pb
2+
, np. - do kilku kropli roztworu dodaje się kroplami roztwór KI. Powstanie
żółtego osadu, rozpuszczalnego w nadmiarze odczynnika, świadczy o obecności
jonu Pb
2+
.
Pb
2+
+ 2I
-
= PbI
2
↓
żółty
PbI
2
+ KI = K[PbI
3
]
bezbarwny
PbI
2
rozpuszcza się także w gorącej wodzie i po oziębieniu krystalizuje w
postaci złotych blaszek.- do roztworu dodać kilka kropel 3 molowego H
2
SO
4
:
Pb
2+
+ SO
4
2-
= PbSO
4
↓ (
biały)
65

- pozostałą część roztworu oziębić - wytrąci się biały osad PbCl
2
w postaci
igieł.
Oddzielanie jonów Hg
2
2+
od Ag
+
. Identyfikacja Hg
2
2+
Wariant A (p. rys. 2) dla porównywalnych stężeń obu jonów
Do osadu II, zawierającego AgCl i Hg
2
Cl
2
dodaje się 10 kropel stęż.
roztworu amoniaku i odwirowuje. AgCl przechodzi do roztworu (Roztwór III)
a w osadzie (Osad III) pozostaje HgNH
2
Cl i Hg:
AgCl + 2NH
3
= [Ag(NH
3
)
2
]
+
+ Cl
-
Hg
2
Cl
2
+ NH
3
= HgNH
2
Cl
↓
+ Hg
↓
+ HCl
Osad III odwirowuje się, oddziela od roztworu i przenosi do
parowniczki dodając ok. 6 kropel wody królewskiej ( 6 kropel stęż. HCl + 2
krople stęż. HNO
3
). Zawartość parowniczki należy ostrożnie ogrzewać do
rozpuszczenia się osadu i odparować prawie do sucha:
2HgNH
2
Cl + 6Cl
-
+ 2NO
3
-
+ 4H
+
= 2[HgCl
4
]
2-
+ N
2
↑
+ 2NO
↑
+ 4H
2
O
3Hg + 2NO
3
-
+ 12Cl
-
+ 8H
+
= 3[HgCl
4
]
2-
+ 2NO
↑
+ 4H
2
O
Do pozostałości w parowniczce dodać 5 -10 kropel wody destylowanej i po
rozpuszczeniu osadu dodać 2 - 3 krople SnCl
2
. Powstanie białego, a przy
dalszym dodawaniu SnCl
2
- czarnego osadu świadczy o obecności jonu Hg
2
2+
.
[HgCl
4
]
2-
D Hg
2+
+ 4Cl
-
2Hg
2+
+ 8Cl
-
+ Sn
2+
= Hg
2
Cl
2
↓
+ [SnCl
6
]
2-
biały
Hg
2
Cl
2
+ 4Cl
-
+ Sn
2+
= 2Hg
↓
+ [SnCl
6
]
2-
czarny
Identyfikacja Ag
Bezbarwny roztwór III, zawierający [Ag(NH
3
)
2
]Cl i nadmiar NH
3
,
zakwasza się 3 molowym HNO
3
do uzyskania odczynu kwaśnego wobec
papierka lakmusowego:
[Ag(NH
3
)
2
]Cl + HNO
3
= AgCl
↓
+ NH
4
NO
3
biały
Wytrącenie się białego osadu, lub zmętnienie roztworu pochodzące od
wydzielonego AgCl, świadczy o obecności jonów Ag
+
.
66

Osad AgCl po odsączeniu dzielimy na dwie części:
-
część osadu należy wystawić na działanie światła słonecznego, które
powoduje szybkie jego fioletowienie na skutek fotochemicznego rozpadu
AgCl.
-
drugą część osadu rozpuścić w roztworze Na
2
S
2
O
3
i
podgrzać. Powstanie czarnego osadu Ag
2
S świadczy o obecności Ag
+
.
AgCl + 2S
2
O
3
2-
= [Ag(S
2
O
3
)
2
]
3-
2[Ag(S
2
O
3
)
2
]
3-
t
→
Ag
2
S
2
O
3
+ 3S
2
O
3
2-
Ag
2
S
2
O
3
+ H
2
O = Ag
2
S
↓
+ H
2
SO
4
Opis wykonania analizy systematycznej roztworu zawierającego duży, w
stosunku do jonów Ag
+
, nadmiar jonów Hg
2
2+
(Wariant B, rys. 2)
W normalnym toku analizy nie jest możliwe wykrycie małych ilości
jonów Ag
+
wobec dużej zawartości jonów Hg
2
2+
. Wydzielona pod wpływem
NH
3
duża ilość wolnej rtęci redukuje powierzchniowo wytrącony AgCl do
wolnego srebra, które wytrąca się razem z osadem HgNH
2
Cl + Hg. Tryb
postępowania wówczas jest następujący:
Osad II zawierający AgCl i Hg
2
Cl
2
( po uprzednim sprawdzeniu obecności
jonów Hg
2
2+
) ogrzewa się z małą ilością wody bromowej. Osad AgCl pozostaje
nierozpuszczalny ( część przechodzi w AgBr ) - osad IV a Hg
2
Cl
2
ulega
rozpuszczeniu (Roztwór IV) :
Hg
2
Cl
2
+ Br
2
aq. = HgCl
2
+ HgBr
2
Roztwór IV odparowuje się w celu usunięcia nadmiaru bromu i
odsącza osad IV zawierający AgCl ( AgBr ).
Osad ten, po kilkakrotnym przemyciu wodą, rozpuszcza się w NH
3
·H
2
O
(Roztwór V) i sprawdza na obecność jonów Ag
+
.
W roztworze IV, po oddzieleniu AgCl ( AgBr ), znajduje się HgCl
2
i HgBr
2
,
które identyfikujemy za pomocą SnCl
2
.
67
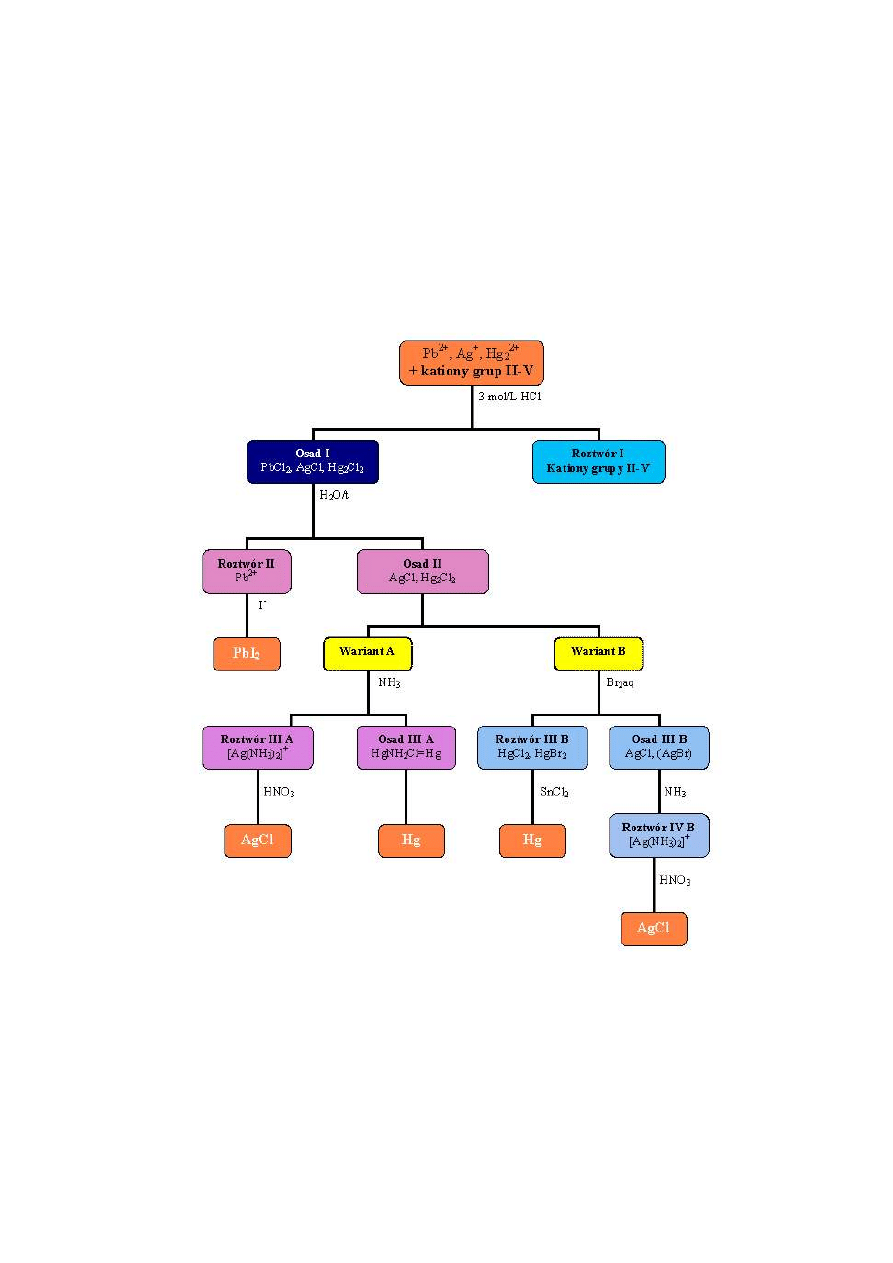
Rys. 2. Schemat analizy systematycznej I grupy kationów
Wariant A – dla porównywalnych stężeń kationów
Wariant B – dla dużego nadmiaru jonów Hg
2
2+
w stosunku do jonów Ag
+
68

XIII.1.3. Reakcje kationów I grupy
Ołów Pb
5d
10
6s
2
p
2
Ołów jest metalem leżącym w 14 ( IV A ) grupie układu okresowego.
Tworzy związki na +2 i +4 stopniu utlenienia, przy czym związki ołowiu(IV)
są nietrwałe i łatwo przechodzą w związki ołowiu(II), z tego względu są
silnymi utleniaczami.
Ołów i jego związki są silnie toksyczne. Wodorotlenek ołowiu(II)
wykazuje właściwości amfoteryczne, jednakże jego charakter zasadowy jest
zaznaczony znacznie silniej niż charakter kwasowy.
Do rozpuszczalnych soli ołowiu(II) zaliczamy: Pb(NO
3
)
2
i Pb(CH
3
COO)
2
.
Solami umiarkowanie rozpuszczalnymi są: PbCl
2
, PbBr
2
i PbI
2
.
Większość soli ołowiu(II) to sole trudno rozpuszczalne np: PbSO
4
,
PbS, PbCrO
4
, PbCO
3
.
Reakcje jonu Pb
2+
1. Kwas chlorowodorowy i rozpuszczalne chlorki
wytrącają biały osad chlorku ołowiu(II), który wytrąca się z zimnego i niezbyt
rozcieńczonego roztworu:
Pb
2+
+ 2Cl
-
= PbCl
2
↓
PbCl
2
rozpuszcza się:
- w gorącej wodzie. Po oziębieniu roztworu chlorek ołowiu(II) ponownie
wytrąca się w postaci charakterystycznych igieł.
- w stężonym kwasie chlorowodorowym i w stężonych roztworach chlorków
z utworzeniem kwasu chloroołowiowego(II) lub chloroołowianów (II):
PbCl
2
+ HCl = H[PbCl
3
]
PbCl
2
+ KCl = K[PbCl
3
]
Związki te rozkładają się po rozcieńczeniu wodą:
H[PbCl
3
] = PbCl
2
↓
+ HCl
69

2. Mocne zasady NaOH, KOH
wytrącają biały osad amfoterycznego wodorotlenku ołowiu(II), rozpuszczalny
w nadmiarze odczynnika z utworzeniem tetrahydroksoołowianu(II):
Pb
2+
+ 2OH
-
= Pb(OH)
2
↓
Pb(OH)
2
+ 2OH
-
D [Pb(OH)
4
]
2-
Osad Pb(OH)
2
nie rozpuszcza się w amoniaku.
Utleniacze, np. nadtlenek wodoru, utleniają Pb(OH)
2
tworząc ciemnobrunatny
PbO
2
:
Pb(OH)
2
+ H
2
O
2
= PbO
2
↓
+ 2H
2
O
3. Amoniak NH
3
wytrąca biały osad wodorotlenku ołowiu(II) nierozpuszczalny w nadmiarze
odczynnika:
Pb
2+
+ 2NH
3
+ 2H
2
O = Pb(OH)
2
↓
+ 2NH
4
+
4. Jodki
wytrącają żółty osad jodku ołowiu(II). Osad ten jest trudniej rozpuszczalny od
PbCl
2
.
Pb
2+
+ 2I
-
= PbI
2
↓
PbI
2
rozpuszcza się:
- w gorącej wodzie. Po oziębieniu roztworu, PbI
2
wytrąca się w postaci
żółto złocistych błyszczących kryształów,
- w nadmiarze HI i KI tworząc związki koordynacyjne kwasu
jodoołowiowego(II)
lub jodoołowian(II):
PbI
2
+ HI D H[PbI
3
]
PbI
2
+ KI D K[PbI
3
]
5. Chromian(VI) potasu i dichromian(VI) potasu , K
2
CrO
4
i K
2
Cr
2
O
7
wytrącają żółty osad chromianu(VI) ołowiu(II), nierozpuszczalny w kwasie
octowym i amoniaku, rozpuszczalny w kwasie azotowym(V) i mocnych
zasadach, tworząc tetrahydroksoołowian(II):
Pb
2+
+ CrO
4
2-
= PbCrO
4
↓
PbCrO
4
+ 4OH
-
D [Pb(OH)
4
]
2-
+ CrO
4
2-
70

Dichromian(VI) potasu wytrąca chromian(VI) ołowiu(II), przy czym wydziela
się mocny kwas, który częściowo rozpuszcza osad:
2Pb
2+
+ Cr
2
O
7
2-
+ H
2
O = 2PbCrO
4
↓
+ 2H
+
Dlatego reakcja z chromianem(VI) potasu jest czulsza.
Aby zapobiec rozpuszczaniu osadu dodaje się CH
3
COONa. Octan wiąże
powstający w reakcji kwas mineralny i tworzy się słabo zdysocjowany kwas
octowy.
6. AKT (CH
3
CSNH
2
)
i rozpuszczalne w wodzie siarczki
wytrącają z niezbyt kwaśnych ( HCl ) roztworów czarny osad siarczku ołowiu
(II). Z roztworów o dużym stężeniu HCl, wytrąca się najpierw pomarańczowy
osad dichlorosiarczku diołowiu(II) Pb
2
SCl
2
( PbS·PbCl
2
), który przy
nadmiarze H
2
S przechodzi w czarny PbS:
Pb
2+
+ S
2-
= PbS
↓
PbS rozpuszcza się w gorącym, rozcieńczonym kwasie azotowym(V):
3PbS + 2NO
3
-
+ 8H
+
= 3Pb
2+
+ 3S
↓
+ 2NO
↑
+ 4H
2
O
Przy użyciu bardziej stężonego HNO
3
tworzy się biały siarczan ołowiu(II):
3PbS + 8NO
3
-
+ 8H+ = 3PbSO
4
↓
+ 8NO
↑
+ 4H
2
O
7. Kwas siarkowy(VI) i rozpuszczalne siarczany(VI)
wytrącają biały, krystaliczny osad siarczanu(VI) ołowiu(II):
Pb
2+
+ SO
4
2-
= PbSO
4
↓
PbSO
4
rozpuszcza się:
- w stężonym kwasie siarkowym(VI):
PbSO
4
+ H
2
SO
4
= Pb(HSO
4
)
2
- w roztworze octanu amonu i winianu amonu:
PbSO
4
+ 2CH
3
COO
-
= Pb(CH
3
COO)
2
+ SO
4
2-
- w stężonych zasadach po podgrzaniu:
PbSO
4
+ 4OH
-
D [Pb(OH)
4
]
2-
+ SO
4
2-
8. Chlorek cyny(II) i jodek potasu
tworzy z jonami Pb
2+
pomarańczowoczerwoną sól podwójną: 2PbI
2
·SnI
2
.
Wykonanie: pasek bibuły filtracyjnej, zwilżony kwasem siarkowym(VI)),
71

zanurza się w badanym roztworze. Następnie umieszcza się na nim kroplę
kwasu siarkowego(VI), po czym pasek dokładnie spłukuje się wodą. Powstały
PbSO
4
przylega do bibuły i po dodaniu kropli odczynnika ( SnCl
2
+ KI ) -
powstaje czerwonopomarańczowa plama.
Srebro Ag
4d
10
5s
1
Srebro jest metalem leżącym w grupie 11 (I B) układu okresowego.
Ze struktury elektronowej atomu srebra wynika jego tendencja tworzenia jonów
Ag
+
przez oddanie jednego elektronu. Znane są jednak także związki srebra Ag
(II) i Ag(III) o silnych właściwościach utleniających.
Większość soli srebra to sole nierozpuszczalne w wodzie. Tworzą
one jednak łatwo związki koordynacyjne ( kompleksy ) z amoniakiem,
cyjankami, tiosiarczanami(VI) itp., które są rozpuszczalne.
Do rozpuszczalnych soli srebra zaliczamy: AgNO
3
, AgF, AgClO
3
,
AgClO
4
, AgMnO
4
i Ag
2
SO
4
.
Solami trudno rozpuszczalnymi są: CH
3
COOAg i AgNO
2
.
Do soli nierozpuszczalnych należą: Ag
2
S, Ag
2
CrO
4
, Ag
2
Cr
2
O
7
,
Ag
3
PO
4
, Ag
4
[Fe(CN)
6
], Ag
3
[Fe(CN)
6
] i sole o wzorze ogólnym AgX ( X = Cl,
Br, I, CN, SCN).
Większość soli srebra ulega rozkładowi pod wpływem światła ( fotolizie ).
Reakcje jonu Ag
+
1. Kwas chlorowodorowy i rozpuszczalne chlorki
wytrącają z obojętnych lub kwaśnych roztworów biały, serowaty osad chlorku
srebra(I):
Ag+ + Cl
-
= AgCl
↓
Osad ten pod wpływem światła fioletowieje wskutek fotochemicznego rozpadu
z wytworzeniem metalicznego srebra.
Osad AgCl jest trudno rozpuszczalny w rozcieńczonych kwasach.
AgCl rozpuszcza się:
- w amoniaku, tworząc chlorek diaminasrebra (I):
AgCl + 2NH
3
= [Ag(NH
3
)
2
]Cl
72

Z tego roztworu po dodaniu kwasu azotowego (V) ponownie wytrąca się
AgCl:
[Ag(NH
3
)
2
]
+
+ Cl
-
+ 2H
+
= AgCl
↓
+ 2NH
4
+
a po dodaniu KI, wytrąca się osad AgI:
[Ag(NH
3
)
2
]
+
+ I
-
= AgI
↓
+ 2NH
3
Podobnie rozłożyć można jon diaminasrebra(I) działaniem siarkowodoru:
2[Ag(NH
3
)
2
]
+
+ H
2
S + 2H
+
= Ag
2
S
↓
+ 4NH
4
+
- w roztworze tiosiarczanu(VI) sodu tworząc ditiosiarczano(VI)srebrzan(I):
AgCl + 2S
2
O
3
2-
= [Ag(S
2
O
3
)
2
]
3-
+ Cl
-
-
w roztworze cyjanku potasu tworząc dicyjanosrebrzan(I) :
AgCl + 2CN
-
= [Ag(CN)
2
]
-
+ Cl
-
Z tego roztworu po dodaniu kwasu azotowego(V) wydziela się cyjanek
srebra(I) i silnie trujący cyjanowodór:
[Ag(CN)
2
]
-
+ H
+
= AgCN
↓
+ HCN
↑
- w stężonym kwasie chlorowodorowym i w stężonych roztworach chlorków
z utworzeniem kwasu chlorosrebrowego(I)
AgCl + HCl D H[AgCl
2
]
2. Mocne zasady NaOH, KOH
wytrącają ciemnobrunatny osad tlenku srebra(I), nierozpuszczalny w nadmiarze
odczynnika:
2Ag + 2OH
-
= 2AgOH
↓
= Ag
2
O
↓
+ H
2
O
Osad rozpuszcza się w amoniaku z utworzeniem bezbarwnego wodorotlenku
diaminasrebra(I).
3. Amoniak NH
3
wytrąca ciemnobrunatny osad tlenku srebra(I) rozpuszczalny w nadmiarze
odczynnika z utworzeniem bezbarwnego wodorotlenku diaminasrebra(I):
2Ag
+
+ 2NH
3
+ H
2
O = Ag
2
O
↓
+ 2NH
4
+
Ag
2
O + 4NH
3
+ H
2
O D 2[Ag(NH
3
)
2
]OH
4. Bromki i jodki
wytrącają jasnożółty osad AgBr, słabo rozpuszczalny w amoniaku i
73

kremowożółty AgI, nierozpuszczalny w amoniaku:
Ag
+
+ Br
-
= AgBr
↓
Ag
+
+ I
-
= AgI
↓
Są one natomiast rozpuszczalne w KCN, Na
2
S
2
O
3
, w stężonych roztworach KI i
KBr:
AgI + 2CN
-
D [Ag(CN)
2
]
-
+ I
-
AgI + 2S
2
O
3
2-
D [Ag(S
2
O
3
)
2
]
3-
+ I
-
AgI + I
-
D [AgI
2
]
-
Odpowiednie związki powstają z AgBr. Żółty osad AgI, w wyniku reakcji
fotochemicznego rozkładu, zielenieje pod wpływem światła.
5. Chromian(VI) potasu K
2
CrO
4
wytrąca czerwonobrunatny osad chromianu(VI) srebra, nierozpuszczalny w
rozcieńczonym kwasie octowym, a rozpuszczalny w rozcieńczonym kwasie
azotowym(V) i amoniaku:
2Ag
+
+ CrO
4
2-
= Ag
2
CrO
4
↓
6. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają czarny osad siarczku srebra(I) :
2Ag
+
+ S
2-
= Ag
2
S
↓
rozpuszczalny w rozcieńczonym kwasie azotowym(V) na gorąco i w stężonym
roztworze cyjanku potasu :
3Ag
2
S + 2NO
3
-
+ 8H
+
= 6Ag
+
+ 2NO
↑
+ 3S
↓
+
4H
2
O
Ag
2
S + 4CN
-
= 2[Ag(CN)
2
]
-
+ S
2-
7. Heksacyjanożelazian(II) potasu K
4
[Fe(CN)
6
] i heksacyjanożelazian(III)
potasu K
3
[Fe(CN)
6
]
wytrącają odpowiednio biały osad heksacyjanożelazianu(II) srebra(I) :
4Ag
+
+ [Fe(CN)
6
]
4-
= Ag
4
[Fe(CN)
6
]
↓
oraz pomarańczowy osad heksacyjanożelazianu(III) srebra(I) :
3Ag
+
+ [Fe(CN)
6
]
3-
= Ag
3
[Fe(CN)
6
]
↓
74

8. Metale
o mniejszym od srebra potencjale normalnym, takie jak : Fe, Zn, Al, Pb, Sn,
Cu, Cd i inne, redukują sole srebra(I) do wolnego metalu, który wydziela się w
postaci bardzo rozdrobnionego ciemnoszarego osadu, np.:
2Ag
+
+ Zn = 2Ag + Zn
2+
Wykonanie : blaszka metalu, zanurzona do roztworu soli srebra(I), pokrywa się
nalotem zredukowanego metalu.
9. Inne reduktory
np. FeSO
4
, SnCl
2
redukują sole srebra(I) do srebra metalicznego :
Ag
+
+ Fe
2+
= Ag + Fe
3+
2Ag + Sn
2+
= Sn
4+
+ 2Ag
Podobny efekt otrzymuje się w przypadku użycia reduktorów organicznych,
takich jak kwas mrówkowy, aldehyd mrówkowy, kwas winowy i inne. W
trakcie powolnego ogrzewania na łaźni wodnej amoniakalnego roztworu jonów
Ag
+
z kwasem winowym na ściankach probówki tworzy się lustro srebrne
( dokładnie opisano tę reakcję w III grupie anionów ).
Rtęć
5d
10
6s
2
Rtęć leży w grupie 12 (IIB) układu okresowego. Jest jedynym
metalem występującym w stanie ciekłym w temperaturze pokojowej.
Atom rtęci posiada dwa elektrony na zewnętrznej powłoce i przez
oddanie ich tworzy jon Hg
2+
, który w obecności rtęci metalicznej tworzy jon
dirtęci(II) - Hg
2
2+
. Ten układ nie jest trwały i jony Hg
2
2+
ulegają reakcji
dysproporcjonowania :
Hg
2
2+
D Hg
2+
+ Hg↓
Rtęć tworzy dwa szeregi związków: dirtęci(II) zawierające jon Hg
2
2+
,
zaliczane do I grupy kationów i związki rtęci(II) zawierające jon Hg
2+
,
zaliczane do II grupy kationów, gdzie omówiono ich reakcje analityczne.
Do rozpuszczalnych soli rtęci zaliczamy: Hg
2
(NO
3
)
2
, Hg(NO
3
)
2
, Hg
(CN)
2
, HgCl
2
( sublimat ) i HgSO
4
.
75

Do soli nierozpuszczalnych należą: Hg
2
Cl
2
( kalomel ) ,Hg
2
Br
2
, Hg
2
I
2
,
HgS, HgI
2
i Hg
2
SO
4
.
Reakcje jonu dirtęci(II) Hg
2
2+
1. Kwas chlorowodorowy i rozpuszczalne chlorki
wytrącają biały osad chlorku dirtęci(II) ( kalomel ), nierozpuszczalny w
rozcień-czonych kwasach :
Hg
2
2+
+ 2Cl
-
= Hg
2
Cl
2
↓
Rozpuszcza się :
- w wodzie królewskiej ( 3 obj. stęż. HCl i 1 obj. stęż. HNO
3
)
Hg
2
Cl
2
+ 2Cl = 2HgCl
2
- w wodzie bromowej ( Br
2
aq. )
Hg
2
Cl
2
+ Br
2
= HgCl
2
+ HgBr
2
-
w stężonym kwasie chlorowodorowym i w stężonych roztworach chlorków,
z utworzeniem jonu tetrachlorortęcianowego(II)
Hg
2
Cl
2
+ 2Cl
-
D [HgCl
4
]
2-
+ Hg↓
- słabo w stężonym kwasie azotowym(V)
Hg
2
Cl
2
+ 6HNO
3
= 2Hg(NO
3
)
2
+ 2NO
2
↑ + 2HCl + 2H
2
O
- słabo w stężonym kwasie siarkowym(VI)
Hg
2
Cl
2
+ 3H
2
SO
4
= 2HgSO
4
+ SO
2
↑ + 2HCl + 2H
2
O
Pod wpływem działania amoniaku na osad Hg
2
Cl
2
powstaje biały osad chlorku
amidortęci(II) - HgNH
2
Cl oraz rtęć metaliczna, powodująca zczernienie
osadu :
Hg
2
Cl
2
+ 2NH
3
= HgNH
2
Cl
↓
+ NH
4
Cl + Hg
↓
Osad HgNH
2
Cl i Hg rozpuszcza się w wodzie królewskiej :
2HgNH
2
Cl + 6Cl
-
+ 2NO
3
-
+ 4H
+
= 2[HgCl
4
]
2-
+ N
2
↑
+ 2NO
↑
+ H
2
O
3Hg + 12Cl
-
+ 2NO
3
-
+ 8H
+
= 3[HgCl
4
]
2-
+ 2NO
↑
+ 4H
2
O
2. Mocne zasady KOH, NaOH
wytrącają czarny osad złożony z tlenku rtęci(II) i rtęci metalicznej :
Hg
2
2+
+ 2OH
-
= HgO
↓
+ Hg
↓
+ H
2
O
76

3. Amoniak NH
3
wytrąca z azotanu(V) dirtęci(II) osad azotanu(V) amidooksortęci(II) i rtęci
metalicznej, która nadaje osadowi barwę szarą :
4. Jodki
wytrącają żółtozielony osad jodku dirtęci(II), rozpuszczalny w nadmiarze
odczynnika z utworzeniem bezbarwnego kompleksowego jonu –
tetrajodortęcianu(II) i meta-licznej rtęci :
Hg
2
2+
+ 2I
-
= Hg
2
I
2
↓
Hg
2
I
2
+ 2I
-
= [HgI
4
]
2-
+ Hg
↓
5. Chromian(VI) potasu K
2
CrO
4
wytrąca na gorąco czerwony osad chromianu(VI) dirtęci(II), nierozpuszczalny
w rozcieńczonym kwasie azotowym(V) oraz w roztworach zasad :
Hg
2
2+
+ CrO
4
2-
= Hg
2
CrO
4
↓
6. AKT (CH
3
CSNH
2
) i rozpuszczalne w wodzie siarczki
wytrącają z kwaśnych roztworów osad siarczku rtęci(II) z wydzieleniem
metalicznej rtęci :
Hg
2
2+
+ S
2-
= HgS↓ + Hg↓
Siarczek ten jest słabo rozpuszczalny w rozcieńczonych kwasach, rozpuszcza
się w wodzie królewskiej :
3HgS + 12Cl
-
+ 2NO
3
-
+ 8H
+
= 3[HgCl
4
]
2-
+ 2NO
↑
+ 3S
↓
+ 4H
2
O
7. Miedź metaliczna
redukuje związki dirtęci(II) do metalicznej rtęci :
Hg
2
2+
+ Cu = 2Hg
↓
+ Cu
2+
Wykonanie: wypolerowaną blaszkę miedzianą zanurzyć do roztworu soli dirtęci
(II). Po upływie 1 minuty przemyć wodą i przetrzeć miękką szmatką. Płytka
pokrywa się srebrzystym lustrem. Uwaga: rtęć jest silnie trująca !
77
2 Hg
2
(NO
3
)
2
+4NH
3
+ H
2
O = O
Hg
Hg
NH
2
NO
3
+ 2Hg + 3 NH
4
NO
3

8. Chlorek cyny(II) SnCl
2
i inne reduktory
wytrącają szary osad rozdrobnionej metalicznej rtęci:
Hg
2
2+
+ 2Cl
-
= Hg
2
Cl
2
↓
Hg
2
Cl
2
+ Sn
2+
+ 4Cl
-
= 2Hg
↓
+ [SnCl
6
]
2-
Inne reduktory, np. metale o mniejszym od rtęci potencjale normalnym ( Pb,
Sn, Cd, Al, Fe, Co, Zn ),wytrącają również ciemnoszary osad metalicznej rtęci.
XIII.1. Zagadnienia
1. Dlaczego do wytrącania chlorków kationów I grupy nie można stosować
stężonego kwasu chlorowodorowego ?
2. Jakie reakcje wykorzystuje się do rozdzielania chlorków kationów I grupy ?
3. Napisać reakcje rozpuszczania AgCl i nazwać powstałe związki.
4. Różnice w rozpuszczalności AgCl, AgBr, i AgI.
5. Który z kationów i dlaczego można oddzielić od dwu pozostałych przy
użyciu NH
3
?
6. Napisać reakcje kationów I grupy z jonami jodkowymi i ich nadmiarem,
oraz z nadmiarem mocnej zasady i amoniaku.
7. Za pomocą odpowiednich reakcji przeprowadzić przemiany :
AgNO
3
→
Ag
2
O →AgCl → [ Ag(NH
3
)
2
]
+
→AgBr → [Ag(S
2
O
3
)
2
]
3-
→AgI
→Ag
2
S
8. Podać sposób rozdzielania Ag
+
i Pb
2+
za pomocą nadmiaru amoniaku i
nadmiaru mocnej zasady.
9. Podać przykłady reakcji w których jon Hg
2
2+
ulega reakcji
dysproporcjonowania.
10.Jak reagują jony Pb
2+
z jonami CrO
4
2-
i Cr
2
O
7
2-
. Która z tych reakcji jest
bardziej czuła i dlaczego ?
11.
Napisać reakcje prowadzące do rozdzielania jonów Ag
+
od Hg
2
2+
w toku
analizy systematycznej.
12.Który z chlorków kationów I grupy jest najtrudniej rozpuszczalny ? Napisać
reakcje jego rozpuszczania.
13.Jakim reakcjom ulega jon Hg
2
2+
w trakcie analizy systematycznej ?
78

14.Dlaczego w obecności dużej ilości jonów Hg
2
2+
a małej ilości jonów Ag
+
nie
można w analizie systematycznej wykryć jonów Ag
+
?
15.Dlaczego jony Pb
2+
wykrywa się zarówno w I jak i w grupie II kationów ?
79
Wyszukiwarka
Podobne podstrony:
Rozdzielanie kationów I grupy w toku analizy chemicznej
Analiza leków Wykrywanie kationów grupa 4 i 5, Farmacja
Rozdzielanie kationów IV grupy w toku analizy chemicznej
Analiza leków Wykrywanie kationów grupa 3, Farmacja
pwsz ioś kalisz Ćw. 6 POLARYMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz ioś kalisz Ćw 4 Spektrofotometria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, ana
,Analiza chemicznych zanieczyszczeń środowiska , Zasada powstawania widma mas
analiza chemiczna 2
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
Analiza chemiczna 5
pwsz ioś kalisz Analiza-Pehametria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz ioś kalisz polarymetria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza chemi
analiza chemiczna kobiety, zabawne
Analiza chemiczna spoiw
,Analiza chemicznych zanieczyszczeń środowiska , Chromatografia
Chemia związków wanadu Synteza i analiza chemiczna otrzymanych izopoliwanadów
,Analiza chemicznych zanieczyszczeń środowiska , specjacja
,Analiza chemicznych zanieczyszczeń środowiska , chemometria
Analiza chemiczna 1
więcej podobnych podstron