Zachodniopomorski Uniwersytet Technologiczny w Szczecinie
Wydział Nauk o śywności i Rybactwa
Zakład Opakowalnictwa i Biopolimerów
I N S T R U K C J A
Ć
W I C Z E N I E 12
Węglowodory

1. SPRZĘT
1.1 Mieszadło magnetyczne
1.2 Rurki szklane
1.3 Probówki z korkiem i szklana rurką
1.4 2 Naczyńka wagowe
1.5 Statyw z uchwytami i łapami
1.6 Kolbki stożkowe
1.7 Probówki
1.8 Zapałki
3. CEL ĆWICZENIA
Celem ćwiczenia jest otrzymanie acetylenu oraz zbadanie najważniejszych właściwości
węglowodorów.
4. WĘGLOWODORY
Węglowodory są podstawowymi związkami organicznymi. Ich cząsteczki składają się
wyłącznie z węgla (C) i wodoru (H). Węglowodory ze względu na budowę dzielimy na kilka
grup, które przedstawiono na poniższym rysunku:
2. ODCZYNNIKI
2.1. Roztwór KMnO
4
2.2. Węglik wapnia – karbid – CaC
2
2.3. Heptan
2.4. Rozpuszczalnik – n-ksylen
2.5. Kwas siarkowy VI
2.6. Alkohol etylowy – C
2
H
5
OH
4.1 ALKANY
Są grupą węglowodorów, w których pomiędzy atomami węgla tworzącymi cząsteczkę
występują tylko wiązania pojedyncze. Wzór ogólny
C
n
H
2n+2
.
Alkany o łańcuchach prostych tworzą szereg homologiczny, w którym każdy następny w
kolejności węglowodór ma o jedną grupę (metylowa) -CH
2
więcej. Szereg homologiczny
alkanów rozpoczyna metan o wzorze sumarycznym CH
4
. Poniżej przedstawiono szereg
homologiczny alkanów.
Wzór ogólny - C
n
H
2n+2
Wzór
Nazwa alkanu
CH
4
Metan
C
2
H
6
Etan
C
3
H
8
Propan
C
4
H
10
Butan
C
5
H
12
Pentan
C
6
H
14
Heksan
C
7
H
16
Heptan
C
8
H
18
Oktan
C
9
H
20
Nonan
C
10
H
22
Dekan
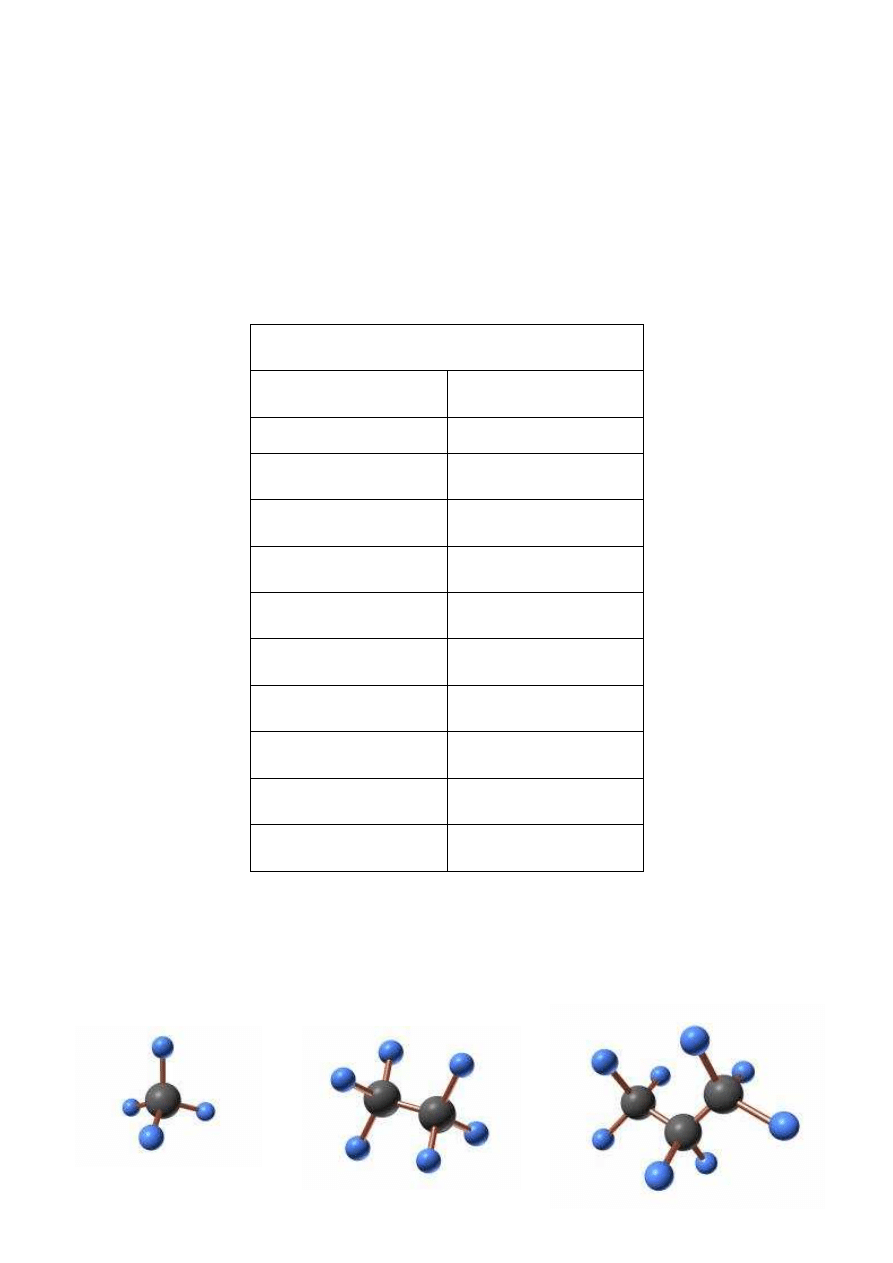
Poniżej przedstawiono modele cząsteczek niektórych alkanów:
a) metan
b) etan
c) propan
Obok alkanów o łańcuchach prostych występują alkany o łańcuchach rozgałęzionych.
Alkany rozgałęzione to węglowodory w cząsteczkach których możemy wyróżnić główny
łańcuch węglowy i podstawniki. Podstawniki tworzą rozgałęzienia.
Przykłady węglowodorów rozgałęzionych:
•
2,3-dimetylobutan
CH
3
CH
CH
CH
3
CH
3
CH
3
1
2
3
4
Czerwonym kolorem zaznaczono łańcuch główny, czarnym podstawniki.
•
3-etylo-2,3,5,5,7-pentametylooktan
C
H
3
CH
CH
2
C
CH
2
C
CH
CH
3
CH
3
CH
2
CH
3
CH
3
CH
3
CH
3
CH
3
1
2
3
4
5
6
7
8
d) butan
e) penten
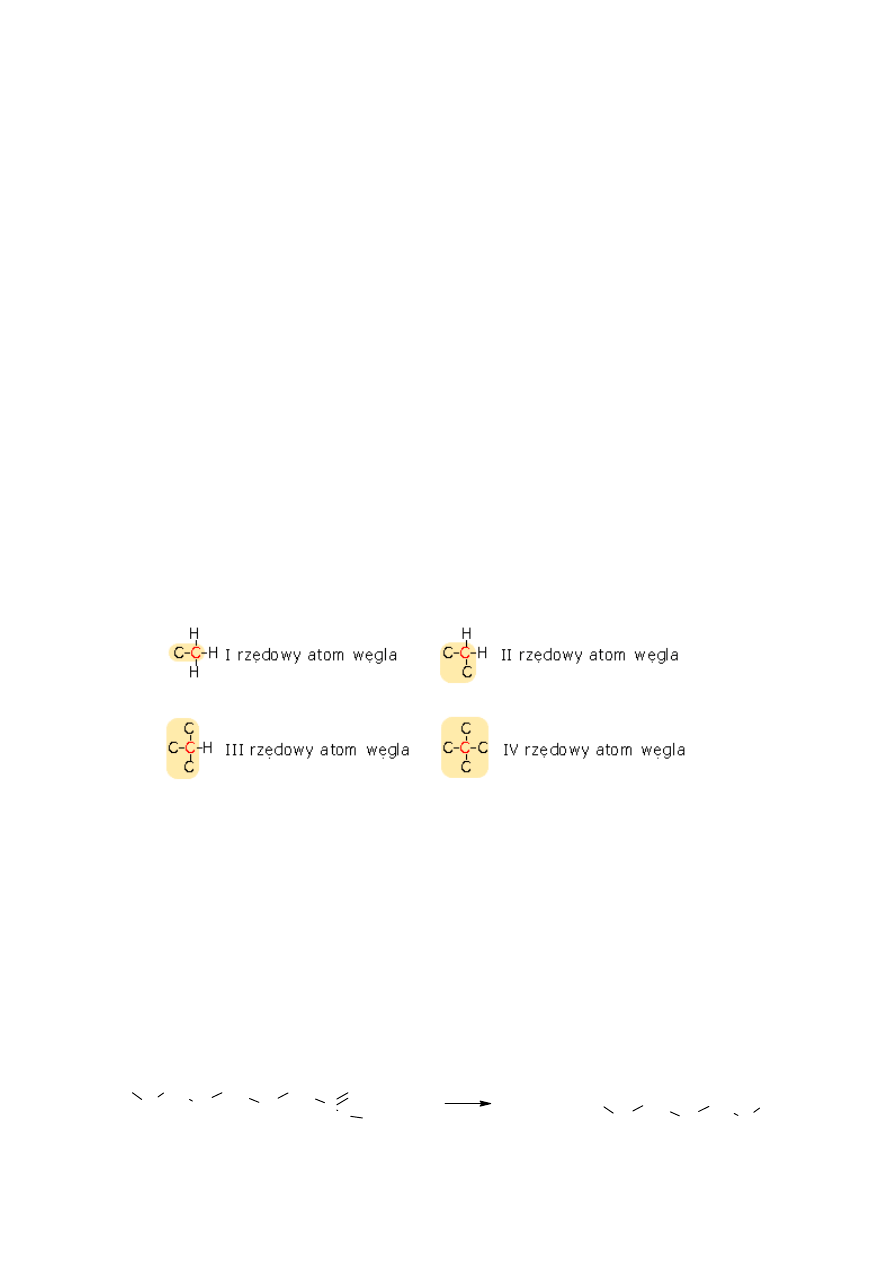
Za łańcuch główny przyjmuje się tu najdłuższy z możliwych łańcuchów węglowych,
o największej liczbie podstawników.
Atomom węgla tworzącym łańcuch główny nadaje się numerację tak, by atomy
zawierające podstawniki miały jak najniższe wartości. Jeżeli zasada, jak w przypadku
powyższego związku, nie znajduje zastosowania, to numerację rozpoczyna się od tego końca
cząsteczki, od którego wcześniej pojawi się kolejny podstawnik.
Powtarzające się łańcuchy boczne określa się przedrostkami: di-, tri, tetra-,.
Tworząc nazwę związku, podstawniki wymienia się w kolejności alfabetycznej.
Reguła nie uwzględnia przedrostków. Tak np. pięć podstawników metylowych implikuje
nazwę 2,3,5,5,7-pentametylo... ale istotna jest jedynie pierwsza litera nazwy podstawnika
(tzn. „m” a nie „p”).
Cząsteczki alkanów o łańcuchach rozgałęzionych zawierają atomy węgla o różnej
rzędowości, tj. różnej liczbie atomów węgla połączonych z rozpatrywanym węglem.
Atom węgla może być I-rzędowy (węgiel jest połączony tylko z jednym atomem
węgla- jak w przypadku etanu), II-rzędowy, III-rzędowy, IV rzędowy (gdy wszystkie cztery
wiązania rozpatrywanego atomu węgla są tworzone z atomami węgla).
Przedstawiona powyżej cząsteczka 3-etylo-2,3,5,5,7-pentametylooktanu zawiera dwa
węgle IV-rzędowe, dwa węgle III-rzędowe, trzy węgle II-rzędowe i osiem węgli I-rzędowych.
4.1.1 Metody otrzymywania alkanów
1.
Metoda Dumasa - prażenie soli sodowych kwasów karboksylowych z wodorotlenkiem
sodu.
Przykładem jest synteza n-heptanu z soli sodowej kwasu oktanowego.
C
H
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
C
O
O
Na
+
NaOH
Na
2
CO
3
+
C
H
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3

2.
Metoda Wurtza – działanie metalicznego sodu na fluorowcoalkany.
Przykładem jest synteza n-dekanu z 1-jodopentanu.
C
H
3
CH
2
CH
2
CH
2
CH
2
I
C
H
3
CH
2
CH
2
CH
2
CH
2
I
+
2Na
C
H
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
+
2NaI
3.
Addycja wodoru do wiązań nienasyconych węglowodorów (uwodornienie).
Przykładem jest synteza butanu z 2-butynu.
C
H
3
CH
CH
CH
3
+
H
2
C
H
3
CH
2
CH
2
CH
3
Ni
temperatura
4.1.2 Właściwości fizyczne alkanów
Właściwości fizyczne alkanów są zależne od liczby atomów węgla w cząsteczce. Alkany
posiadające:
•
od 1 do 4 atomów węgla - są gazami (gaz ziemny)
•
od 5 do 17 atomów węgla - są cieczami (benzyny)
•
więcej jak 18 atomów węgla - są ciałami stałymi (parafina)
Wszystkie alkany są nierozpuszczalne w wodzie, natomiast dobrze w rozpuszczalnikach
organicznych. Dobrze palą się, stąd wykorzystanie ich jako paliwa.
4.1.3 Właściwości chemiczne alkanów - reakcje
Węglowodory nasycone wykazują bardzo małą reaktywność, co wynika z trwałości
wiązań (duża energia wiązań). Są odporne na działanie mocnych kwasów i zasad, a także
utleniaczy.
1.
Spalanie
Np. spalanie metanu (reakcja z tlenem z powietrza)
CH
4
+ 2O
2
→
CO
2
+ 2H
2
O
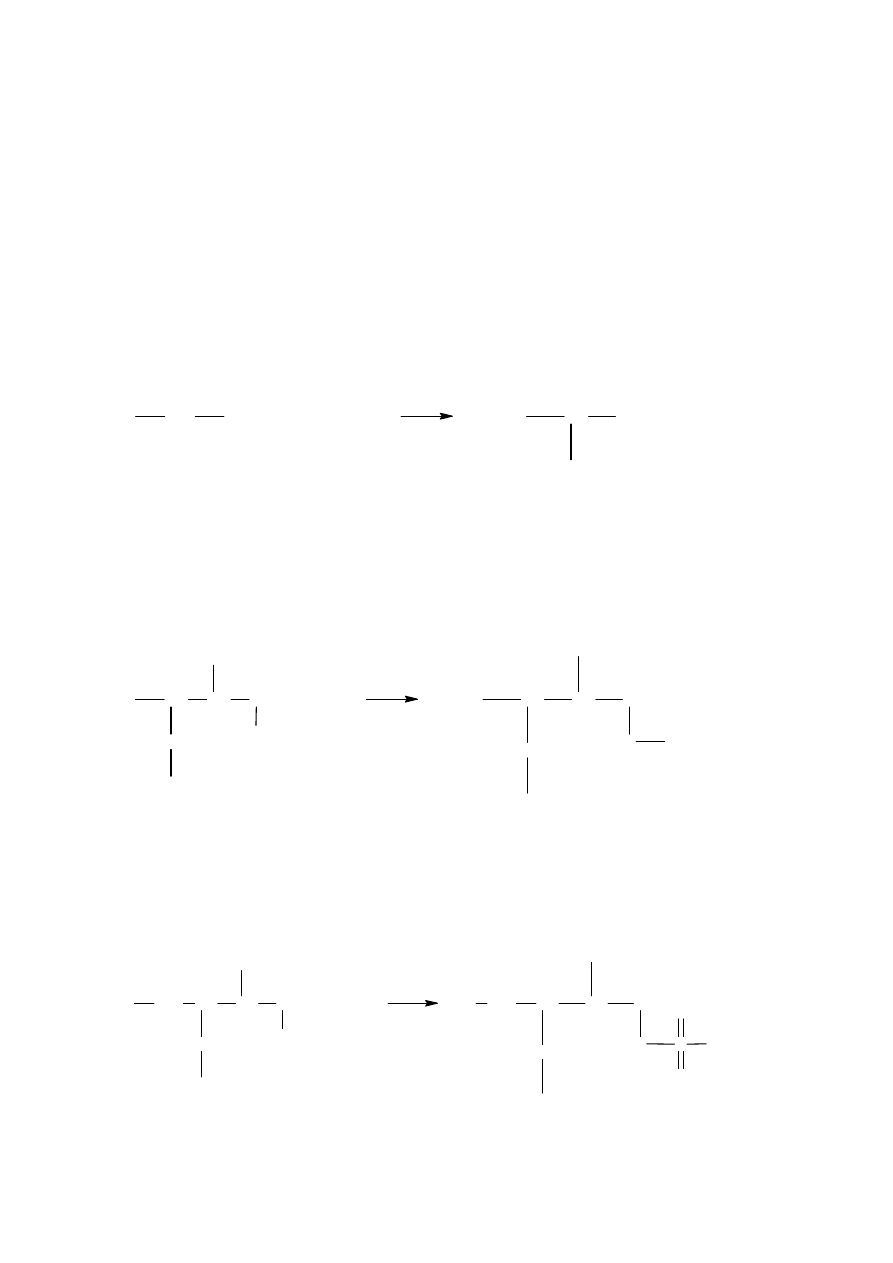
Przy niedostatecznym dostępie powietrza produktem reakcji jest tlenek węgla (czad) - CO.
Oto przebieg reakcji
2CH
4
+ 3O
2
→
2CO + 4H
2
O
lub
CH
4
+ O
2
→
C + 2H
2
O
Podobnie spalają się pozostałe alkany.
2.
Fluorowcowanie
Przykładem jest synteza 2-chloropropanu przez chlorowanie propanu.
C
H
3
CH
2
CH
3
+
Cl
2
C
H
3
CH
CH
3
Cl
+
HCl
hv
temperatura
Fluorowcoalkany są związkami reaktywnymi. Tworzenie alkoholi, amin, nitryli itp.
odbywa się przez podstawienie atomu fluorowca odpowiednią grupą funkcyjną.
3.
Nitrowanie
Przykładem jest synteza 3,4-dimetylonitroheksanu z 3,4-dimetyloheksanu.
C
H
3
CH
CH
CH
2
CH
3
CH
2
CH
3
CH
3
HNO
3
+
+
O
H
2
C
H
3
CH
CH
CH
2
CH
3
CH
3
CH
2
C
H
2
NO
2
1
2
3
4
5
6
1
2
3
4
5
6
4. Sulfonowanie
Przykładem jest synteza kwasu 4-etylo-3-metyloheksylosulfonowego z 4-etylo-3-
metyloheksanu.
CH
2
CH
CH
CH
2
CH
3
C
H
3
CH
2
CH
3
CH
3
H
2
SO
4
+
+
O
H
2
C
H
3
CH
2
CH
CH
CH
2
CH
3
CH
3
CH
2
C
H
2
S
OH
O
O
1
2
3
4
5
6
1
2
3
4
5
6
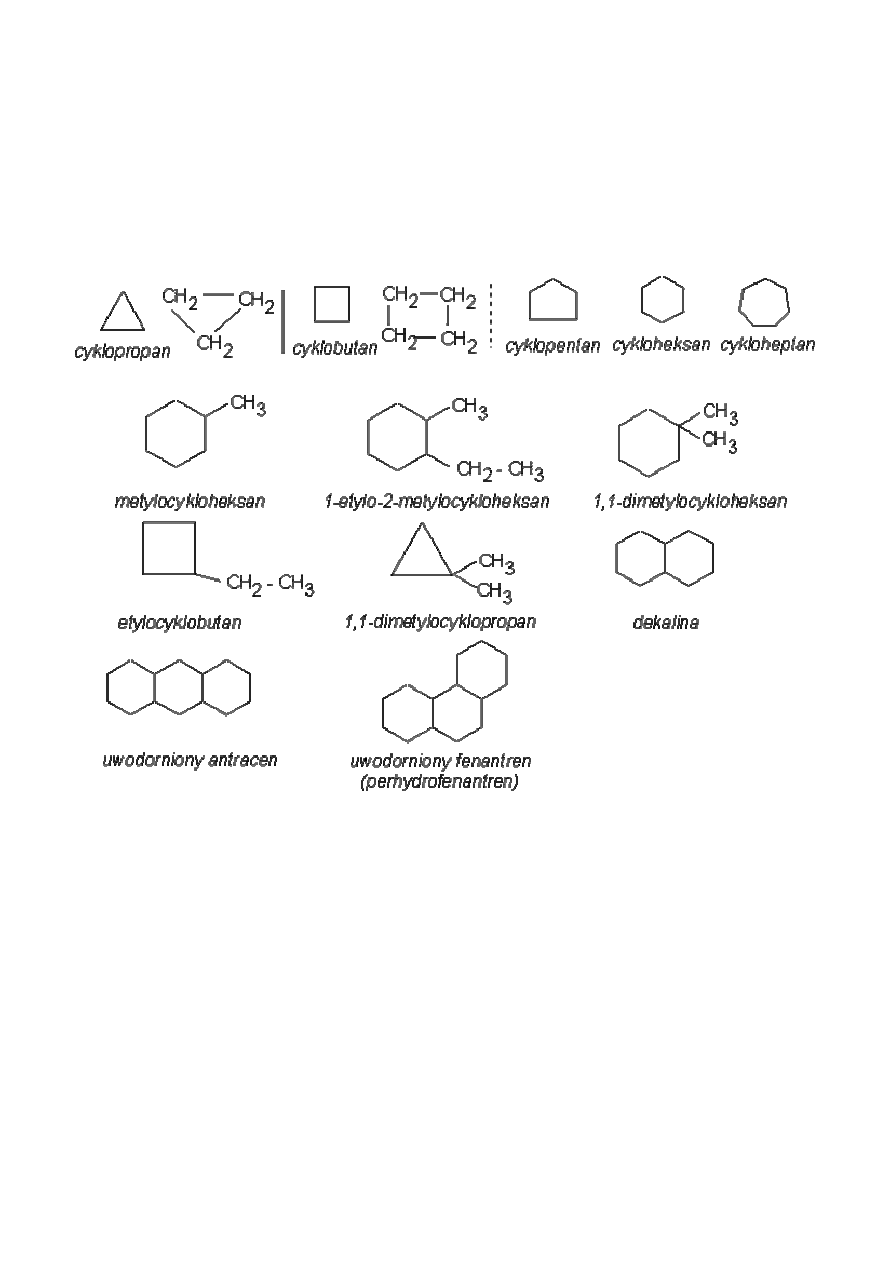
4.1.4 Cykloalkany
Są grupą węglowodorów, których cząsteczki zawierają pierścienie zbudowane z
atomów węgla połączonych pojedynczymi wiązaniami.
Nazwy cykloalkanów tworzy się przez dodanie przedrostka –cyklo. Poniżej przedstawiono
wzory strukturalne cykloalkanów:
4.2 ALKENY
Są grupą węglowodorów łańcuchowych posiadających wiązanie podwójne. Wzór
ogólny
C
n
H
2n
.
Metan nie ma swojego przedstawiciela w tej grupie.
Każdy kolejny alkan ma odpowiednik, którego nazwę tworzy się przez zamianę końcówki „–
an” alkanu na „-en” alkenu. W ten sposób powstają nazwy kolejnych alkenów
o łańcuchach prostych: eten, propen, 1-buten, 2-buten, itd. Cyfra w nazwie alkenu wskazuje
na numer węgla, przy którym występuje wiązanie podwójne.
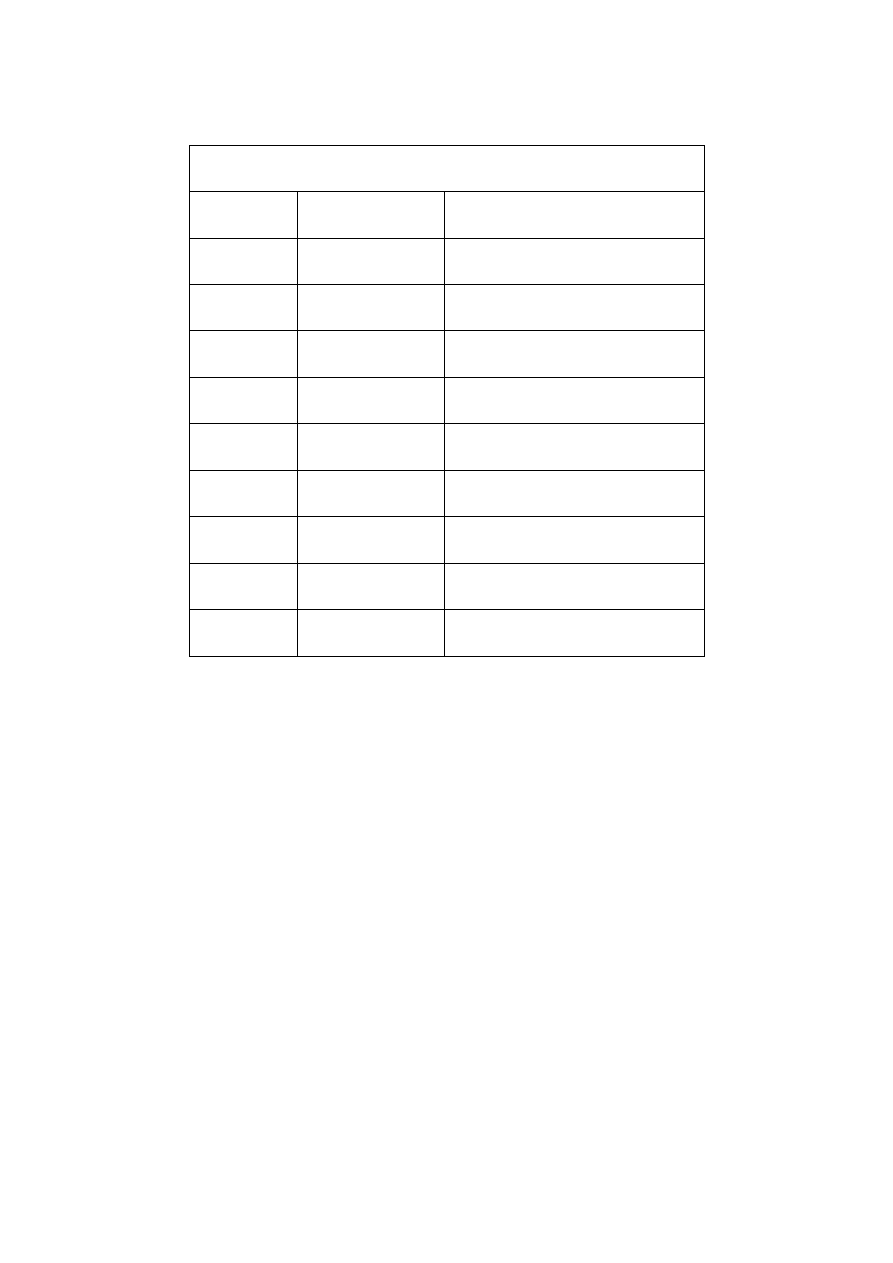
Szereg homologiczny alkenów
Wzór ogólny - C
n
H
2n
Wzór
Nazwa alkenu
Nazwa odpowiedniego alkanu
C
2
H
4
Eten
Etan
C
3
H
6
Propen
Propan
C
4
H
8
Buten
Butan
C
5
H
10
Penten
Pentan
C
6
H
12
Heksen
Heksan
C
7
H
14
Hepten
Heptan
C
8
H
16
Okten
Oktan
C
9
H
18
Nonen
Nonan
C
10
H
20
Deken
Dekan
Wzory strukturalne niektórych alenów:
a) 1-penten
b) 1-propen
H H H H
C ═ C
C
C
C
H
H H H H H
c) 2-buten
H H H H
H
C
C ═ C
C
H
H H
H H
C ═ C
C
H
H H H
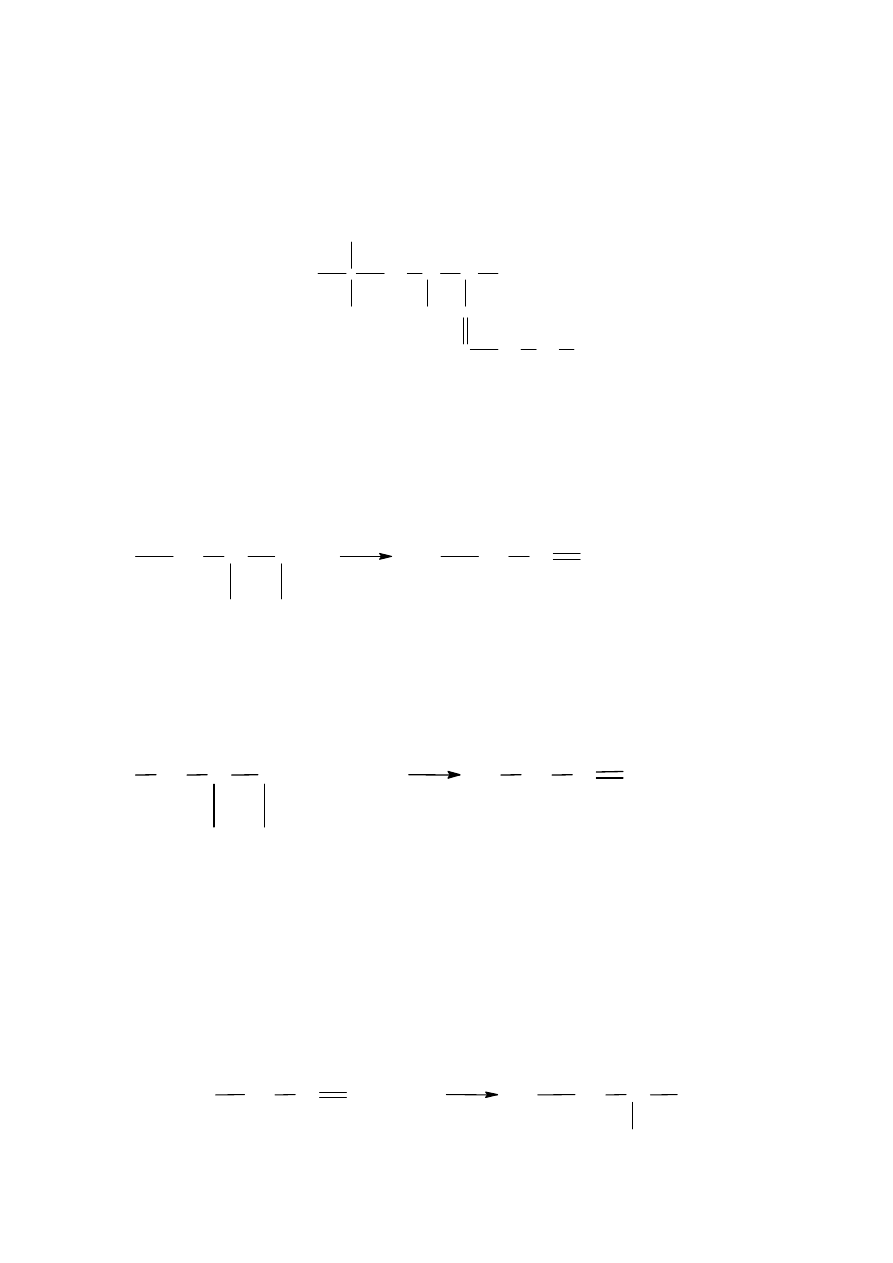
Nazwy alkenów rozgałęzionych tworzy się po uprzednim ustaleniu łańcucha
głównego i odpowiednim ponumerowaniu tworzących go atomów węgla. Numerację
rozpoczyna się od tego końca cząsteczki, bliżej którego jest wiązanie podwójne.
Przykładem alkenu o łańcuchu rozgałęzionym jest 6,7,9,9-tetrametylo-4-deken.
C
H
3
C
CH
2
CH
CH
CH
C
H
CH
2
CH
2
CH
3
CH
3
CH
3
CH
3
CH
3
1
2
3
4
5
6
7
8
9
10
4.2.1 Metody otrzymywania alkenów:
1.
Dehydratacja alkoholi (przykład: synteza 1-butenu z 1-butanolu)
C
H
3
CH
2
CH
CH
2
OH
H
H
2
SO
4
st
ęż
.
C
H
3
CH
2
CH
CH
2
+
H
2
O
1
2
3
4
1
2
3
4
2.
Eliminacjia fluorowcowodoru z fluorowcoalkanów (np.)
C
H
3
CH
2
CH
CH
2
Br
H
C
H
3
CH
2
CH
CH
2
+
H
2
O
+
KOH(st
ęż
)
+
KBr
1
2
3
4
1
2
3
4
4.2.2 Właściwości chemiczne alkenów
Alkeny ulegają reakcjom:
1.
Addycji fluorowcowodorów i cząsteczek fluorowców.
Przykładami są synteza 2-bromobutanu z 1-butenu oraz synteza 1,2-dibromobutanu z 1-
butenu
C
H
3
CH
2
CH
CH
2
+
HBr
C
H
3
CH
2
CH
CH
3
Br
1
2
3
4
1
2
3
4
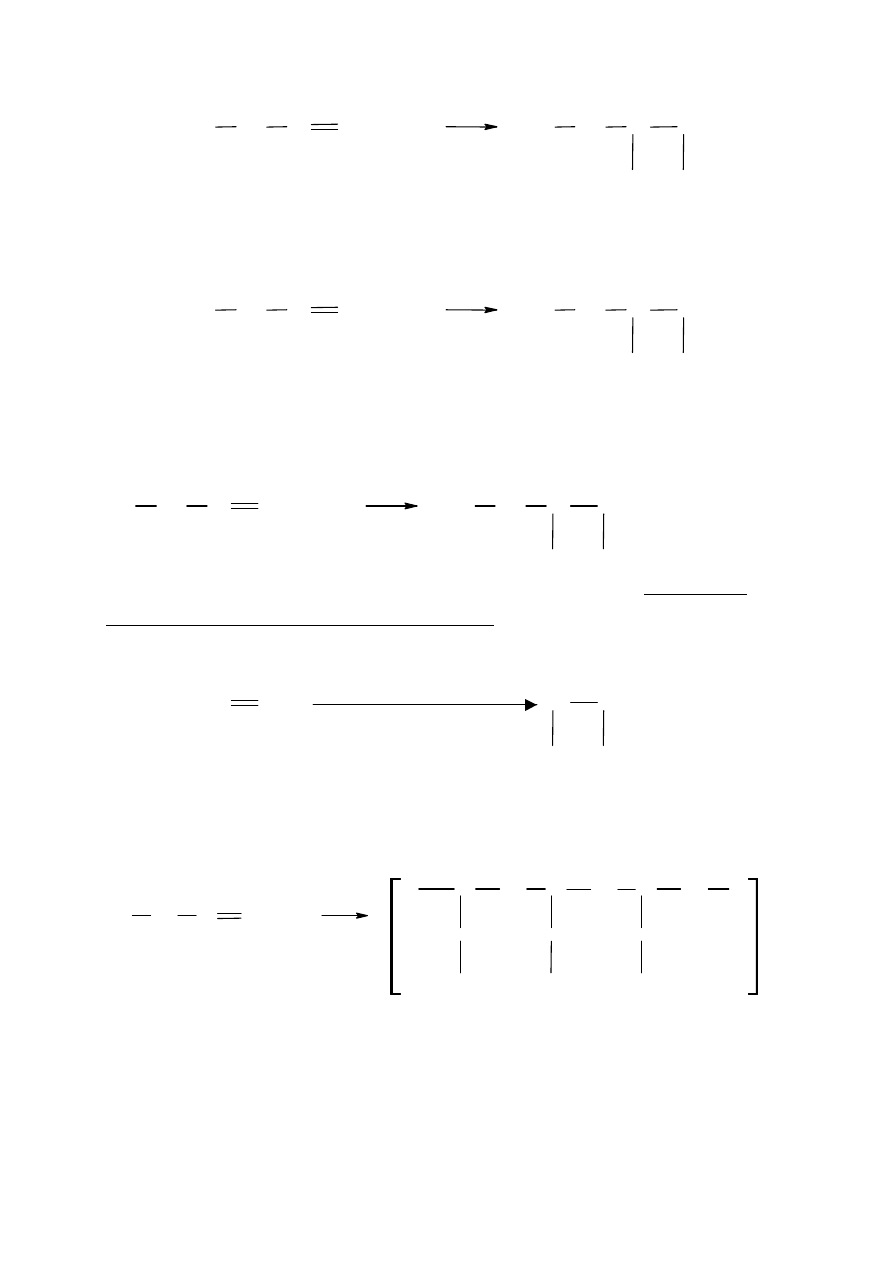
C
H
3
CH
2
CH
CH
2
C
H
3
CH
2
CH
CH
2
Br
Br
+
Br
2
2
1
3
4
2
1
3
4
2.
Uwodornieniu
Przykładem jest synteza butanu z 1-butenu
C
H
3
CH
2
CH
CH
2
C
H
3
CH
2
CH
CH
2
H
H
+
H
2
2
1
3
4
2
1
3
4
3.
Utlenieniu np.:
– synteza 1,2-butanodiolu z 1-butenu
C
H
3
CH
2
CH
CH
2
C
H
3
CH
2
CH
CH
2
O
H
O
H
+
H
2
O
utleniacz
2
1
3
4
2
1
3
4
–utlenianie etenu– reakcji tej towarzyszy odbarwienie roztworu KMnO
4
– reakcja ta jest
wykorzystywana do odróżniania alkenów od alkanów
2
CH
CH
2
CH
CH
2
O
H
O
H
KMnO
4
.H
2
O
2
1
2
1
MnO
2
2
4. Polimeryzacji
Przykładem jest synteza poli(1-butenu) z 1-butenu
C
H
3
CH
2
CH
CH
2
CH
2
CH
CH
2
CH
CH
2
CH
2
CH
CH
2
CH
3
C
H
3
CH
2
CH
3
----
----
+
H
2
O
katalizator
temperatura
n
2
2
2
1
1
1
3
3
3
4
4
4
1,2 etandiol (glikol)
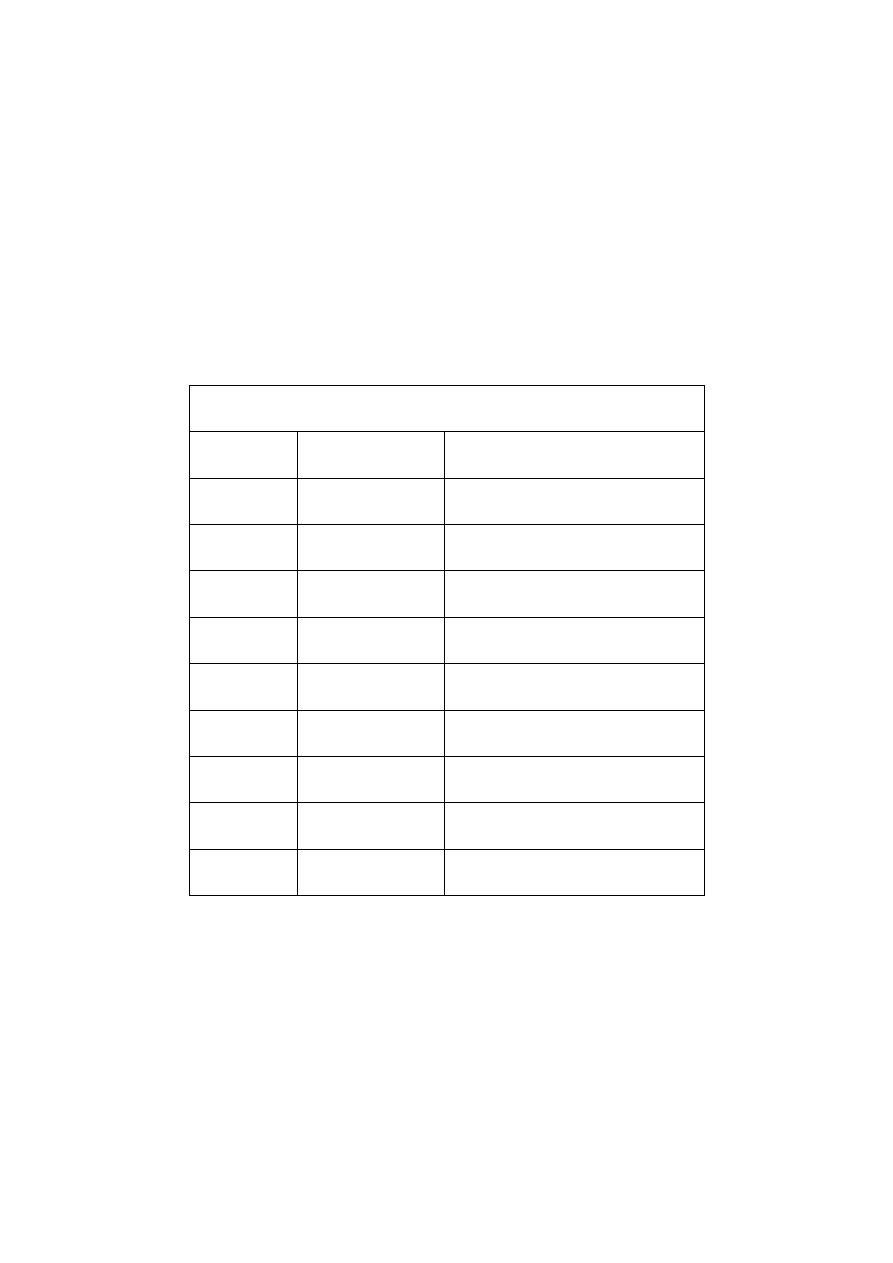
4.3 ALKINY
Są grupą węglowodorów łańcuchowych zawierających jedno wiązanie potrójne. Wzór
ogólny
C
n
H
2n-2
.
Nazwę tworzy się przez dodanie do rdzenia nazwy alkanu, o identycznej z danym alkinem
liczbie atomów węgla, końcówki „-yn”. Przykładowe nazwy: etyn (acetylen), propyn, 1-
butyn, 2-butyn. Cyfra przed nazwą wskazuje pierwszy atom węgla w łańcuchu, który ma
wiązanie potrójne.
Szereg homologiczny alkinów
Wzór ogólny - C
n
H
2n-2
Wzór
Nazwa alkenu
Nazwa odpowiedniego alkanu
C
2
H
2
Etyn
Etan
C
3
H
4
Propyn
Propan
C
4
H
6
Butyn
Butan
C
5
H
8
Pentyn
Pentan
C
6
H
10
Heksyn
Heksan
C
7
H
12
Heptyn
Heptan
C
8
H
14
Oktyn
Oktan
C
9
H
16
Nonyn
Nonan
C
10
H
18
Dekyn
Dekan
Wzory strukturalne niektórych alkinów:
a) etyn
b) 1-propyn
H H
C ≡ C
H H
C ≡ C
C
H
H
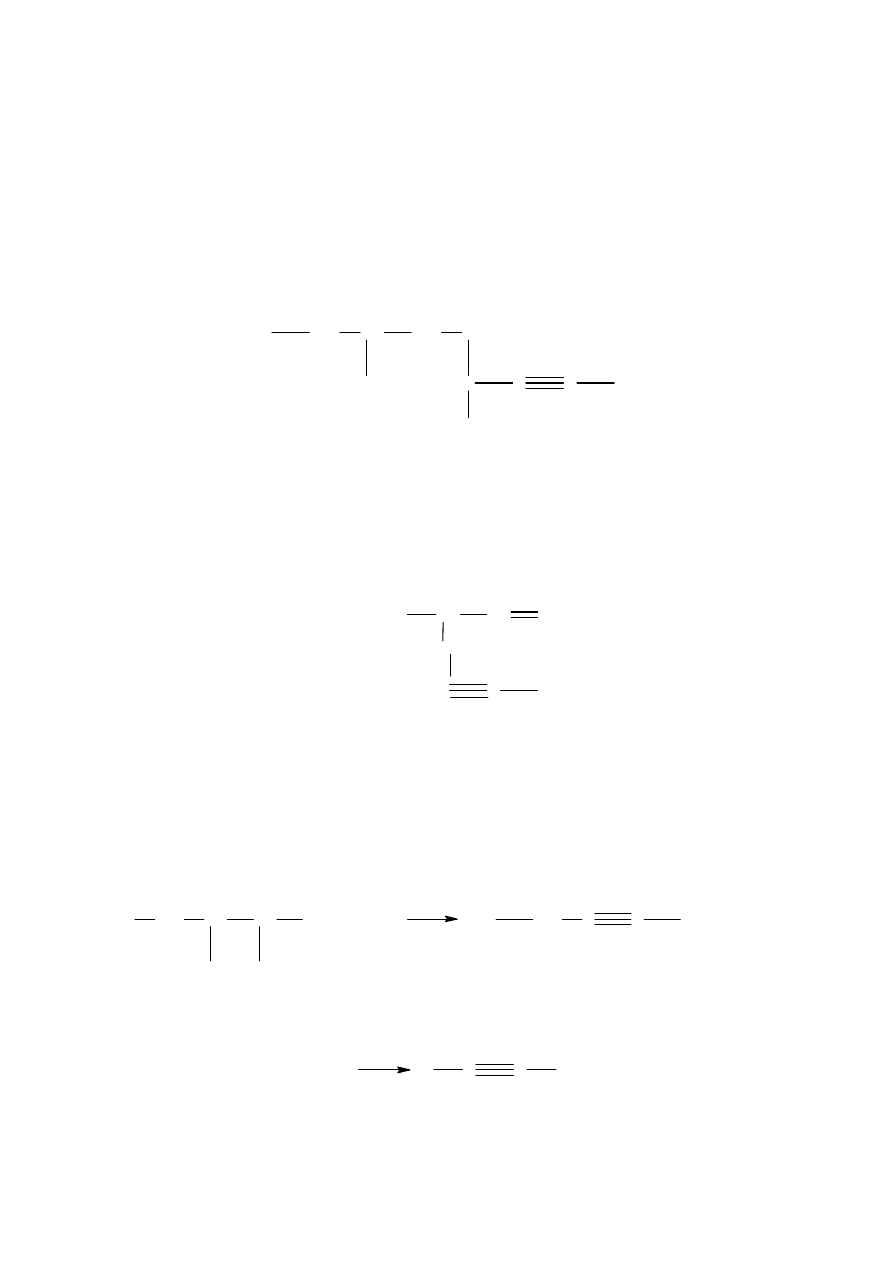
c) 1-butyn
Do rodziny alkinów zalicza się również węglowodory o łańcuchach rozgałęzionych.
Przykładem może być 4,7-dimetylo-2-nonyn
C
H
3
CH
2
CH
CH
2
CH
2
C
H
C
C
CH
3
CH
3
CH
3
2
1
3
4
5
6
7
8
9
Numerowanie łańcucha głównego rozpoczyna się od końca cząsteczki, bliżej którego
zlokalizowane jest wiązanie potrójne. Jeżeli cząsteczka posiada obok wiązań potrójnych także
wiązania podwójne, to numerowanie łańcucha głównego rozpoczyna się od tego końca
cząsteczki, bliżej którego znajduje się pierwsze z wiązań wielokrotnych. Za przykład niech
posłuży 3-metylo-1-hepten-5-yn.
C
H
3
CH
CH
CH
2
CH
2
C
C
CH
3
2
1
3
4
5
6
7
4.3.1 Metody otrzymywania alkinów:
1.
Eliminacji z cząsteczki difluorowcoalkanu dwu atomów fluorowca, przyłączonych do
sąsiadujących atomów.
Przykład stanowi synteza 2-pentynu z 2,3,-dichloropentanu.
C
H
3
CH
2
CH
CH
CH
3
Cl
Cl
+
2KOH
C
H
3
CH
2
C
C
CH
3
+
2KCl
+
2H
2
O
2
1
3
4
5
2
1
3
4
5
2.
Hydrolizy węglika wapnia (otrzymywanie etynu).
CaC
2
+
2H
2
O
C
C
H
H
+
Ca(OH)
2
H H H
C ≡ C
C
C
H
H H
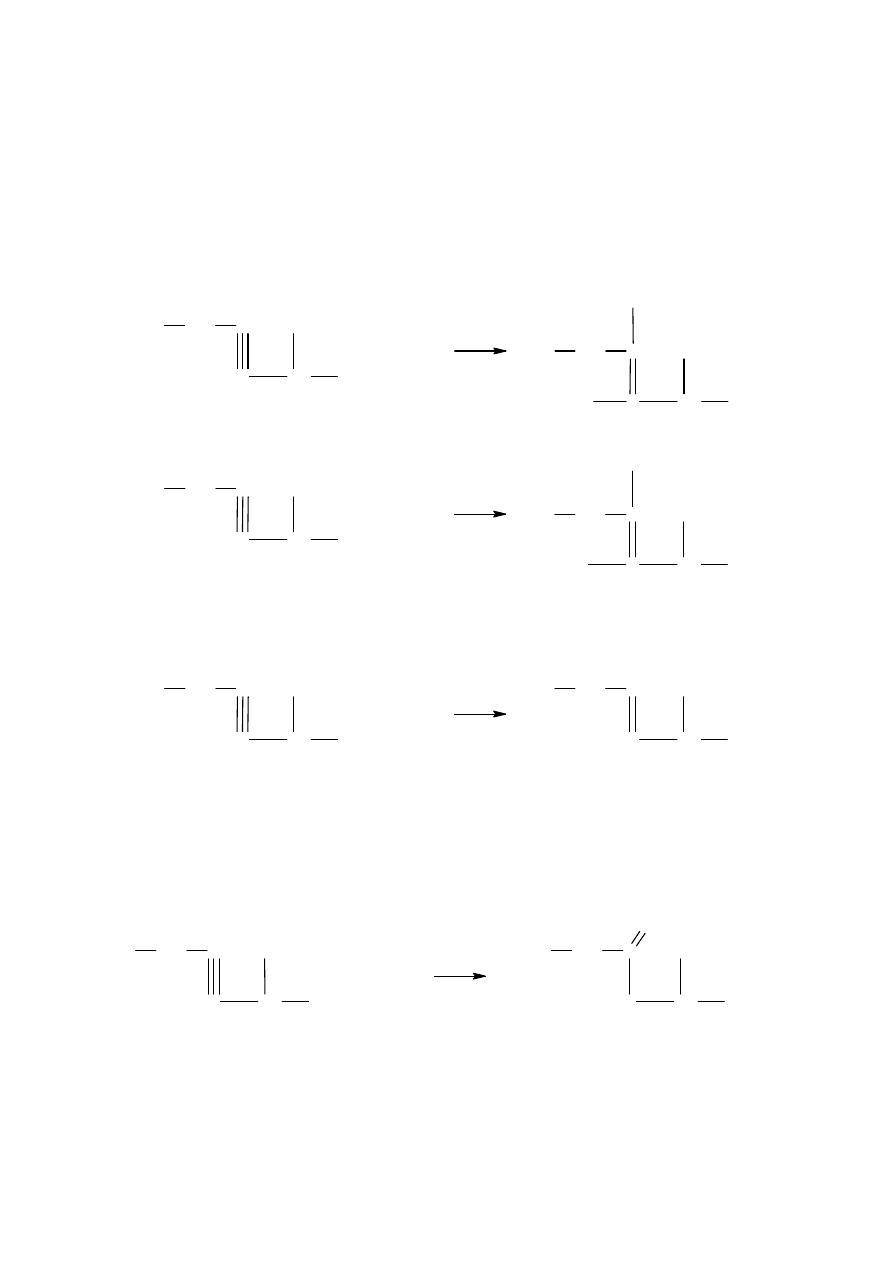
4.3.2 Właściwości chemiczne
Alkiny są bardzo reaktywną grupą związków.
Ulegają reakcjom:
1.
Addycji cząsteczki fluorowca lub fluorowcowodoru. Za przykład służy synteza
3,4- dibromo-2-metyloheksenu oraz 4-bromo-2-metyloheksenu z 2-metylo-3-heksynu
C
H
3
CH
2
C
C
CH
CH
3
CH
3
+
Br
2
C
H
3
CH
2
C
C
CH
CH
3
CH
3
Br
Br
1
2
3
4
5
1
2
3
4
5
6
C
H
3
CH
2
C
C
CH
CH
3
CH
3
+
HBr
C
H
3
CH
2
C
C
CH
CH
3
CH
3
Br
H
2
1
3
4
5
6
2
1
3
4
5
6
2.
Uwodornienia (za przykład służy synteza 2-metylo-3-heksenu z 2-metylo-3-heksynu)
C
H
3
CH
2
C
C
CH
CH
3
CH
3
+
H
2
C
H
3
CH
2
CH
C
H
CH
CH
3
CH
3
2
1
3
5
6
4
2
1
3
4
5
6
3.
Utlenienia (za przykład służy synteza 2-metylo-4-heksanonu [ketonu etylowo-2-
metylopropylowego] z 2-metylo-3-heksynu)
C
H
3
CH
2
C
C
CH
CH
3
CH
3
+
H
2
O
C
H
3
CH
2
C
C
H
2
CH
CH
3
CH
3
O
katalizator
2
1
3
4
5
6
2
1
3
4
5
6
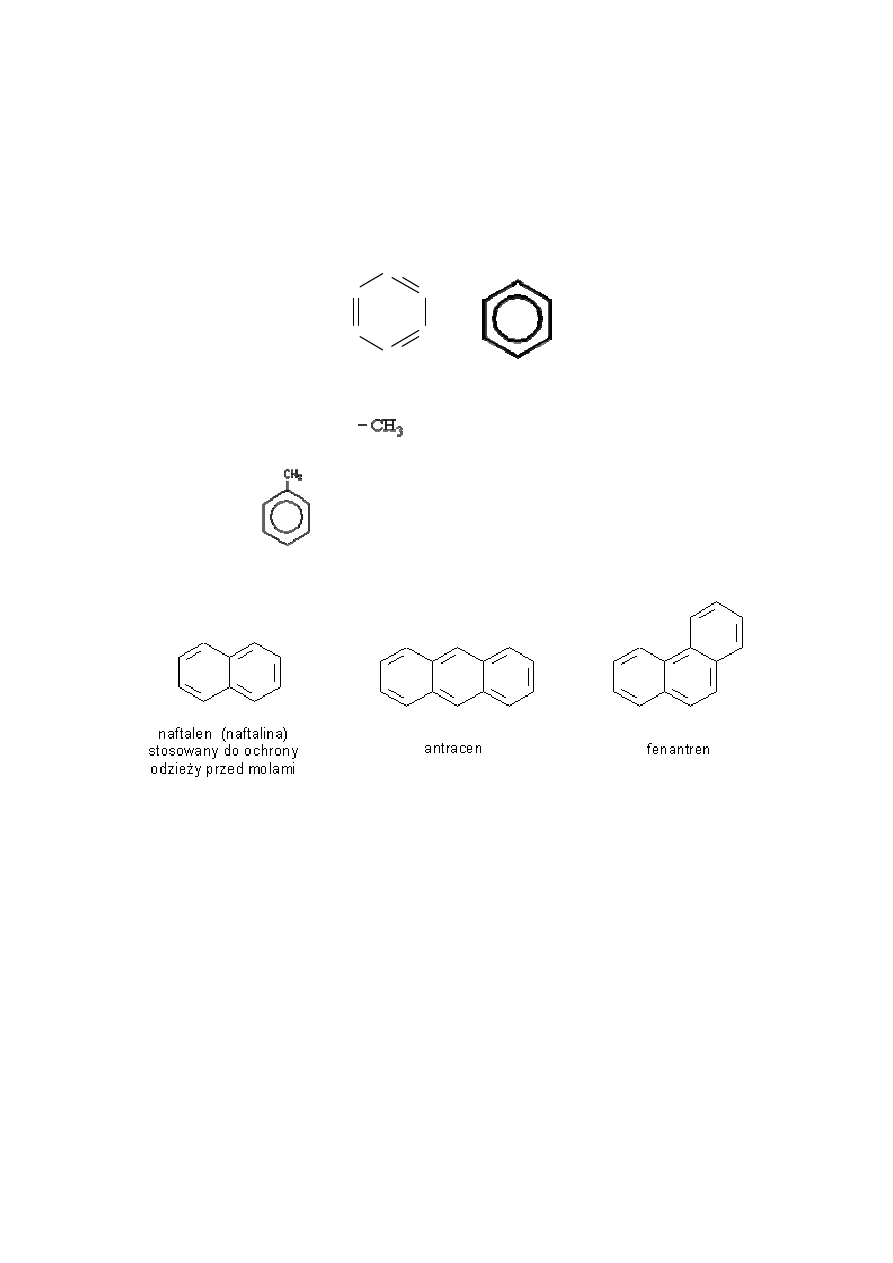
4.4 WĘGLOWODORY AROMATYCZNE
Są grupą węglowodorów, których cząsteczki mają budowę pierścieniową i zawierają
wiązanie zdelokalizowane pomiędzy wszystkimi atomami węgla tworzącymi pierścień.
Najprostszym przedstawicielem tej grupy związków jest benzen o wzorze sumarycznym
C
6
H
6
.
C
H
CH
CH
CH
C
H
CH
Inne związ
Najprostszą pochodną benzenu jest toluen, w którym jeden z atomów wodoru
został zastąpiony grupą metylową
.
matyczne:
toluen
4.4.1 Właściwości chemiczne benzenu
Benzen ulega reakcjom substytucji, do których zalicza się reakcje chlorowania,
nitrowania, sulfonowania, alkilowania, acylowania oraz reakcjom addycji, do których zalicza
się chlorowanie i uwodornienie.
Doświadczalne badanie własciwości węglowodorów aromatycznych nie jest zaprojektowane
ze względu na wysoką szkodliwość i kancerogenność przedstawicieli tej grupy.

5. WYKONANIE ĆWICZENIA
UWAGA ĆWICZENIA STUDENCI PRZEPROWADZAJĄ
POD KONTROLĄ PROWADZĄCEGO!!!!
5.1 Zachowanie się przykładowych węglowodorów wobec nadmanganianu VII potasu
Przebieg ćwiczenia:
a) do próbówki nr 1 należy wlać 1 cm
3
heptanu;
b) do próbówki nr 2 należy wlać 1 cm
3
rozpuszczalnika (n-ksylen);
c) do próbówki nr 1 i nr 2 należy dodać 1 cm
3
rozcieńczonego roztworu manganianu VII
potasu;
d) zanotować wynik obserwacji (barwa, konsystencja) bezpośrednio po zmieszaniu;
e) do obu próbówek należy dodać 2 – 3 krople rozcieńczonego kwasu siarkowego VI;
f) zawartość w obu próbówkach należy dokładnie wymieszać;
g) należy ponownie zanotować wynik obserwacji po upływie 20 minut ekspozycji
w świetle.
h) o czym świadczy zmiana barwy?
i) proszę napisać równania odpowiednich reakcji.
5.2 Otrzymywanie etynu (acetylenu) i badanie jego właściwości
Przebieg ćwiczenia:
a)
do probówki nr1 wrzucamy jeden kawałek węglika wapnia
b)
wlewamy 2 cm
3
mieszaniny wody z alkoholem etylowym (w stosunku 1:1) – dodatek
etanolu ma na celu „rozcieńczenie” wody, ponieważ z czystą wodą reakcja przebiega
zbyt gwałtownie;
c)
próbówkę należy zatkać korkiem z umieszczoną w nim rurką;
d)
do próbówki nr 2 należy wlać 1 cm
3
rozcieńczonego roztworu manganianu VII potasu;
e)
wylot rurki należy umieścić w próbówce nr 2; co zaobserwowano?
f)
za pomocą papierka wskaźnikowego badamy odczyn roztworu poreakcyjnego o czym
ś
wiadczy takie pH roztworu?
g)
Napisać równania reakcji otrzymywania acetylenu oraz reakcji z manganianem VII
potasu.

5.3. Badanie rozpuszczalności i właściwości węglowodorów
a) przygotować 3 zlewki;
b) w kolbce przygotować roztwór wody ze środkiem powierzchniowo czynnym tj. do wody
destylowanej należy dodać niewielką ilość np. płynu do mycia naczyń;
c) w każdej zlewce należy umieścić po 5 cm
3
heptanu;
d) do pierwszej zlewki należy dodać 20 cm
3
wody destylowanej; co zaobserwowano?
e) do drugiej zlewki należy dodać 5 cm
3
rozpuszczalnika; co zaobserwowano?
f) do trzeciej zlewki należy dodać 20 cm
3
roztworu ze środkiem powierzchniowo czynnym;
co zaobserwowano?
g) po 5 minutach należy umieścić każdą ze zlewek na mieszadle magnetycznym i mieszać
przez 2 minuty; co zaobserwowano?
h) zlewki odstawić na 5 minut, po upływie tego czasu należy zanotować wynik obserwacji.
i) jakie wnioski można wyciągnąć na temat właściwości fizycznych użytych w ćwiczeniu
węglowodorów? (np. gęstość, stan skupienia w temperaturze pokojowej etc.)
Literatura:
1.
John Mc. Murry; Chemia organiczna; WN PWN; Warszawa 2000
2.
H. Marzec; Chemia organiczna; WU ATR; Bydgoszcz 2001
3.
J. D. Roberts, M. C. Caserio; Chemia organiczna; PWN Warszawa 1969
4.
P. Mastalerz; Chemia organiczna; PWN Warszawa 1984

Ć
WICZENIA LABORATORYJNE Z CHEMII - ZAGADNIENIA DO KOLOKWIUM
WĘGLOWODORY
1.
Alkany, alkeny i alkiny, budowa cząsteczek, nazewnictwo, homologi, grupy alkilowe
(metylowa, etylowa), wiązania pojedyncze, podwójne i potrójne między atomami węgla,
rzędowość atomów węgla.
2.
Właściwości fizyczne alkanów, rozpuszczalność w wodzie i węglowodorach, gęstość
ciekłych alkanów względem wody, szkodliwość dla środowiska wodnego.
3.
Reakcje alkanów z fluorowcami, reakcja podstawienia, rodniki, łańcuchowy mechanizm
wolnorodnikowy.
4.
Reakcje alkenów z fluorowcopochodnymi, reakcja addycji, rola wiązania C=C.
5.
Porównanie reaktywności alkanów i alkenów; trwałość wiązań C-C i C-H w cząsteczkach
alkanów, wiązania niespolaryzowane; wiązania
σ
i
π.
6.
Związki aromatyczne, benzen, budowa cząsteczki, wiązanie zdelokalizowane, związek
z reaktywnością benzenu, aromatyczne podstawienie elektrofilowe.
Przykłady pytań:
1.
Narysować wzory sumaryczne i strukturalne następujących węglowodorów: propanu,
propenu, propynu.
2.
Narysować wzór strukturalny 2,2-dietylo-1,3,5- trimetylooktanu, określić rzędowość
atomów węgla w tym związku.
3.
Porównać reaktywność alkanów i alkenów; wyjaśnić różnicę na podstawie trwałości
wiązań występujących w cząsteczkach węglowodorów nasyconych i nienasyconych.
4.
Scharakteryzować rozpuszczalność alkanów w wodzie; porównać gęstość ciekłych
alkanów z wodą; wytłumaczyć dlaczego niebezpieczne dla środowiska wodnego są awarie
tankowców.
5.
Porównać reakcję metanu (CH
4
) i benzenu (C
6
H
6
) z bromem; podkreślić i wyjaśnić
różnice.
Wyszukiwarka
Podobne podstrony:
dodatkowe1 analiza 11 12 2 sem Nieznany
1 MSL temat 2011 12 zaoczneid 1 Nieznany
dodatkowe8 analiza 2011 12 id 1 Nieznany
DTR S72 2 2007 02 12 dopisane w Nieznany
EKON Zast Mat Wyklad 11 12 id Nieznany
12 ABU2HTLMWLKN7M2BWYHLK6YEARZZ Nieznany
a09 fizyka statystyczna (12 21) Nieznany
materialy z weglowodorow weglow Nieznany
BIALKA I WEGLOWODANY cz Weglow Nieznany (2)
AiR 11 12 wyklad 09 02 12 2011 Nieznany (2)
12 rozdzial 12 PGQDKVM4BGI4BF32 Nieznany (2)
Historia?ministracji 8 12 201 Nieznany
12 rozdzial 12 V6II5BK2U765TSPK Nieznany
23 Wytwarzanie olefin i weglowo Nieznany (2)
13 Rozdzial 12 PHHJ6MRRUZXKRYO3 Nieznany
jednofunkcyjne pochodne weglowo Nieznany (2)
jednofunkcyjne pochodne weglowo Nieznany
Hurra I Lekcja 3 cw Str 12 id 2 Nieznany
Izomeria konstytucyjna weglowod Nieznany
więcej podobnych podstron