
STANY SKUPIENIA MATERII
Stan gazowy i ciekły
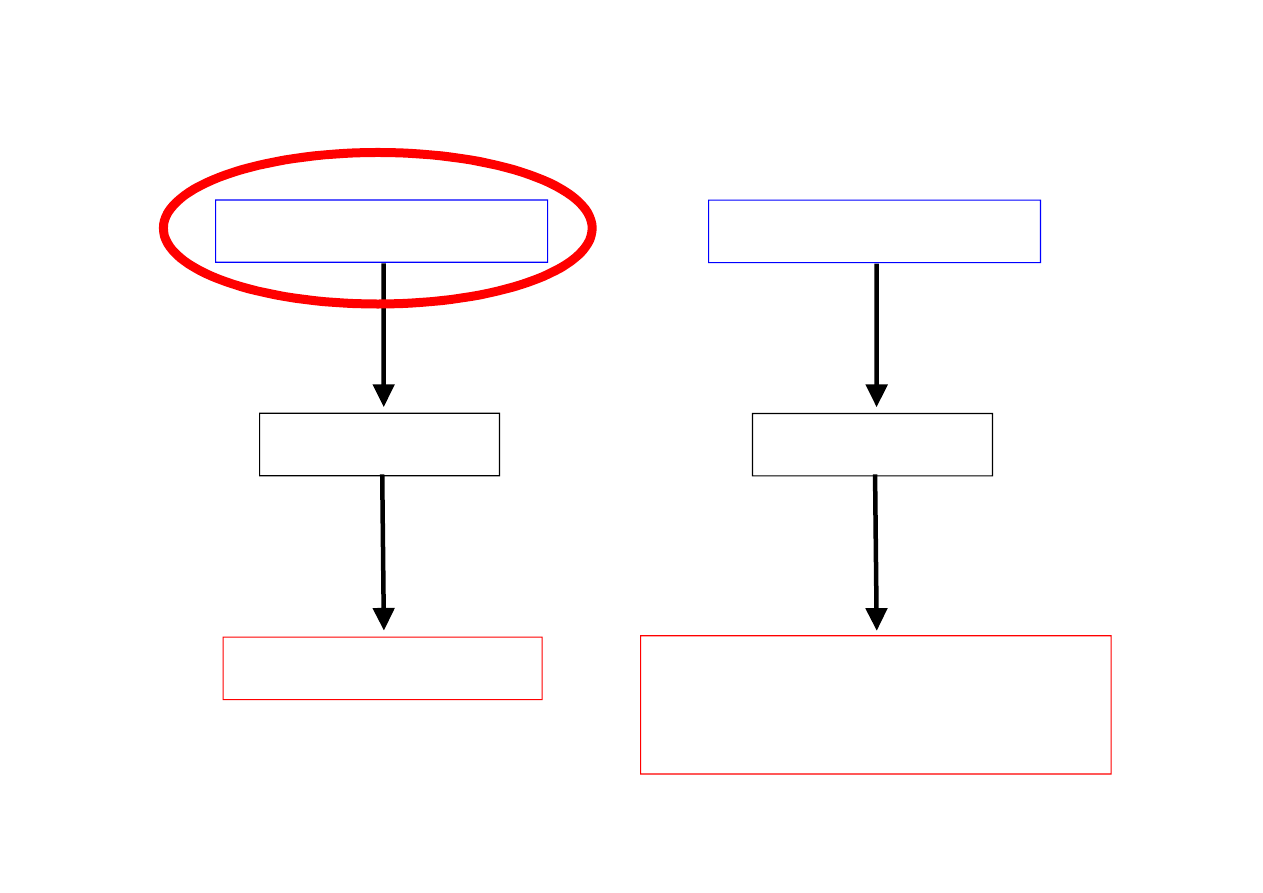
MATERIAŁ
Działanie
środowiska
Odpowiedź
materiału
WŁAŚCIWOŚĆ
ŚRODOWISKO
Co to jest właściwość materiału?
BETON
Działanie
środowiska
Rozpuszczanie
BRAK
KWASOODPORNOŚCI
KWAS
P.Łukowski, 2

P.Łukowski, 3
Ile znamy stanów skupienia materii?
-
kryształ
-
kryształ plastyczny
-
kryształ condis
-
ciało amorficzne
-
ciekły kryształ
-
ciecz izotropowa
-
faza nadciekła
-
ciecz nadkrytyczna
-
gaz
-
plazma
-
plazma neutronowa
-
plazma kwarkowa (stan hipotetyczny)
-
... ?
P.Łukowski, 4
W praktyce budowlanej występują trzy
tradycyjne stany skupienia:
- gazy,
- ciecze,
- ciała stałe.
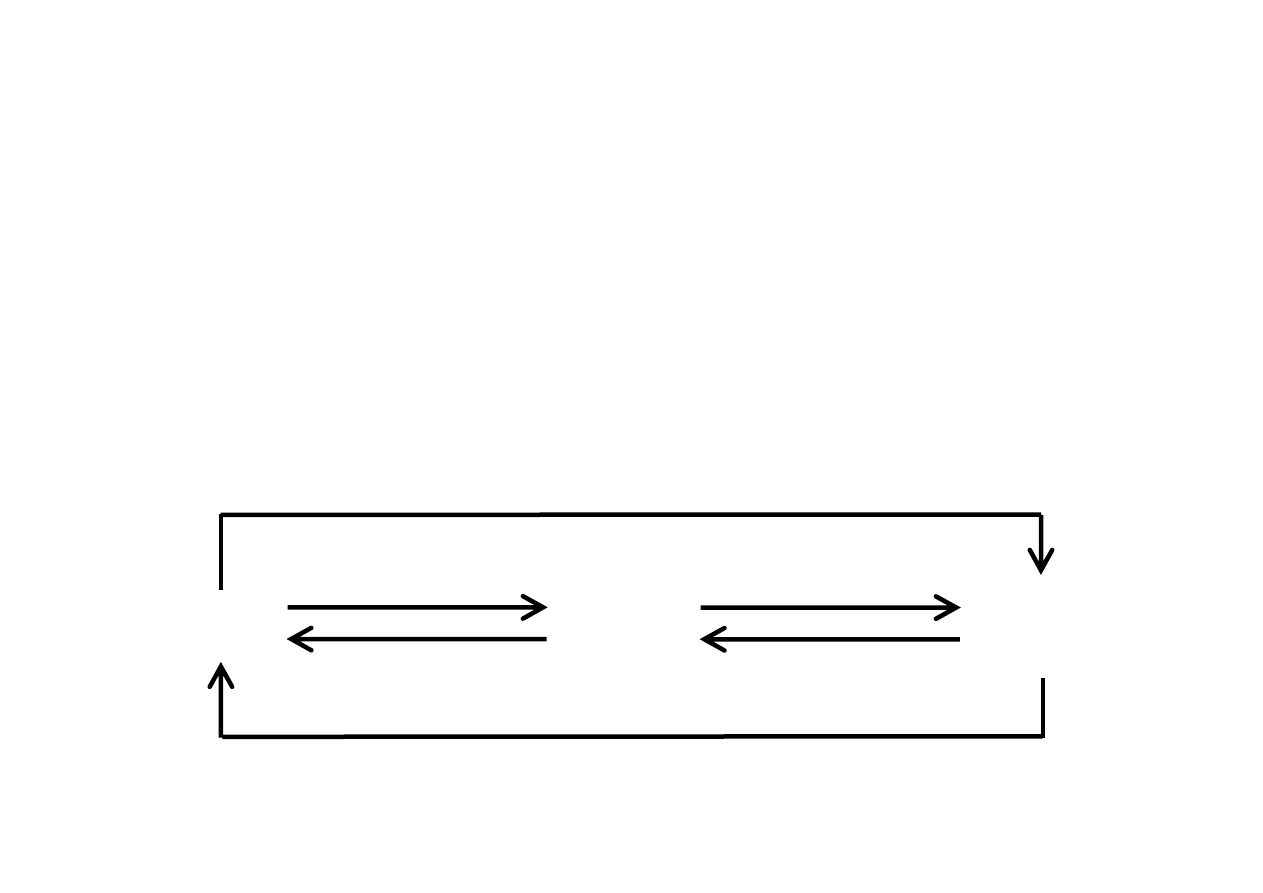
GAZ
CIECZ
skraplanie
parowanie
CIAŁO
STAŁE
krzepnięcie
topnienie
resublimacja
sublimacja

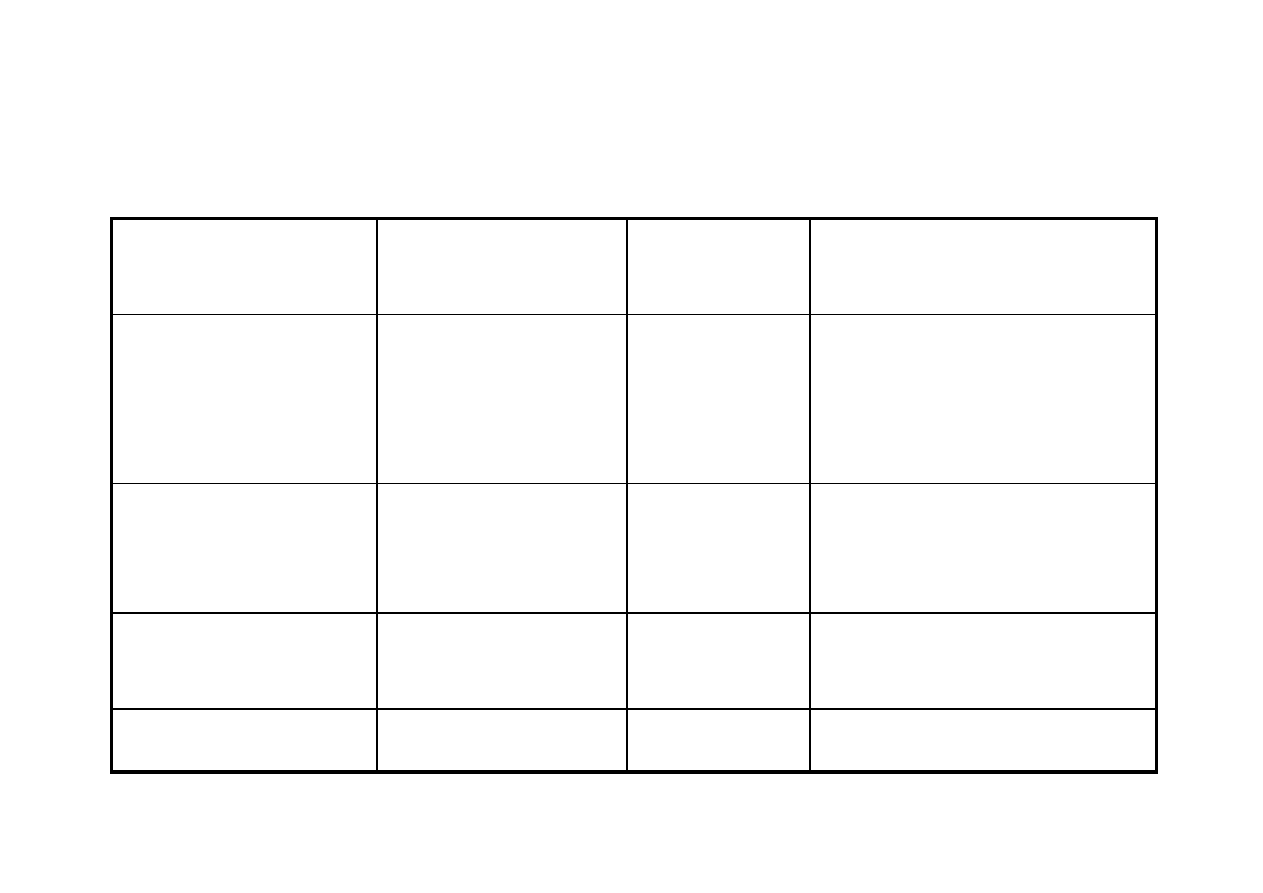
Charakterystyka stanów skupienia materii
Cecha
Gaz
Ciecz
Ciało stałe
Zmiana kształtu
+
+
-
Zmiana objętości
+
-
-
Uporządkowanie
struktury wewnętrznej
Brak
Częściowe,
lokalne,
chwilowe
Całkowite lub
prawie całkowite
Defekty struktury
wewnętrznej
Całkowite
zdeformowanie
Bardzo liczne
Nieliczne
Odległości między
cząsteczkami
Bardzo duże
Duże
Małe
Siła wiązań
międzycząsteczkowych
Bardzo mała
Średnia
Duża
Przestrzenne
ukierunkowanie
właściwości
Izotropowe
± Izotropowe
Anizotropowe
P.Łukowski, 5

P.Łukowski, 6
Stan gazowy
Gaz doskonały:
- cząsteczki to punkty materialne o zerowej objętości,
- całkowity brak oddziaływań międzycząsteczkowych,
- zderzenia cząsteczek są doskonale sprężyste.

Prawo Boyle’a-Mariotta:
pV = const (przemiana izotermiczna, T = const)
czyli p
↑⇔
V
↓
, p
↓⇔
V
↑
Prawa stanu gazowego
(dla gazu doskonałego)
Prawo Charlesa:
V/T = const (przemiana izobaryczna, p = const)
czyli V
↑⇔
T
↑
, V
↓⇔
T
↓
Prawo Amontona:
p/T = const (przemiana izochoryczna, V = const)
czyli p
↑⇔
T
↑
, p
↓⇔
T
↓
P.Łukowski, 7

Prawo Avogadra:
w warunkach normalnych (p = 0,1 MPa, T = 273 K)
1 mol (tj. 6,023⋅10
23
cząsteczek lub atomów) gazu
zajmuje objętość ok. 22,4 dm
3
Prawa stanu gazowego
(dla gazu doskonałego)
Równanie stanu gazowego:
pV = nRT
n – liczba moli gazu, R – stała gazowa
P.Łukowski, 8
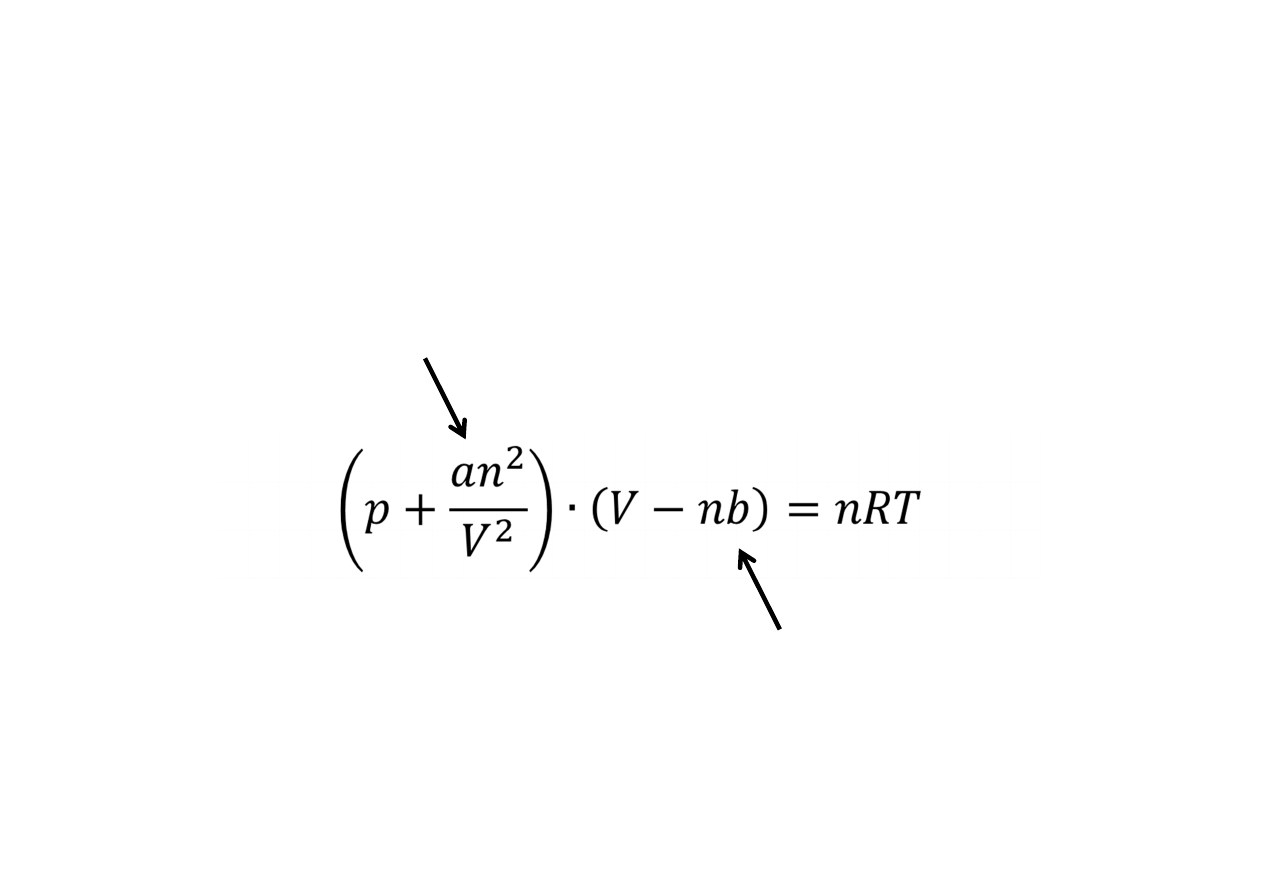
P.Łukowski, 9
Równanie stanu gazu rzeczywistego
(Van der Waalsa)
poprawka na ciśnienie
wewnętrzne (oddziaływania
międzycząsteczkowe)
poprawka na
objętość cząsteczek
P.Łukowski, 10
Siły spójności cieczy
Rodzaj cieczy
Wiązania I
rzędu
Wiązania
II rzędu
Przykład
Ciecze
niepolarne
(cząsteczki
niebiegunowe)
Atomowe
Van der
Waalsa
Benzyna
Ciecze polarne
(cząsteczki
dipolowe)
Atomowe
spolaryzowane
Van der
Waalsa,
wodorowe
Woda
Stopione sole
Jonowe
-
Stopione krzemiany
w piecu cementowym
Stopione metale Metaliczne
-
Surówka żelaza
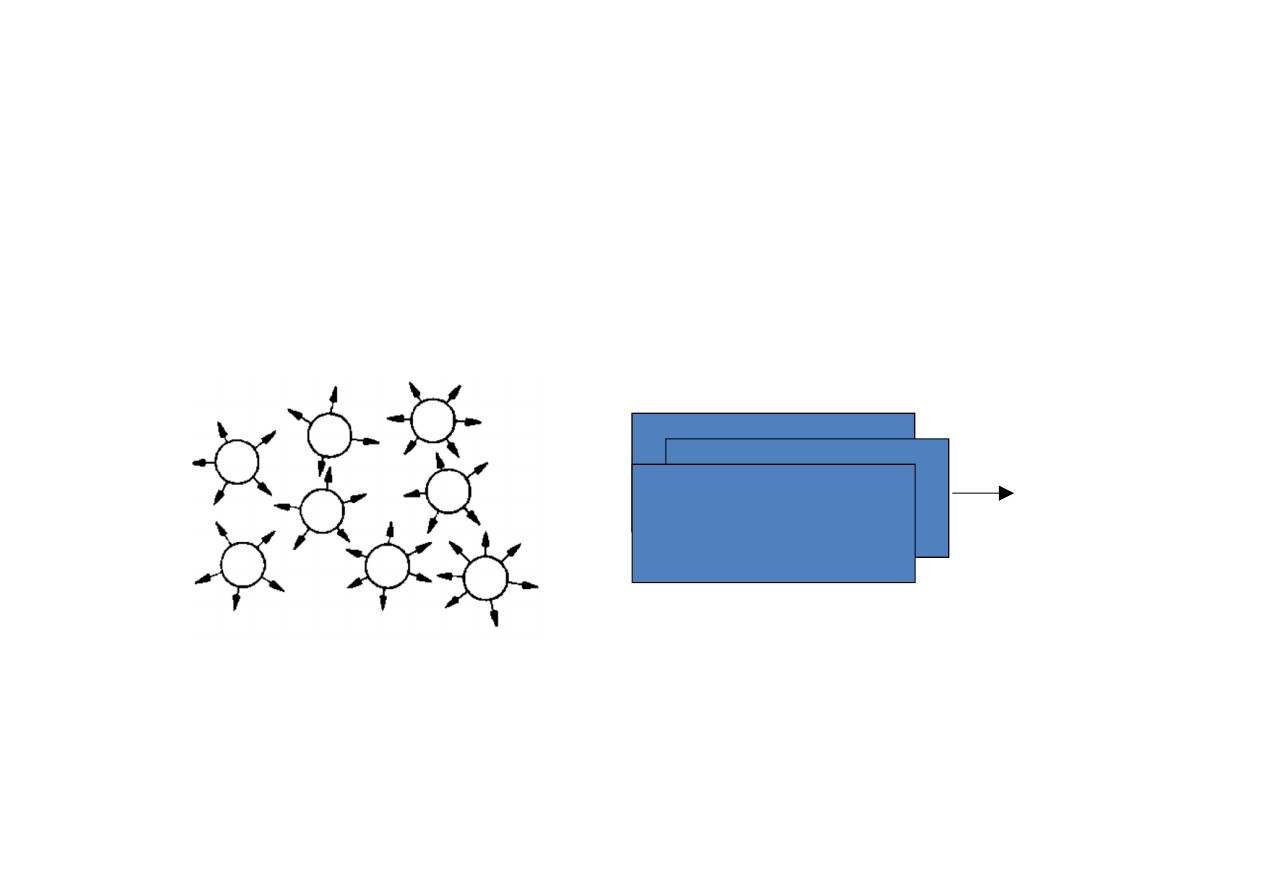
Stan ciekły
P.Łukowski, 11
Stan ciekły
Cząsteczki mogą tylko nieznacznie oddalać się od
siebie, ale mogą się przesuwać względem siebie.
Opór przesuwania warstewek cieczy ≡ lepkość, czyli
tarcie wewnętrzne.
Miarą lepkości jest siła niezbędna do poruszania
warstwy cieczy o powierzchni 1 m
2
z prędkością 1 m/s
w stosunku do drugiej warstwy, oddalonej o 1 m.
P.Łukowski, 12
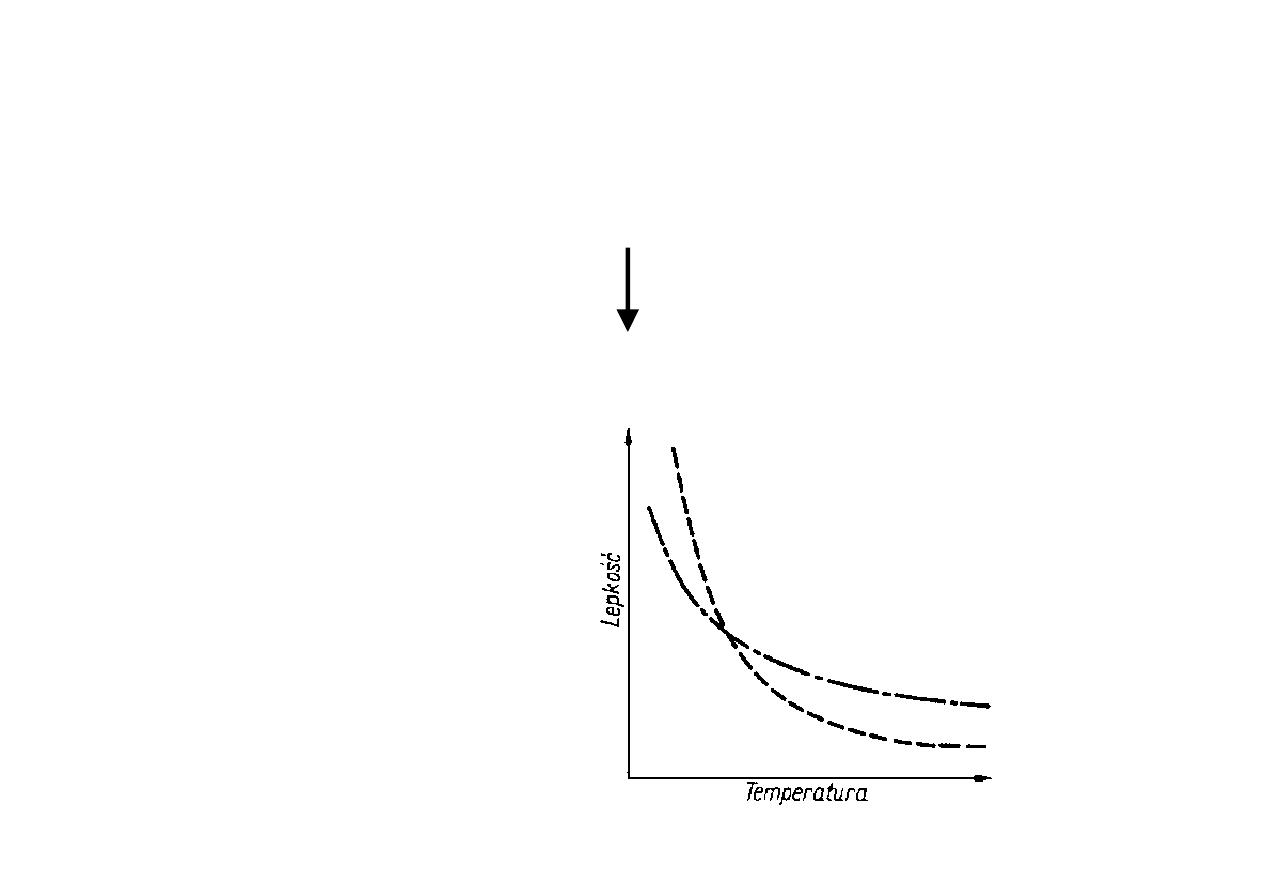
Lepkość a temperatura
Lepkość prawie wszystkich cieczy maleje ze
wzrostem temperatury.
Wzrost temperatury ⇒ wzrost energii kinetycznej
cząsteczek ⇒ wzrost odległości między cząsteczkami
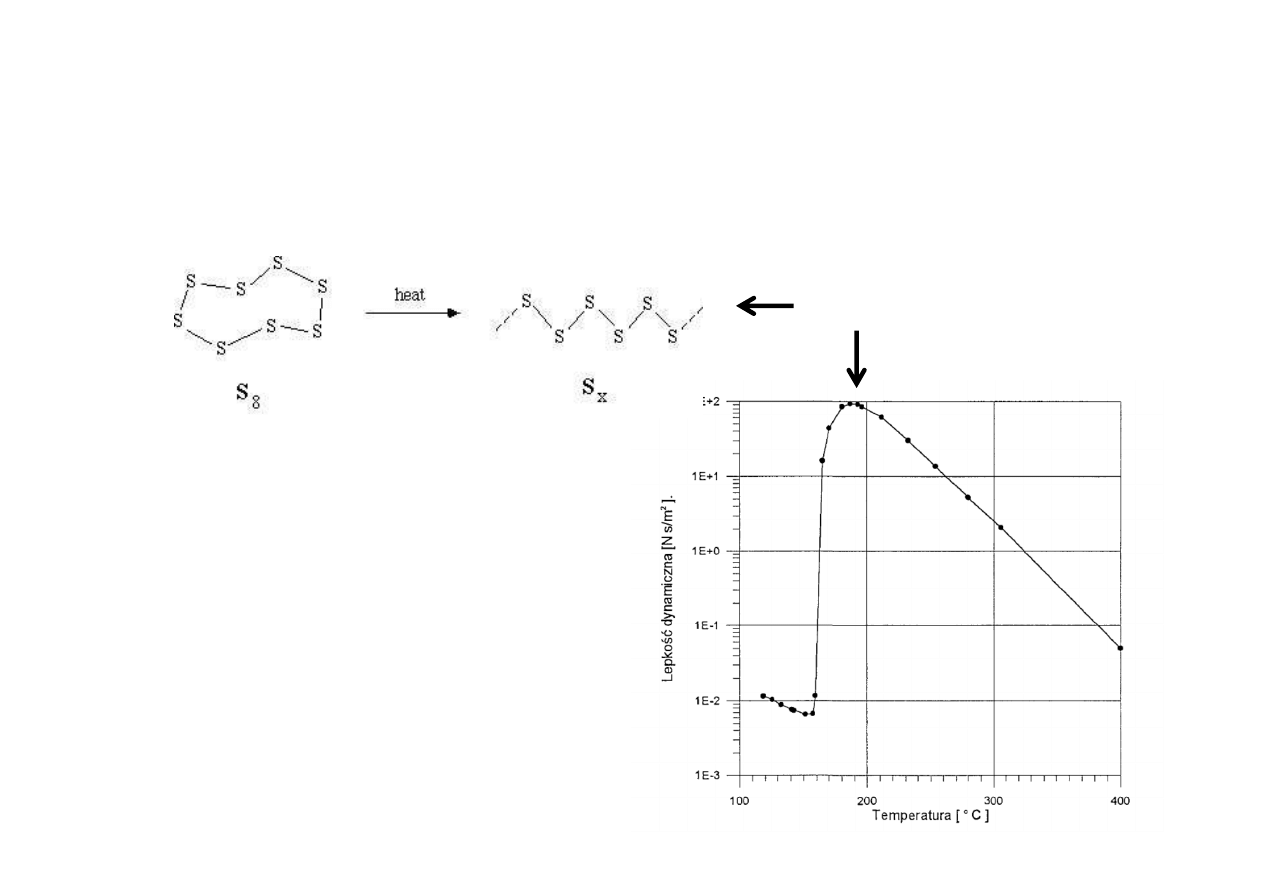
Wyjątek: ciecze ulegające pod wpływem temperatury
przemianom chemicznym, np. polimeryzacji.
Lepkość a temperatura
Siarka
P.Łukowski, 13

Napięcie powierzchniowe
Powierzchnia cieczy w kontakcie z inną fazą (stałą,
gazową lub ciekłą) zachowuje się jak sprężysta błona.
W ujęciu ilościowym:
Napięcie powierzchniowe = energia przypadająca na
jednostkę powierzchni ≡ praca potrzebna do
rozciągnięcia powierzchni o tę jednostkę.
P.Łukowski, 14
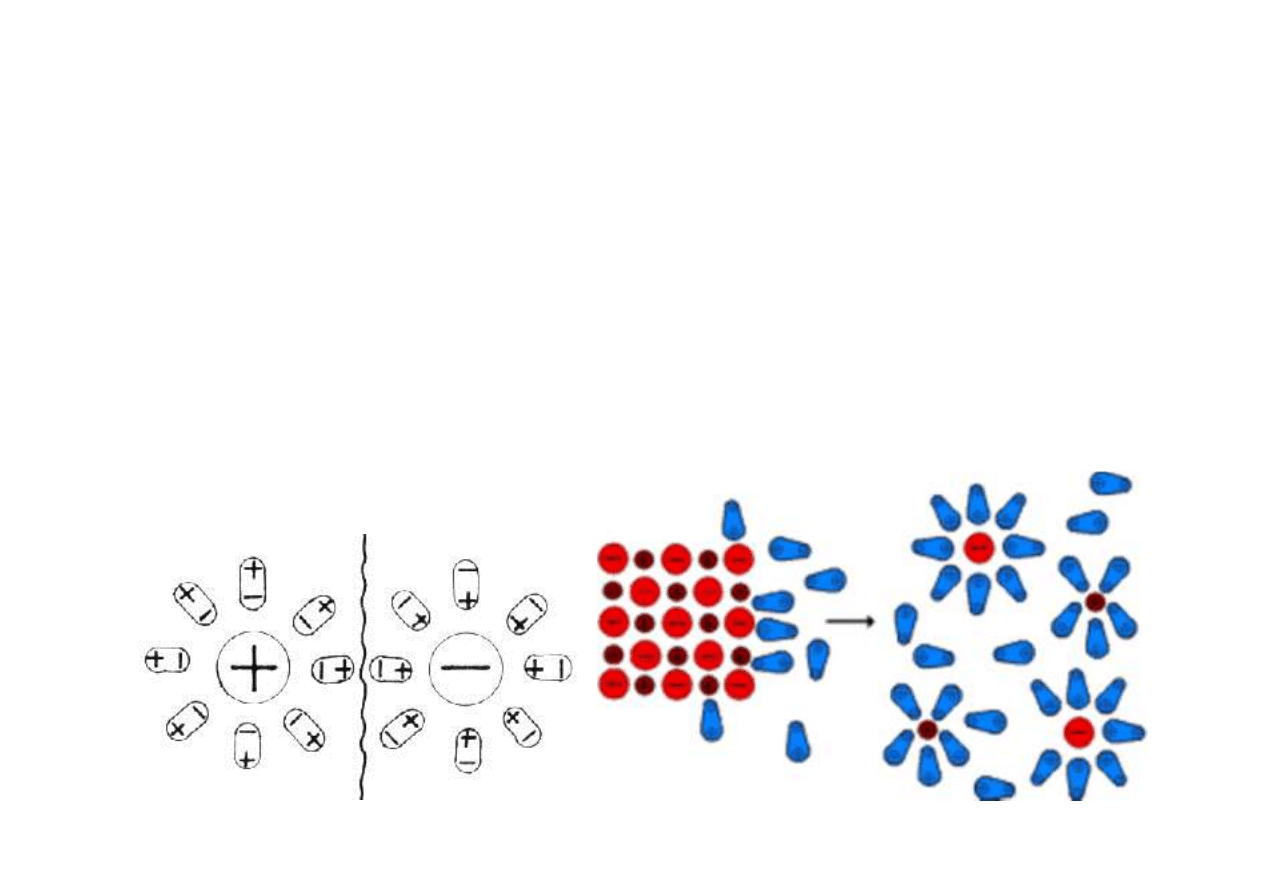
Roztwory i rozpuszczanie
P.Łukowski, 15
Roztwór ≡ układ jednofazowy, składający się z substancji
rozpuszczonej i rozpuszczalnika; rozproszenie substancji
rozpuszczonej jest na poziomie cząsteczkowym (< 1 nm).
Etapy rozpuszczania ciała stałego w cieczy:
- niszczenie sieci krystalicznej
- solwatacja (w przypadku wody – hydratacja)
- dyfuzja cząstek rozpuszczonych (cząsteczek, jonów) w
głąb fazy ciekłej
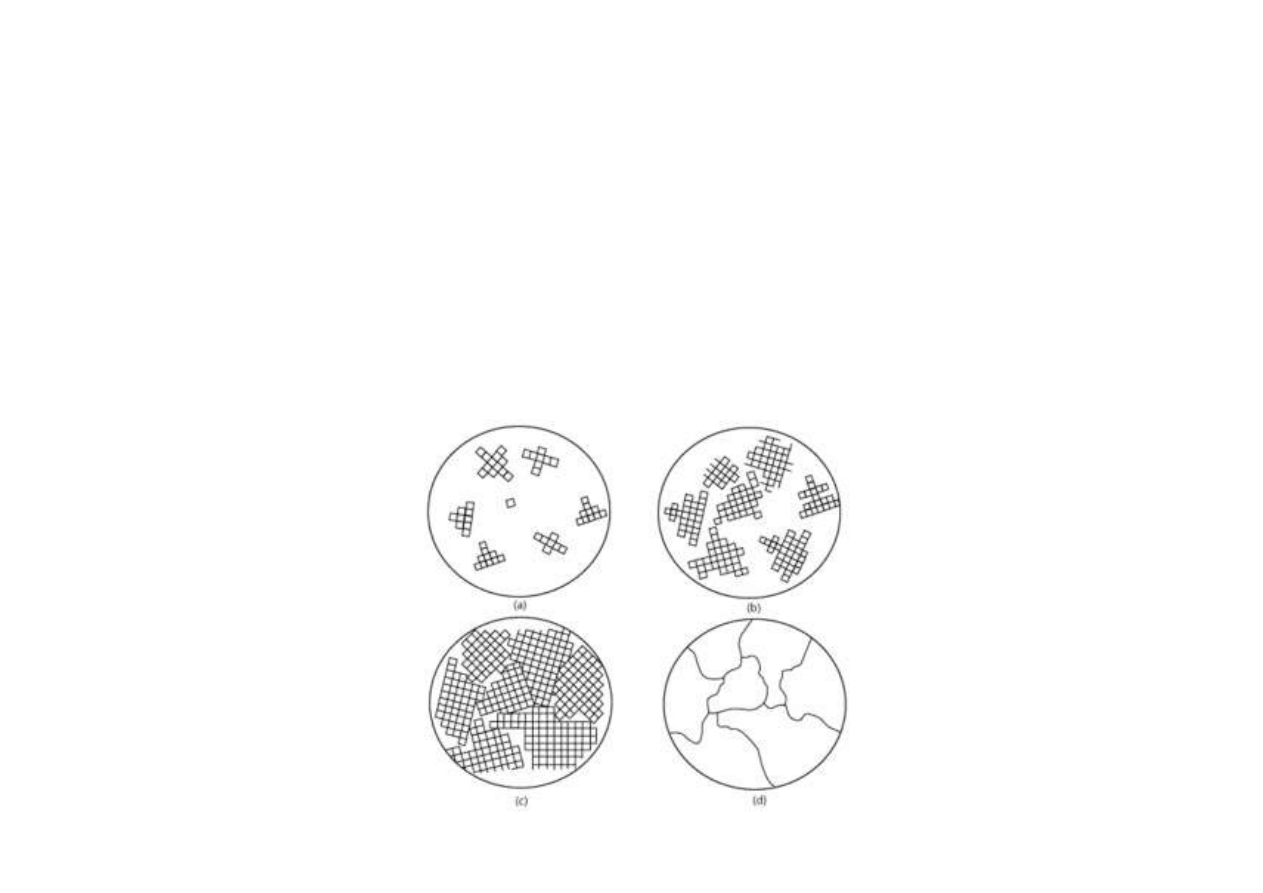
Krystalizacja
Krystalizacja to proces odwrotny do rozpuszczania.
Etapy krystalizacji:
- powstawanie zarodków krystalizacji
- wzrost kryształu
- dyfuzja cząstek substancji rozpuszczonej do fazy stałej,
a cząstek rozpuszczalnika w kierunku przeciwnym
P.Łukowski, 16
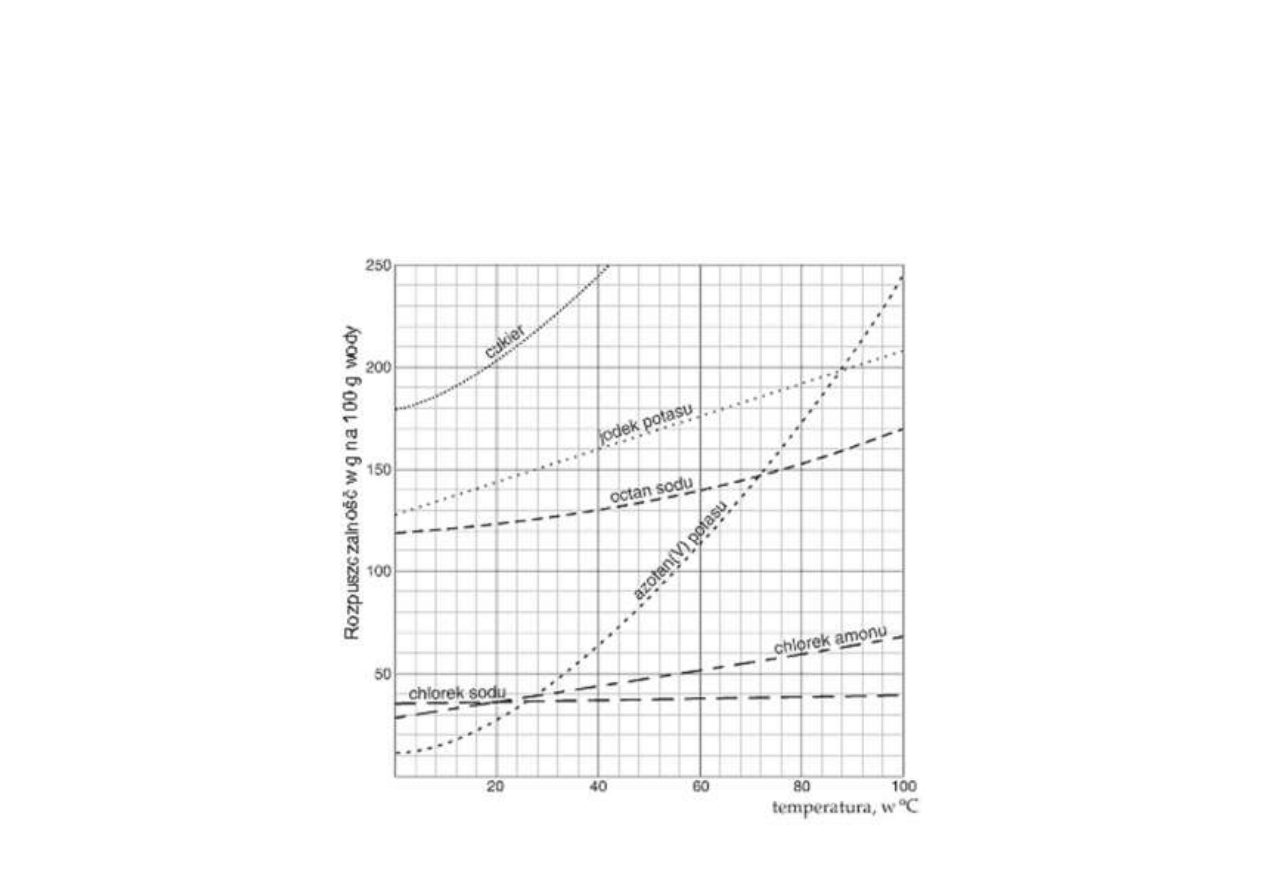
Rozpuszczalność ciał stałych w cieczach
Rozpuszczalność większości ciał stałych w cieczach
wzrasta
ze wzrostem temperatury.
P.Łukowski, 17

Rozpuszczalność ciał stałych w cieczach
Rozpuszczalność większości ciał stałych w cieczach
wzrasta
ze wzrostem temperatury.
Wyjątki ważne w budownictwie!
• Wapno gaszone Ca(OH)
2
• Gips półwodny CaSO
4
⋅½H
2
O i dwuwodny CaSO
4
⋅2H
2
O,
anhydryt CaSO
4
P.Łukowski, 18

Rozpuszczalność ciał stałych w cieczach
Roztwór nasycony ≡ roztwór będący w równowadze z
substancją rozpuszczaną (po dodaniu kolejnej porcji
substancji rozpuszczanej pozostanie ona nierozpuszczona).
Jeśli w trakcie rozpuszczania zachodzi
AB ⇔ A
+
+ B
-
to iloczyn rozpuszczalności L = c
A
+ ⋅ c
B
-
W roztworze nasyconym L = const (T = const)
Dodanie innej substancji o wspólnym jonie
AB ⇔ A
+
+ B
-
CB ⇔ C
+
+ B
-
spowoduje przekroczenie L i krystalizację substancji AB
(efekt wspólnego jonu).
P.Łukowski, 19
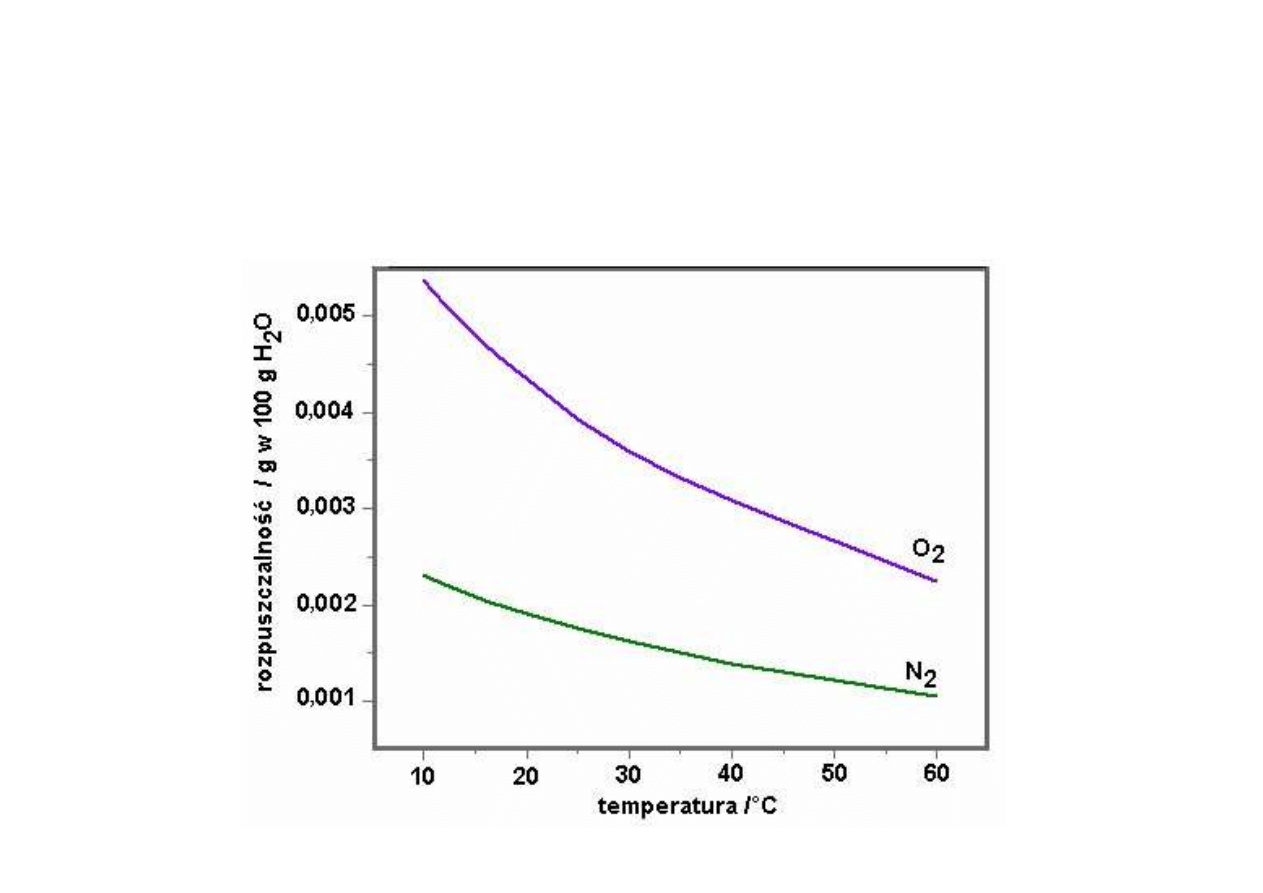
Rozpuszczalność gazów w cieczach
Rozpuszczalność wszystkich gazów w cieczach
maleje
ze wzrostem temperatury.
P.Łukowski, 20
Wyszukiwarka
Podobne podstrony:
1 Stany skupienia materii Zdefiniować pojęcie płynu
2 Stany skupienia materii 2009
Stany skupienia materii, CHEMIA, semestr 1, chemia ogólna
STANY SKUPIENIA MATERII konspekt
08 Stany skupienia materii
04 Klasyfikowanie materialow bu Nieznany
04 OTnS Materialy eksploatacyjn Nieznany (2)
04 ROZKLADY MATERIALOW wiedza o Nieznany
04 Dynamika punktu materialneg Nieznany (2)
04 ROZKLADY MATERIALOW wiedza o Nieznany
AUTOPREZENTACJA materialy szkol Nieznany
cwiczenia 7 25.04.2008, Prawoznawstwo, Materialy e-learning, mgr M. Zalewska
28 04 2013 cw id 31908 Nieznany
04 Egzamin Poprawkowy 2010 201 Nieznany (2)
09 Dobieranie materialow odziez Nieznany (2)
04 metoda dobrego startu zajec Nieznany
więcej podobnych podstron