
STANY SKUPIENIA
MATERII
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
GAZY
ciśnienie (p), objętość (V), temperatura (t [
o
C], T [K]), skład (np. stężenie)
ciśnienie:
N/m
2
= Pa (układ SI);
inne jedn.: mmHg; atm.
101325 Pa = 1013,25 hPa = 760 mmHg = 1 atm.
objętość:
m
3
(układ SI); inne jedn.: dm
3
temperatura:
T = t + 273,15
t =
5
/
9
· (t
F
- 32)
prawo Boyle'a (1662) i Mariotte'a (1672):
W przemianie izotermicznej iloczyn ciśnienia p i objętości V
określonej ilości gazu doskonałego jest wielkością stałą.
(p · V)
T
= const p
1
· V
1
= p
2
· V
2
prawo Charlesa (1787) i Gay-Lussaca (1802):
V
2
= V
1
· (1 +
α · ΔT)
dla p = const
p
2
= p
1
· (1 +
β · ΔT)
dla V = const
α
- współczynnik rozszerzalności temperaturowej gazu,
β
- współczynnik prężności gazów,
0,00366
273,15
1
T
1
β
α
o
=
=
=
=
2
1
2
1
2
1
2
1
T
T
p
p
i
T
T
V
V
=
=

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
prawo Daltona (1801): p = p
1
+ p
2
+ ... + p
n
równanie Clapeyrona:
dla 1 mola gazu:
równanie stanu gazu doskonałego:
const
T
V
p
=
⋅
2
2
2
1
1
1
T
V
p
T
V
p
⋅
=
⋅
lub
R
=
⋅
=
⋅
=
⋅
=
⋅
K
J/mol
8,31
K
273,15
/mol
m
0,022415
N/m
101325
T
V
p
T
V
p
3
2
o
o
o
dla n moli gazu:
p · V = n · R · T
uwzględniając prawa Daltona, Avogadra
i Clapeyrona można wykazać, że:
p
x
p
V
V
p
n
n
p
i
c
i
c
i
i
⋅
=
⋅
=
⋅
=
prawo Grahama (1829):
x
i
- ułamek molowy
1
2
d
d
=
2
1
ν
ν
dyfuzja
− samorzutne rozprzestrzenianie się cząstek substancji
przez daną fazę (stałą, ciekłą lub gazową)
v
1
i v
2
− szybkość dyfuzji gazów 1 i 2
d
1
i d
2
− ich gęstość w danych warunkach
temperatury i ciśnienia
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
gęstość gazu:
gęstość względem wodoru:
gęstość względna gazu D
wz
:
gęstość względem powietrza:
średnia energia kinetyczna cząsteczki gazu:
k - stała Boltzmana,
o
V
M
d
lub
V
m
d
=
=
wz
x
wz
x
wz
x
wz
M
M
M
n
M
n
m
m
D
=
⋅
⋅
=
=
2
M
D
x
H
2
=
29
M
D
x
pow.
=
J/K
10
·
1,38
N
R
k
23
-
A
=
=
T
k
2
3
E
k
⋅
⋅
=
CO
2
O
2
N
2
Gaz
412
482
515
prędkość (m/s)
681
CH
4
1363
He
1921
H
2
prędkość (m/s)
Gaz
Średnie prędkości cząsteczek popularnych
gazów w temperaturze 25
o
C
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
CIECZE
1/ właściwości cieczy
• są praktycznie nieściśliwe,
• brak określonego kształtu (kształt naczynia),
• dyfundują powoli,
• parują z otwartych zbiorników;
2/ gęstość cieczy - zależy od temperatury, gdyż zmiany
temperatury powodują zmiany
objętości cieczy;
3/ ciśnienie pary nasyconej - ciśnienie wywierane przez parę znajdu-
(prężność pary nasyconej)
jacą się w stanie równowagi z cieczą;
V
m
d
=
4/ temperatura wrzenia - temperatura, w której prężność pary cieczy
jest równa ciśnieniu zewnętrznemu;
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
dT
T
R
ΔH
p
dp
2
⋅
=
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
−
⋅
−
=
1
2
1
2
T
1
T
1
R
2,303
ΔH
p
p
log
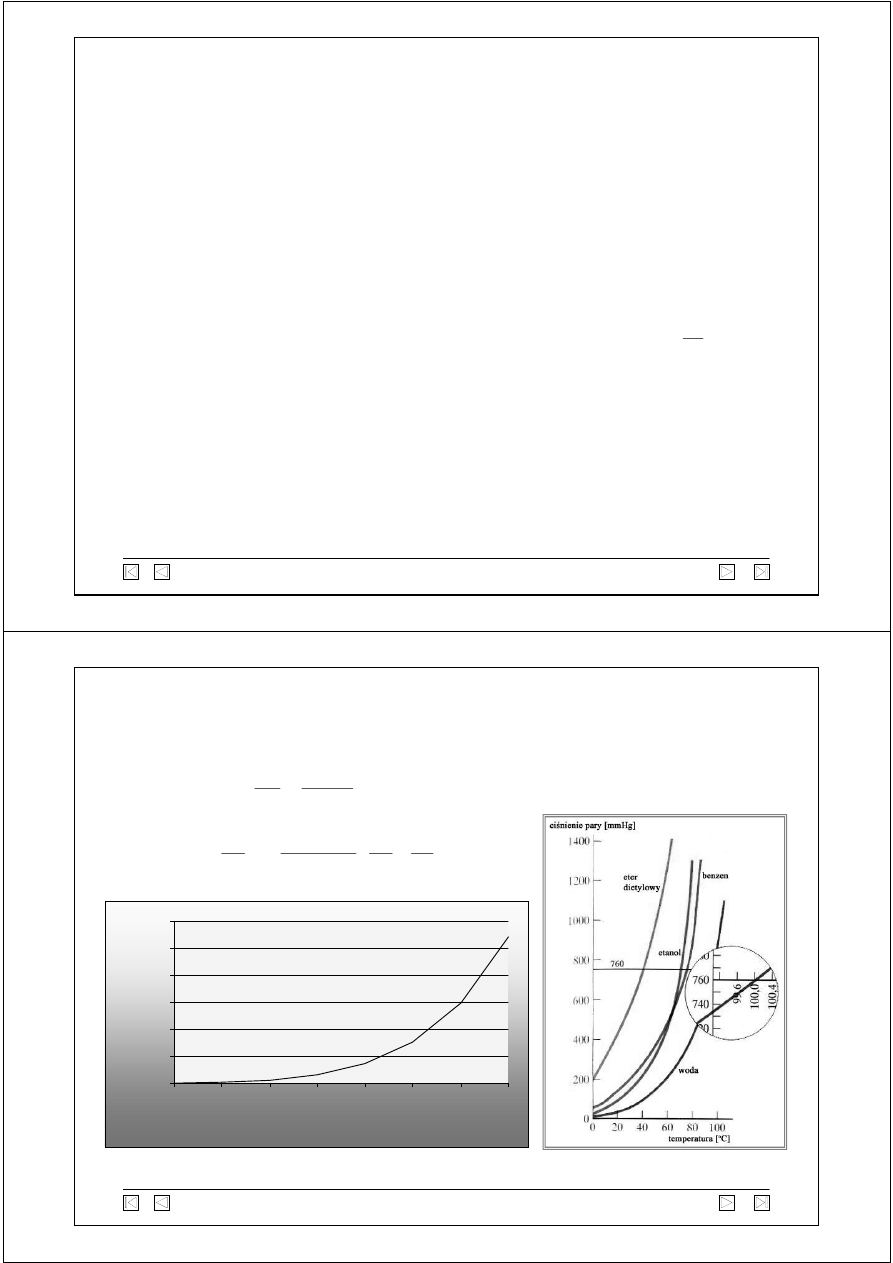
Zależność temperatury wrzenia wody od ciśnienia
zmianę prężności pary nasyconej nad cieczą od temperatury
ujmuje równanie Clausiusa-Clapeyrona:
55,32
17,55
4,58
148,1
355,1
760
1489
2711
0
500
1000
1500
2000
2500
3000
0
20
40
60
80
100
120
140
Temperatura (
o
C)
Ci
śn
ie
n
ie
(
mmH
g
)
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
5/ napięcie powierzchniowe - naturalna skłonność powierzchni cieczy
do kurczenia się, spowodowana siłami
wciągającymi cząsteczki powierzchniowe
do wnętrza fazy;
Napięcie powierzchniowe (
γ)
wybranych cieczy
473,5
Rtęć
71,98
Woda
62,5
Gliceryna
28,2
Benzen
26,2
CCl
4
22,0
Etanol
γ · 10
−3
[J/m
2
]
Ciecz
Napięcie powierzchniowe cieczy jest to praca potrzebna
do zmiany powierzchni cieczy o 1 m
2
.
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
siły kapilarne - siły powodujące wznoszenie się cieczy
w wąskich rurkach (tzw. kapilarach);
siły adhezji - siły wiążące substancję z powierzchnią;
siły kohezji - siły wiążące ze sobą cząsteczki substancji
z utworzeniem zwartego materiału;
menisk cieczy - zakrzywiona powierzchnia utworzona
przez ciecz w wąskiej rurce;
Gdy siły adhezji między cieczą a szkłem
są większe od sił kohezji w cieczy, ciecz
tworzy menisk wklęsły (woda).
Gdy siły kohezji są większe od sił
adhezji, menisk jest wypukły (rtęć)
woda
rtęć
Jaki menisk tworzy woda
w rurce z tworzywa sztucznego ?

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
6/ lepkość - właściwość cieczy charakteryzująca jej opór
wobec płynięcia; „tarcie wewnętrzne”;
przepływ płynu: laminarny - warstwy przesuwają się równolegle
względem siebie;
burzliwy - cząsteczki mieszają się podczas ruchu;
Lepkość (
η) wybranych cieczy
0,55
Toluen
1,08
Etanol
0,90
CCl
4
1,52
Rtęć
0,89
Woda
0,30
Aceton
945
η · 10
−3
[Pa · s]
Gliceryna
Ciecz
Lepkość zwykle maleje ze wzrostem temperatury.
Im większa jest lepkość cieczy, tym wolniejszy jest jej przepływ.
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
7/ wiązanie wodorowe - oddziaływanie między kowalencyjnie związanym
atomem wodoru i należącym najczęściej do innej
cząstki atomem silnie elektroujemnym, dysponu-
jącym wolną parą elektronową;
ta forma wiązania występuje pomiędzy cząsteczkami tego samego
rodzaju (wiązanie wodorowe międzycząsteczkowe) lub wewnątrz
tej samej cząsteczki (wiązanie wodorowe wewnątrzcząsteczkowe)
X ... H – Y
atomy X i Y to najczęściej: N, O, F, Cl
energia wiązania:
siły van der Waalsa
2 – 30 kJ/mol
(oddziaływania międzycząsteczkowe, np. dipol-dipol)
wiązanie wodorowe
10 – 40 kJ/mol
wiązanie atomowe i jonowe
powyżej 100 kJ/mol
długość mostka wodorowego:
X ... H – Y
2,5 – 3,2 Å
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
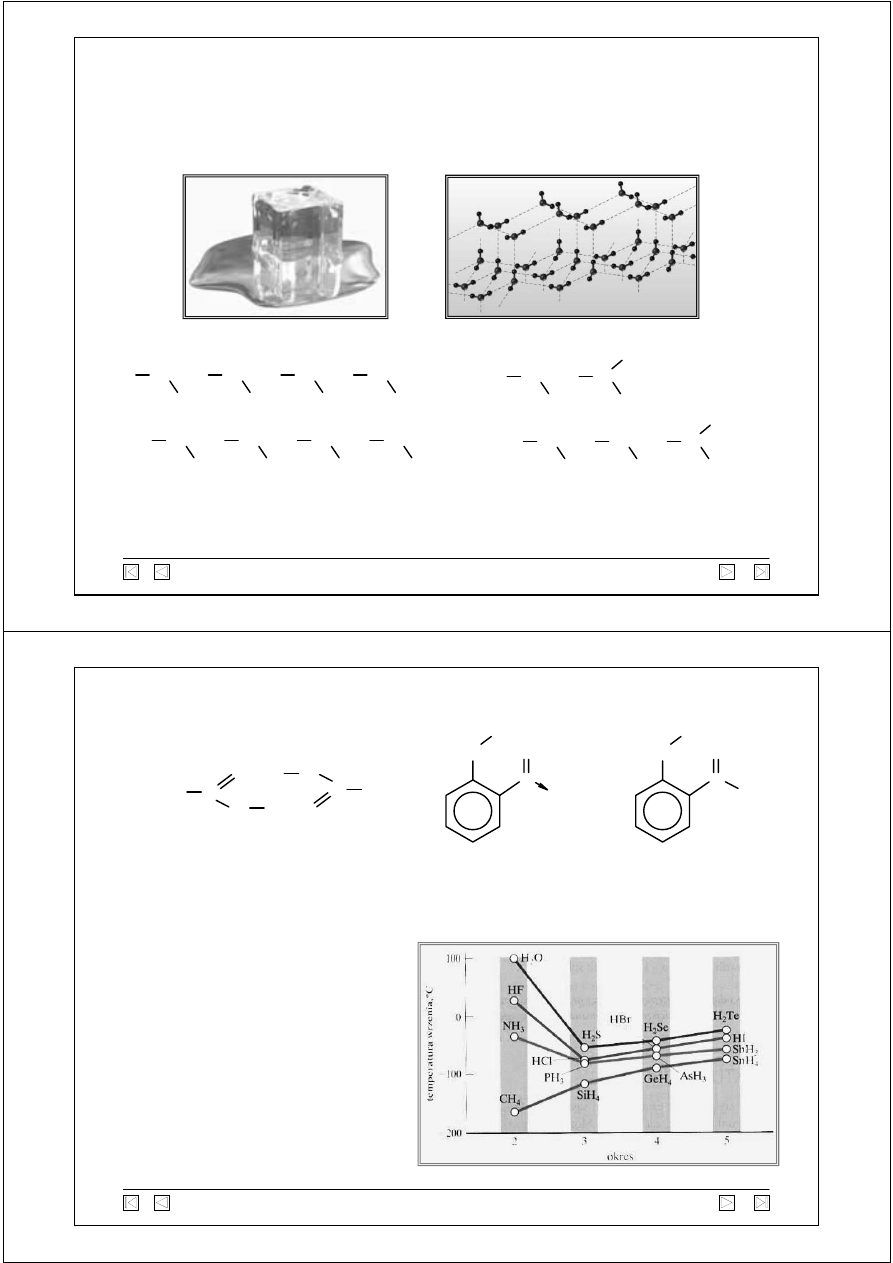
występowanie (m.in.): woda (trzy stany skupienia), NH
3
, HF,
alkohole, aminy, amidy, kwasy nieorganiczne
i organiczne, biopolimery
H
H O . .
.
. .
.
O
H
H
H
H O . .
.
. .
.
O
H
H
...
...
...
...
.
..
.
..
.
..
.
..
H
H O . .
.
. .
.
O
H
H
H
H O . .
.
. .
.
O
H
H
woda
Struktura lodu
Lód
metyloamina w wodzie
H
H O . .
.
N
H
H
...
...
.
..
.
..
.
..
H
H N
H
H O . .
.
. .
.
O
H
H
CH
3
CH
3
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
O
H
N
O
O
. ..
..
.
O
H
O
C
OH
o-nitrofenol
kwas
o-hydroksybenzoesowy
wpływ wiązania wodorowego
na właściwości fizyczne:
• wzrost temperatury wrzenia
i topnienia
• wzrost lepkości
• wzrost momentu dipolowego
cząsteczki
• wzrost entalpii
i entropii parowania
• wzrost przenikalności
elektrycznej
. .
.
CH
3
C
O
O
H
H O
O
C
CH
3
. .
.
kwas octowy (dimer)
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
CIAŁA STAŁE
1/ właściwości ciał stałych
• zajmują charakterystyczną objętość
• są praktycznie nieściśliwe
• wykazują łupliwość
• posiadają niski współczynnik rozszerzalności cieplej
2/ ciała bezpostaciowe i krystaliczne
ciała bezpostaciowe - wykazują właściwości stanu stałego,
ale nie mają uporządkowanej
sieci krystalicznej, np. szkło
ciała krystaliczne - atomy ułożone są w sposób regularny,
tworząc tzw. sieć przestrzenną;
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
3/ alotropia i polimorfizm
alotropia - występowanie pierwiastka chemicznego
w różnych postaciach krystalicznych, np.:
C grafit, diament
S rombowa i jednoskośna
i fulereny
P biały i czerwony
polimorfizm - występowanie substancji chemicznej
w różnych postaciach krystalicznych, np.:
CaCO
3
aragonit i kalcyt
ZnS
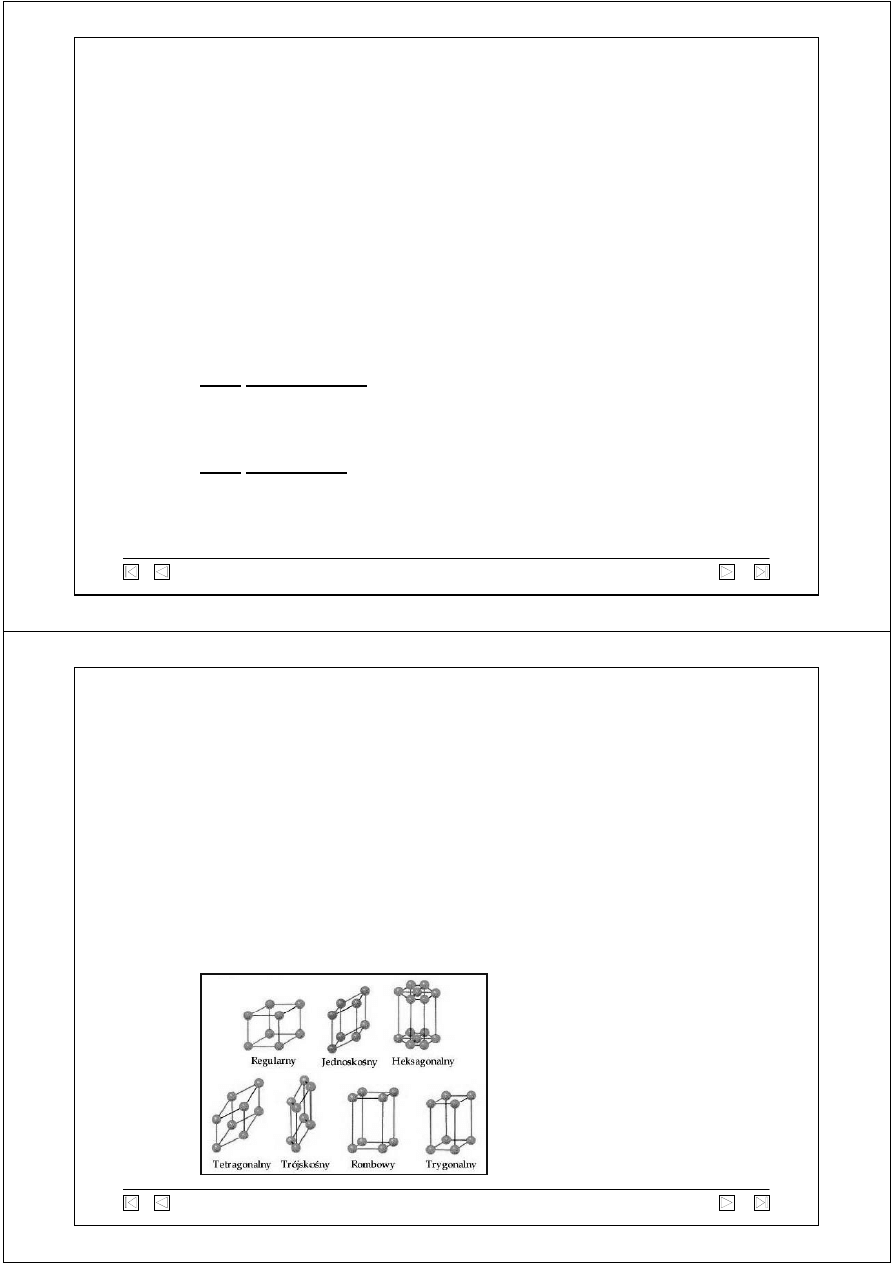
blenda cynkowa i wurcyt
Siedem podstawowych
układów krystalograficznych
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
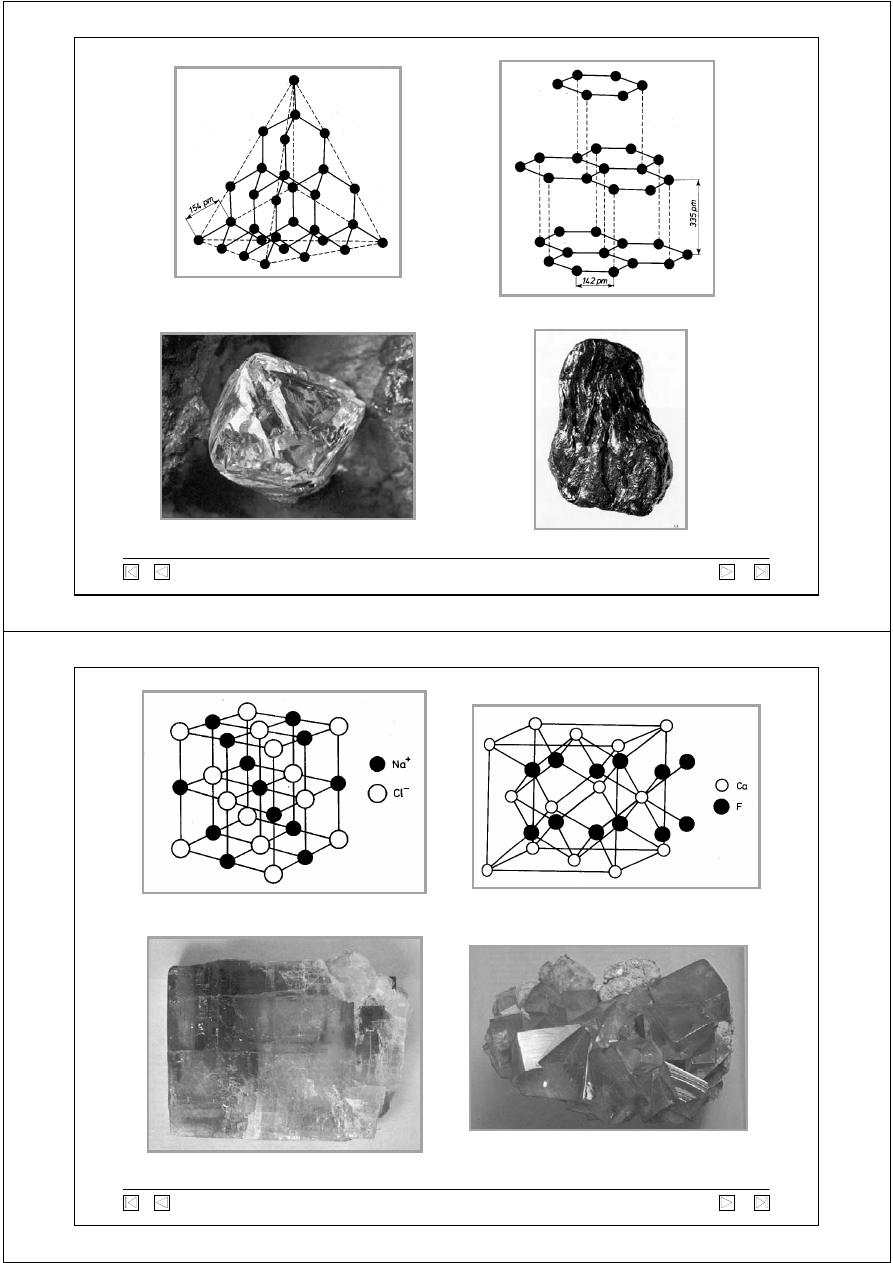
Sieć przestrzenna diamentu
Diament
Grafit
Sieć przestrzenna grafitu
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Sieć przestrzenna NaCl
Sól kamienna (NaCl)
Fluoryt (CaF
2
)
Sieć przestrzenna CaF
2
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
WODA KRYSTALIZACYJNA
1/ woda koordynacyjna
2/ woda anionowa
3/ woda sieciowa
4/ woda konstytucyjna
[Al(H
2
O)
6
]
3+
[Cu(H
2
O)
4
]
2+
BaCl
2
· 2H
2
O
Ca(OH)
2
→ CaO + H
2
O
KH
2
PO
4
→ KPO
3
+ H
2
O
Cu
H
2
O
H
2
O
O
H
H
H
H
O
H
H
O
. ..
..
.
. .
.
. .
.
O
O
O
O
S
Wyszukiwarka
Podobne podstrony:
1 Stany skupienia materii Zdefiniować pojęcie płynu
04 Stany skupienia materii gazy Nieznany (2)
2 Stany skupienia materii 2009
Stany skupienia materii, CHEMIA, semestr 1, chemia ogólna
STANY SKUPIENIA MATERII konspekt
08 Stany nieustalone w obwodach RLCid 7512 ppt
materiałożnawstwo 9 - 08.05.2007, Materiałoznawstwo - wykłady
Trzy stany skupienia wody
44 Trzy stany skupienia substancji
W1B Stany fizyczne materii
2007-11-08 Reprywatyzacja odblokowana, materiały, Z PRASY
stany skupienia wody, przyroda, scenariusz. lekcji kl.4
trzy stany skupienia i ich wlasciwosci, ściagi za free
STATYSTYKA-wykład z 08-04-2000, Materiały z zajęć, statystyka
więcej podobnych podstron