Tlenki
- tlenki niemetali - tlenki metali
CO2, CO, NO2, SO2, Na2O, CaO, FeO, ZnO
-reagują z wodą
Tlenki metali (z I i II gr) |
Tlenki niemetali |
Na2O |
CO2 |
K2O |
SO2 |
MgO |
SO3 |
CaO |
NO2 |
BaO |
P2O5 |
SrO |
|
Odczyn zasadowy Tlenki zasadowe |
Odczyn kwaśni Tlenki kwasowe |
-nie reagują z wodą
Tlenki obojętne
-FeO Fe2O3 Al2O3 ZnO CuO
-CO N2O (nie reagują z kwasami i zasadami)
Tlenki amfoteryczne (w tlenkach obojętnych) - reagują i z kwasem i z zasadą, np.: ZnO, CuO, Al2O3
BaO: 2Ba+O2→2BaO
Ba(OH)2
BaO + H2O
BaCO3
BaO+CO2
SIVO2 : S+O2
SO2
H2SO3
SO2 +H2O
BaSO3
SO2 +BaO
Wodorotlenki
-rozpuszczalne w wodzie -tworzą zasady
NaOH KOH Ba(OH)2 Sr(OH)2
-nierozpuszczalne w wodzie (otrzymywane z reakcji soli z tlenkami metali z I lub II gr)
FeII(OH)2 Fe(OH)3 Mg(OH)2 Cu(OH)2
Zn(OH)2 AlIII(OH)3
Ca(OH)2
Ca + 2H2O → Ca(OH)2 +H2O↑
CaO + H2O → Ca(OH)2
(przykład reakcji w przypadku pierwiastków z I i II grupy)
Mg + 2H2O → ↓Mg(OH)2 + H2O
Cu(OH)2
Cu + H+O →X Cu nie reaguje z wodą!
CuO + H+O →X CuO nie reaguje z wodą!
CuIISVIO4 + 2NaOH →↓Cu(OH)2 + Na2SO4
Al(OH)3
Al(NO3)3 +NaOH(rozcieńczony) →↓Al(OH)3 + 3NaNO3
Cu(OH)2
Ca(OH)2 (zasada)
! każda zasada jest wodorotlenkiem, ale nie każdy wodorotlenek jest zasadą !
Zasadami nie są:
Fe(OH)2 Fe(OH)3 Mn(OH)2
Kwasy
-kwasy beztlenowe:
HCl H2S HBr HI HCN
-kwasy tlenowe
HNVO3 kwas azotowy (V)
HNIIIO2 kwas azotowy (III)
H2SO3 kwas siarkowy (IV)
H2SO4 kwas siarkowy (VI)
H2CO3 kwas węglowy
H3PO4 kwas ortofosforowy
HPO3 kwas metafosforowy
H4P2O7 kwas pirofosforowy
-kwasy beztlenowe powstają z bezpośredniej syntezy pierwiastków
H2 + Cl → 2HCl
S + H2 → H2S
ZnS+ 2HCl →H2S + ZnCl2
2NaCl + H2SO4 → 2HCl +NaSO4
-kwasy tlenowe
CO2 + H2O → H2CO3
P2O5+H2O →
SIVO2 + H2O →H2SO3
SVIO3 + H2O →H2SO4
N2O5 + H2O → 2HNO3
Bezwodniki kwasów
P2O5 + H2O → 2HPO3
P2O5 + 2H2O → H4P2O7
P2O5 + 3H2O → 2H3PO4
NO2 nie jest bezwodnikiem - 2NO2 + H2O → HNO3 + HNO2
HNO3 → N2O5 - bezwodnik kwasu
HNO2 → N2O3 - bezwodnik kwasu
N2O3 + H2O → 2HNO2
-K2SO4 + HCl→ X
+ K2CO3 + HCl → 2KCl + H2O + CO2
+ K2S + HCl → 2KCl +H2S
![]()
![]()
H2CO3 12% najbardziej lotny
![]()
H2S 24%
![]()
HCl 36%
![]()
HNO3 63%
H2SO4 96% najmniej lotny
! Reakcja pomiędzy solą, a kwasem zachodzi, gdy na sól kwasu bardziej lotnego działamy kwasem mniej lotnym.
Sole
BaCl2 ZnSO4 H2(SO4)3 CaS
Ba + HCl → BaCl2 + H2↑ na metal działamy kwasem
ZnO + H2SO4 → ZnSO4 + H2O na tlenek działamy kwasem
2 Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H20 wodorotlenek + kwas
CaCl2 + H2SO4 → CaSO4 + 2HCl sól + kwas
Na2SO4 + BaCl2 → 2NaCl + BaSO4 sól + kwas
BaO + CO2 → BaCO3 tlenek metalu + tlenek niemetalu
-CuCl2 + NaSO4 → X
-Zn(NO3)2 + KCl → X
+FeIISO4 + NaCO3 → ↓FeCO3 + NaSO4
+2Na3PO4 + 3Ba(NO3)2 →↓Ba3(PO4)2 + 6NaNO3
! Reakcja pomiędzy solami zachodzi, gdy przynajmniej jeden z produktów reakcji jest trudno rozpuszczalny lub łatwo lotny.
- rozpuszczalne w wodzie:
KNO3 Cu(NO3)2 Fe(NO4)3
! Wszystkie azotany są rozpuszczalne w wodzie.
HNO3 N
HCl C
H2SO4 S
H3PO4 P
H2CO3 C
K Na N
K2CO3 Na3PO4 (NH4)3PO4
-nierozpuszczalne w wodzie:
AgCl CuCl PbCl2
-trudno rozpuszczalne w wodzie:
CaSO4 Ag2SO4
-prawie nierozpuszczalne w wodzie:
BaSO4 SrSO4 PbSO4
![]()
CaCO3 - sól obojętna
Ca, Fe, Cu, Mg
Ca(HCO3)2 - sól kwaśna
Mg3(PO4)2 - nierozpuszczalne w wodzie
Mg(H2PO4)2 - rozpuszczalne w wodzie (od H3PO4)
MgSO4 - rozpuszczalne w wodzie
MgCO3 - nierozpuszczalne w wodzie
Mg(HCO3)2 - rozpuszczalne w wodzie
Reakcja podstawiania
H3PO4 H3SO4 HNO3
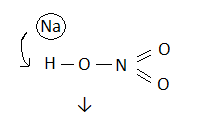
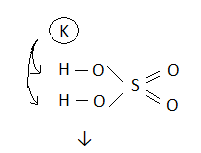
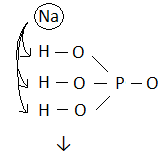
NaH2PO4 KHSO4 NaNO3
NaHPO4
Itd.
jedna sól obojętna,
dwie kwasowe
! kwasy jednowodorowe nie dają soli
Ca(OH)2 + H2CO3 →↓CaCO3 + 2H2O
(CaCO3 - nierozpuszcza się w wodzie)
Ca(OH)2 + H2CO3 → Ca(HCO3)2 + 2H2O
(Ca(HCO3)2 - rozpuszcza się w wodzie)
Ca(OH)3 + H3PO4 → CaHPO4
Ca(H2PO4)2
Ca3(PO4)2
-hydroksosole
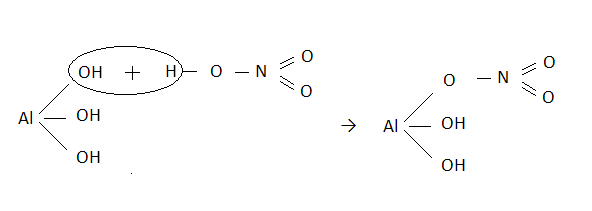
Al(OH)3 + HNO3 → Al(OH)2NO3 + H2O
AlOH(NO3)2 - azotan (V) hydroksoglinu
AlIII (NVO3)3 - azotan (V) dihydroksoglinu HNO3 kw. azotowy(V)
Al(NIIIO2)3 - azotan (III) dihydroksoglinu HNIIIO2 kw. azotowy (III)
a)(FeOH)SO4 - od Fe(OH)3 - siarczan (VI) żelaza (III)
b) (CuOH)2CO3 - węglan hydroksomiedzi (II)
c) [Fe(OH)2]SO4 - siarczan (VI) dihydroksożelaza (II)
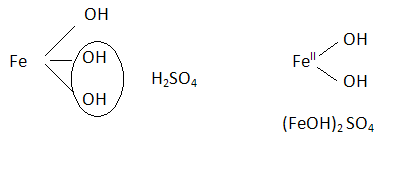
ad.a)
Wyszukiwarka
Podobne podstrony:
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia Wykład 6
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
Chemia Wyklad 4 id 111675
chemia wykłady (6)
Chemia Wykład 9
ściąga chemia wykład, Studia, Sem 1,2 +nowe, ALL, szkoła, Chemia
chemia wykład
(CHEMIA WYKŁAD 7)
chemia wyklady wskrzynka(1), BUDOWNICTWO PŁ, Semestr I, chemia wykład
10.dysocjacja wykład, AGH różne, chemia wykłady
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
chemia wykład 2
3 chemiaogolna wyklad 061009
chemia wykłady (2)
pytania testowe i chemia budowlana -zestaw1, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
więcej podobnych podstron