Nr 8 |
Temat: Prawo podziału Nernsta |
Data wykonania 1998-06-13 |
Rok II Grupa III
|
1.Król Katarzyna 2.Widlarz Łukasz |
Ocena |
Cel ćwiczenia:
Celem ćwiczenia jest wyznaczenie współczynnika podziału kwasu octowego w układzie dwu nie mieszających się cieczy: wody i benzenu.
Wykonanie ćwiczenia:
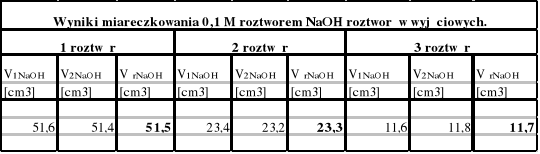
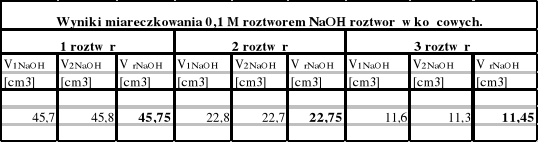
Korzystając z wyjściowego 1M roztworu kwasu octowego sporządzamy po 100 cm3 roztworów o stężeniach: 1 M;0,5 M i 0,25 M. Następnie miareczkujemy wszystkie roztwory po 5 cm3 dwukrotnie 0,1 M roztworem NaOH wobec fenoloftaleiny. Po 25 cm3 każdego roztworu wlewamy do rozdzielaczy dodając 25 cm3 benzenu. Po wymieszaniu spuszczamy warstwę wodną i miareczkujemy dwukrotnie po 5 cm3 roztworem NaOH, 0,1 M.
Opracowanie wyników pomiarów:
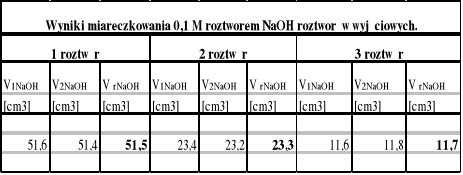
1.Wyniki pomiarów:
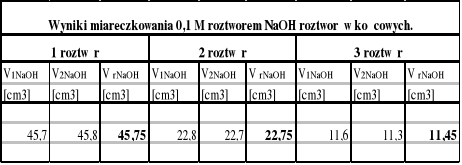
2.Na podstawie wyników miareczkowania obliczamy stężenia badanych roztworów kwasu octowego.
Korzystamy ze wzoru:
![]()
;
gdzie:
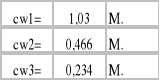
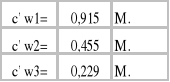
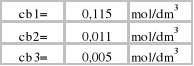
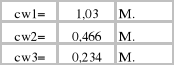
cw - stężenie badanego roztworu [mol/dm3]
VNaOH - objętość 0,1 M NaOH zużytego w miareczkowaniu [cm3]
CNaOH -stężenie roztworu miereczkującego [mol/dm3]
Vroztworu - objętość badanego roztworu [cm3]
a) Stężenia roztworów początkowych:
b) Stężenie kwasu octowego w fazie wodnej:
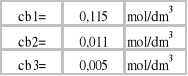
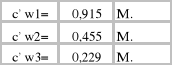
3.Obliczamy stężenie kwasu octowego w benzenie:
![]()
;
4.Obliczamy współczynnik podziału Nernsta (L).
![]()
;
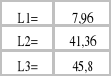
Jak widzimy z powyższych wyników współczynnik podziału zmienia się ze zmianą stężenie roztworów kwasu octowego. Jest to wynikiem zmiany stopnia dysocjacji kwasu octowego ze zmianą stężenia, jak i niecałkowitą asocjacją kwasu octowego w benzenie oraz niewielką dysocjacją kwasu octowego w wodzie.
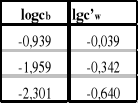
5.Zakładając prawie całkowitą asocjację kwasu octowego w benzenie oraz zaniedbując dysocjacją kwasu octowego w wodzie, wyznaczamy liczbę drobin n tworzących jedną cząsteczkę zasocjowaną i współczynnik podziału L' korzystając ze wzoru:
![]()
;
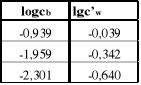
dlatego przeprowadzamy komputerowe obliczenie prostej regresji:
![]()
;
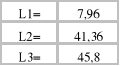
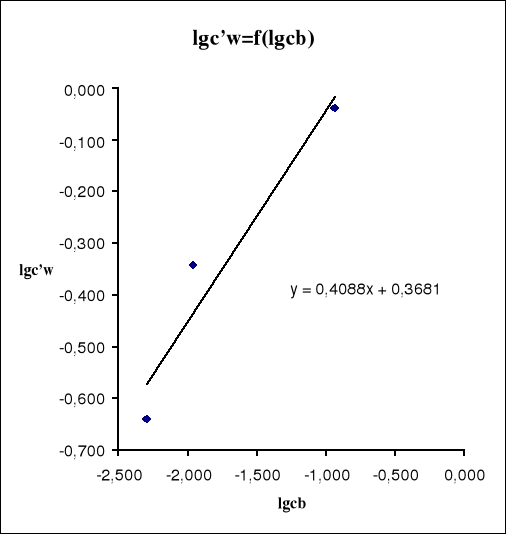
Współczynniki a i b prostej regresji są następujące:
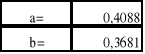
Wartości n i L' obliczamy mając dane a i b:
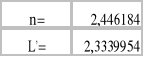
![]()
; ![]()
;a więc
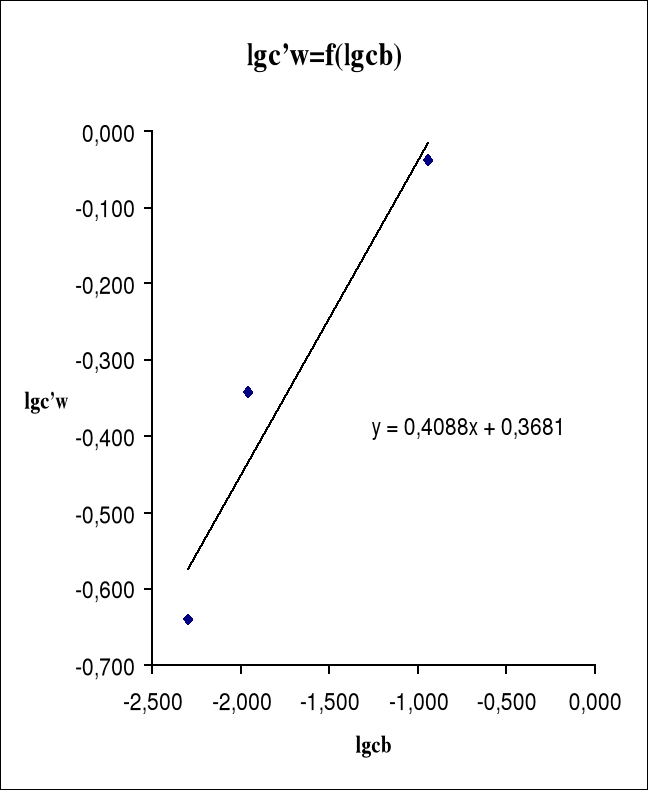
6.Sporządzamy wykres zależności lgc'w=f(lgcb).
7.Wnioski:
Na podstawie sporządzonych obliczeń i wykonanych pomiarów możemy stwierdzić że ze zmianą stężenia roztworu zmienia się współczynnik podziału Nernsta (↑stężenia powoduje ↑L).Wyznaczone wartości n i L' są następujące: n=2,446 i L'=2,334.Te wartości mogą być jednak obarczone błędem wynikającym z niedokładnego odczytu objętości roztworu miareczkującego (NaOH), lub niedokładnego odmierzania odpowiednich objętości składników.
2
1
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Prawo podziału Nernsta spraowzdanie
prawo podzialu nernsta
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta
Prawo podziału Nernsta wykres
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta2
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta1
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta
PRAWO 3
wykład 1 Czym jest prawo
od Elwiry, prawo gospodarcze 03
prawo gospodarcze wspólny znak towarowy
w14 redox, Nernst
Prawo karne 1
więcej podobnych podstron