Cel ćwiczenia:
Wykorzystanie pomiaru przewodnictwa do oznaczenia zawartości kwasu w próbce.
Przebieg doświadczenia:
Do zlewki odmierzyłam pipetą 5ml roztworu HCl i dodałam wody destylowanej. Po wymieszaniu odczytałam początkową wartość przewodnictwa roztworu. Później miareczkowałam go dodając roztwór NaOH porcjami po 0,5ml. Po dodaniu każdej porcji mieszałam roztwór i mierzyłam jego przewodnictwo. Po przepłukaniu zlewki powtórzyłam czynności dla 5ml roztworu CH3COOH, następnie roztworu 5ml HCl razem z 5ml CH3COOH. Wszystkie wyniki zanotowałam w tabeli.
Tabela pomiarowa:
HCl |
|
CH3COOH |
HCl+CH3COOH |
||
VNaOH (ml) |
Γ1, mS |
VNaOH (ml) |
Γ2, mS |
VNaOH (ml) |
Γ3, mS |
0 |
12,21 |
0 |
0,431 |
0 |
13,86 |
0,5 |
10,56 |
0,5 |
0,616 |
0,5 |
12,22 |
1 |
9,41 |
1 |
0,975 |
1 |
10,44 |
1,5 |
7,79 |
1,5 |
1,348 |
1,5 |
8,72 |
2 |
6,69 |
2 |
1,704 |
2 |
7,35 |
2,5 |
5,23 |
2,5 |
2,01 |
2,5 |
5,70 |
3 |
3,94 |
3 |
2,34 |
3 |
4,53 |
3,5 |
3,42 |
3,5 |
2,69 |
3,5 |
3,92 |
4 |
4,20 |
4 |
2,81 |
4 |
4,13 |
4,5 |
5,09 |
4,5 |
2,99 |
4,5 |
4,32 |
5 |
5,83 |
5 |
3,22 |
5 |
4,64 |
5,5 |
6,50 |
5,5 |
3,78 |
5,5 |
4,82 |
6 |
7,16 |
6 |
4,46 |
6 |
4,97 |
6,5 |
7,98 |
6,5 |
4,93 |
6,5 |
5,27 |
7 |
8,74 |
|
|
7 |
5,47 |
7,5 |
9,21 |
|
|
7,5 |
5,64 |
8 |
9,81 |
|
|
8 |
5,94 |
8,5 |
10,71 |
|
|
8,5 |
6,58 |
9 |
10,97 |
|
|
9 |
7,16 |
9,5 |
11,45 |
|
|
9,5 |
7,97 |
10 |
12,09 |
|
|
10 |
8,64 |
10,5 |
12,56 |
|
|
10,5 |
9,17 |
|
|
|
|
11 |
9,73 |
|
|
|
|
11,5 |
10,08 |
|
|
|
|
12 |
10,77 |
|
|
|
|
12,5 |
11,16 |
|
|
|
|
13 |
11,69 |
|
|
|
|
13,5 |
12,14 |
|
|
|
|
14 |
12,59 |
|
|
|
|
14,5 |
13,11 |
|
|
|
|
15 |
13,52 |
|
|
|
|
15,5 |
13,91 |
|
|
|
|
16 |
14,31 |
|
|
|
|
16,5 |
14,93 |
|
|
|
|
17 |
15,16 |
|
|
|
|
17,5 |
15,48 |
|
|
|
|
18 |
15,92 |
|
|
|
|
18,5 |
16,24 |
|
|
|
|
19 |
16,58 |
|
|
|
|
19,5 |
16,73 |
|
|
|
|
20 |
17,13 |
|
|
|
|
20,5 |
17,36 |
|
|
|
|
21 |
17,83 |
|
|
|
|
21,5 |
18,07 |
|
|
|
|
22 |
18,31 |
|
|
|
|
22,5 |
18,58 |
|
|
|
|
23 |
18,87 |
|
|
|
|
23,5 |
19,11 |
|
|
|
|
24 |
19,33 |
|
|
|
|
24,5 |
19,84 |
Wykresy i obliczenia:
Mocny kwas (HCl)
Odczytany punkt zobojętnienia (punkt przegięcia wykresu) : V = 3,4 ml = 0,0034 dm3
Ilość moli zużytego kwasu HCl
(jako że reakcja przebiega według schematu HCl + NaOH → NaCl + H2O przyjmuję, że liczba moli zużytego kwasu jest równa liczbie moli zużytej zasady)
![]()
→ ![]()
n = 0,2
* 0,0034 dm3 = 0,00068 mola
Stężenie kwasu - Cm V = 5 ml = 0,005 dm3
Cm = ![]()
= ![]()
Słaby kwas (CH3COOH)
odczytany punkt zobojętnienia: V= 4,9 ml= 0,0049 dm3
Ilość moli zużytego kwasu CH
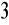
COOH - n
(jako że reakcja przebiega według schematu CH3COOH + NaOH → CH3COONa + H2O przyjmuję, że liczba moli zużytego kwasu jest równa liczbie moli zużytej zasady)
![]()
→ ![]()
n = 0,2
* 0,0049 dm3 = 0,00098 mola
Stężenie kwasu - Cm V = 5 ml = 0,005 dm3
Cm = ![]()
= ![]()
Mieszanina kwasów (HCl + CH3COOH)
odczytane punkty zobojętnienia: V![]()
= 3,4 ml = 0,0034 dm3
V![]()
= 7,8 ml
V2-V1= 7,8 ml -3,4 ml =4,4 ml = 0,0044 dm3
Ilość moli zużytych kwasów
nHCl = 0,2
* 0,0034 dm3 = 0,00068 mola
nCH3COOH = 0,2
* 0,0044 dm3 = 0,00088 mola
Stężenie kwasu - Cm V

= 5ml , V
= 5ml
HCl:
Cm = ![]()
= ![]()
CH
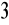
COOH:
Cm = ![]()
= ![]()
Wnioski:
Dzięki wykresom zależności przewodnictwa elektrycznego od objętości danej zasady mogłam określić stężenie miareczkowanych kwasów. W tym celu należało odczytać punkty równoważnikowe ze sporządzonych wykresów. Serie danych na moich wykresach przypominają te zamieszczone w instrukcji, więc mogę zaryzykować stwierdzenie, iż ćwiczenie zostało wykonane poprawnie.
Analiza wykresów ukazuje następujące spostrzeżenia:
Na wykresie miareczkowania mocnego kwasu przewodnictwo początkowo spada, natomiast po przekroczeniu PR (VNaOH=3,4ml) rośnie.
Na wykresie miareczkowania słabego kwasu początkowo następuje lekki wzrost przewodnictwa, który później, mijając PR (VNaOH=4,9ml) wzrasta w nieco większym stopniu.
Na wykresie miareczkowania mieszaniny kwasów początkowo przewodnictwo spada, po przekroczeniu PRI (VNaOH =3,4ml) powoli wrasta, natomiast mijając drugi PR (VNaOH=7,8ml) przewodnictwo wzrasta z większą szybkością.
Dzięki wyznaczonym PR z wykresu obliczyłam liczbę moli oraz stężenia kwasów.
Wyliczone stężenie molowe HCl zarówno w przypadku miareczkowania mocnego kwasu mocną zasadą, jak i miareczkowania mieszaniny kwasów mocną zasadą wyniosło 0,136
.
Identyczne wyniki obu przypadków obliczeń pozwalają mi przypuszczać, iż oznaczenie stężenia kwasu solnego jest miarodajne i zgodne z rzeczywistością.
Stężenie molowe CH3COOH miareczkowanego oddzielnie wyniosło 0,196
a w mieszaninie 0,176
. W tym przypadku obliczone stężenia nieznacznie się od siebie różnią, w granicy okolicy około 10%. Ta niewielka niezgodność może być spowodowana nieco niedokładnymi w czasie odczytami wartości przewodnictwa z wyświetlacza lub dodawaniem NaOH w porcjach, które niekoniecznie musiały wynosić idealnie 0,5 ml. Za przyczynę tej sytuacji można uznać błąd ludzki polegający na niedokładnym odczycie ilości wkroplonej substancji ze skali biurety.
PR
PR
PRI
PRII
Wyszukiwarka
Podobne podstrony:
ch fizyczna 13, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fi
Zagadnienia teoretyczne 41, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr
Część teoretyczna do kolokwium C, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, se
wykresy15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
moje ChF 54, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyc
Wykres zaleznosci temperatury kalorymetru od czasu, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywi
sprawko15, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizyczn
22 wstęp teoretyczny 2015, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4
Moje Ćw 24, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizycz
chemia zywnos, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia Żyw
ChZywnosci - sciaga, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chem
chem zyw sciagi 2003, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Che
9.RÓWNOWAGI FAZOWE W UKŁADACH TRÓJSKŁADNIKOWYCH, Politechnika Łódzka, Technologia Żywności i Żywieni
11.RÓWNOWAGI CHEMICZNE, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV,
0.WSTĘP, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV, Chemia fizyczna
7.RÓWNOWAGI FAZOWE W UKŁACH JEDNOSKŁADNIKOWYCH, Politechnika Łódzka, Technologia Żywności i Żywienie
więcej podobnych podstron