Temat: Badanie kinetyki katalitycznego rozkładu H2O2. |
Materiał teoretyczny: podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, rząd reakcji, stała szybkości), czynniki wpływające na szybkość reakcji chemicznych, katalizator. Manganometryczne oznaczanie nadtlenku wodoru.
WPROWADZENIE
Kinetyka chemiczna zajmuje się szybkością reakcji chemicznych, czynnikami, od których zależy szybkość reakcji (np. temperatura, ciśnienie, katalizator) i mechanizmem reakcji (rozłożeniem reakcji chemicznej na reakcje elementarne).
1. Szybkość reakcji
Szybkość reakcji (v) dla najprostszej przemiany typu A → B zdefiniowana jest następującym wzorem:
v = ![]()
gdzie cA i cB oznaczają odpowiednio stężenie substratu A i produktu B, t - czas. W praktyce dla wolnych reakcji, zwłaszcza na początku przebiegu można zastosować wzory:
v = ![]()
gdzie: ΔcA = co - cA ; ΔcB = cB - 0 = cB (jeżeli stężenie początkowe produktu B wynosiło 0),
co - stężenie początkowe substratu A.
Szybkość reakcji wyraża zmianę stężenia reagenta w czasie. Jednostką szybkości jest jednostka stężenia molowego przez jednostkę czasu np. mol⋅dm-3⋅s-1.
2. Równanie kinetyczne
Równanie kinetyczne reakcji określa szybkość reakcji jako funkcję stężeń molowych reagentów. Dla przemiany typu A → B ma najczęściej ogólną postać:
v = k cAn
gdzie k - stała szybkości reakcji, n - rząd reakcji.
Wartości k i n wyznacza się doświadczalnie dla danej reakcji prowadzonej w określonych warunkach (temperatura, ciśnienie, obecność lub brak katalizatora). Stała szybkości jest funkcją temperatury opisaną równaniem Arrheniusa:
![]()
gdzie A - współczynnik proporcjonalności, Ea - energia aktywacji (kJ/mol), R - stała gazowa (8.31 J/K),
T - temperatura w kelwinach.
Rzędem reakcji ze względu na określony reagent nazywamy wykładnik potęgi, w której występuje stężenie tego reagenta w równaniu kinetycznym.
Na przykład reakcja typu A + B → C + D, o równaniu kinetycznym v = k cAcB jest reakcją pierwszego rzędu ze względu na reagent A i pierwszego rzędu ze względu na reagent B, zaś reakcja o równaniu kinetycznym: v = k cA2 jest reakcją drugiego rzędu ze względu na reagent A.
3. Reakcje pierwszego rzędu
Załóżmy, że reakcja przedstawiona równaniem A → B jest reakcją pierwszego rzędu. Szybkość tej reakcji (v) jest proporcjonalna do pierwszej potęgi chwilowego stężenia cA substratu A:
v = k cA
Mierząc szybkość reakcji jako ubytek stężenia substratu A w funkcji czasu, otrzymujemy równanie kinetyczne w postaci różniczkowej:
![]()
Rozdzielając zmienne i całkując obustronnie powyższe równanie otrzymujemy:
ln![]()
Stałą całkowania wyznaczamy z warunków początkowych: dla t = 0, cA = co, stąd: ![]()
czyli: ![]()
przekształcając powyższe równanie otrzymujemy: ![]()
. Z równania tego otrzymujemy:
![]()
stąd: ![]()
Z powyższych równań wynika, że dla reakcji pierwszego rzędu:
- stężenie substratu maleje wykładniczo w funkcji czasu: cA = ![]()
![]()
- zależność ![]()
od czasu t jest funkcją liniową przechodzącą przez początek układu współrzędnych.
- współczynnik kierunkowy prostej odpowiada wartości k.
- wymiarem stałej szybkości jest odwrotność jednostki czasu.
- okres połowicznej przemiany substratu (τ1/2) wynosi τ1/2 = ![]()
Rys. Graficzne zależności charakterystyczne dla reakcji pierwszego rzędu:
a) zmiana stężenia substratu w czasie reakcji (stężenie substratu maleje zgodnie z funkcją cA = co ![]()
b) liniowa zależność ![]()
od czasu reakcji t o współczynniku kierunkowym równym k.
4. Katalizator
Katalizator jest to związek chemiczny, który zwiększa szybkość reakcji obniżając energię aktywacji Ea poprzez zmianę mechanizmu reakcji. Zmiana mechanizmu oznacza zmianę etapów (reakcji) elementarnych czyli faktycznej sekwencji łączenia się atomów i cząsteczek.
5. Rozkład nadtlenku wodoru
Rozkład zachodzi wg równania: H2O2 → H2O + ½ O2↑
W pokojowej temperaturze i bez katalizatora samorzutny rozkład zachodzi bardzo wolno. Reakcję tę katalizuje wiele substancji, w tym jony metali, a także promieniowanie UV. W zależności od rodzaju katalizatora powstają różne produkty przejściowe w etapach pośrednich i ogólny rząd reakcji może mieć różne wartości. W przypadku katalizy jonami Fe3+ kinetyka odpowiada reakcji pierwszego rzędu. Postęp reakcji rozkładu H2O2 można śledzić w oparciu o ubytek substratu, tzn. H2O2.
W organizmach żywych nadtlenek wodoru wydzielany jest jako produkt procesu uzyskiwania energii. Jako związek szkodliwy dla organizmu szybko rozkładany jest dzięki enzymowi katalazie.
Cel ćwiczenia
1) Potwierdzenie rzędowości reakcji katalitycznego rozkładu H2O2 w obecności Fe3+.
2) Wyznaczenie stałej szybkości reakcji.
3) Badanie wpływu katalizatora na szybkość reakcji.
WYKONANIE
Odczynniki: mianowany roztwór KMnO4, 0.02 M Fe2(SO4)3, 1 % H2O2, 2 M H2SO4.
1. Przygotowanie mieszanin reakcyjnych i pobieranie próbek.
Mieszaniny reakcyjne
Do dwóch kolb stożkowych wprowadzić po 75.00 cm3 1% roztworu nadtlenku wodoru, a następnie odpowiednio:
kolba 1 - 5.00 cm3 wody destylowanej (układ bez katalizatora)
kolba 2 - 5.00 cm3 0.02 M Fe2(SO4)3
Czas dodania katalizatora Fe2(SO4)3 uważamy za czas rozpoczęcia reakcji rozkładu nadtlenku wodoru.
Próbkowanie
Pobrać próbki o objętości po 5.00 cm3 odpowiednio:
kolba 1 - 3 próbki co 30 min (t = 0, t = 30 min, t = 60 min).
kolba 2 - 4 próbki co 15 min (t = 15 min, t = 30 min, t = 45 min, t = 60 min).
Uwaga:
Próbka pobrana z kolby 1 (bez katalizatora) dla t = 0, odpowiada próbce dla t = 0, z katalizatorem.
Po dodaniu katalizatora układ intensywnie mieszać!
Analiza
Próbkę po pobraniu należy wprowadzić do kolby zawierającej 10 cm3 2 M H2SO4 (kolbę z kwasem należy przygotować przed pobraniem próbki). We wszystkich przypadkach za czas pobrania próbki przyjmujemy moment wprowadzenia próbki do roztworu H2SO4 (w silnie kwaśnym środowisku rozkład nadtlenku wodoru zostaje zahamowany). Ilość nierozłożonego H2O2 oznaczać miareczkując mianowanym roztworem KMnO4.
2. Manganometryczne oznaczanie H2O2.
Nadtlenek wodoru w stosunku do silnych utleniaczy (np. MnO4−, PbO2, MnO2, w środowisku kwaśnym) zachowuje się jak reduktor. Reakcję nadtlenku wodoru z manganianem(VII) potasu przedstawia równanie:
2MnO4− + 5H2O2 + 6H+ → 2Mn2+ + 5O2↑ + 8H2O
Aby reakcja przebiegła szybko musi być znaczne stężenie kwasu siarkowego(VI) w miareczkowanym roztworze.
Pobraną próbkę roztworu H2O2 o objętości 5.00 cm3 wprowadzić do kolby stożkowej zawierającej 10 cm3 2 M H2SO4 i miareczkować mianowanym roztworem KMnO4 o stężeniu C, do trwałego, lekko różowego zabarwienia.
Zawartość H2O2 (w mol/dm3) obliczyć wg wzoru:
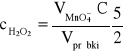
3. Opracowanie wyników.
a) Obliczyć stężenie H2O2 w poszczególnych próbkach.
Stężenie H2O2 w próbce bez katalizatora dla t = 0 odpowiada początkowemu stężeniu H2O2 (cA = ![]()
).
b) Sporządzić wykresy zależności stężenia H2O2 od czasu reakcji dla mieszanin reakcyjnych 1 i 2.
c) Sporządzić wykresy zależności ln(co/cH2O2) od czasu reakcji dla mieszanin reakcyjnych 1 i 2, wykreślić proste i wyznaczyć współczynniki kierunkowe k.
d) Przedyskutować otrzymane wartości stałych szybkości k w badanych układach.
e) Określić wpływ katalizatora na przebieg reakcji.
Nr |
Katalizator Fe2(SO4)3 |
Czas reakcji [min] |
Objętość KMnO4 [cm3] |
Stężenie H2O2 [mol/dm3] |
ln ( |
k [min−1] |
1 |
0.00 M |
0 |
|
|
|
|
|
|
30 |
|
|
|
|
|
|
60 |
|
|
|
|
2 |
0.02 M |
0 |
|
|
|
|
|
|
15 |
|
|
|
|
|
|
30 |
|
|
|
|
|
|
45 |
|
|
|
|
|
|
60 |
|
|
|
|
Literatura
Krzysztof Pigoń, Zdzisław Ruziewicz „Chemia fizyczna” PWN
Peter Wiliam Atkins „Podstawy chemii fizycznej” PWN
5
Wyszukiwarka
Podobne podstrony:
Program 2013, Biologia UJ, Chemia nieorganiczna, instrukcje
Instrukcja stala i stopien 2013, Biologia UJ, Chemia nieorganiczna, instrukcje
Instrukcja V stala i stopien, Biologia UJ, Chemia nieorganiczna, laboratoria
Instrukcja VII iloczyn, Biologia UJ, Chemia nieorganiczna, laboratoria
Instrukcja I roztwory, Biologia UJ, Chemia nieorganiczna, laboratoria
chromatografia 2013, Biologia UJ, Chemia organiczna, Laborki
Instrukcja XII kinetyka, BIOLOGIA UJ LATA I-III, ROK I, semestr I, chemia nieorganiczna i ogólna
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
cwiczenia 1 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
cwiczenia 9 i 10 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczen
cwiczenia 8 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
cwiczenia 7B instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
Instrukcje - Alacymetria cz 1, Technologia Żywności, I ROK, Chemia nieorganiczna
Konwersatorium III, BIOLOGIA UJ LATA I-III, ROK I, semestr I, chemia nieorganiczna i ogólna
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
cwiczenia 1 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
odp test 1, 1 ROK Biologia i geologia, spec.Ochrona przyrody, Chemia nieorganiczna
Egzamin 4, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
więcej podobnych podstron