Obliczenia dla Kwasu solnego o C=0,5 mol/l
Czas t [min]
T1 25
T2 45
T3 65
T4 87
T5 113
Czas t [s]
T1 25*60=1500
T2 45*60=2700
T3 65*60=3900
T4 87*60=5220
T5 113*60=6780
Objętość V [cm3]
V0 11.2
V1 11.8
V2 12.4
V3 12.6
V4 13.9
V5 14
V∞ 20,9
![]()
Dla V1
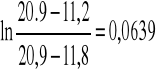
Dla V2
![]()
![]()
Dla V1
![]()
Dla V2
![]()
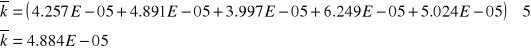
![]()
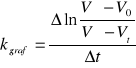
![]()
![]()
![]()
Obliczenia dla Kwasu solnego o C=1,5 mol/l
Czas t [min]
T1 24
T2 44
T3 63
T4 97
T5 106
Czas t [s]
T1 24*60=1440
T2 44*60=2640
T3 63*60=3780
T4 97*60=5820
T5 106*60=6360
Objętość V [cm3]
V0 32.4
V1 35.9
V2 36.2
V3 37.3
V4 37.6
V5 39.4
V∞ 43.9
![]()
Dla V1
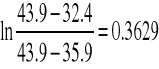
Dla V2
![]()
![]()
Dla V1
![]()
Dla V2
![]()
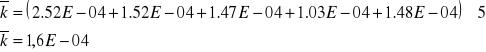
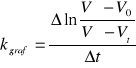
![]()
Wnioski:
Stała szybkości reakcji w środowisku kwasu solnego o C=0,5 mol/l jest mniejsza (4,884 10-5) niż stała szybkości w środowisku kwasu o C=1,5 mol/l (1,6 10-4). Wynika z tego, że im większe stężenie kwasu czyli stężenie jonów wodorowych tym większa stała szybkości reakcji. Reakcja opisana w tym doświadczeniu przebiega szybciej im jest większe stężenie kwasu. Jony wodorowe są katalizatorem i powodują wzrost szybkości tej reakcji.
Wyszukiwarka
Podobne podstrony:
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
ChFizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
poprawa, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
fIZYCZNA5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł,
13 fiza word, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
moje 18, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
więcej podobnych podstron