Cv poszczególnych substancji rośnie do temperatury TD, powyzej tej temperatury wynosi 25 J/mol ·K.
Średnia energia atomu: E=3kT
Cv = dE/dT = 3Na·k =25 J/mol ·K
Temperatura TD jest punktem podziału między obszarem wysokotemperaturowym a niskotemperaturowym, w którym nalezy stosować mechanikę kwantową.


Przewodnictwo ciepła - zjawisko przepływu energii cieplnej pomiędzy punktami o róznej temperaturze.
W przypadku gazu przewodnictwo ciepła polega na wzajemnym przekazywaniu energii bezładnego ruchu cieplnego molekuł, co prowadzi do wyrównywania się
energii(temperatury).
•Dla ciał stałych w przewodnictwie ciepła uczestniczą:
-fonony- sieciowe przewodnictwo cieplne
-gaz elektronowy- elektronowe przewodnictwo cieplne
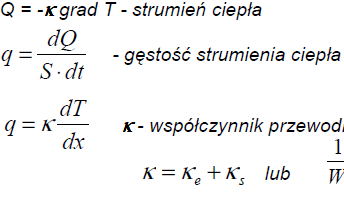
Przewodnictwo ciepła opisuje się równaniem:
Q = - grad T,
![]()
gdzie: Q - wektor strumienia cieplnego, - współczynnik przewodnictwa ciepła, T - temperatura.
Dla kryształów metali i dielektryków w niskich temperaturach występuje maksimum przewodnictwa cieplnego.
• W dielektrykach - mechanizm fononowy
• W metalach - przewodnictwo cieplne znacznie większe niz w dielektrykach, co wskazuje na istotną rolę gazu elektronowego w transporcie energii cieplnej.
Rozszerzalność cieplna ciał stałych - zmiana rozmiarów liniowych ciała wraz z temperaturą α - współczynnik rozszerzalności cieplnej (względna zmiana długości przypadająca na zmianę temperatury o 1 stopień)
Większa rozszerzalność - słabsze wiązania Słabsze wiązania - nizsza temperatura topnienia
Przewodnictwo ciepła :
Q = - T
gdzie: Q - wektor strumienia cieplnego, - współczynnik przewodnictwa ciepła, T - temperatura
Przewodnictwo elektryczne:
= σ U - prawo Ohma ( - wsp. dyfuzji )
gdzie: - gęstość prądu, σ - przewodnictwo właściwe, U -róznica potencjałów.
σ = e·e·e
e - ładunek elektronu, e - gęstości wolnych nośników prądu, e - ruchliwość e = e E ve- prędkość elektronu w polu E
Oporność właściwa:
ρ = ρf + ρd
1/ = 1/ f + 1/d
Reguła Matthiesena: prawdopodobieństwo rozproszenia elektronu jest sumą prawdopodobieństw rozproszenia z udziałem poszczególnych procesów:
ρ (T) = ρd (d) + ρf (T)
ρd (Nd) - opornosc resztkowa
Czyste metale mają małą oporność resztkową. Silnie zdefektowane kryształy maja duzą oporność resztkową
![]()
TWR- Temperaturowy współczynnik rezystancji
RT - rezystancja w temp. T [Ω], R0 - rezystancja w temp. odniesienia T0 [Ω], α - temp. współczynnik rezystancji [K-1],
ΔT - zmiana temp. równa T-T0 [K],
Prawo Wiedemanna - Franza - mówi, ze stosunek przewodności cieplnej do elektrycznej dla metali jest wprost proporcjonalny do temperatury: α=LT
Współczynnik L, zwany liczbą Lorentza - jest w temp. pokojowej prawie jednakowy dla większości metali.
L = 2,4453·10-8 W·/K2
WŁAŚCIWOŚCI MECHANICZNE
Napręzenie rozciągające σ :
Siła F jest równowazona przez siłę oporu wewnętrznego:
σ = F/S [N/m2] ; [MN/m2 ]
S -pole powierzchni przekroju poprzecznego pręta
Napręzenie styczne (ścinające) :
σ = Fn/S [N/m2; MN/m2 ]
= Fs/S [N/m2; MN/m2 ]
Reakcją materiału na napręzenie jest odkształcenie
1.Odkształcenie pod wpływem napręzenia rozciągającego:
εn = l/l0 - nominalne odkształcenie liniowe, podłuŜne
εp = -a/a0 - odkszt. poprzeczne, zmiana przekroju poprz.
Współczynnik Poissona:
ν = - εp / εn
2. Odkształcenie pod wpływem napręzenia ścinającego
(odkształcenie postaciowe): γ = /l0 = tg
Dla małych odkształceń:
= G·γ (napręzenie ~odkształcenia)
G -moduł Kirchhoffa, współczynnik spręzystości poprzecznej, analogicznie do modułu Younga Dla małych napręzeń rozciągających - prawo Hook'a :
σ = E·ε - odkształcenie jest wprost proporcjonalne do napręzenia
E - moduł spręzystości Younga lub współczynnik spręzystości wzdłużnej Wartość modułu Younga jest miarą oporu stawianego przez sąsiadujące atomy podczas zwiększania między nimi odległości. Moduł spręzystości E określa sztywność materiału - opór materiału przeciw wydłuzaniu. Moduł spręzystości i temperatura topnienia rosną wraz ze wzrostem siły wiązań. Moduł Younga E zalezy od : •typu wiązań między atomami, •składu chemicznego, •struktury krystalicznej; •jest właściwością anizotropową
Pełzanie - zwiększające się z upływem czasu odkształcenie plastyczne pod wpływem stałego obciążenia
Gęstość strumienia magnetycznego (indukcja magn.):
B = H
H - natęzenie pola magnetycznego
- przenikalność magnetyczna materiału
Przenikalność względna materiału:
w =/o
o -przenikalność magnetyczna prózni
B = oH +oM (od prózni + od materiału); M-namagnesowanie, moment magnet. przypadający na jedn. obj. materiału
Podatność magnetyczna:
m= M /H → w = 1+ m - stopień wzmocnienia pola magn. przez materiał
B= owH= oH(1+ m) → B ≈ oM
Moment magnetyczny atomu -wypadkowy moment magnetyczny wszystkich momentów magnetycznych
orbitalnych i spinowych. •Moment magnetyczny wykazują atomy, które mają niesparowane elektrony •Momenty magnetyczne elektronów walencyjnych znoszą się nawzajem
Moment spinowy pojedynczego elektronu - magneton Bohra: B=e·h / 4m
Diamagnetyki- materialy nie posiadające trwałych dipoli magnetycznych. Moment magnetyczny atomów jest równy zero. cynk miedz chlor olow
Paramagnetyki mają moment magnetyczny atomu rózny od zera, ale zwrot tych wektorów jest rózny i wypadkowy moment magnetyczny jest równy zero. Aluminium cyna magnez chrom.
Ferromagnetyki- to substancje charakteryzujące się tym, ze w małych obszarach zwanych DOMENAMI występuje samorzutne uporządkowanie momentów magnetycznych atomów. Dziela się na ferrimagnetyki i antyferromagnetyki. Fe, Ni, Co
Wraz ze wzrostem temperatury namagnesowanie maleje
Pętla histerezy prezentuje zaleŜność namagnetyzowania od zewnętrznego pola magnetycznego.
Indukcja nasycenia jest to wartość namagnetyzowania (wektory momentów magnetycznych we wszystkich domenach są zgodne ze zwrotem zewnętrznego pola).
OB - jest to pozostałość magnetyczna, czyli wartość namagnetyzowania przy wyłączonym polu zewnętrznym.
OC - nazywa się koercją magnetyczną, jest to wartość zewnętrznego pola magnetycznego, potrzebnego do rozmagnesowania próbki próbkę.
STANY SKUPIENIA
Gazy - nie mają określonego kształtu i objętości,
- nie istnieją oddziaływania między cząsteczkami (atomami),
- odległości między cząsteczkami są znacznie większe niŜ ich
rozmiary (kilkadziesiąt razy), - znacznie zmieniają swoją objętość pod wpływem ciśnienia i temperatury.
Ciecze - nie maja określonego kształtu, zajmują określoną objętość, - istnieją słabe oddziaływania miedzy cząsteczkami((siły kohezji), - odległości między cząstkami są porównywalne z ich rozmiarami, - ich objętość nieznacznie zalezy od ciśnienia, mała ściśliwość.
• znajdują się w równowadze termodynamicznej z parami (pręzność par)
Ciała stałe - mają określony kształt i objętość, cząstki (atomy, jony, cząsteczki) zajmują stałe, określone miejsce w przestrzeni, - istnieją silne oddziaływania miedzy cząstkami (wiązania chemiczne) - nie istnieją odległości między cząstkami (struktura gęsto upakowana)
•ciała krystaliczne - wykazują przestrzenne uporządkowanie dalekiego zasięgu, tworzą sieć krystaliczną monokryształy uporządkowanie w całej objętości kryształu polikryształy uporządkowanie w obrębie pewnych obszarów (ziaren)
•ciała bezpostaciowe - brak uporządkowania dalekiego zasięgu, (uporządkowanie(amorficzne) bliskiego zasięgu, kilka pm, szkła krzemionkowe, niektóre polimery organiczne, sadza)
Zmiany stanu skupienia pod wpływem temperatury:
- topnienie: ciało stałe - ciecz
- parowanie: ciecz - gaz
- sublimacja: ciało stałe - gaz
- kondensacja: gaz - ciecz
- krzepnięcie: ciecz - ciało stałe
- resublimacja: gaz - ciało stałe
t1: 0 ⇒ A - wzrost drgań sieci krystalicznej (A - temperatura topnienia)
t2: A ⇒ B - niszczenie sieci krystalograficznej (pobierane jest ciepło topnienia)
t3: B ⇒ C - zwiększanie energii kinetycznej cząsteczek (C - temp. wrzenia)
t4: C ⇒ D - niszczenie sił międzycząsteczkowych cieczy (ciepło parowania)
t5: > D - zwiększanie energii kinetycznej cząsteczek (parowanie)
Gaz doskonały - wyidealizowany gaz ,w którym;
-nie istnieją oddziaływania międzycząsteczkowe -pomijana jest objętość własną cząsteczek -cząsteczki poruszają się ruchem jednostajnuym prostoliniowym -cząsteczki ulegają zderzeniom idealnie sprężystym
Prawo Avogadra (1811r):
Jednakowe objętości róznych gazów znajdujących się pod tym samym ciśnieniem i w tej samej temperaturze zawierają jednakową liczbę cząsteczek. Liczbę cząsteczek zawartych w 1 molu wynosi: N = 6,023 · 1023
jednakowa liczba moli w tych samych warunkach ciśnienia i temperatury powinna zajmować tę samą objętość.
Objętość jednego mola gazu doskonałego, tzw. objętość molowa, w warunkach normalnych (0C i ciśnienie atm. = 1013 hPa) wynosi: Vo = 22,415 dcm3 (litra)
Prawo Boyle'a - Mariotte'a- przemiana izotermiczna:
W stałej temperaturze objętość danej masy gazu jest odwrotnie
proporcjonalna do ciśnienia. P1/p2 = V2/V1
Prawo Gaya-Lussaca (1802)- przemiana izobaryczna:
Przy stałym ciśnieniu objętość danej masy gazu jest wprost
proporcjonalna do temperatury. V1/T1 = V2/T2
Przy stałej objętości ciśnienie danej masy gazu jest wprost
proporcjonalne do temperatury (przemiana izohoryczna) p1/T1 = p2/T2
Równanie stanu gazu: pV/T=const=R=NA*k= 8,31[J/mol*K]
Prawo Daltona:
Całkowite ciśnienie mieszaniny gazów jest równe sumie ciśnień cząstkowych poszczególnych składników.
Dyfuzja - samorzutne rozprzestrzenianie się cząsteczek wywołane ruchem molekularno-kinetycznym (wypływ cząsteczek przez wąski otwór - efuzja).
•dyfuzja zachodzi w ciałach stałych, cieczach i gazach.
•przyczyną dyfuzji jest róŜnica ciśnień.
Szybkość dyfuzji zalezy od gęst. gazów - prawo Grahama:
u1/u2=√(d2/d1)=t2/t1
u - szybkość dyfuzji d - gęstość gazu T= const., p=const.
t - czas wypływu określonej objętości gazu. Im większa cząst. tym mniejsza szybkość dyfuzji i dłuzszy czas wypływu
Teoria kinetyczna gazu pozwala przedstawić rozkład prędkości cząsteczek dla róznych temperatur. Maksimum odpowiada prędkości, jaką posiada największa liczby cząsteczek. Jest ona określana jako średnia prędkość.
ciśnienie gazu: p=1/3N*m*uśr2
N-liczba czast. V-objetosc, l-dlugosc sciany sześcianu,
u-predkosc Czas między kolejnymi zderzeniami cząsteczki ze ścianą A1:
t = 2·l / ux
Częstość zderzeń ze ściana A1: f = ux / 2·l
Siła działająca na ścianę A1 (pochodząca od jednej cząsteczki):
Fi = p / t = 2m·ux· ux / 2·l = m·ux2 / l
Ciśnienie działające na ścianę A1 pochodzące od N cząsteczek:
p = F/S = N·m·ux2 / l·S
Średnia prędkość dla kierunków x, y, z:
uśr2 = ux2+uy2+uz2; ux=uy=uz, ux2=1/3·uśr2
p V N muśr2
Średnia energia kinetyczna cząsteczek:
Eśr = 3/2 k T = ½ m*usr2
Średnia energia jest proporcjonalna do temperatury a współczynnik zalezyod ilości atomów w cząsteczce:
Eśr =( i/2) k T
i - liczba stopni swobody
i = 3 dla jedno atomowych
i = 5 dla dwu atomowych
i = 6 dla 3 i więcej atomowych.
Równanie stanu gazu rzeczywistego (r. van der Waalsa):
(p+(n2*a)/V2)*(V-nb)=nRT
(a, b -stałe)
TK - temperatura krytyczna - zalezy od siły oddziaływań międzycząst. Powyzej Tk gaz nie moze ulec skropleniu
Stan równowagi ciecz-para (dla T=const) - jest to stan, w którym liczba cząsteczek przechodzących z cieczy w stan pary jest równa liczbie cząsteczek pary skraplających się w ciecz w tym samym czasie(szybkość parowania staje się równa szybkości skraplania pary).
Napięcie powierzchniowe definiowane jest jako praca, którą nalezy wykonać, aby zwiększyć powierzchnię swobodną o jednostkę powierzchni lub jako siła styczna do powierzchni przypadającą na jednostkę długości
σ
σ
Napięcie powierzchniowe jest tym większe, im większe są oddziaływania międzycząsteczkowe (siły kohezji FK).
•Dodatek substancji jonowych, np.. NaCl podwyŜsza napięcie powierzchniowe •Dodatek tzw. substancji powierzchniowo czynnych (surfaktantów) obniza napięcie powierzchniowe (σ = 20-30 mN/m ) •Obnizenie napięcia powierzchniowego cieczy powoduje poprawę zwilŜalności ciał stałych przez tę ciecz (wzrost sił adhezji FA)
Lepkość cieczy: F δδ
- współczynnik lepkości dynamicznej lub lepkość dynamiczna. []= N·s/m2
- lepkoscć kinematyczna; = /ρ gdzie ρ - gestoscć. [ ]=1m2/s
• Im większe siły międzycząsteczkowe tym większa lepkość. • Ciecze polarne (woda, gliceryna) wykazują większą lepkość niz niepolarne (aceton, benzen). • Lepkość maleje ze wzrostem temperatury
KINEMATYKA CHEMICZNA
Związki nieorganiczne to związki nie zawierające węgla w cząsteczce (za wyjątkiem tlenków węgla, węglanów i węglików). Np.Tlenki Wodorki Wodorotlenki Kwasy Sole Inne
Tlenki: ZASADOWE K2O, MnO KWASOWE CO2, N2O5, CrO3, OBOJĘTNE CO, NO Mn2O7 AMFOTERYCZNE ZnO, MnO2, As2O3.
Otrzymywanie
• przez utlenianie pierwiastków: - 2Mg + O2 = 2MgO
• przez utlenianie tlenku: - 2CO +O2 +2CO2
• przez redukcję tlenku: - CO2 + Mg = MgO + CO
• przez spalanie związków org.: - C2H5OH + O2 = 2CO2 +3H2O
• przez rozkład termiczny - soli: - MgCO3 = MgO + CO2
- tlenków: - 4MnO2 = 2Mn2O3 + O2
- wodorotlenków: - Cu(OH)2 = CuO + H2O
Właściwości
Tlenki zasadowe (bezwodniki zasadowe): tlenki metali, głównie litowców i berylowców, ciała stałe, wiązania jonowe.
• reagują z wodą: - MgO + H2O = Mg(OH)2
• reagują z kwasami: - CaO +H2SO4 = CaSO4 + H2O
• reagują z tlenkami kwasowymi: - MgO +CO2 = MgCO3
Tlenki kwasowe (bezwodniki kwasowe): głównie tlenki niemetali (najczęściej gazy), lub tlenki metali na wyŜszym stopniu utlenienia (ciała stałe), wiązania kowalencyjne.
• reagują z wodą: - CO2 + H2O = H2CO3
• reagują z wodorotlenkami: - SO2 + Mg(OH)2 = MgSO4 + H2O
• reagują z tlenkami zasadowymi: - CO2 + CaO = CaCO3
Tlenki amfoteryczne: tlenki metali i niemetali, reagują zarówno z kwasami jak i z zasadami dając sole. - ZnO + H2SO4 = ZnSO4 + H2O - ZnO + 2NaOH = Na2ZnO2 + H2O
Wodorek - związek dowolnego pierwiastka (E) z wodorem.
EHn - E - z grupy 1-15 (NaH,CaH2, AlH3) - wodorki metali, ciała stałe;
HnE - E - z grupy 16, 17 (HCl, HF, H2S) - wodorki niemetali, gazy;
Otrzymywanie: przez bezpośrednią syntezę pierwiastka z wodorem, często z wykorzystaniem katalizatora, wysokiego ciśnienia i temperatury. H2 + Ca = CaH2 H2 + S = H2S
Właściwości
•wodorki metali reagują z wodą: NaH + H2O = NaOH + H2 •wodorki niemetali rozpuszczają się w wodzie tworząc kwasy beztlenowe (HF, HCl)
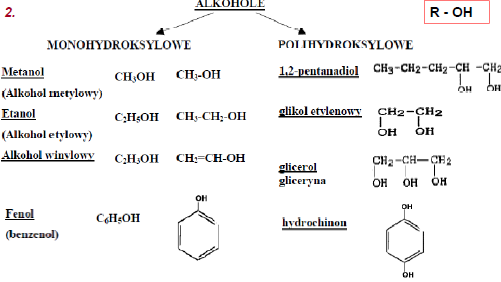
Wodorotlenki - związki składające się z metalu i grupy OH - M(OH)n - dziela się na zasadowe i amfoteryczne
Otrzymywanie
•w reakcji metali (lekkich) z wodą: 2Na + 2H2O = 2NaOH +H2
•w reakcji tlenków metali z wodą: CaO + H2O = Ca(OH)2
• w reakcji strącania osadu:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Właściwości
W większości są ciałami stałymi, w wodzie ulegają dysocjacji elektrolitycznej, tworzą elektrolity. Moc elektrolitu zalezy od elektroujemności metalu (siły wiązania między metalu z tlenem w grupie OH).
Wodorotlenki zasadowe: reagują z kwasami, nie reagują z zasadami; Wodorotlenki amfoteryczne: reagują z kwasami i mocnymi zasadami
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH = Na2ZnO2 +2H2O
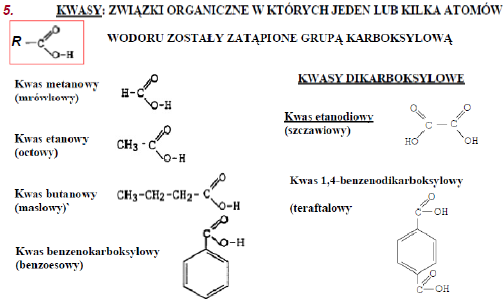
Kwasy to związki składające się z H i reszty kwasowej HnR.
Reszta kwasowa kwasów beztlenowych: S2-, Br -
Reszta kwasowa kwasów tlenowych: PO4 3-, SO4 2-
Otrzymywanie
• w reakcji bezwodnika kwasowego z wodą:
CO2 + H2O = H2CO3
• w reakcji strącania osadu:
Na2SiO3 + H2SO4 = H2SiO3 + Na2SO4
• w reakcji soli z mocnym kwasem:
Ca(CH3COO)2 + H2SO4= 2CH3COOH + CaSO4
• przez rozpuszczane w wodzie wodorków : HF, HCl
Właściwości
• w wodzie ulegają dysocjacji ( moc elektrolitów zalezy od stopnia dysocjacji) • reagują z wodorotlenkami (reakcja zobojętnienia): HCl + NaOH = NaCl + H2O • reagują z metalami nieszlachetnymi: H2SO4 + Zn = ZnSO4 + H2
• z metalami szlachetnymi zachodzą reakcje redox,
• reagują z tlenkami metali: CaO + H2CO3 = CaCO3
Sole - to substancje składające się z kationów metalu i anionów reszty kwasowej. Sole proste -MnRm - jeden rodzaj kationu i jeden rodzaj anionu. Dysocjują zgodnie z reakcją: Ca(NO3)2 ↔ Ca2+ +2NO3-
Sole kwaśne (wodorosole)Mn[HkR]m - wywodzą się z kwasów wielowodorowych. Zawierają wodór kowalencyjnie związany z anionem; jeden rodzaj kationu i jeden rodzaj anionu:
NaHSO4 ↔ Na+ +HSO4-
Sole zasadowe (hydroksosole) -Mn(OH)kRm - powstają z wodorotlenków wielohydroksylowych,są na ogół ciałami stałymi, krystalicznymi, dysocjują na trzy rodzaje jonów: Mg(OH)Cl ↔ Mg2+ + OH - + Cl -
Otrzymywanie
• w r. zobojętnienia: Cu(OH)2 + HCl = CuCl2+ 2 H2O
• w r. kwasu z metalem: Fe +2HCl = FeCl2 +2H2O
• w r. tlenku zasad. z kwasem: CaO+2HNO3=Ca(NO3)2+H2O
• w r. wodorotlenku z tlenkiem kwasowym:2KOH+SO3=K2SO
• w r. tlenku zasadowego z kwasowym: MgO +CO2 + MgCO3
• w reakcji metalu z niemetalem: Zn + S = ZnS
Reakcją chemiczną nazywamy proces, w którym z cząsteczek, atomów lub jonów substancji wyjściowych (substratów) powstają cząsteczki, atomy lub jony produktów. Właściwości produktów róznią się od właściwości substratów.
Stopień przereagowania wskazuje, jaka część substratu została przeniesiona w produkt w wyniku reakcji chemicznej.
Prawo zachowania masy: suma mas substratów jest równa sumie mas produktów.
Prawo stosunków stałych: pierwiastki chemiczne reagują ze sobą w stałych, ściśle określonych stosunkach:
- ilościowych (stechiometrycznych), np. C + O2 = CO2 (1:2mol)
-wagowych: 12 : 32 ( 3: 8) - wagowo
1. Reakcje syntezy - substraty łącza się tworząc produkty:
A + B → AB
S + O2 → SO2 - spalanie siarki w tlenie
MgO + H2O →Mg(OH)2 - rozpuszczanie tlenku metalu w H2O
2NO2 → N2O4 - łączenie się dwóch cz. w dimer (dimeryzacja)
nC2=CHCl → (-CH2 - CHCl0-)n - łączenie się duzej liczby cz. (polimeryzacja)
2. Reakcje analizy - reakcje rozkładu substratów na składniki prostsze pod wpływem róznych czynników zewnętrznych, AB→A+B
CaCO3 CaO + CO2 - dysocjacja termiczna (piroliza)
2AgCl 2 Ag + Cl2 - fotoliza
O2 O + O+ + e - radioliza lub jonizacja
3. Reakcje wymiany - substraty wymienią się atomami:
Zn + H2SO4 → ZnSO4 + H2 wymiana pojedyncza:
AB + C → AC + B
CaCl2 +H2SO4 → CaSO4 +2HCl wymiana podwójna:
AB + CD →AC + BD
Reakcje termiczne
1. Reakcje egzotermiczne - powstają produkty o energii wewnętrznej mniejszej niz suma energii substratów.
C + O2 → CO2 + 394 kJ - energia jest oddawana do otoczenia
2. Reakcje endotermiczne - powstają produkty o energii wewnętrznej większej niz suma energii substratów
Ag2O → 2Ag + ½ O2 - 30 kJ - E jest pobierana z otoczenia
Inne rodzaje doprowadzonej energii:
• Reakcje elektrochemiczne - zachodzą pod wpływem prądu elektrycznego lub powodują powstawanie prądu (ogniwa, akumulatory) • Reakcje fotochemiczne - pod wpływem światła (fali elektromagnetycznej) • Reakcje fonochemiczne - (sonochemiczne), pod wpływem ultradźwięków • Reakcje radiacyjno-chemiczne - pod wpływem promien.jonizującego
Stopień utlenienia - liczba elektronów, jaką atom lub jon przyjąłby lub oddał, gdyby utworzone wiązanie miało charakter czysto jonowy. Reduktor - pierwiastek, który oddaje elektrony (ulega utlenieniu) Utleniacz - pierwiastek, który przyjmuje elektrony (ulega redukcji)
Iiczba elektronów oddanych = liczbie elektronów pobranych
1. Reakcje jonowe - przebiegają szybko, zwykle w roztworach:
Ba2+ +2Cl- + 2H+ + SO4
2- = BaSO4 + 2H+ + 2Cl-
2. Reakcje cząsteczkowe - przebiegają powoli, najczęściej w fazie gazowej:
2 SO2 + O2 = 2 SO3
3. Reakcje rodnikowe
Rodniki - bardzo aktywne atomy lub grupy atomów, które mają niesparowane elektrony. Powstają pod wpływem wysokiej temperatury lub absorpcji kwantu promieniowania elektromagn.
Kinetyka chemiczna - dział chemii zajmujący się szybkością przebiegu reakcji.
1.Reakcje homogeniczne - jednorodne, zachodzą całkowicie w jednej fazie.
2.Reakcje heterogeniczne - niejednorodne, przebiegają na granicy rozdziału faz.
Szybkość reakcji - zmiana stęŜenia substratów i produktów w czasie
POCZATEK
Właściwości kryształów metalicznych: • brak kierunkowych wiązań, co zapewnia plastyczność, odporność na pękanie
• duza koncentracja elektronów swobodnych (1-2 elektrony/atom), co skutkuje duzą przewodnością elektryczną i cieplną • sztywność, metaliczny połysk, zdolność do tworzenia stopów i roztworów stałych
Pierwiastki bloku d i s są metalami: • elektrony s uczestniczą w jonizacji - tworzą "gaz elektronowy", • nie sparowane elektrony d - mogą tworzyć z sąsiednimi atomów wiązania kowalencyjne (koordynacyjne), zwiększając twardość i kruchość metali.
Pierwiastki s-elektronowe
•Konfiguracja elektronowa: s1 -litowce, s2- berylowce
•Nazewnictwo: metale alkaliczne, metale ziem rzadkich, metale lekkie •Wartościowość: +1, +2 •DuŜe promienie atomowe, mała masa →mała gęstość
Pierwiastki d-elektronowe
•Mają elektrony walencyjne na dwóch podpowłokach: s i d
•Prawie wszystkie są metalami (ze względu na elektrony s)
•Wykazują małe powinowactwo elektronowe (rzadko tworzą jony ujemne) •Występują jako jony dodatnie (oddają elektrony s i d) - prawie wszystkie występują na +2 stopniu utlenienia (struktura s2) - zawierają elektrony na orbitalach typu d i dlatego występują na wyzszych stopniach utlenienia, np. Cr(VI), Mn(VII), Pt(IV), Au(III), - nie sparowane elektrony typu d powodują, ze tworzą one związki barwne i związki kompleksowe.
ZWIAZKI KOMPLEKSOWE
•Puste orbitale typu d są powodem silnej skłonności pierwiastków do tworzenia związków kompleksowych.
•W kompleksie wyróznia się atom (lub jon) centralny i otaczające go atomy lub grupy atomów, zwane ligandami.
•Ligandy to atomy, lub cząsteczki posiadające wolną parę elektronową. •Związek kompleksowy moze być obojętną cząsteczką lub jonem, np. [Cu(NH3)4]2+, [Fe(CN)6]4-, [Co(NH3)Cl]3-, [Co(NH3)6]3+, Ni(CO)4, SO4
ZWIAZKI BARWNE
Barwa- absorpcja w zakresie widzialnym - pochłanianiem kwantów światła przez elektrony znajdujące się na częściowo zapełnionej podpowłoce d (rozszczepienie podpowłoki typu d pod wpływem ligandów). Przy całkowicie zapełnionej podpowłoce d lub przy braku elektronów d jony proste metali tego bloku są bezbarwne Bezbarwne: d0 i d10- elektronowe, np: Ti4+, Sc3+, Ag+, Zn2+, Cd2+, Hg2+
PIERWIASTKI D-elektronowe
• d↑ r↓ - rośnie przyciąganie przez q jądra,
rośnie gęstość, •d>5 - ekranowanie jądra przez elektrony
d↓ - r ↑ •małe r -silne wiązania - rmin → Ttopn max
Temperatura topnienia:
Blok s: mała Ttopn Blok p: mała Ttopn
-największa dla konfiguracji s2p3 -najwięcej niesparowanych elektronów typu p - najsilniejsze wiązania
Blok d: duza Ttopn. - największa dla konfiguracji s2d5
-najwięcej niesparowanych elektronów typu p, silne wiązania
- najmniejsza dla konfiguracji s2d10
- brak oddziaływań międzyelektrodowych
WŁAŚCIWOŚCI METALI:
1. Wiązania metaliczne2. Metaliczny połysk3. Gęsto upakowana struktura4. DuŜa przewodność cieplna5. dobra przewodność elektryczna6. Duza wytrzymałość mechaniczna spręŜystość plastyczność, wytrzymałość na rozciąganie odporność na pękanie7. Zdolność do tworzenia związków miedzymetalicznych i stopów8. zróznicowane właściwości magnetyczne9.Mała odporność chemiczna(korozja).
•Kolor wszystkich metali jest szary. •Metale charakteryzują się częściowo zapełnionym pasmem przewodnictwa. •Następuje adsorpcja fononów w obrębie pasma. •Ze względu na wiele dozwolonych poziomów w paśmie, metale pochłaniają całe
spektrum częstotliwości. •Światło jest absorbowane w cienkie, przypowierzchniowej warstwie o grubości rzędu 0.1μm (ze względu na duŜą liczbę dozwolonych poziomów). •Pochłonięte fotony zostają łatwo wyemitowane z metalu. • Metale bardzo dobrze odbijają światło • Metale są przezroczyste dla promieniowania o bardzo duzej częstotliwości
STRUKTURY KRYSTALICZNE
Symbolika Pearsona (dwie litery i liczba np.. cF4; hP2):
•Pierwsza litera mała- układ krystalograficzny •Druga litera duŜa- typ sieci Bravais'go c ubic - regularny P prymitywna
h exagonal - heksagonalny, I przestrz. centrowana
t rigonal - rombowy F ściennie centrowana t etragonal - tetragonalny C centrowana na podstawie o rthorombic - rombowy R romboedryczna monoclinic jednoskośny
a nortic (triclinic) trójskośny
• Liczba- liczba atomów w komórce elementarnej
Oznaczenia stechiometryczne:
Grupa A - struktury pierwiastków (np.Cu, Mg, W) Grupa B - struktury związków dwuskładnikowych AB (np. NaCl, CsCl)
Grupa C - struktury związków dwuskładnikowych AB2 (np.CaF2, TiO2) Grupa D - struktury związków AnBm i związków o bardziej złoŜonych wzorach (np. Al2O3)
Większość metali posiada strukturę:
•FCC-face centered cubic (Al, Cu, Ag, Au, Pb, Ni, Pd, Pt, Ir,Ca)
•BCC body centered cubic (Cr, Fe, W, Ta , V, Li, Na, K, Rb, Cs)
•HCP-heksagonal close packed (Be, Mg, Ti, Zr, Zn, Cd, Tl, Sc)
AFP (atomic packing factor) - współczynnik wypełnienia (gęstość upakowania) atomów: część objętości komórki elementarnej zajęta przez atomy lub jony
APF = N x Va / Vk; Va - objętość atomu Vk - objętość komórki elementarnej N - ilość atomów przypadających na komórkę elementarną
DRGANIA SIECI KRYSTALICZNEJ
Drgania jednego atomu przenoszą się na sąsiednie atomy, ostatecznie rozciągają się one na całą sieć krystaliczną w postaci fal spręzystych (fal sieciowych). Taki ruch atomów w postaci fali spręzystej nosi nazwę drgań normalnych. Mozna przyjąć, ze drgania te są harmoniczne (tzn. siła F = - kx). Drgania cieplne - drgania akustyczne - wywołują falę sieciową o małych częstotliwościach, małe wartości energii. Drgania wywołane np. przez zmienne pole elektryczne - drgania optyczne - fale sieciowe o większych częstotliwościach (do 1013 Hz), drgania wysokoenergetyczne.
L - długość kryształu
a - odległość miedzy atomami
v - prędkość fazowa fali sieciowej
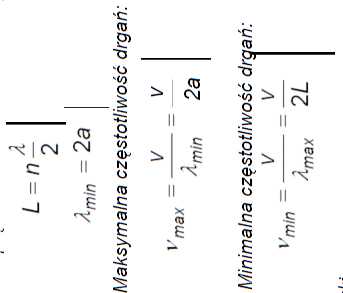
Jezeli falę sieciową potraktujemy jako kwantowy oscylator harmoniczny, energia drgań atomów jest skwantowana i minimalna porcja (kwant energii) drgań wynosi:
E = h f
Kwant taki nazywamy fononem.
Fala spręzysta (sieciowa) jest to zbiór fononów, które przemieszczają się w krysztale z określoną prędkością fali. Im wyzsza temperatura tym większa częstotliwość drgań sieci. Im większa częstotliwość, tym większa ilość fononów.
Fonony są korpuskularnym opisem fal spręzystych w ciele stalym. Mozna je traktować jako swoisty gaz wypełniający kryształ. Są one ściśle związane z siecią krystaliczną i istnieją tylko wtedy, gdy istnieje sieć. Nie mogą one opuścić kryształu. Nazywane są quasicząstkami. Energia ruchu drgających atomów kryształu jest równa sumie energii fononów.

Przemieszczając się w ciele stałym fonony przenoszą energię.
Temperatura Debye'a - graniczna wartość temperatury, ponizej której przejawia się kwantowy charakter drgań cieplnych w krysztale. Powyzej temperatury Debye'a T > Θ dozwolone są wszystkie częstotliwości drgań.
Θ =h*fd/k
(fD - częstotliwość Debye'a,
k - stała Boltzmanna)
![]()
Szybkość chwilowa- V=dc/dt=tgα, gdzie c-stężenie.
Reakcje szybkie - ułamki sekund (reakcje wybuchowe, jonowe, fotochemiczne) Reakcje wolne - kilka lat (korozja)
Zalezność szybkości reakcji od stęzenia reagentów: V=dc/dt=k·ca
Szybkość reakcji: V =k[A]a[B]b ;k-stała szybkości reakcji
Równanie Arrheniusa: szybkość reakcji rośnie wykładniczo ze wzrostem temperatury- V=As*e^(Ea/RT)*[A]a[B]b; As-stała, Ea-molowa energia aktywacji procesu.
Postać logarytmiczna: lnV=(-Ea/RT)+C
Katalizatory - substancje, które zmniejszają energię aktywacji i zwiększają V.
Inhibitory - zwiększają energie aktywacji, zmniejszają V (ochrona przed korozją).
CHEMIA ROZTWORÓW
Roztworem nazywamy jednorodny układ, złozony z rozpuszczalnika i fazy rozpuszczonej
Rozpuszczanie:
Etap I - proces endotermiczny (-CI):
- pokonanie sił spójności między cząsteczkami substancji rozpuszczanej,
- pokonanie sił spójności między cząsteczkami rozpuszczalnika.
Etap II - proces egzotermiczny (+CII):
Solwatacja - przyłączanie polarnych cząsteczek rozpuszczalnika do jonów lub
cząsteczek substancji rozpuszczonej
Hydratacja - solwatacja w roztworach wodnych
Rozpuszczanie - jest procesem odwracalnym, mozna odzyskać rozpuszczoną substancję przez odparowanie rozpuszczalnika.
Rozpuszczalność ciał stałych na ogół wzrasta z temperaturą,
rozpuszczalność gazów - maleje z temperaturą.
Roztwarzanie - przejście substancji stałej do roztworu w wyniku reakcji chemicznej, zwykle nie jest procesem odwracalnym, np. Na+H2O=NaOH+½ H2
Rozpuszczalność - masa substancji rozpuszczonej, rozpuszczona w 100 g rozpuszczalnika (T,p=const.), potrzebna do utworzenia roztworu nasyconego.
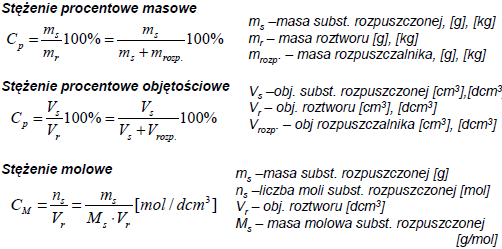

Prawo Raoulta - pręzność pary nasyconej nad roztworem nielotnej substancji jest mniejsza niz nad czystym rozpuszczalnikiem. Względne obnizenie pręzności pary nad roztworem jest równe ułamkowi molowemu substancji rozpuszczonej.
ΔP/P0=n/(n+N)=x; ΔP=Po-P
P0 - ciśnienie pary czystego rozpuszczalnika; P - ciśnienie cząstkowe rozpuszczalnika nad roztworem; X - ułamek molowy substancji rozpuszczonej; n - liczba moli substancji rozpuszczonej; N - liczba moli rozpuszczalnika
ρ Tk = Ek · Cm
ρ Te = Ee · Cm
Ek-stała krioskopowa; Ee-stała ebulioskopowa; Cm-stezenie molarne roztworu
Dyfuzja - rozprzestrzenianie się cząsteczek substancji stałych, ciekłych lub gazowych, wywołane nieustannym ruchem cząsteczek. Szybkość dyfuzji: V=-D*S*dc/dx; dc- roznica stezen substancji w dwoch warstwach cieczy odległych o dx; S-przekroj warstwy; D-wspolczynnik dyfuzji; dn/dt- zmiana liczby moli subst dyfundującej w t przez pow. S.
Osmoza - jednostronna dyfuzja rozpuszczalnika przez błonę półprzepuszczalną
Ciśnienie osmotyczne -jeŜeli osmoza zachodzi w
zamkniętym naczyniu (prawo van't Hoffa):
= c · R · T; C - stęŜenie molowe roztworu [mol/dcm3]; R - stała gazowa; T - temperatura [K]
Dysocjacja elektrolityczna - proces rozpadu substancji na jony pod wpływem rozpuszczalnika. W wodzie - najlepiej dysocjują substancje o wiązaniach jonowych i kowalencyjnych spolaryzowanych
Elektrolity - substancje, które podczas rozpuszczania rozpadają się na jony.
Stopień dysocjacji -stosunek liczby cząsteczek N (moli cząsteczek n) rozpadających się na jony do ogólnej liczby cząsteczek (moli cząsteczek) wprowadzonych do roztworu
Stopień dysocjacji zalezy od: •rodzaju elektrolitu•stęzenia roztworu (wzrasta z rozcieńczeniem roztworu) •temperatury (wzrasta ze wzrostem temperatury) •obecności innych substancji w roztworze
Elektrolity mocne ( ≈ 100%): •część kwasów nieorganicznych, np. HCl, HBr, HI, H2SO4, HNO3, HClO4, •wodorotlenki litowców i berylowców (z wyjątkiem Be(OH)2 i Mg(OH)2), •prawie wszystkie rozpuszczalne sole (wyjątek: niektóre sole rtęci, kadmu i cynku).
•Elektrolity słabe ( = kilka%): •część kwasów nieorganicznych, np. H2S, HCN, H2CO3, H2SO3, H3BO3, •część wodorotlenków nieorganicznych, np. NH4OH, większość wodorotlenków
metali II- i III- wartościowych, •większość kwasów organicznych, np. CH3COOH, HCOOH.
•Elektrolity średniej mocy: •H3PO4, H3AsO4, Mg(OH)2.
Aktywność jonów:
a = f · C; f - współczynnik aktywności; C- stęzenie roztworu.
Stała dysocjacji -stosunek iloczynu stęzeń jonów do stęzenia cząsteczek niezdysocjowanych
pH (współczynnik Sörensena) - ujemny logarytm ze stęŜenia jonów wodorowych pH = -log [H+]
pH =7 - roztwór obojętny pH <7 - roztwór kwaśny pH >7 - roztwór zasadowy
Stęzenie rzeczywistych elektrolitów: Cj = f·CM · ·n
CM - stęzenie molowe; - stopień dysocjacji; n - liczba jonów powstających z jednej cząsteczki elektrolitu; f - współczynnik aktywności jonów
Przykład:
H2SO4 ↔ 2H+ + SO4-
CM =0,005; =1, f = 1, n=2
[H+] = 0,005 ·1 ·2 = 10-2 mol/cm3
pH = 2
Bufory - mieszaniny mające zdolność przeciwdziałania zmianom pH. Składają się ze słabych kwasów lub słabych zasad i ich soli.
Wskaźniki (indykatory) - słabo zdysocjowane kwasy lub zasady organiczne, których jony wykazują odmienne zabarwienie niż niezdysocjowane cząsteczki.
• Hydroliza soli mocnych kwasów i słabych zasad,
np. NH4Cl ( NH4OH i HCl)
NH4Cl + H2O = NH4OH + H+ + Cl-
NH4+ + Cl- + H2O = NH4OH +H+ + Cl-
NH4+ +H2O = NH4OH + H+
Powstaje słaba zasada (w niewielkim stopniu zdysocjowana na jony), odczyn roztworu jest kwaśny (pH<7)
•Hydroliza soli słabych kwasów i mocnych zasad, np. CH3COONa
CH3CONa + H2O = CH3COOH + Na+ + OH-
CH3COO- + Na+ + H2O = CH3COOH + Na+ + OH
CH3COO- + H2O = CH3COOH + OH
Powstaje słaby kwas, odczyn otrzymanego roztworu jest zasadowy (pH > 7).
•Hydroliza soli słabych kwasów i słabych zasad, np. CH3COONH4
CH3COONH4 + H2O = CH3COOH + NH4OH
Powstaje słaby kwas i słaba zasada.
CHEMIA ORGANICZNA
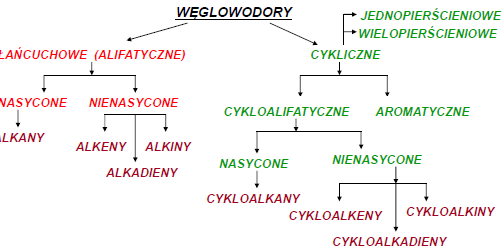
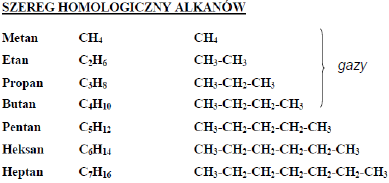
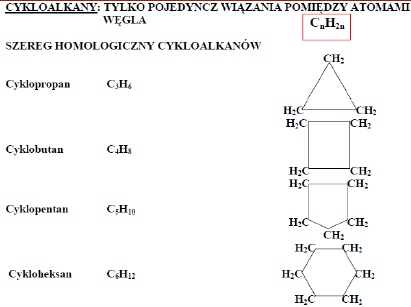
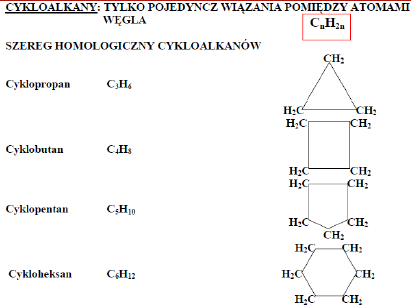
Alkany
Właściwości:
•Mało aktywne chemicznie •Niepolarne •Lżejsze od wody •Rozpuszczają się w rozpuszczalnikach niepolarnych (alkohol, benzen, toluen) •Źle rozpuszczają się w rozpuszczalnikach polarnych (woda, kwasy, zasady) •Ze wzrostem długości łańcucha węglowego zwiększa się temperatura topnienia i wrzenia •Wszystkie ulegają reakcji spalania. •Zastosowanie: paliwa gazowe, benzyna, oleje napędowe
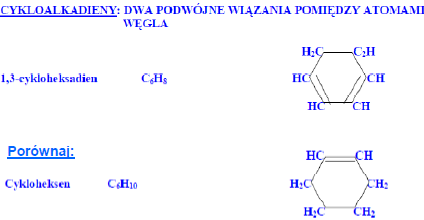
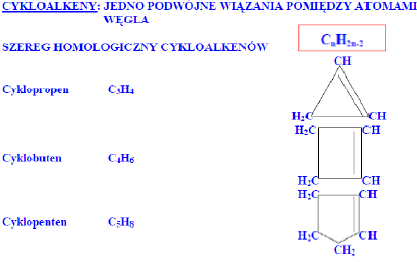
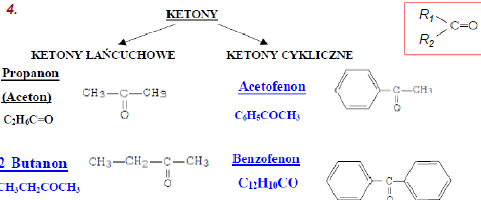
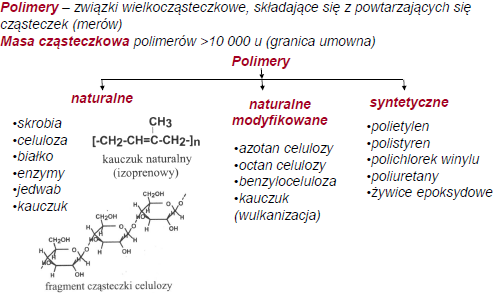

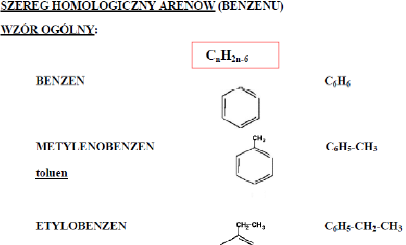
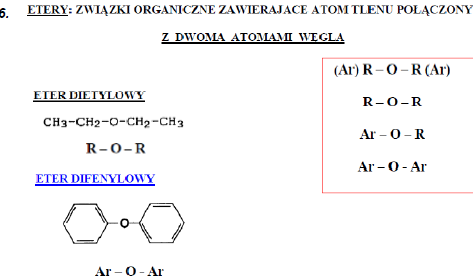

1
1
6
5
4
3
2
4
2
Wyszukiwarka
Podobne podstrony:
chemia studia 1 kolo, Studia - Mechatronika PWR, Chemia (Irena Zubel)
chemia sciaga kolo I, Studia PG, Semestr 02, Chemia, Koło
ściąga chemia, Studia PG, Semestr 02, Chemia, Koło
chemia pytania kolo 1
CHEMIA~7, Studia, Politechnika
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
chemia, poprawa I kolo, Adsorpcja apolarna- zachodzi ona wówczas gdy czasteczka związku jest adsobow
Chemia-zag kolo-TwMet
Chemia wykłady, koło II sem v.3.0, Izomeria optyczna
CHEMIA ROLNA 2 KOLO, niezbędnik rolnika 2 lepszy, chemia rolna
Kolokwium 3 1999 2000, Chemia, studia PRz, Kataliza
Chemia1-3, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
Kolokwium 2 1999 2000, Chemia, studia PRz, Kataliza
chemia k-2, Studia, Chemia, chemia7
CHEMIA ROLNA 7 KOLO, SGGW
Chemia 2, STUDIA
odpowiedzi chemia 2, Studia PWr W-10 MBM, Semestr II, Chemia, Chemia, Chemia, chemia
więcej podobnych podstron