
1
Wydział Inżynierii Materiałowej i Ceramiki
Akademii Górniczo-Hutniczej w Krakowie
Materiały pomocnicze do zajęć seminaryjnych z przedmiotu
„CHEMIA ORGANICZNA”
kierunek: Inżynieria materiałowa
część II
Opracowanie:
dr inż. Edyta Stochmal
dr hab. inż. Magdalena Hasik
Kraków 2009

2
SPIS TREŚCI
Str.
1. Analiza elementarna związków organicznych ...................................... 3
2. Spektroskopowe metody badań związków organicznych:
spektroskopie IR oraz
1
H NMR ........................................................... 4
3. Położenia pasm w widmach IR wybranych związków organicznych ... 13
4. Położenia sygnałów w widmach
1
H NMR wybranych
związków organicznych ........................................................................ 14

3
ANALIZA ELEMENTARNA ZWIĄZKÓW ORGANICZNYCH
1. Oblicz udziały procentowe każdego z pierwiastków w wymienionych związkach
organicznych:
a)
etan CH
3
CH
3
b)
chloroform CHCl
3
c)
etanol C
2
H
5
OH
d)
kwas octowy CH
3
COOH
e)
kwas acetylosalicylowy (aspiryna) C
9
H
8
O
4
f)
anilina C
6
H
5
NH
2
g)
kwas sulfanilowy C
6
H
7
NO
3
S
h)
aceton CH
3
C(O)CH
3
i)
penicylina C
16
H
18
N
2
O
4
S
2. Podaj wzory empiryczne związków organicznych, w których na podstawie analizy
elementarnej wykryto następujące zawartości procentowe pierwiastków:
a) 61,00% C,
11,88% H,
27,12% O;
b) 40,40% C,
6,67% H,
52,93% O;
c) 46,60% C,
8,80% H,
31,00% O,
13,60% N;
d) 61,00% C,
15,25% H,
23,75% N;
e) 39,34% C, 8,20% H, 52,46% S;
f) 41,30% C,
5,35% H, 10,70% N,
24,40% S,
reszta to tlen.
3. Oblicz procentową zawartość węgla i wodoru w związku organicznym, jeśli wiadomo, że
w wyniku spalenia 0,171 g tego związku otrzymuje się 0,264 g dwutlenku węgla i 0,099 g
wody.
4. Określ wzór empiryczny substancji organicznej, wiedząc, że po spaleniu 0,608 g tej
substancji otrzymuje się 1,540 g dwutlenku węgla, 0,363 g wody oraz 112 ml azotu
(objętość mierzona w warunkach normalnych
)
.
5. W wyniku spalenia 21 g pewnego związku organicznego zawierającego węgiel, wodór
i siarkę otrzymano 9,0 g H
2
O, 22,4 dm
3
CO
2
i pewną ilość SO
2
. Podaj wzór sumaryczny
tego związku.
6. W wyniku spalenia 1,08 g pewnego związku organicznego otrzymano 2,11 g CO
2
i 1,08 g
H
2
O. Ustal: skład procentowy tego związku, wzór elementarny, wzór rzeczywisty
(wiedząc, że wyznaczona eksperymentalnie masa molowa związku wynosiła 90 g/mol)
oraz zaproponuj możliwe wzory strukturalne (6 możliwości). Jakiego typu izomerami są
względem siebie te związki?
7. Odważono dwie próbki substancji badanej, każdą o masie 0,724 g. Po spaleniu pierwszej
z nich otrzymano 1,137 g CO
2
i 0,155 g H
2
O. W drugiej oznaczono azot, który w wyniku
j)
eter dietylowy (C
2
H
5
)
2
O
k) metyloamina CH
3
NH
2
l) toluen C
6
H
5
CH
3
m) bromobenzen C
6
H
5
Br
n) mocznik (H
2
N)
2
C=O
o) metanal HCHO
p) kwas szczawiowy (COOH)
2
r) alkohol benzylowy C
6
H
5
CH
2
OH
s) benzofenon (C
6
H
5
)
2
C=O
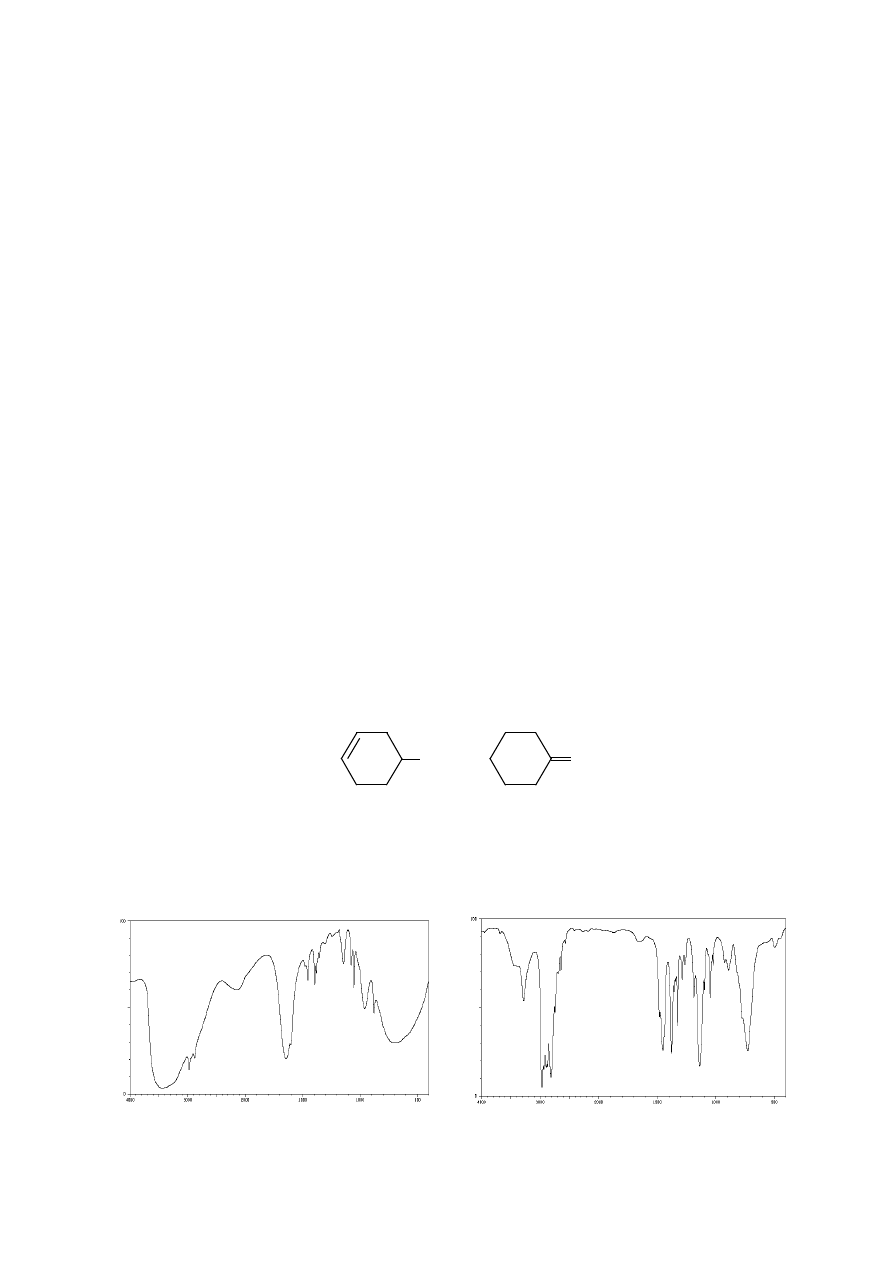
4
reakcji wydzielił się w stanie wolnym, zajmując objętość 96,46 cm
3
(w przeliczeniu na
warunki normalne). Oblicz: wzór elementarny, wzór rzeczywisty (wiedząc, że oznaczona
eksperymentalnie masa molowa tego związku wynosi 168,0 g/mol) i zaproponuj możliwe
wzory strukturalne związków o obliczonym wzorze (3 możliwości). Jakiego typu
izomerami są względem siebie te związki?
8. Na podstawie wyników analizy elementarnej ustalono skład procentowy badanej
substancji: 62% C, 10,4% H, 27,6% O. Ustal: wzór elementarny, wzór rzeczywisty, jeśli
masa molowa tego związku wynosi 58,1 g/mol oraz możliwe wzory strukturalne
(maksymalnie 9 możliwości). Jakiego typu izomerami są względem siebie te związki?
9. Zawartość procentowa węgla w alkoholu jednowodorotlenowym A wynosi 52,174%,
w kwasie jednokarboksylowym B 88,852%, a w estrze alkoholu A i kwasu B 72,000%.
Masa molowa kwasu jest o 76 g/mol większa od masy molowej alkoholu. Ustal wzory
sumaryczne alkoholu, kwasu i estru oraz zaproponuj ich wzory strukturalne.
SPEKTROSKOPOWE METODY BADAŃ ZWIĄZKÓW
ORGANICZNYCH: SPEKTROSKOPIE IR ORAZ
1
H NMR
10. Co to jest liczba falowa, w jakich jednostkach się ją wyraża i jaki jest jej związek
z długością fali?
11. Widma IR izomerycznych związków A i B o wzorze sumarycznym C
6
H
10
O zawierają
następujące pasma charakterystyczne: związek A 1710 cm
-1
, związek B 3350 cm
-1
oraz
1070 cm
-1
. Którą z poniższych struktur można przypisać związkowi A, a którą związkowi
B? Podaj nazwy systematyczne obu związków.
12. Poniżej przedstawiono widma IR etyloaminy (a) oraz dietyloaminy (b) Przypisz
występujące w nich pasma drganiom odpowiednich fragmentów cząsteczek. Jaka jest
istotna różnica między tymi widmami w zakresie 3500 – 3300 cm
-1
?
O
OH
a)
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
b)
T
ra
n
s
m
it
a
n
c
ja
[
%
]
Liczba falowa [cm
-1
]
5
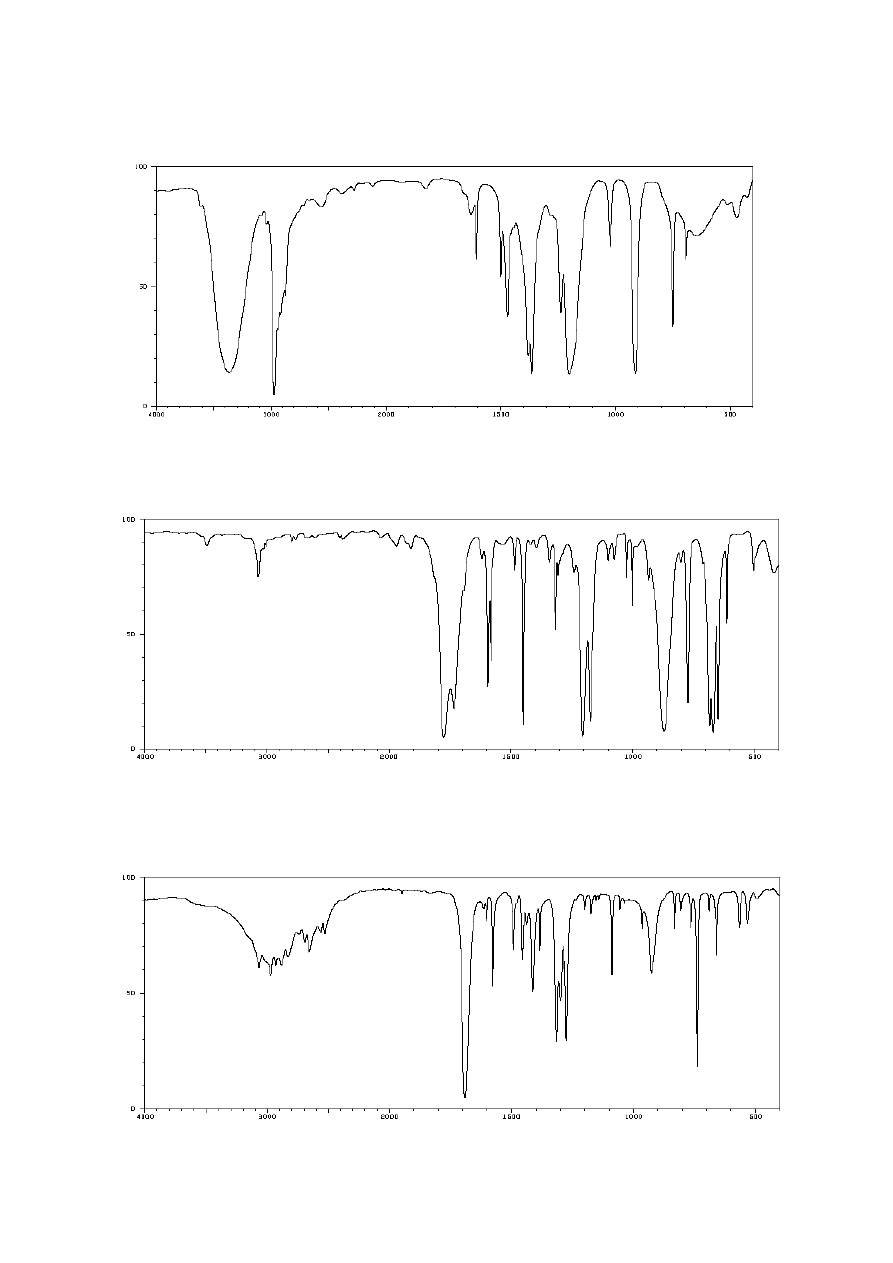
13. Poniżej przedstawiono widmo IR 2-metylopropan-2-olu (alkoholu tert-butylowego).
Przypisz występujące w nim pasma drganiom odpowiednich fragmentów cząsteczki.
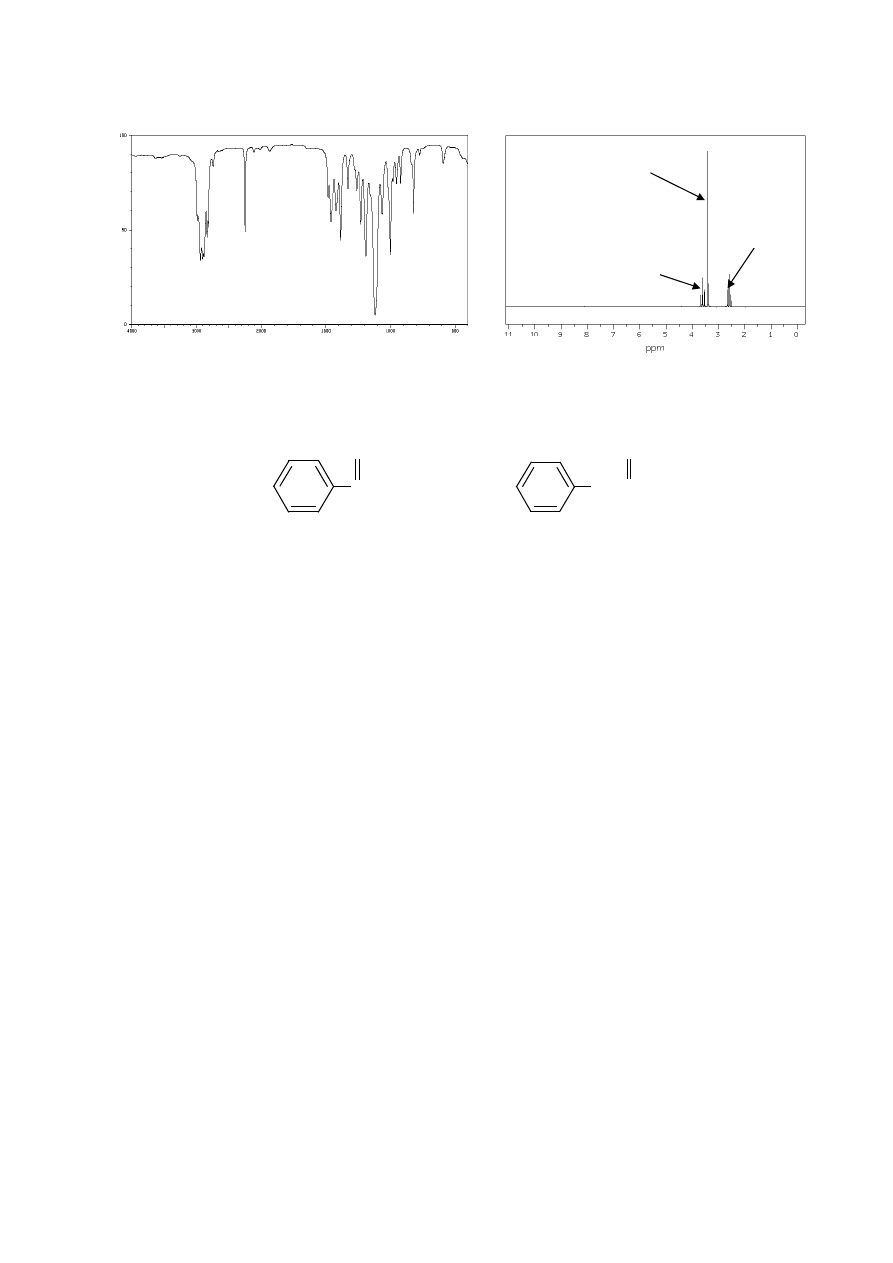
14. Poniżej przedstawiono widmo IR chlorku benzoilu. Przypisz występujące w nim pasma
drganiom odpowiednich fragmentów cząsteczki.
15. Poniżej przedstawiono widmo IR kwasu o-metylobenzoesowego. Przypisz występujące
w nim pasma drganiom odpowiednich fragmentów cząsteczki.
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
Liczba falowa [cm
-1
]
6
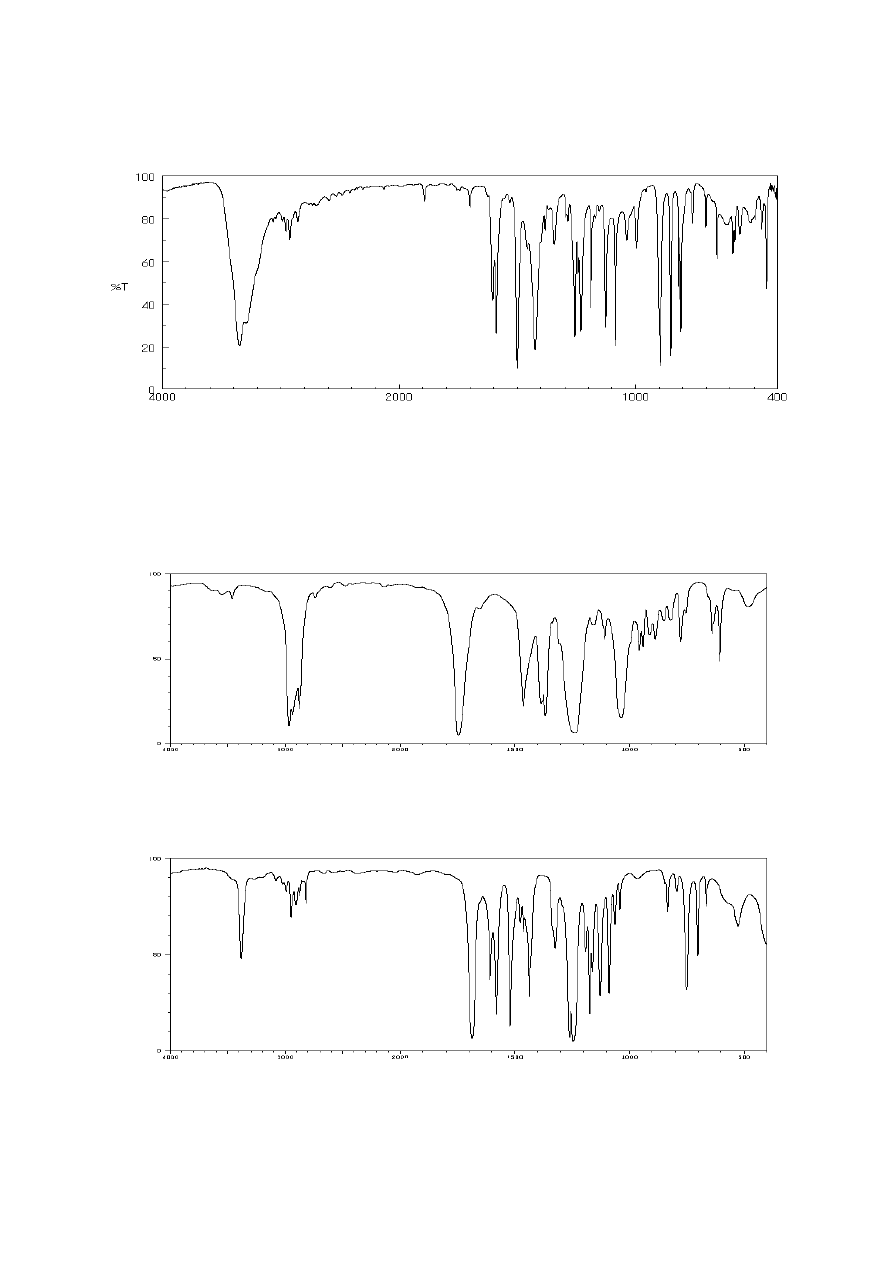
16. Poniżej przedstawiono widmo IR 5-chloro-2-metylofenolu. Przypisz występujące w nim
pasma drganiom odpowiednich fragmentów cząsteczki.
17. Na podstawie analizy przedstawionych widm IR odpowiadających związkom
organicznym o podanych wzorach sumarycznych wskaż, jakie elementy strukturalne
(grupy funkcyjne) wchodzą w skład tych związków.
a) wzór sumaryczny: C
8
H
16
O
2
b) wzór sumaryczny: C
9
H
11
O
2
N
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
Liczba falowa [cm
-1
]
Liczba falowa [cm
-1
]
7
c) wzór sumaryczny: C
8
H
9
ON
d) wzór sumaryczny: C
8
H
6
O
2
N
2
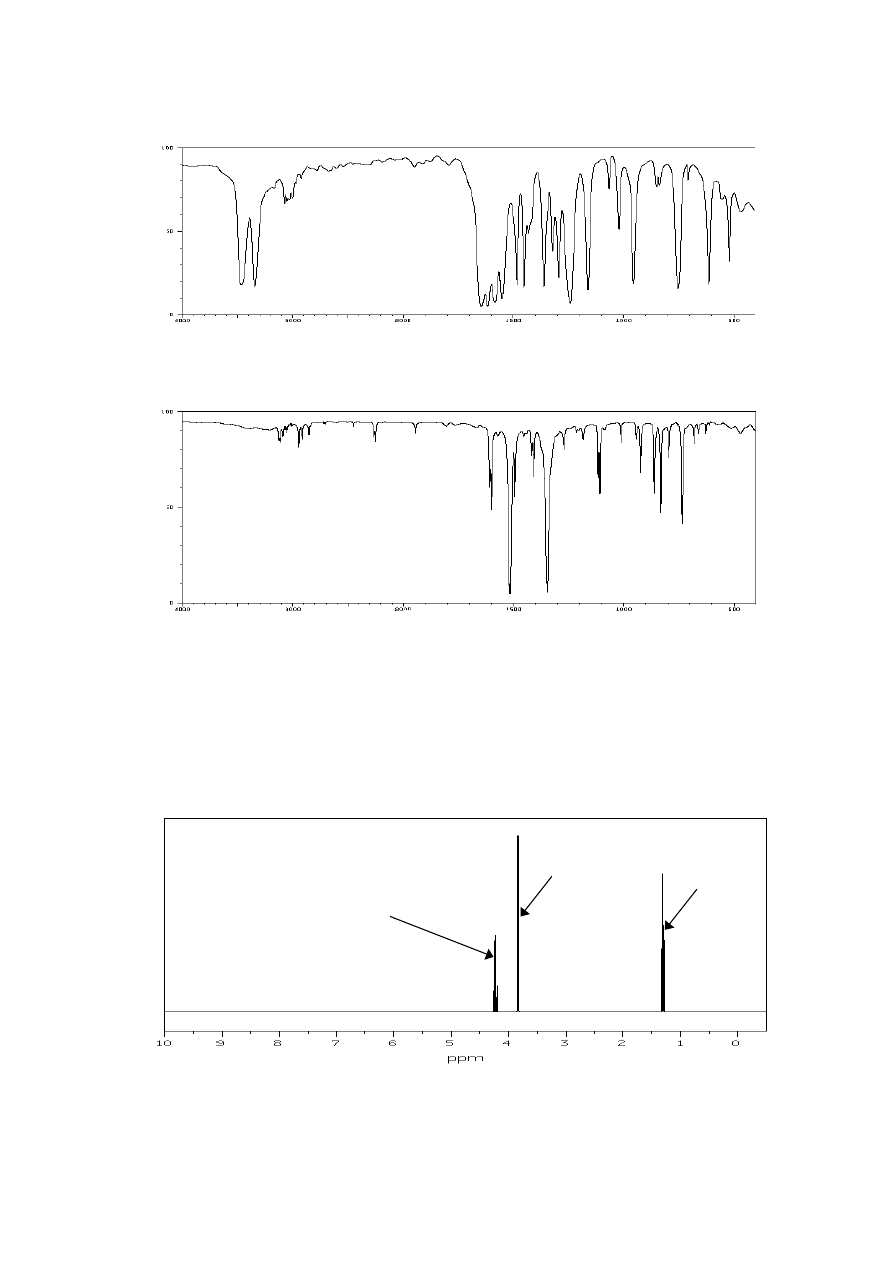
18. Co to jest przesunięcie chemiczne? W jaki sposób można je wyrażać?
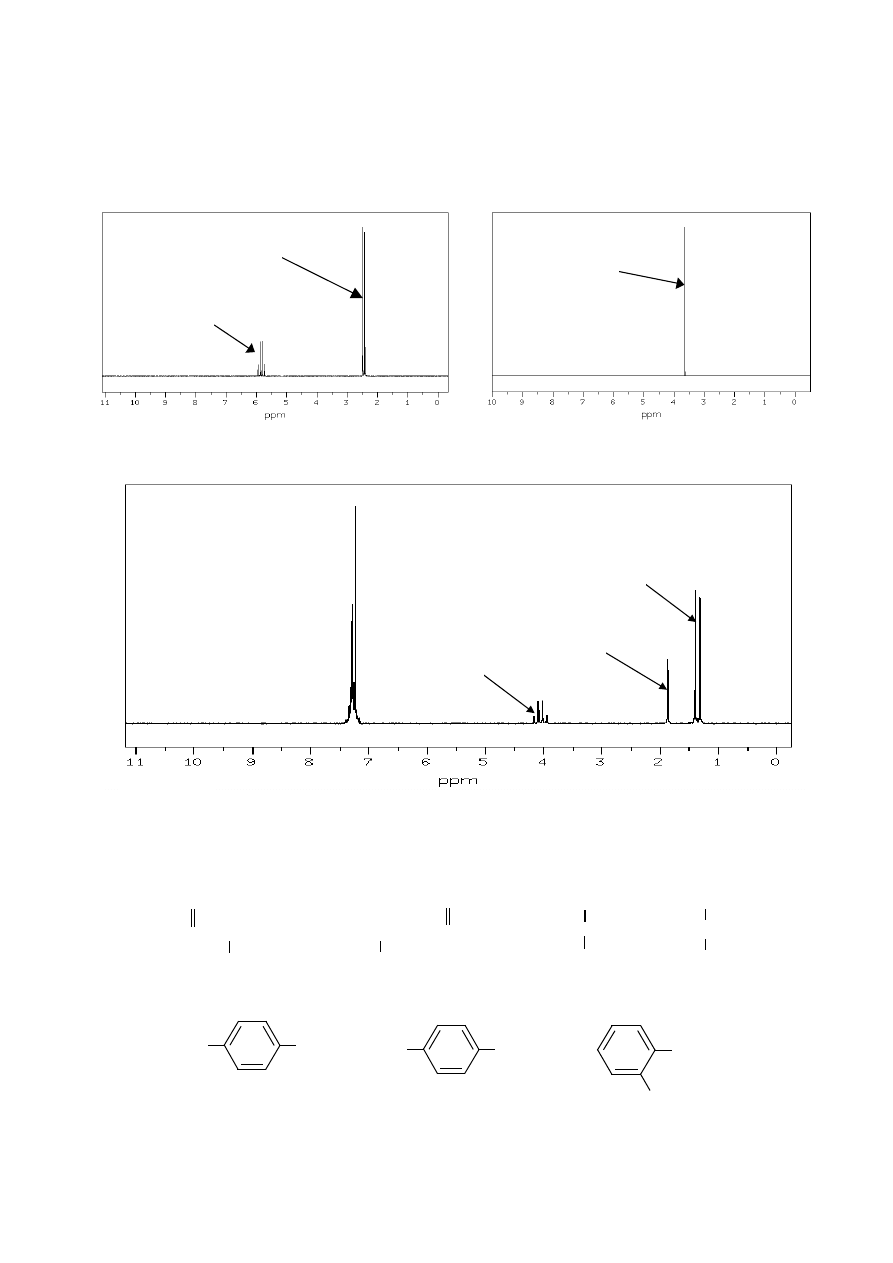
19. Poniżej przedstawiono widmo
1
H NMR bromooctanu etylu. Przypisz występujące w nim
sygnały odpowiednim atomom wodoru cząsteczki tego estru, wyjaśnij przyczynę poja-
wienia się multipletów i określ, jakie są stosunki intensywności grup sygnałów w widmie.
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
kwartet
singlet
tryplet
8
20. Widma
1
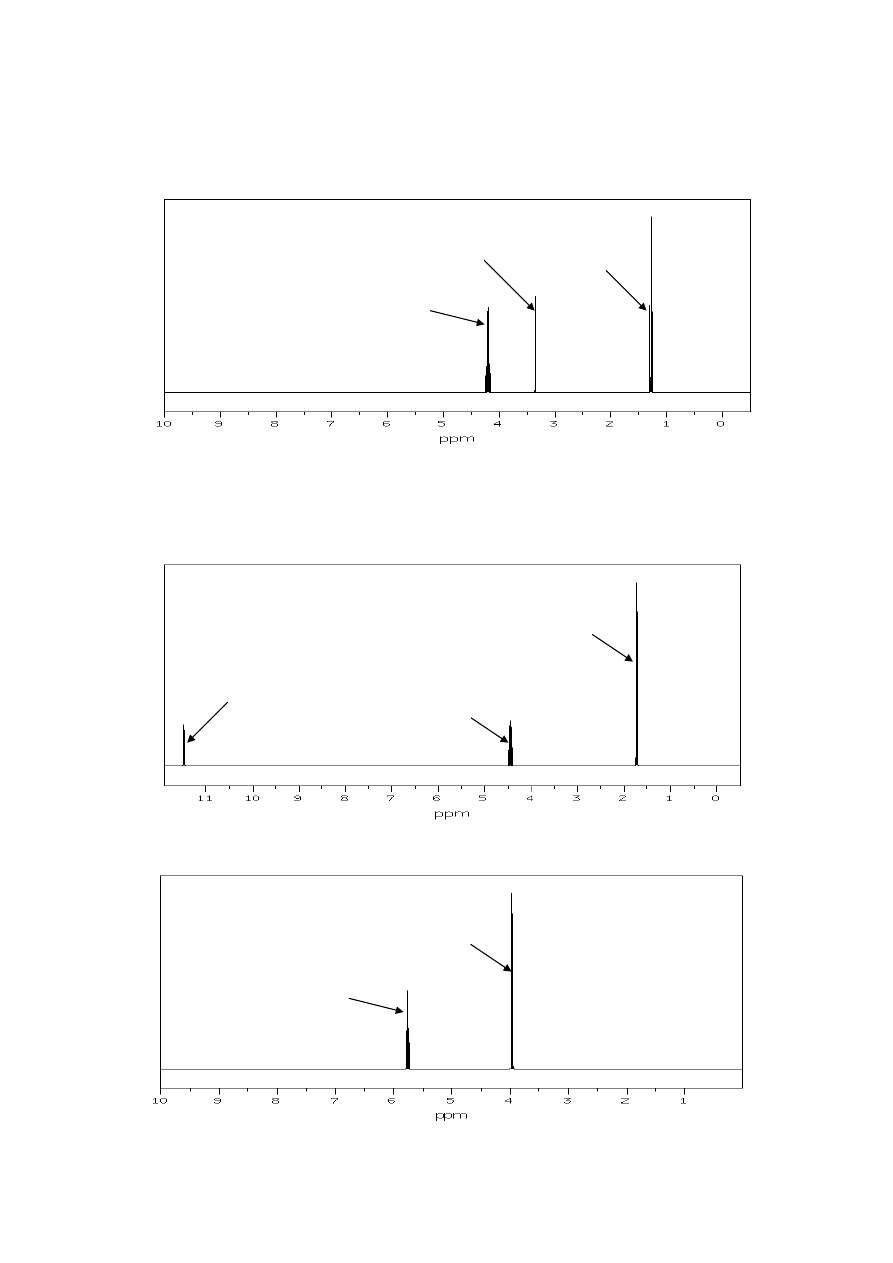
H NMR oznaczone literami a) i b) odpowiadają dwóm izomerom dibromoetanu.
Zaproponuj strukturę tych izomerów, przypisz sygnały występujące w widmach
odpowiednim atomom wodoru ich cząsteczek, wyjaśnij przyczynę pojawienia się
multipletów i określ, jakie są stosunki intensywności grup sygnałów w widmie.
21. Poniżej przedstawiono widmo
1
H NMR (1-aminoetylo)benzenu. Przypisz występujące
w nim grupy sygnałów odpowiednim atomom wodoru cząsteczki.
22. Ile sygnałów (lub grup sygnałów) będą zawierały widma
1
H NMR przedstawionych
związków? Które z tych sygnałów będą multipletami?
kwartet
tryplet
singlet
a)
b)
CH
3
-C-O-CH-CH
3
CH
3
O
CH
3
-CH-CH
2
-C-O-CH
3
CH
3
O
Br-C-Br
CH
3
CH
3
CH
3
-C-N(CH
3
)
2
OCH
3
OCH
3
NO
2
O
2
N
NO
2
Br
NO
2
NO
2
a)
b)
c)
d)
d)
e)
f)
kwartet
singlet
dublet
9
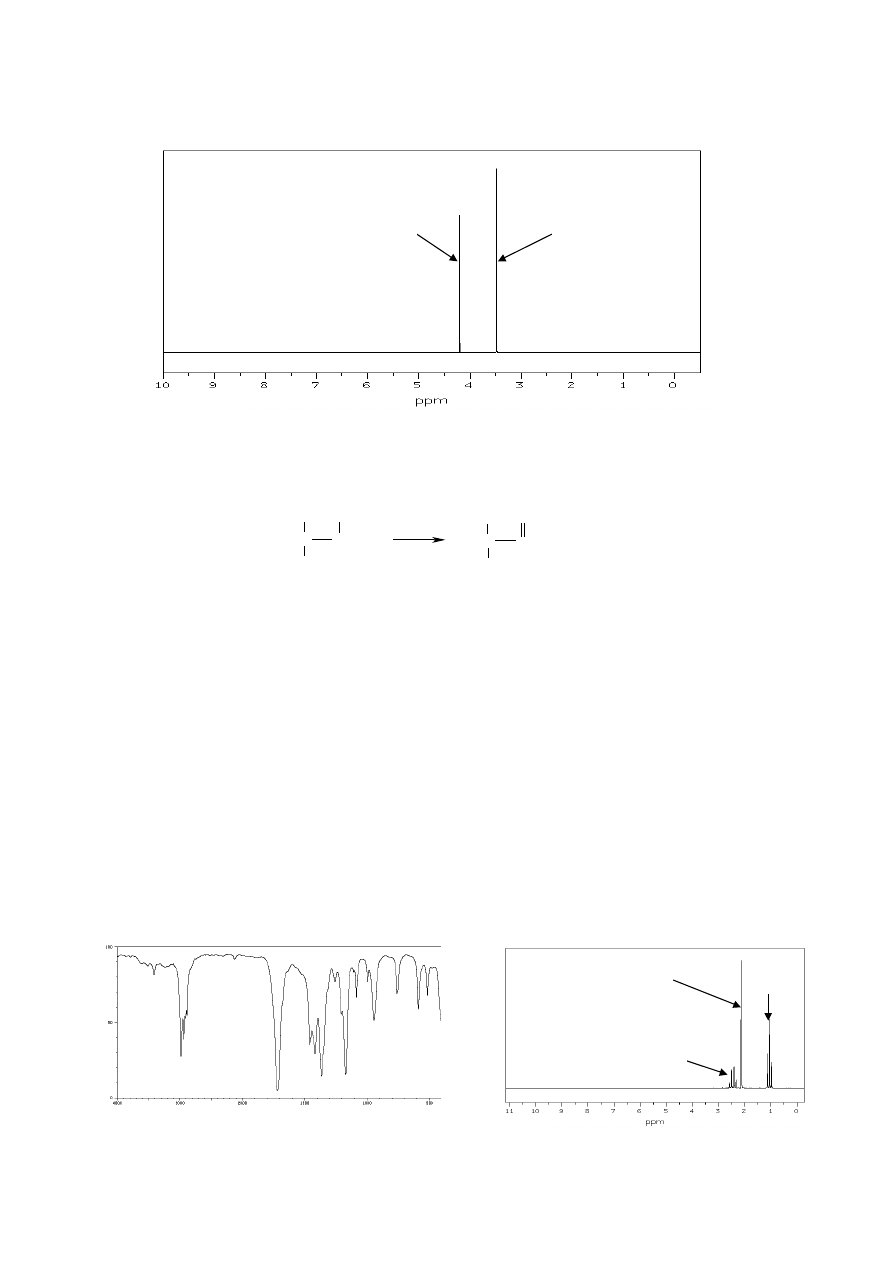
23. Poniżej przedstawiono widmo
1
H NMR malonianu dietylu, tj. estru o wzorze
CH
2
(COOC
2
H
5
)
2
. Przypisz występujące w nim sygnały odpowiednim atomom wodoru
cząsteczki tego estru, wyjaśnij przyczynę pojawienia się multipletów i określ, jakie są
stosunki intensywności grup sygnałów w widmie.
24. Na podstawie analizy przedstawionych widm
1
H NMR odpowiadających związkom
organicznym o podanych wzorach sumarycznych, zaproponuj strukturę tych związków.
a) wzór sumaryczny: C
3
H
5
ClO
2
b) wzór sumaryczny: C
2
H
3
Cl
3
kwartet
singlet
dublet
tryplet
dublet
dublet
kwartet
singlet
10
c) wzór sumaryczny: C
3
H
5
ON
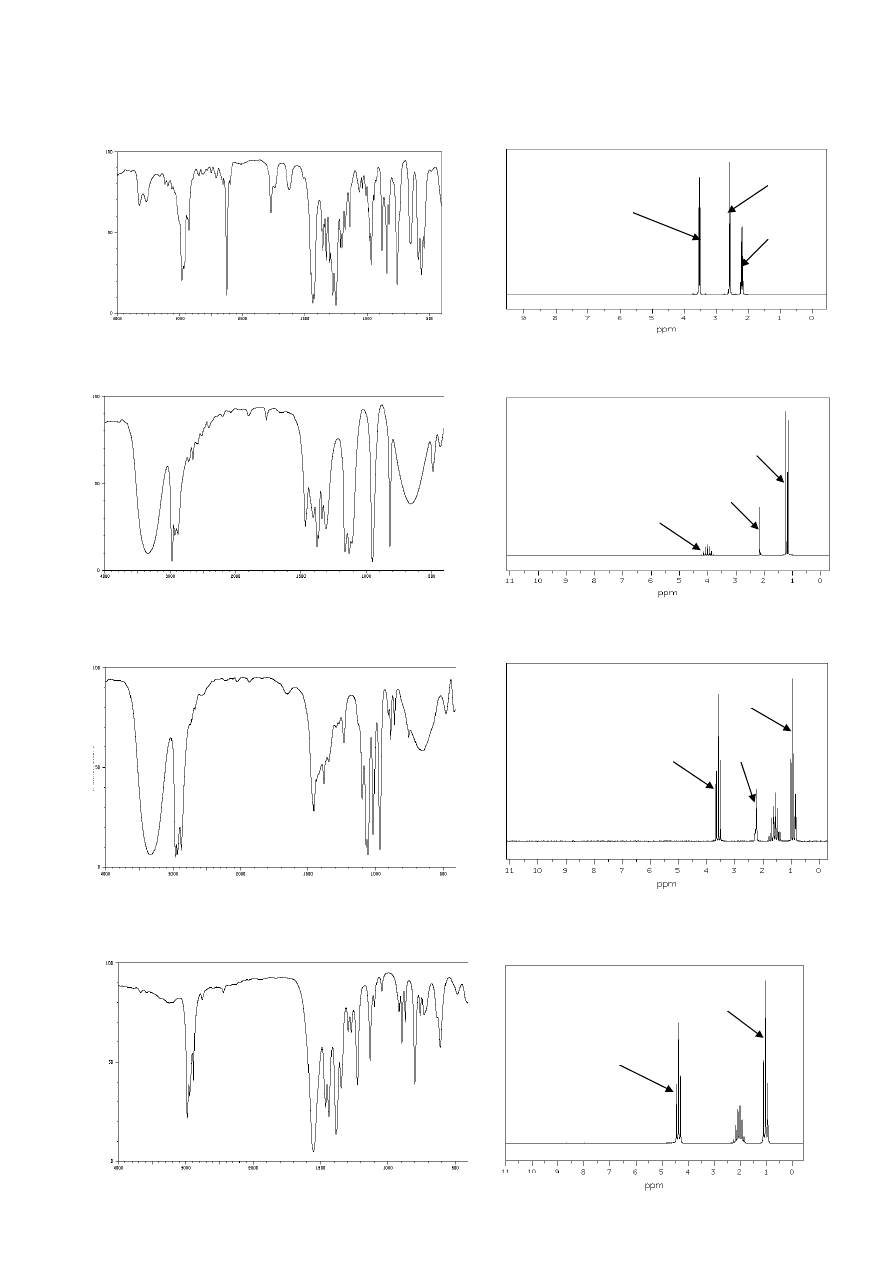
25. Na czym może polegać zastosowanie spektroskopii IR do śledzenia postępu
przedstawionej reakcji? Zaproponuj, ile grup sygnałów będą zawierały widma
1
H NMR
substratu i produktu tej reakcji – jaka będzie ich multipletowość i względna intensywność.
26. Zaproponuj, za pomocą jakiej metody spektroskopowej można w najprostszy sposób
rozróżnić związki w podanych parach:
a) pentan-2-on i pentan-3-on,
b) cykloheksanol i cykloheksanon,
c) eter dimetylowy i eter dietylowy,
d) mrówczan metylu i kwas octowy,
e) p-metylofenol i eter fenylowo-metylowy.
27. Na podstawie analizy przedstawionych widm IR oraz
1
H NMR odpowiadających
związkom organicznym o podanych wzorach sumarycznych, zaproponuj strukturę tych
związków.
a) wzór sumaryczny: C
6
H
8
O
singlet
singlet
CH
3
-C
CH
3
CH
3
CH-CH
3
OH
CH
3
-C
CH
3
CH
3
C-CH
3
O
kwartet
singlet
tryp-
let
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
11
b) wzór sumaryczny: C
4
H
6
BrN
c) wzór sumaryczny: C
3
H
8
O
d) wzór sumaryczny: C
3
H
8
O
e) wzór sumaryczny: C
3
H
7
O
2
N
2
tryplet
pentet
tryplet
singlet
dublet
heptet
tryplet
tryplet
singlet
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
tryplet
tryplet
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
12
f) wzór sumaryczny: C
3
H
5
ON
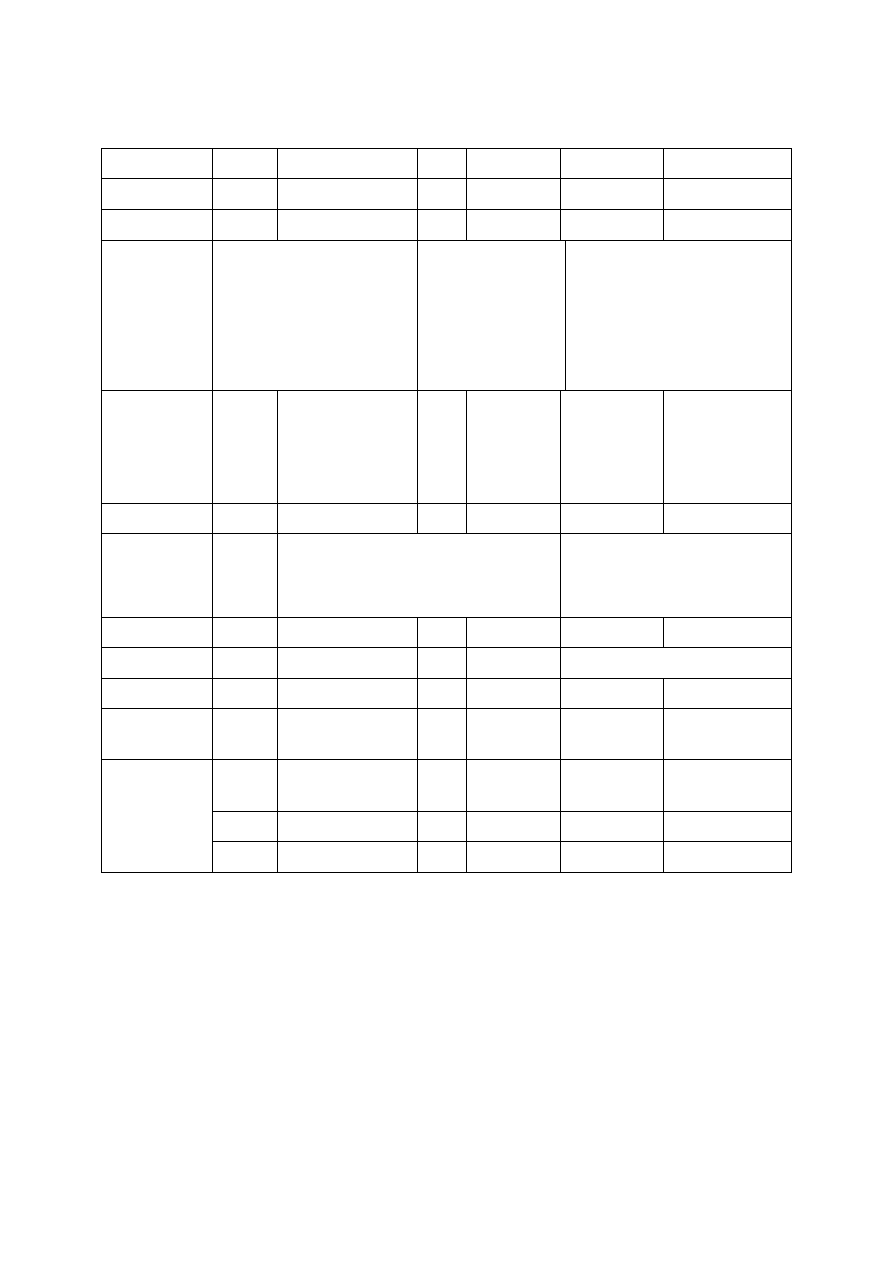
28. Zaproponuj sposób rozróżnienia dwóch izomerycznych związków A i B o podanych
wzorach za pomocą a) spektroskopii IR, b) spektroskopii
1
H NMR.
Liczba falowa [cm
-1
]
T
ra
n
s
m
it
a
n
c
ja
[
%
]
singlet
tryplet
tryplet
CH
2
C-OH
O
C-OCH
3
O
A
B
13
Położenia pasm (w cm
-1
) w widmach IR wybranych związków organicznych
Alkany
C-C
1800-1300
C-H 2960 -2850
Alkeny
C=C
1680-1640
C-H 3095-3010
Alkiny
C
≡
C
2300-2100
C-H
~3300
Pierścień
aromatyczny
grupa pasm 1600-1400
C-H
1-podstawiony
o-dipodstawiony
m-dipodstawiony
p-dipodstawiony
~3300
770-730, 710-690
770-735
850-810, 710-690
840-810
Alkohole
i kwasy
karboksylowe
OH
alkohole:
szerokie 3600-
3300,
kwasy trochę
niżej
C-O 1250-1100
intensywne
Etery
-//-
-//-
Związki
karbonylowe
C=O
1850-1650 (ketony alifatyczne:
~1715, ketony aromat. ~1690,
aldehydy: ~1740, halogenki: ~1790,
kwasy:
~1710)
w aldehydach alifatycznych
zwykle C-H < 2800 cm
-1
Aminy
N-H
3500-3400
C-N 1600-1300
Amidy
-//-
-//-
-//-
-//-
C=O też obecne
Nitryle
C
≡
N
2260-2215
Związki
nitrowe
N-O
1650-1500
i 1390-1250
C-F
1400-1000
(intensywne)
C-Cl
750-700
Halogenki
C-Br
600-500

14
Położenia sygnałów (w ppm) w widmach
1
H NMR wybranych związków organicznych
alkilowy pierwszorzędowy R-CH
3
0,7-1,3
alkilowy drugorzędowy R-CH
2
-R
1,2-1,4
alkilowy trzeciorzędowy`R
3
C-H
1,4-1,7
allilowy: H-C-C=C
1,6-2,2
winylowy (alkenowy): H-C=C
4,6-5,9 (alkenowy do 7,9)
acetylenowy: H-C
≡
C
2-3
aromatyczny: Ar-H
6-8,5
benzylowy: Ar-C-H
2,3-3
chlorkowy: H-C-Cl
3-4
bromkowy: H-C-Br
2,5-4
alkoholowy: H-C-OH
3,4-4
alkoholowy: H-C-OH
2,4-5
eterowy: H-C-OR
3,7-4,1
estrowy: H-COOR
2-2,2
kwasowy: H-COOH
2-2,6
karboksylowy: H-COOH
10,5-12
aldehydowy: RCHO
9-10
wodorotlenowy: R-OH
1-5,5
fenolowy: Ar-OH
4-12
aminowy: NH
2
1-5
α
-podstawiony aromatyczny Ar-CH
3
2,5-2,7
α
-podstawiony ketonem –C(O)-CH
3
2,1-2,4
β
-monopodstawiony H-C-C-Y
2-5
β
-dipodstawiony H-C-C(Z)-Y
2,5-7
Wyszukiwarka
Podobne podstrony:
Materialy do seminarium inz mat 09 10 czesc III
Materialy do seminarium inz mat 09 10 czesc III
Materialy do seminarium inz mat 09 10 czesc III
Materialy do seminarium inz mat Nieznany
LP V sem, do uczenia, materialy do nauczania, rok2010-2011, 09.10.2010, upowszechnianie informacji
Materialy do seminarium IM 2009 10 czesc I
Materialy do seminarium IM 2009 10 czesc I
4 konta ksiegowe cwiczenia, Semestr V, Finanse i Rachunkowosc, Wyklady i materialy do seminarium
Materialy do seminarium tech chem 13 14 id 284873
arkusz kalkulacny technilogia V sem zadanie2, do uczenia, materialy do nauczania, rok2010-2011, 23..
Sprawozdanie z ćwiczenia nr2, Polibuda, studia, Inżynieria Materiłowa, spr, sprawozdania inz mat, s
tworzenie bazy danych, do uczenia, materialy do nauczania, rok2010-2011, 24.10.2010, baza danych
MATERIAŁ DO PRACY NAMBER 3 Z DN( 11 10
niemiecki materiały do egzaminu, abc1 uebungen 09
4 konta ksiegowe cwiczenia, Semestr V, Finanse i Rachunkowosc, Wyklady i materialy do seminarium
akumulator do volkswagen polo 86c 09 10 11 13
Materialy do seminarium TCh 2011 12
więcej podobnych podstron