
PRACE NAUKOWO - BADAWCZE
50
PRZEGLĄD PAPIERNICZY · 68 · STYCZEŃ 2012
Wprowadzenie
Papier należy do materiałów technicznych, które są szcze-
gólnie wrażliwe na niszczącą aktywność mikroorganizmów,
przede wszystkim grzybów. Grzyby strzępkowe odpowiedzialne
za biodegradację papieru pojawiają się już na etapie produkcji,
a ich dalszy rozwój w gotowych produktach zależy od sposobu
przechowywania (1-3). W korozji mikrobiologicznej gotowych
wyrobów papierniczych biorą udział głównie mikroorganizmy,
które mają zdolność do hydrolizowania celulozy zawartej w pa-
pierze. Rozwój grzybów celulolitycznych w papierze powoduje
nie tylko zmiany na jego powierzchni, ale również zmienia che-
miczną i fizyczną strukturę papieru (4). Skutkiem tego procesu
może być całkowite zniszczenie materiału. Zarodniki grzybów są
wszechobecne i mogą pochodzić nie tylko z samego papieru, ale
również z otaczającego środowiska, przede wszystkim z powie-
trza. Zarodniki są mało wrażliwe na niesprzyjające środowisko
zewnętrze i mogą w tych warunkach przetrwać wiele lat. Wi-
doczne makroskopowo grzybnie mogą się rozwinąć nawet przy
niewielkiej wilgotności.
W celu ograniczenia rozwoju grzybów stosuje się mikrobiocydy,
substancje chemiczne o działaniu przeciwdrobnoustrojowym,
których właściwy dobór możliwy jest po określeniu mikroflory
dominującej w danym środowisku. Z przeprowadzonych do-
tychczas badań wynika, że każda postać morfologiczna pleśni
reaguje inaczej na działanie środków biobójczych (5). Nie bez
Zastosowanie mikrobiocydów alkiloamoniowych
w ochronie papieru przed grzybami
strzępkowymi
Applications of alkylammonium microbiocides
to protect paper materials against moulds
ANNA KOZIRÓG, BEATA GUTAROWSKA, BOGUMIŁ BRYCKI
W artykule przedstawiono wyniki badań skuteczności mikrobiocydów
alkiloamoniowych ograniczających populację grzybów strzępkowych
o właściwościach celulolitycznych, powodujących biodegradację
wyrobów papierniczych.
Słowa kluczowe: biocydy, ochrona papieru, grzyby strzępkowe
The article provides results of biocidal efficacy of alkylammonium
microbiocides against cellulite fungi which are responsible for bio-
degradation of paper materials.
Keywords: biocides, paper protection, moulds
Dr A. Koziróg, dr hab. B. Gutarowska, Instytut Technologii Fermentacji
i Mikrobiologii, Wydział Biotechnologii i Nauk o Żywności, Politechnika
Łódzka, 90-924 Łódź ul. Wólczańska 171/173; Prof. UAM dr hab. B. Brycki,
Pracownia Chemii Mikrobiocydów, Wydział Chemii, Uniwersytet im. Adama
Mickiewicza, 60-780 Poznań, ul. Grunwaldzka 6
e-mail: anna.kozirog@p.lodz.pl, gustaw@p.lodz.pl, brycki@amu.edu.pl
znaczenia pozostaje także wiek szczepu. Szczepy młode są
bardziej wrażliwe na działanie mikrobiocydów, w porównaniu
do szczepów dojrzałych, które pozostają na powierzchni papieru
w formie konidiów (6). Dlatego też, przed wyborem odpowied-
niego preparatu biobójczego, istotne jest stwierdzenie, jaka
mikroflora występuje w miejscu przeznaczonym do dezynfekcji.
Stosowanie mikrobiocydów w odpowiednim stężeniu i czasie dla
konkretnej mikroflory i danego środowiska powoduje inaktywację
i skuteczne zniszczenie drobnoustrojów. Zły dobór związków
chemicznych może prowadzić nie tylko do tego, że proces dezyn-
fekcji staje się nieskuteczny, ale co więcej, w dezynfekowanym
obszarze mogą pojawić się formy oporne, które przystosowały
się do tych warunków.
Celem przeprowadzonych badań była identyfikacja grzybów
strzępkowych wyizolowanych z pomieszczeń bibliotecznych
w Polsce, ocena ich właściwości celulolitycznych oraz okre-
ślenie wrażliwości na mikrobiocydy przygotowane na bazie soli
alkiloamoniowych.
Część doświadczalna
Identyfikacja grzybów strzępkowych i ich uzdolnienia ce-
lulolityczne
Badane szczepy grzybów strzępkowych wyizolowano z różnych
pomieszczeń i zbiorów bibliotecznych w Polsce. Diagnostykę
grzybów przeprowadzono na podłożu Czapek (firmy Merck)
i podłożu naturalnym – brzeczce (5°Blg) porównując cechy
makro- i mikroskopowe wyizolowanych gatunków z kluczami
diagnostycznymi (7).
Ocenę właściwości celulolitycznych określono na podłożu
o pH=6,4 z dodatkiem celulozy jako jedynego źródła węgla.

PRACE NAUKOWO - BADAWCZE
51
PRZEGLĄD PAPIERNICZY · 68 · STYCZEŃ 2012
Podłoże na płytkach Petriego szczepiono mikroorganizmami
punktowo, inkubowano w temperaturze 27°C. Po 48 i 168 go-
dzinach inkubacji, w celu sprawdzenia efektu hydrolizy celulozy
przez badane gatunki grzybów strzępkowych, powierzchnię pod-
łoża zalano płynem Lugola i obserwowano strefy przejaśnienia
wokół kolonii.
Ocena skuteczności działania mikrobiocydów metodą dy-
fuzyjną
Do oceny wybrano pięć najbardziej aktywnych celuloli-
tycznie szczepów. Zastosowano pięć preparatów na bazie
czwartorzędowych soli alkiloamoniowych, poliamin alkilowych
i sekwestrantów, które przygotowano w Pracowni Chemii Mi-
krobiocydów Uniwersytetu im. Adama Mickiewicza w Poznaniu.
Skład mikrobiocydów podano w tabeli 1. Każdy preparat przy-
gotowano w stężeniach 0,8; 0,4; 0,1; 0,05 i 0,01 μl/ml. Wartości
minimalnych stężeń hamujących wzrost drobnoustrojów (MIC)
wyznaczono metodą dyfuzyjną.
Tabela 1. Substancje czynne w mikrobiocydach wykorzystywanych w ba-
daniach
Substancje czynne
Oznaczenia mikrobiocydów/Zawartość
substancji czynnych (mg/g)
M-1
M-2
M-3
M-4
M-5
Chlorki tetraalkiloamoniowe
a
150
150
150
150
150
Poliaminy alkilowe
b
17
34
17
34
34
Sekwestranty
c
0
0
40
40
60
a)
5. generacja soli tetraalkiloamoniowych (mieszanina chlorków dialkilo-
dimetyloamoniowych (dioktylo, 25%; didecylo, 25%, oktylodecylo, 50%)
z chlorkiem benzalkoniowym (C
12
, 40%; C
14
, 50%; C
16
, 10%) (11)
b)
bis(N,N-aminopropylo)-N-alkilo(C
8
-
25%, C
12
- 50%, C
14
- 25%) amina
c)
PBTC, NTA
W pierwszym etapie przeprowadzono standaryzację inokulum
w celu uzyskania gęstości zarodników 10
6
jtk/ml. Kolejno na płytki
z pożywką MEA (firmy Merck) wprowadzono 0,1 ml zawiesiny
zarodników i rozprowadzono na całej powierzchni pożywki ste-
rylnym gładzikiem. Następnie w pożywce wycinano studzienki
średnicy 10 mm, do których wprowadzano przygotowane wcze-
śniej roztwory badanych preparatów. Tak przygotowane hodowle
inkubowano 48 godzin w temperaturze 27°C. Po tym czasie ob-
serwowano strefy zahamowania wzrostu grzybów strzępkowych
wokół studzienek. Wielkości strefy wyliczono wg wzoru:
gdzie:
X – wielkość strefy zahamowania wzrostu,
A – średnica strefy bez widocznego wzrostu,
B – średnica otworu wyciętego w pożywce, do którego wpro-
wadzono biocyd.
Omówienie wyników
Spośród wyizolowanych grzybów strzępkowych dominowały
dwa rodzaje – Aspergillus i Penicillium (rys. 1). Są to grzy-
by powszechnie występujące w środowisku, m.in. w glebie
i powietrzu, powodujące psucie żywności czy biodeteriorację
drewna i papieru. Ze względu na ich częstą obecność w różnych
pomieszczeniach magazynowych, nazywane są też „pleśniami
magazynowymi” (8). Wśród badanych pleśni z rodzaju Asper-
gillus zdiagnozowano 3 gatunki, a z rodzaju Penicillium – 7
gatunków.
Wyniki aktywności celulolitycznej wyizolowanych szczepów
przedstawiono w tabeli 2. Trzy spośród 22 izolatów nie wykazały
zdolności celulolitycznych – Alternaria tenussima i dwa gatunki
z rodzaju Mucor. Najwcześniej, po 2 dobach hodowli, zdolność
do rozkładu celulozy zaobserwowano u Chaetomium globosum
i Aspergillus flavus. Jednak największą aktywnością cechowały
się Aspergillus niger, Penicillium cyclopium i Chaetomium glo-
bosum, u których występowały największe strefy przejaśnienia
wokół kolonii.
Tabela 2. Gatunki grzybów strzępkowych wyizolowanych z badanych
bibliotek i ich aktywność celulolityczna
Rodzaj
Gatunek
Aktywność
celulolityczna
po 7 dniach
wyizolowanych grzybów strzępkowych
1 Aspergillus
A. niger
A. flavus
A. ochraceus
++
+
+
2 Penicillium
P. cyclopium
P. terrestre
P. purpurogenum
P. variable
P. notatum
P. virdicatum
P. albidum
++
+
+
+
+
+
+
3 Alternaria
A. tenussima
A. alternata
-
+
4 Cladosporium
C. herbarum
C. macrocarpum
+
+
5 Chaetomium
Ch. globosum
++
6 Mucor
M. hiemalis
M. racemosus
-
-
7 Acremonium
A. strictum
+
8 Fusarium sp.
+
Na podstawie przeprowadzonych badań wytypowano mikro-
florę dominującą, która charakteryzowała się uzdolnieniami ce-
lulolitycznymi. Do tej grupy należą: Aspergillus niger, Aspergillus
ochraceus, Chaetomium globosum, Penicillium terrestre i Peni-
cillium cyclopium. Powyższe drobnoustroje poddano działaniu
mikrobiocydów M-1 – M-5. W tabeli 3 przedstawiono wartości
minimalnych stężeń testowanych środków przeciwgrzybowych
wobec pięciu testowanych gatunków grzybów strzępkowych. Na
podstawie tych wyników określono wartości MIC, które zebrano
w tabeli 4.
Rys. 1. Rodzaje grzybów strzępkowych w zbiorach bibliotecznych w Polsce
(% całkowitej ilości wyizolowanych grzybów)
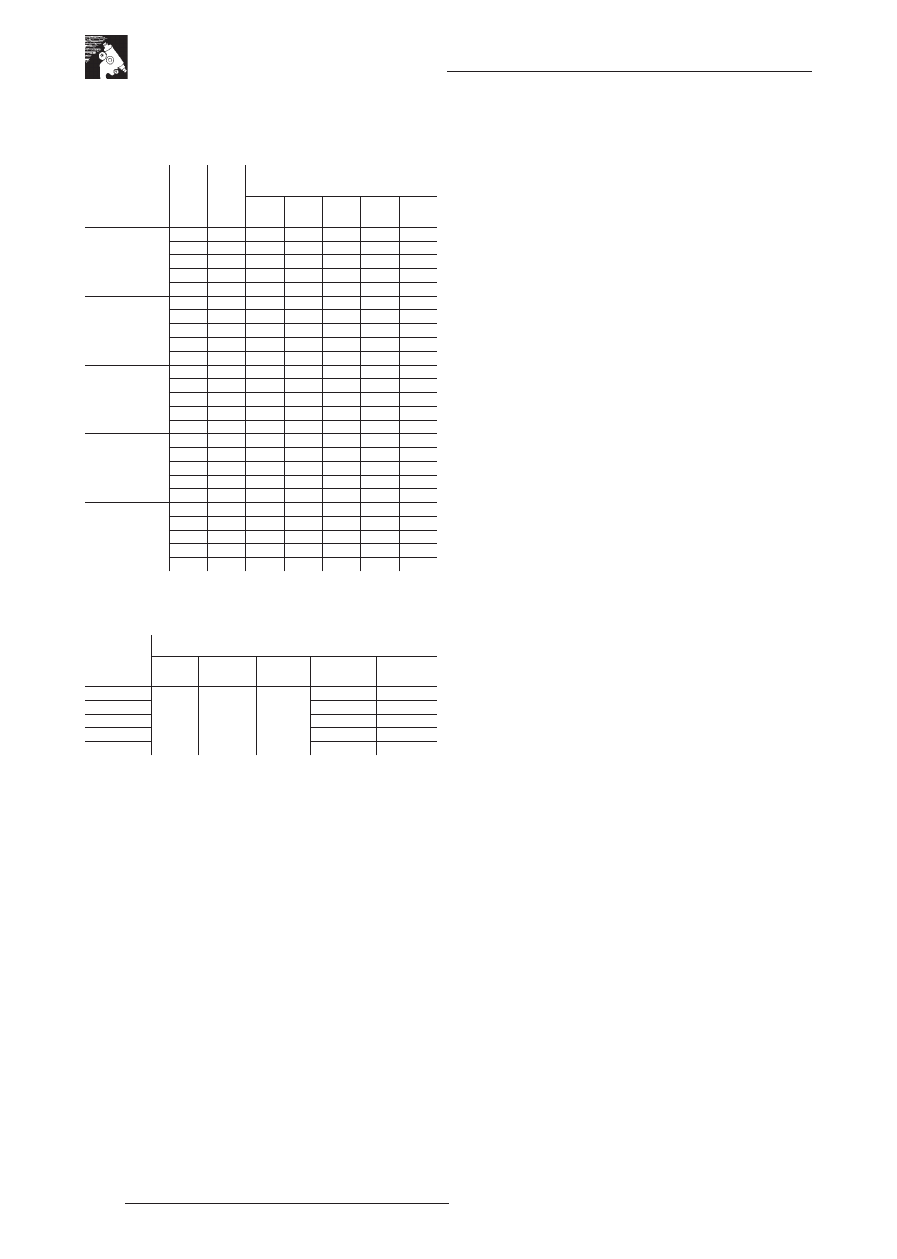
PRACE NAUKOWO - BADAWCZE
52
PRZEGLĄD PAPIERNICZY · 68 · STYCZEŃ 2012
Tabela 3. Wielkość stref zahamowania wzrostu grzybów strzępkowych
pozwalająca określić wartości minimalnych stężeń hamujących wzrost
Gatunki grzy-
bów strzępko-
wych
Ro-
dzaj
bio-
cydu
Kon-
trola
Stężenia mikrobiocydów [μl/ ml]
0,8
0,4
0,1
0,05
0,01
A.niger
M-1
0
15
13
6
0
0
M-2
0
17
14
12
0
0
M-3
0
16
15
9
0
0
M-4
0
18
13
11
0
0
M-5
0
20
18
15
0
0
A. ochraceus
M-1
0
15
13
7
0
0
M-2
0
16
12
12
0
0
M-3
0
15
13
8
0
0
M-4
0
18
15
13
0
0
M-5
0
18
15
13
0
0
Ch. globosum
M-1
0
15
14
8
0
0
M-2
0
17
14
12
0
0
M-3
0
15
13
9
0
0
M-4
0
20
14
12
0
0
M-5
0
20
14
12
0
0
P. terrestre
M-1
0
14
12
10
0
0
M-2
0
14
13
12
11
0
M-3
0
12
12
10
0
0
M-4
0
24
17
13
11
0
M-5
0
22
15
12
11
0
P. cyclopium
M-1
0
14
12
10
0
0
M-2
0
16
14
12
11
0
M-3
0
14
11
10
0
0
M-4
0
24
18
12
11
0
M-5
0
26
20
12
11
0
Tabela 4. Wartości minimalnych stężeń mikrobiocydów (MIC, μl/ml) hamu-
jących rozwój wybranych gatunków grzybów strzępkowych
Oznaczenia
biocydów
Gatunki grzybów strzępkowych
A.
niger
A. ochra-
ceus
Ch. glo-
bosum
P. terrestre
P. cyclo-
pium
M-1
0,1
0,1
0,1
0,1
0,1
M-2
0,05
0,05
M-3
0,1
0,1
M-4
0,05
0,05
M-5
0,05
0,05
Najskuteczniejsze w działaniu okazały się preparaty M-2, M-4
i M-5. Zastosowanie ich w stężeniu 0,05 μl/ml było wystarczające
do zahamowania wzrostu szczepów z rodzaju Penicillium. Dla
osiągnięcia tego samego efektu w przypadku środków biobój-
czych M-1 i M-3 wymagane jest użycie dwukrotnie większych
stężeń.
Najmniejszą wrażliwość na zastosowane mikrobiocydy
wykazywały grzyby Aspergillus niger, Aspergillus ochraceus
i Chaetomium globosum. Dla tych gatunków wartość MIC dla
wszystkich preparatów wynosiła 0,1 μl/ml. Stwierdzono, że
najskuteczniejszymi preparatami są mikrobiocydy M-4 i M-5
zawierające czwartorzędowe sole alkiloamoniowe w stężeniu 150
mg/g, poliaminy alkilowe w stężeniu 34 mg/g oraz sekwestranty.
Powyższe preparaty w stężeniu 0,8 μl/ml powodowały pojawienie
się największych stref zahamowania wzrostu.
Podsumowanie
Stwierdzono, że wśród zidentyfikowanych w środowisku biblio-
tecznym grzybów strzępkowych występuje duża różnorodność,
zarówno rodzajów, jak i gatunków, chociaż ponad 50% wszystkich
izolatów stanowią pleśnie z rodzaju Aspergillus i Penicillium.
Wymienione w tabeli 2 gatunki bardzo często występują na ma-
teriałach bibliotecznych, takich jak książki, papier i pergamin, co
potwierdzają wyniki uzyskane przez innych badaczy (9, 10).
Do najskuteczniejszych mikrobiocydów należą te, które
w swoim składzie zawierają oprócz czwartorzędowych soli
alkiloamoniowych również sekwestranty i poliaminy alkilowe
o podwyższonym stężeniu (34 mg/g). Wśród badanych grzybów
strzępkowych najbardziej wrażliwe okazały się szczepy z rodzaju
Penicillium.
Z przeprowadzonych badań wynika, że przed przeprowadze-
niem dezynfekcji należy określić rodzaj dominującej w danym
środowisku mikroflory i w stosunku do niej dobrać właściwe
mikrobiocydy. Odpowiedni rodzaj i stężenie preparatu biobójcze-
go pozwoli uniknąć pojawienia się szczepów opornych. Bardzo
dobra aktywność przeciwdrobnoustrojowa badanych preparatów
umożliwia ich praktyczne wykorzystanie jako inhibitorów biode-
terioracji papieru.
Serdeczne podziękowania składamy Pani prof. dr hab. Zofii
Żakowskiej z Instytutu Technologii Fermentacji i Mikrobiologii
za cenne wskazówki i dyskusje, które pozwoliły na powstanie
niniejszej pracy.
Pracę tę dedykujemy naszemu Koledze Zbyszkowi Pajewskie-
mu, który był łącznikiem między mikrobiologami i konserwato-
rami dzieł sztuki.
LITERATURA
1. Stobińska H., Zyska B.: „Papier – produkcja, wytwory papiernicze, ma-
teriały w zbiorach bibliotecznych”, [w] Praca zbiorowa: „Mikrobiologia
materiałów”, red. Zyska B., Żakowska Z., Wyd. Politechniki Łódzkiej,
Łódź 2005, s. 137-185.
2. Gutarowska B, Cichocka A.: „Ocena zanieczyszczenia mikrobiologicznego
mas papierniczych oraz wody technologicznej stosowanych w procesie
produkcji papieru”, Przegl. Papiern. 65, 9, 551 (2009).
3. Gutarowska B., Cichocka A.: „Zastosowanie metody oznaczania ergo-
sterolu do szybkiej oceny zanieczyszczenia grzybami na różnych etapach
produkcji papieru”, Przegl. Papiern. 66, 1, 45 (2010).
4. Pinzari F., Pasquariello G, De Mico A.: “Biodeterioration of Paper: A SEM
Study of Fungal Spoilage Reproduced Under Controlled Conditions”,
Macromolecular Symposia 238, 1, 57 (2006).
5. Koziróg A.: „Oporność grzybów strzępkowych na N,N-bis(3-aminopropylo)
dodecyloaminę”, Praca doktorska, Politechnika Łódzka 2006.
6. Koziróg A., Pajewski Z., Żakowska Z., Brycki B.: „Skuteczność działania
biocydów na grzyby strzępkowe rozwijające się na powierzchniach ma-
teriałów”, Ochrona przed Korozją 10s/A, 50, 95-98 (2007).
7. Samson R.A., Hoekstra E.S., Frisvad J.C., Filtenborg O.: “Introduction to
food and air borne fungi”, CBS Baarn, The Netherlands, 1996.
8. Piotrowska M., Żakowska Z.: „Grzyby strzępkowe” [w] Praca zbiorowa:
„Mikrobiologia techniczna”, red. Libudzisz Z., Żakowska Z., Kowal K.,
PWN, Warszawa 2007, s. 60-83.
9. Zyska B.: “Fungi Isolated from Library Materials. A Review of The Lit-
erature”, International Biodeterioration and Biodegradation 40, 1, 43-51
(1997).
10. Fabbri A.A., Ricelli A., Brasini S., Fanelli C.: “Effect of Different Antifungals
on the Control of Paper Biodeterioration Caused by Fungi”, International
Biodeterioration and Biodegradation 39, 1, 61-65 (1997).
11. Block S.S. (ed) 2001. Disinfection, Sterilization, and Preservation,
Lippincott Williams and Wilkins, 5th Edition, Philadelphia, USA.
Wyszukiwarka
Podobne podstrony:
Urządzenie do ochrony prosiąt przed przygnieceniami
Wprowadzenie do ochrony drewna przed korozją biologiczną
Wprowadzenie do ochrony drewna przed korozją biologiczną, Konstrukcje ciesielskie word
70. Wprowadzenie do ochrony drewna przed korozją biologiczną, Technologia i wymagania
10 Zastosowanie mikrobiologii predyktywnej do określenia szy
Urządzenie do ochrony prosiąt przed przygnieceniami
D19240227 Rozporządzenie Rady Ministrów z dnia 3 marca 1924 r w sprawie zastosowania stałej jednost
Scenariusz zajec prawo dzie ka do ochrony przed przemocą
Mikrobiologia zagadnienia do egzaminu całość, Politechnika Wrocławska, Ochrona Środowiska W7, Semest
BIBLIOTEKA INSTALATORA Zastosowanie przewodów grzewczych przy ochronie budynków i ich otoczenia prz
Zastosowanie przewodów grzewczych przy ochronie budynków i ich otoczenia przed śniegiem i mrozem eb
Ochrona budowli przed wodą i wilgocią gruntową
WykĹ‚ad ochrona pacjenta przed zakażeniem
TECHNIKI SONDAŻU Z ZASTOSOWANIEM ANKIETY.(1), Dokumenty do szkoły, przedszkola; inne, Metody, metody
Surowce stosowane do produkcji papieru
ABC ochrony komputerami przed atakami hackera
Opis zawodu Operator urządzeń do prod. papieru, Opis-stanowiska-pracy-DOC
OCHRONA STATKU PRZED POŻAREM
więcej podobnych podstron