
Wykład 14
1
Mikrobiologia przemysłowa
Zastosowanie mikroorganizmów w przemyśle farmaceutycznym i medycynie
1
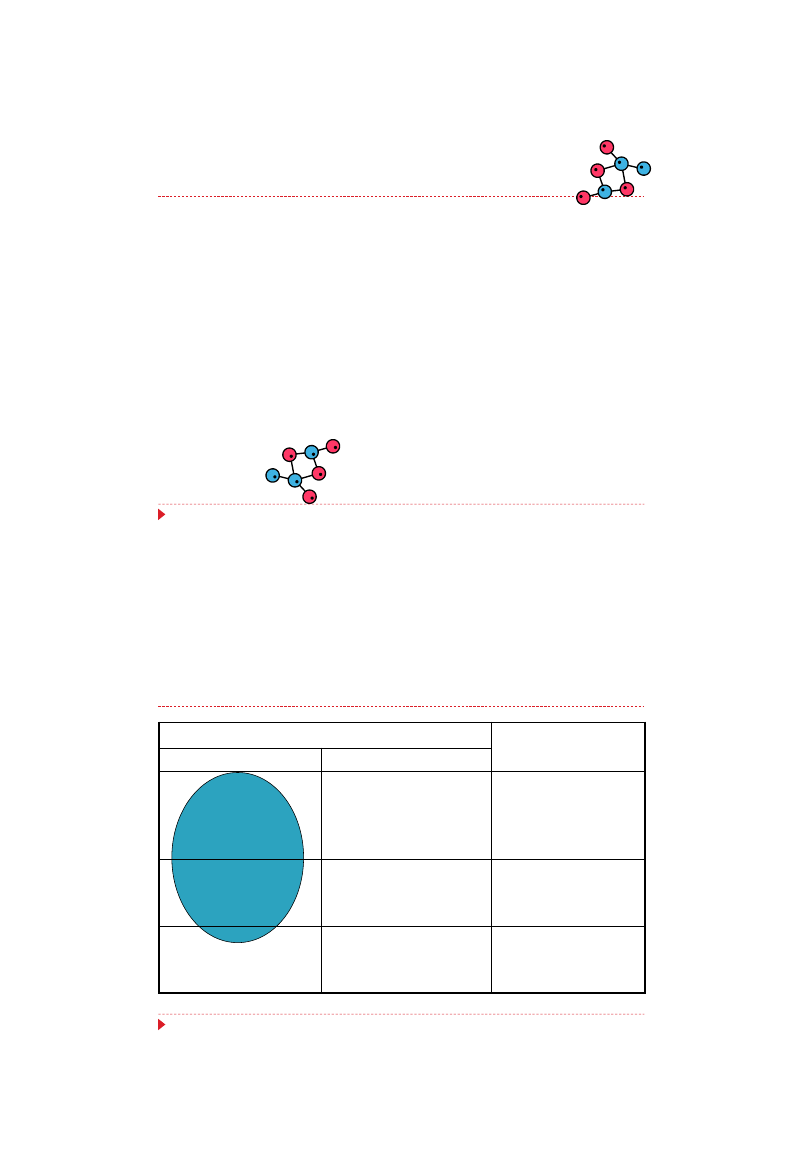
Po pierwsze penicylina
Era
antybiotyków
została
zapoczątkowana przez Alexandra
Fleminga, który w roku 1928
zaobserwował zahamowanie wzrostu
gronkowców na płytce zakażonej
pleśnią z rodziny Penicillium
2
Wykład 14
2
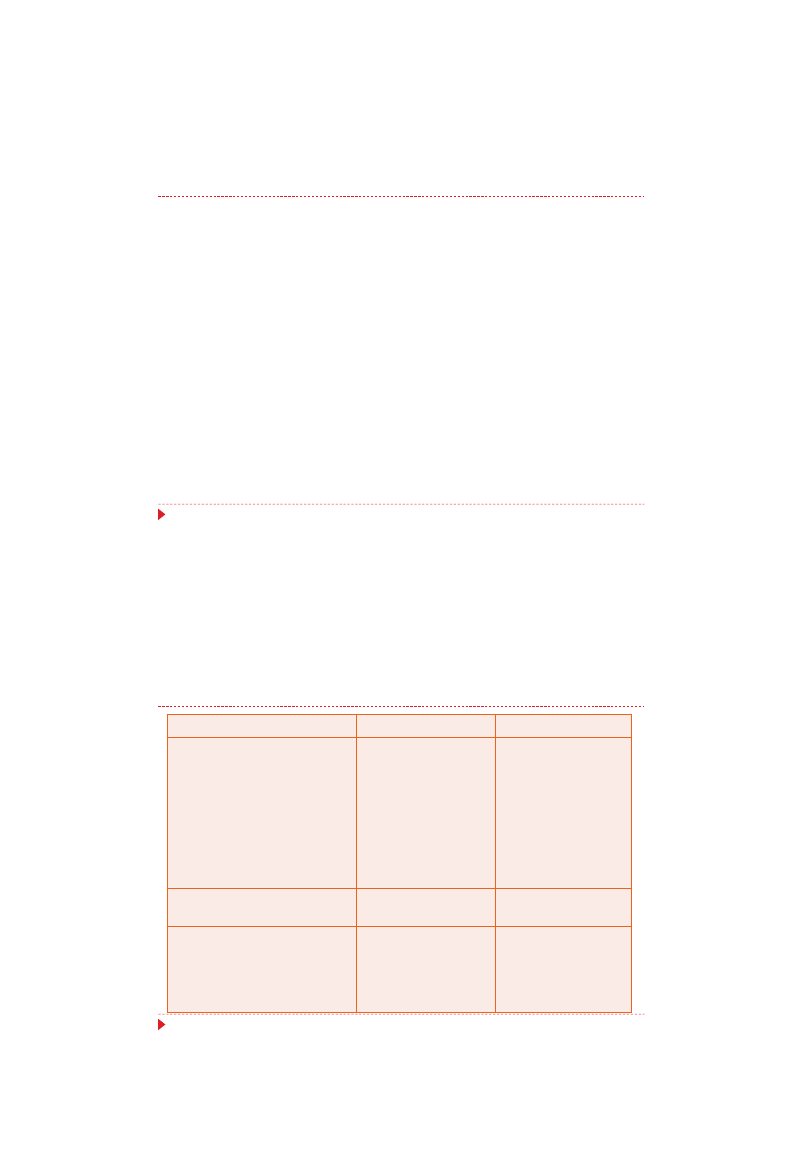
Antybiotyki – parę słów przypomnienia
Antybiotyki – są małocząsteczkowymi substancjami naturalnymi,
najczęściej pochodzenia drobnoustrojowego lub ich półsyntetycznymi
modyfikacjami albo syntetycznymi analogami, które w małym stężeniu
działają wybiórczo na struktury i procesy biologiczne, hamując wzrost
lub rozmnażanie komórek
3
Produkcja antybiotyków przez mikroorganizmy
Mikroorganizmy
Liczba
antybiotyków
Grupa
Rodzaj
Promieniowce
Streptomyces
Micromonospora
Nocradia
>6000
~5000
>400
~300
Inne bakterie
Bacillus
Pseudomonas
>1000
~200
~100
Grzyby
Penicillium
Aspergillus
>2000
~200
~150
4
Wykład 14
3
Produkcja antybiotyków przez
mikroorganizmy
Około
90%
antybiotyków naturalnych, produkowanych przemysłowo
w przemyśle lub obecnie, stanowią produkty metabolizmu
promieniowców
, np. aminoglikozydy, makrolidy, tetracykliny, polieny,
antracykliny, ryfamycyny
Ograniczone znaczenie mają produkty pozostałych bakterii, głównie z
rodzaju Bacillus, należą tu niektóre antybiotyki peptydowe, m.in..
bacytracyna, gramicydyna, polimyksyny
5
Ważniejsze antybiotyki produkowane przez
promieniowce
Promieniowce
Aktywność
Antybiotyk
Micromonospora purpurea
Anycolatopsis mediterranei
(Nocardia mediterranea)
Streptomyces aureofaciens
Streptomyces kanamyceticus
Saccharopolyspora erythraea
Streptomyces floridae Streptomyces
griseus Streptomyces lincolnensis
Streptomyces orientalis
przeciwbakteryjna
gentamycyny ryfamycyny
tetracykliny kanamycyny
erytromycyna wiomycyna
streptomycyna
linkomycyna
wankomycyna
Streptomyces nodosus
Streptomyces noursei
przeciwgrzybowa
amfoterycyny nystatyna
Streptomyces antibioticus
Streptomyces caespitosus
Streptomyces galilaeus
Streptomyces peucetius
Streptomyces verticillus
przeciwnowotworowa
aktynomycyna
mitomycyna aklarubicyna
daunorubicyna
bleomycyna
6

Wykład 14
4
Zarys biotechnologii antybiotyków
Proces produkcji antybiotyków obejmuje:
Przygotowanie wyjściowego materiału posiewowego
Proces biosyntezy antybiotyków w bioreaktorze
Wyodrębnianie antybiotyków z zawiesiny pohodowlanej i ich
oczyszczanie
7
Przygotowanie wyjściowego materiału posiewowego
1.
ETAP
Namnażanie szczepów producenckich na podłożu stałym
(promieniowce i grzyby)
2.
ETAP
Rozmnażanie materiału posiewowego w hodowli wgłębnej
8
Wykład 14
5
Namnażanie szczepów producenckich na podłożu stałym
Pożywki używane do namnażania spór grzybów lub promieniowców
są zestalone agarem i zawierają najczęściej łatwo przyswajalne
- Organiczne źródła węgla i energii
np. sacharozę, glukozę, czasami surowce skrobiowe,
- Źródło azotu
np. jony amonowe i azotanowe, czasami wyciągi mięsne lub inne,
- Zestaw soli nieorganicznych.
9
!!! UWAGA !!!
Zasadą jest używanie pożywek o małym stężeniu związków węgla i
azotu, przy czym szczególnie ważna jest limitacja źródła azotu,
będąca czynnikiem ograniczającym rozmnażanie komórek grzybni i
stymulującym proces sporulacji
Namnażanie szczepów producenckich na podłożu stałym
10

Wykład 14
6
Rozmnażanie materiału posiewowego w hodowli wgłębnej
Rozmnażanie materiału posiewowego w hodowli wgłębnej prowadzi się
dwuetapowo
1.
Początkowo mikroorganizmy namnaża się w kolbach
wstrząsanych aż do osiągnięcia wskazanych wartości OD hodowli
(optical density),
11
2.
Następnie w mikroorganizmy hoduje się w bioreaktorach o
pojemności od kilku do kilkudziesięciu litrów na podłożach
wzbogaconych w kompleksowe surowce, takie jak:
- namok kukurydziany,
- wyciągi lub hydrolizaty mięsne
- wyciągi drożdżowe
obecne w pożywce stosowanej na etapie hodowli wybranego
mikroorganizmu i produkcji przez niego antybiotyku
Rozmnażanie materiału posiewowego w hodowli wgłębnej
12
Wykład 14
7
Proces biosyntezy antybiotyków w bioreaktorze
Proces biosyntezy antybiotyków polega na prowadzeniu hodowli
drobnoustrojów w bioreaktorze z mieszaniem i napowietrzaniem, w
podłożu zapewniającym pełne wykorzystanie metabolicznego
potencjału szczepu produkcyjnego
13
Jak osiągnąć
pełne wykorzystanie metabolicznego
potencjału szczepu produkcyjnego
Z jednej strony należy stworzyć
optymalne warunki rozwoju
aktywnej biomasy i biosyntezy
produktu
WYBÓR PODŁOŻA PRODUKCYJNEGO
Z drugiej natomiast surowce
użyte do sporządzenia podłoża
powinny być możliwie tanie
14
Wykład 14
8
WYBÓR PODŁOŻA PRODUKCYJNEGO
Podłoża produkcyjne przygotowuje się zazwyczaj z wystandaryzowanych
surowców kompleksowych, takich jak:
mąka sojowa lub kukurydziana,
namok kukurydziany,
wyciągi mięsne
do których dodawane są wybrane dla konkretnego szczepu producenckiego
źródła węgla, azotu, soli mineralnych, czynniki wzrostowych i prekursorów
syntezy bioproduktu
15
Źródło Węgla
Podstawowym składnikiem podłoża jest źródło węgla i energii, wykorzystywane do
rozmnażania komórek i syntezy produktu; mogą to być
monosacharydy np. glukoza
disacharydy np. sacharoza, laktoza.
Jeżeli w procesie używane są drobnoustroje wytwarzające enzymy amylolityczne
np. bakterie z rodzaju Bacillus czy promieniowce, wówczas do przygotowania
podłoża wykorzystuje się skrobię ziemniaczaną lub kukurydzianą
16

Wykład 14
9
Źródło Azotu
Źródłem azotu mogą być sole amonowe, woda amoniakalna, ale w
praktyce przemysłowej są nim najczęściej surowce kompleksowe,
takie jak namok kukurydziany lub mąka sojowa.
N
2
17
Inne istotne czynniki wzrostowe
Podłoża produkcyjne mogą zawierać specjalne składniki, takie jak czynniki
wzrostowe np. wybrane aminokwasy i witaminy potrzebne dla wzrostu szczepu
producenckiego będącego najczęściej mutantem auksotroficznym
Poza tym wprowadza się odpowiednio zoptymalizowany zestaw soli mineralnych
potrzebnych do wzrostu komórek i biosyntezy antybiotyku oraz CaCO
3
jako czynnik
neutralizujący powstające kwasy organiczne.
18

Wykład 14
10
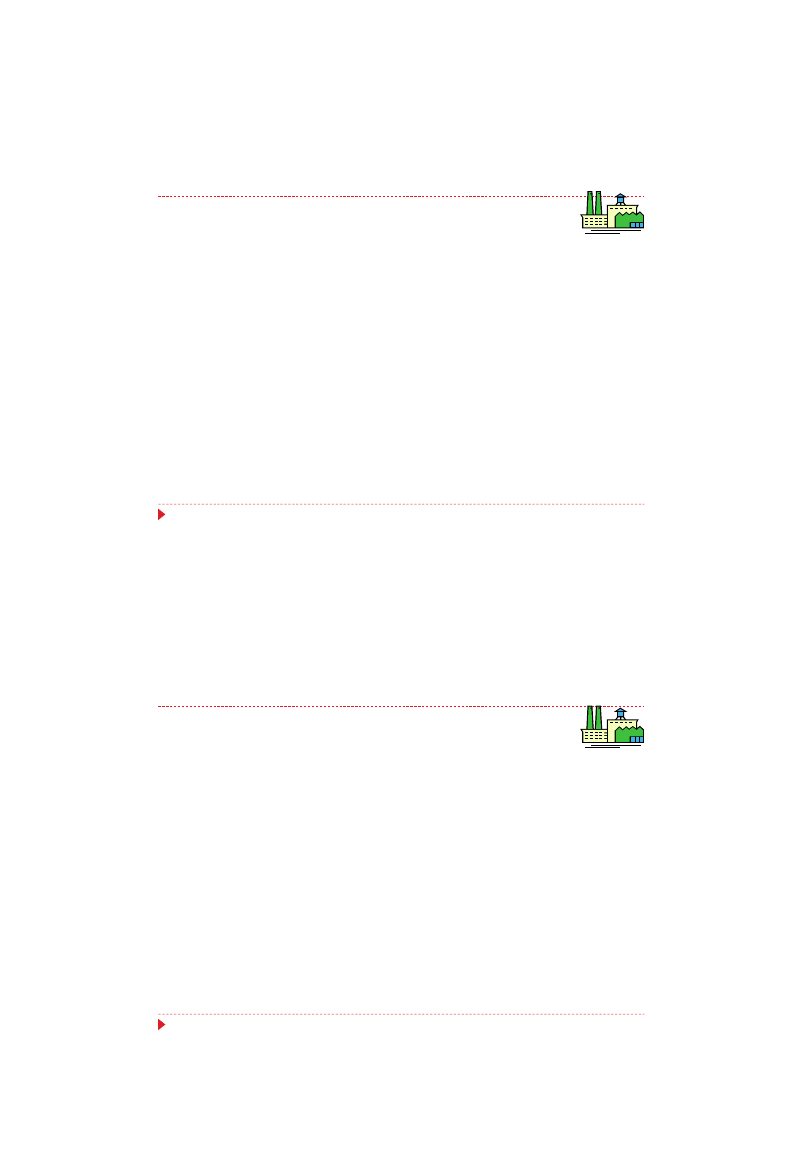
Prekursory wzrostu
Produkcja penicyliny
L-cysteina
L-walina
Kwas L-α-aminoadypinowy
19
Prekursory produktu końcowego
Produktem naturalnej biosyntezy
antybiotyków jest zwykle kompleks
kilku lub nawet kilkunastu
podobnych metabolitów o różnej
aktywności
antybiotycznej,
toksyczności i innych cechach
farmakologicznych
Przykładem jest powstawanie
kompleksu kilku naturalnych
penicylin w normalnej hodowli
Penicillium chrysogenum
20
Wykład 14
11
Prekursory produktu końcowego
Celem procesu biotechnologicznego
z użyciem Penicillium chrysogenum
powinno być natomiast wytwarzanie z
największą wydajnością jednego tylko
produktu penicyliny benzylowej
(penicyliny G)
Jej selektywne powstawanie uzyskuje
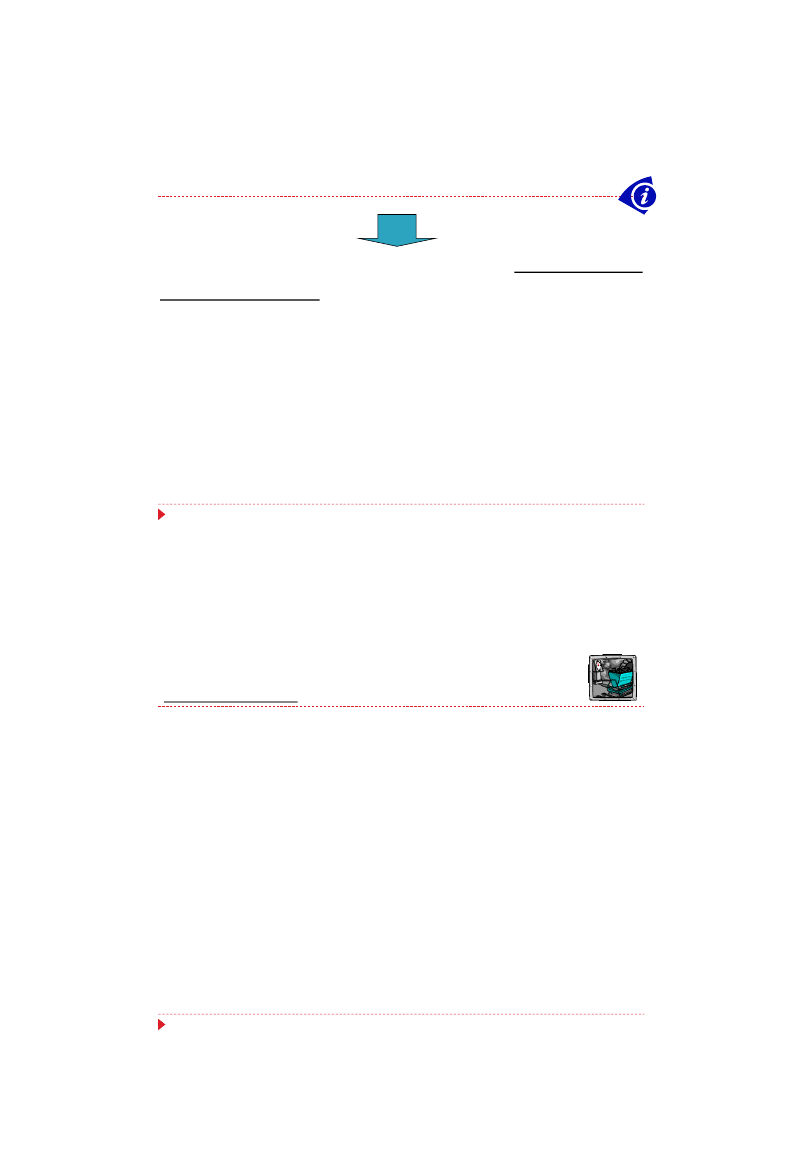
się, dodając do bioreaktora prekursory
zawierające resztę fenylooctanową
Kwas
fenylooctowy
Penicylina G
21
Prekursory produktu końcowego
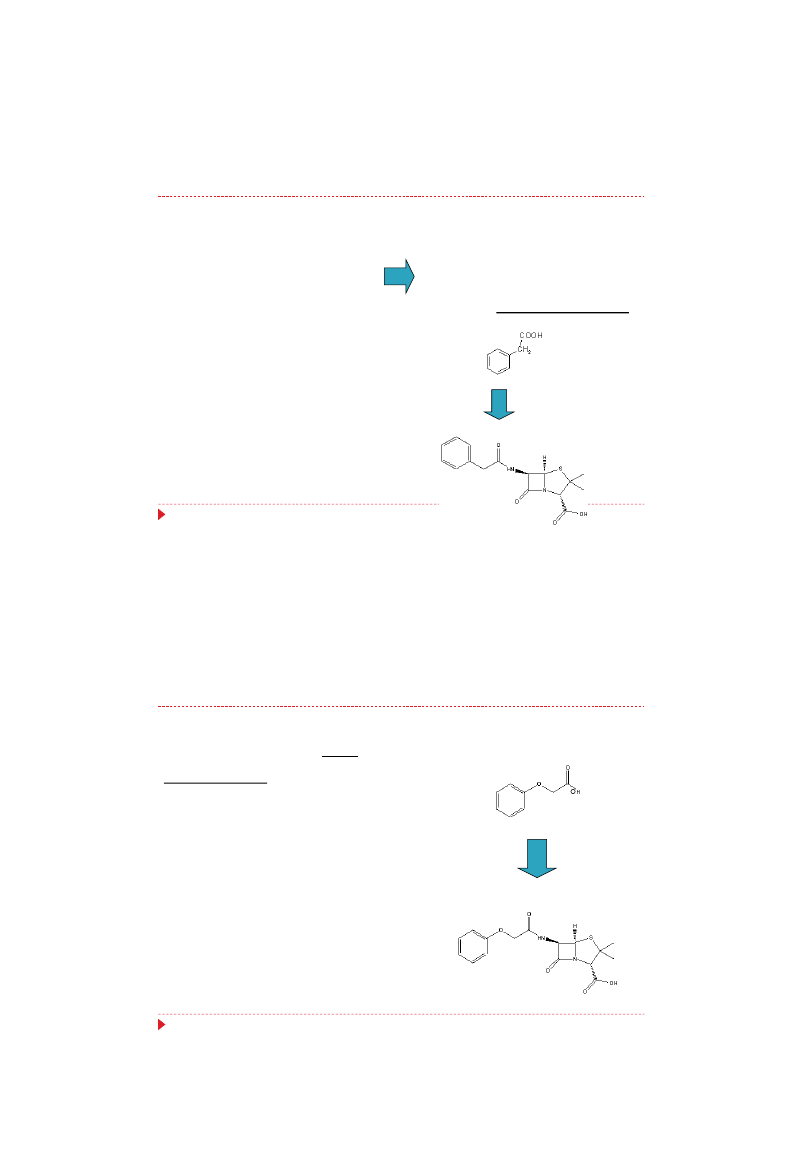
Gdy substrat zawiera resztę
fenoksyoctanową,
wynikiem
biosyntezy jest fenoksymetylowa
penicylina V, nowa biosyntetyczna
penicylina, nie występująca wśród
produktów biosyntezy naturalnej.
Penicylina V
Kwas
fenoksyoctowy
22

Wykład 14
12
Synteza penicylin – warunki prowadzenia procesu
Biosynteza antybiotyków „nie jest związana” ze szlakami
metabolicznymi odpowiedzialnymi za wzrost drobnoustrojów
Klasycznym
sposobem
prowadzenia
procesu
biosyntezy
antybiotyków, których powstawanie nie jest bezpośrednio związane
ze wzrostem drobnoustrojów, stanowi hodowla okresowa z zasilaniem
(FBC, ang. feed batch culture).
23
Synteza penicylin – warunki prowadzenia procesu
Proces biosyntezy penicyliny prowadzony jest zazwyczaj w
bioreaktorach o pojemności 150 -200 m
3
wyposażonych w
mechaniczne mieszadło tarczowo-łopatkowe i bełkotkę oraz w układy
regulacji temperatury, szybkości przepływu powietrza, natlenienia
podłoża, dozowania pożywek i prekursorów
24
Wykład 14
13
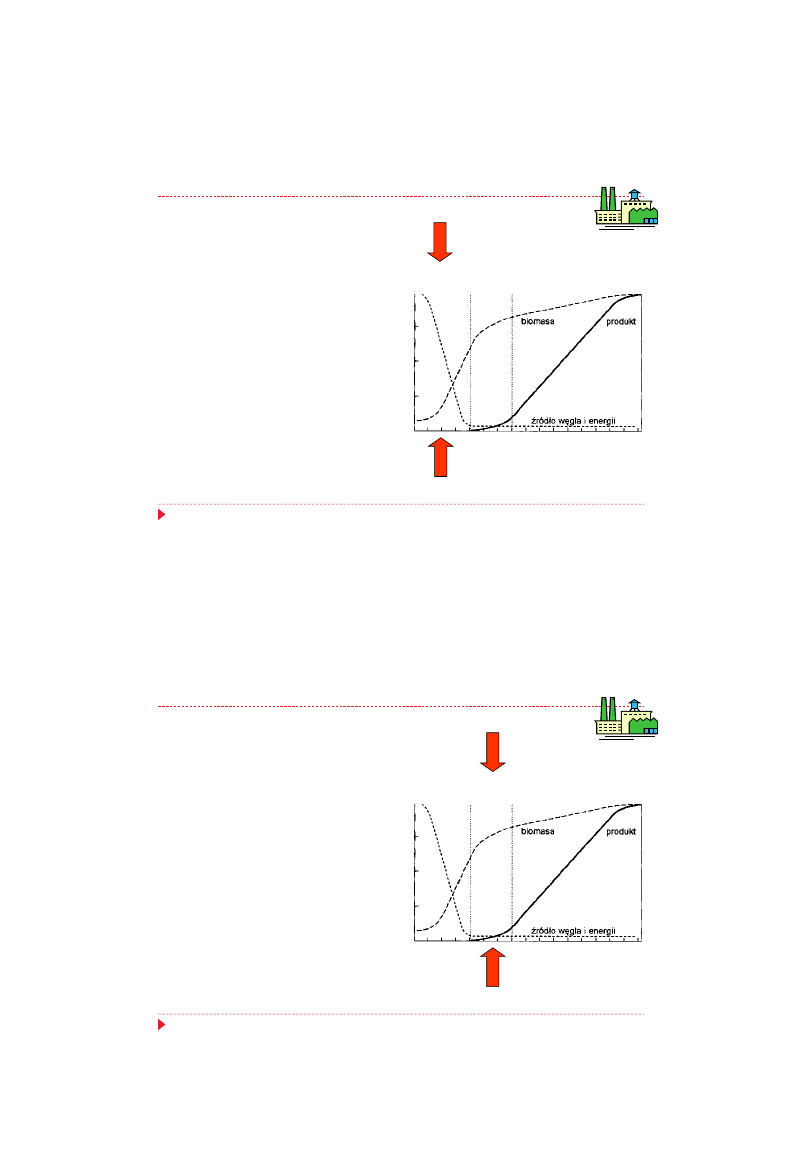
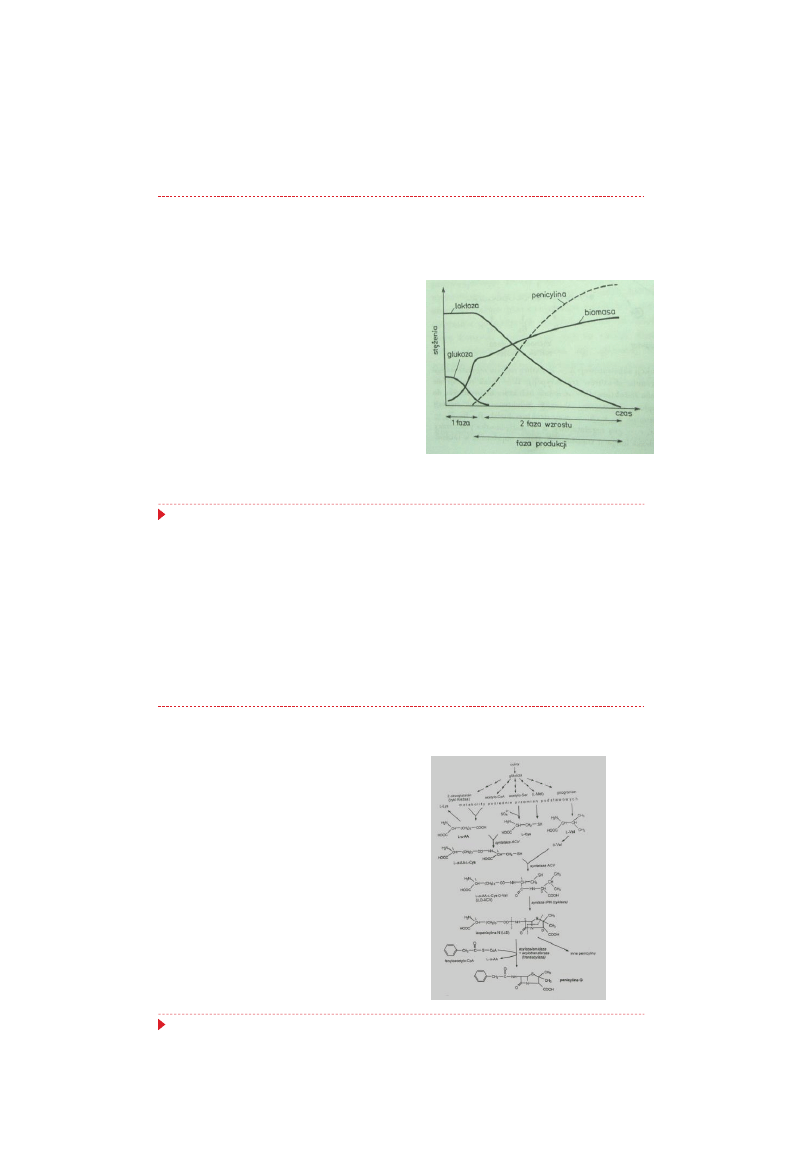
Synteza penicylin – etap I procesu produkcji
Pierwsza faza - namnażanie grzybni,
trwająca 36-40 godzin, charakteryzuje
się szybką asymilacją składników
podłoża i intensywnym oddychaniem
komórek,
Podczas początkowego namnażania
komórek korzystna jest temperatura
około 27°C, po czym obniża się ją do
24-25°C.
faza wzrostu
(trofofaza)
faza
przej
ściowa
faza produkcji (idiofaza)
%
1
0
0
zasilanie hodowli
glukozą,
źródłem azotu
i prekursorem
25
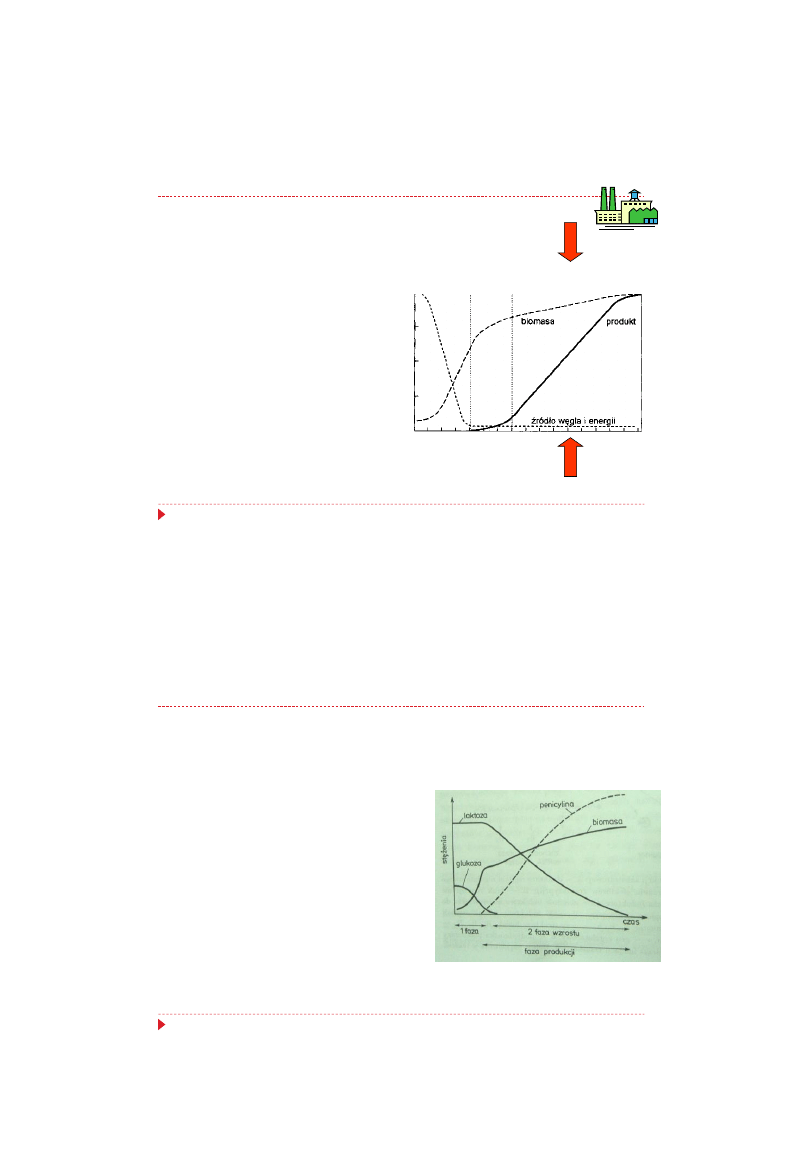
Synteza penicylin – etap II procesu produkcji
Po wyczerpaniu się zasadniczej
ilości
łatwo
przyswajalnych
składników podłoża, a zwłaszcza
glukozy, może występować krótka
faza przejściowa, w której zachodzi
ograniczenie wzrostu grzybni i
derepresja syntezy enzymów
szlaku biosyntezy penicyliny
faza wzrostu
(trofofaza)
faza
przej
ściowa
faza produkcji (idiofaza)
zasilanie hodowli
glukozą,
źródłem azotu
i prekursorem
26
Wykład 14
14
Synteza penicylin – etap III procesu produkcji
Faza produkcji (idiofaza)
Charakteryzuje
się
ona
zredukowaną szybkością wzrostu
biomasy i intensywną syntezą
penicyliny.
Stosuje się ciągłe, powolne
dozowanie laktozy (eliminując w
ten sposób mechanizm represji
katabolicznej)
oraz
kwasu
fenylooctowego (prekursora).
faza wzrostu
(trofofaza)
faza
przej
ściowa
faza produkcji (idiofaza)
zasilanie hodowli
glukozą,
źródłem azotu
i prekursorem
27
Regulacja źródłem węgla
Produkcja penicyliny przez Penicillium chrysogenum
Wymaga zniesienia ogólnometabolicznego układu
represji katabolicznej
Decyduje nie rodzaj źródła węgla, ale szybkość jego
metabolizmu
Represja kataboliczna
synteza kwasu L-α-aminoadypinowego (L-α-AA)
synteza
syntetazy
L-α-aminoadypinoilo-L-
cysteinylo-D-waliny (syntetazy ACV)
synteza syntazy izopenicyliny N (syntazy IPN)
28
Wykład 14
15
Regulacja fosforanowa
Produkcja penicyliny przez Penicillium chrysogenum
Wymaga zniesienia ogólnometabolicznego
układu represji katabolicznej
Nadmiar jonu fosforanowego pogłębia efekt
represji katabolicznej
stymuluje transport glukozy do komórki
stymuluje metabolizm glukozy
29
Regulacja związkami azotu
Produkcja penicyliny przez Penicillium chrysogenum
Wymaga obecności glutaminy jako
donora grupy aminowej w syntezie
aminokwasowych
prekursorów
penicyliny
Nadmiar jonu amonowego powoduje
represję syntetazy glutaminowej
30
Wykład 14
16
Synteza penicylin – etap III procesu produkcji
Wydajna produkcja penicyliny wymaga utrzymania szybkości wzrostu biomasy
podczas fazy produkcji na określonym poziomie
W tradycyjnej technologii w fazie produkcji powolny wzrost grzybni pozostaje w
ścisłej korelacji z asymilacją wolno przyswajanej laktozy.
31
Synteza penicylin – etap III procesu produkcji
Zbyt niskie stężenie glukozy, a także źródła azotu i siarki w fazie produkcji
penicyliny prowadzi do autolizy grzybni i obniżenia wydajności antybiotyku,
Dozowanie tych składników do podłoża podczas intensywnej produkcji penicyliny
umożliwia natomiast znaczne przedłużenie procesu biosyntezy i uzyskanie wyższej
wydajności produktu.
32
Wykład 14
17
Synteza penicylin – podsumowanie
Morfologia grzybni Penicillium chrysogenum w procesie biosyntezy penicyliny
zależy od
szczepu,
składu podłoża,
pH
warunków mieszania (typu bio-reaktora);
mogą tworzyć się luźne kłaczki, mniej lub bardziej zwarte kuleczki (pellets) o
wymiarach poniżej 1mm (w większych pojawia się centralna strefa autolizy
grzybni na skutek niedotlenienia) lub rozwija się grzybnia nitkowata, tworząca
gęstą zawiesinę w podłożu hodowlanym
33
Synteza penicylin – podsumowanie
Dlatego przez cały czas fermentacji penicylinowej prowadzi się intensywne
napowietrzanie podłoża (0.5-1.0 wm), utrzymując stopień natlenienia hodowli
powyżej 30% stanu nasycenia.
34
Wykład 14
18
Synteza penicylin – podsumowanie
Wzrost w postaci kuleczek, względnie gęstych kłaczków, sprzyja obniżeniu lepkości
zawiesiny hodowlanej, a to ułatwia mieszanie i napowietrzanie hodowli, a następnie
oddzielenie grzybni od podłoża pohodowlanego. Taka postać grzybni może jednak
powodować limitację procesów metabolicznych na skutek dużych oporów na drodze
dyfuzji substratów i produktów, a zwłaszcza tlenu wewnątrz zwartych skupisk
komórek. Jeżeli jednak kuleczki grzybni są małe i dostatecznie luźne, można
uzyskać wydajną produkcję penicyliny.
35
Produkcja dekstranu
Dekstran jest α-glukanem, zawierającym różne wiązania, zależnie od organizmu,
który go wytwarza; jest produkowany przez wiele bakterii gram-dodatnich i gram-
ujemnych, włącznie z Leuconostoc mesenteroides i różnymi gatunkami
Streptococcus
Wytwarzany z sacharozy przez enzym
zewnątrzkomórkowy – dekstranosacharazę,
która prowadzi reakcję polimeryzacji glukozy,
pochodzącej z sacharozy z uwolnieniem
fruktozy do pożywki
36

Wykład 14
19
Produkcja dekstranu
Właściwości dekstranów mogą być zmieniane przez hydrolizę polimeru po jego
strąceniu z roztworu z użyciem egzo- i endodekstranaz lub przez traktowanie
słabymi kwasami, w celu uzyskania produktu charakteryzującego się masą
cząsteczkową o założonym zakresie
37
Produkcja dekstranu
Dekstran był pierwszym polisacharydem bakteryjnym produkowanym na skalę
przemysłową i jest wytwarzany przez firmę Pharmacia od około 50 lat.
Początkowo stosowany jako płyn krwiozastępczy
Obecnie dekstrany mają wiele zastosowań w medycynie m.in.
w zapobieganiu zakrzepicy
w opatrunkach jako absorbent płynu wysiękowego
również wykorzystywane w laboratoriach jako baza złoża stosowanego w
filtracji żelowej (Sephadex)
również stosowane jak dodatki do żywności
38

Wykład 14
20
Białka terapeutyczne
Składniki wielu tradycyjnych lekarstw
Naturalnie wystepujące białka otrzymywane ze zwierząt, roślin lub mikroorganizmów,
jak również z ciała ludzkiego (krwi, moczu, łożyska lub gruczołu przysadki), np.:
świńska insulina,
VIII i IX czynnik krzepnięcia krwi z frakcjonowania krwi ludzkiej,
pankreatyna jako wspomagacz trawienia
proteazy Ancrod i Batroxobin uzyskiwane z jadu żmii
Obce białka są immunogenne dla człowieka, co może prowadzić do gwałtownej interakcji i
uniemozliwiac powtórną aplikacje leku białkowego. Również izolacja tych białek z płynów i
tkanek niesie za sobą możliwość zakażenia wirusowego prowadząc do ryzyka infekcji
pacjentów innymi chorobami, np. wirusem HIV
39
Białka terapeutyczne
Białka terapeutyczne, takie jak hormony, czynniki wzrostu i różnicowania, odgrywają
rolę w przekazywaniu sygnałów, podczas gdy inne funkcjonują jako biokatalizatory
(enzymy) lub inhibitory, lub efektory układu immunologicznego (przeciwciała). Dlatego
używane są, by zastąpić, wzmocnić lub zahamować procesy fizjologiczne.
Najbardziej popularne są:
Erytropoetyna
Insulina
Somatotropina (ludzki hormon wzrostu)
Czynnik pobudzający wzrost kolonii granulocytów (G-CSF)
Interferon α
Przeciwciała monoklonalne
40

Wykład 14
21
Białka terapeutyczne
Najczęściej używanymi gospodarzami do produkcji białek
heterologicznych są
komórki ssaków
komórki owadów
drożdże
bakterie
41
Białka terapeutyczne
komórki ssaków
komórki jajnikowe chomika chińskiego (CHO), komórki nerki młodego chomika
(BHK) lub komórki szpiczaka myszy (NS0, SP/0)
można uzyskać wysoki poziom ekspresji białek (do 100 pg/dzień/komórkę)
wydzielanych do pożywki fermentacyjnej, poprawnie sfałdowanych i zazwyczaj z
modyfikacjami potranslacyjnymi zbliżonymi do ludzkich
Rozwój stabilnych linii komórkowych o wysokim poziomie ekspresji białek
terapeutycznych może wymagać wielu rund amplifikacji i zabierać wiele miesięcy
czasu, a koszty produkcji są duże
Stosowane głównie do produkcji glikozylowanych białek terapeutycznych, gdzie
wymagana jest poprawna modyfikacja białka, istotna dla efektu terapeutycznego
42

Wykład 14
22
Białka terapeutyczne
komórki ludzkie
Jednym ze sposobów zagwarantowania identyczności rekombinowanego produktu
białkowego z oryginalnym białkiem ludzkim jest użycie jako systemu ekspresji
komórek ludzkich
Zamiast klonować gen lub sekwencję DNA kodującą pożondane białko do komórki
gospodarza, manipuluje się promotorem w celu aktywacji ekspresji endogennego
genu ludzkiego
43
Białka terapeutyczne
komórki owadów
Gen kodujący pożądane białko jest wstawiany do genomu bakulowirusa, który bardzo
wydajnie infekuje komórki owada i wykorzystuje jego aparat metaboliczny do
przejściowej produkcji dużych ilości białka (do 500 mg/litr pożywki hodowlanej) w
ciągu 2-3 dni po infekcji
Wykorzystywany często do uzyskiwania w szybkim czasie małych ilości białka do
badań przedklinicznych
44
Wykład 14
23
Białka terapeutyczne
drożdże
Saccharomyces cerevisae, Pichia pastoris
Organizmy eukariotyczne rutynowo hodowane na dużą skalę
Rekombinantowe białka zazwyczaj znajdują się wewnątrz komórki, jednak
dołączenie odpowiednij sekwencji liderowej umożliwia sekrecję większości białek do
medium hodowlanego
Białka są poprawnie zwinięte i mają mostki disiarczkowe, ale glikozylacja różni się od
wzoru glikozylacji ssaków
Obecnie tylko jedno wprowadzone na rynek białko terapeutyczne – insulina – jest
produkowana z wykorzystaniem drożdży
45
Białka terapeutyczne - przykłady
Grupa leków
Przykłady białek
cytokiny i
antagoniści
Interferon alfa-2a
Interferon alfa-2b
Interferon alfacon-1
Peginterferon alfa-2a
Peginterferon alfa-2b
Interferon beta-1a
Interferon beta-1b
Interferon gamma-1b
Aldesleukin (IL-2)
Filgrastim (G-CSF)
Pegfilgrastim
Lenograstim (G-CSF)
Molgramostim (GM-CSF)
Sargramostin (GM-CSF)
Tasonermin (TNF-α)
Becaplermin (PDGF-BB)
Oprevelkin (IL-II)
Anakinra (IL-IRA)
Grupa leków
Przykłady białek
hormony i peptydy
Insulina
Insulina lispro
Insulina aspart
Insulina glargine
Epoetyna alfa (erytropoetyna)
Epoetyna beta (erytropoetyna)
Epoetyna delta (erytropoetyna)
Darbepoetyna-alfa
Folitropina alfa
Folitropina beta
Glukagon
Somatotropina
Lutropina-alfa
Teriparatide (PTH I-34)
Kalcytonina z łososia
Tyrotropina-alfa
Choriogonadotropina A2
Osteogeniczne białko 1
Dibotermina alfa (BMP-2)
Pegvisomat (antagonista hGH)
Nesirtide (peptyd natriuretyczny)
46
Wykład 14
24
Białka terapeutyczne - przykłady
Grupa leków
Przykłady białek
czynniki
krzepliwości i
inhibitory
Eptacog alfa
Czynnik antyhemofilowy
Moroktokog alfa (muteina FVIII)
Nonacog alfa
Desirudyna
Lepirudyna
Drotrekogina alfa (aktywowana białkiem C)
Inhibitor α1-proteinazy
Grupa leków
Przykłady białek
enzymy
Alteplaza (t-PA)
Reteplaza (muteina t-PA)
Tenekteplaza (muteina t-PA)
Monteplaza (muteina t-PA)
Dornaza-alfa (RNaza)
Imigluceraza
Agalzydaza alfa
Agalzydaza beta
Resburykaza
Laronidaza
47
Białka terapeutyczne - przykłady
Grupa leków
Przykłady białek
szczepionki
Szczepionka przeciw zapaleniu wątroby
Szczepionka przeciw boreliozie
Szczepionka di-per-te (przeciw błonicy,
teżcowi I krztuścowi)
Szczepionka przeciw rotawirusom
Grupa leków
Przykłady białek
białka fuzyjne
Denileukin diftitoks
Etanercept
Alefacept
48

Wykład 14
25
Białka terapeutyczne
Bakterie
Jako systemy ekspresyjne zapewniają szybki rozwój, dużą wydajność i względnie
niedrogą produkcję
Białka mogą być akumulowane wewnątrzkomórkowo lub wydzielane do przestrzeni
periplazmatycznej (E. coli) lub do pożywki fermentacyjnej (Bacillus spp.)
Brak modyfikacji potranslacyjnych i prawidłowego zwijania białek eukariotycznych,
ponadto na końcu aminowym, gdzie może być obecna reszta N-formylometioniny
(można ominąć to dołączając koniec fuzyjny np. His-tag, który po ekspresji może być
wykorzystany przy oczyszczaniu i jest odcinany za pomocą odpowiedniej proteazy)
Niekiedy białka eukariotyczne mogą być błędnie fałdowane i akumulują się w
nierozpuszczalne tzw. ciała inkluzyjne, wymagające dalszej obróbki
System nadaje się do produkcji białek nie wymagających obróbki potranslacyjnej
49
Szczepionki – mają na celu przygotowanie organizmu do obrony przed
mikroorganizmami chorobotwórczymi; są to preparaty biologiczne pobudzające
odpowiedź immunologiczną organizmu prowadząc do wytworzenia swoistych
przeciwciał skierowanych przeciw określonemu patogenowi.
W przypadku wirusów najczęściej antygenami są białka kapsydu lub otoczki
wirusów i to one odpowiadają za wytworzenie odpowiednich przeciwciał
Wykorzystanie wirusów w medycynie
50

Wykład 14
26
Szczepionki pierwszej generacji:
Inaktywowane – tworzone z całych cząstek wirusowych, traktowanych związkami chemicznymi
lub z cząstek poddanych działaniu czynników fizycznych, w celu pozbawienia właściwości
chorobotwórczych, ale z zachowaniem właściwości antygenowych; np. szczepionki przeciwko
wściekliźnie, kleszczowemu zapaleniu mózgu, czy poliomyelitis (choroba Heinego-Medina)
Atenuowane – zawierają całe cząstki wirusowe, ale osłabione, najczęściej przez delecje genów
odpowiedzialnych za chorobotwórczość wirusów; np. szczepionki przeciwko odrze czy różyczce;
zaletą tych szczepionek jest możliwość podawania małej dawki wirusów i wysoka stymulacja
układu odpornościowego , wynikająca z zachowania zdolności wirusa do namnażania się
Wykorzystanie wirusów w medycynie
51
Szczepionki drugiej generacji:
Podjednostkowe – zawierają jedynie najbardziej immunogenne antygeny, czyli białka otoczki
wirusa; np. szczepionka przeciw WZW typu B i grypie
Szczepionki trzeciej generacji:
Szczepionki DNA – wywołują bardzo silną reakcję układu immunologicznego; immunizacja
następuje na drodze bezpośredniego wprowadzenia genów kodujących białka antygenu, które
następnie ulegają ekspresji w komórkach gospodarza; szczepionki są w fazie badań
klinicznych; np. szczepionki przeciwko wirusom HIV, WZW B i C, cytomegalii, opryszczki,
wścieklizny, grypy, HPV.
Wykorzystanie wirusów w medycynie
52

Wykład 14
27
Wykorzystanie wirusów w medycynie
Terapia genowa:
SUPLEMENTACYJNA – dostarczenie komórce prawidłowej kopii genu, który
będzie ulegał transkrypcji obok genu wadliwego
SUPRESYJNA – hamowanie ekspresji genu, który wymknął się spod kontroli,
wprowadzany jest gen, którego toksyczny produkt prowadzi do śmierci
zainfekowanej komórki, np. w komórkach nowotworowych
53
Wykorzystanie wirusów w medycynie
Najczęściej stosowanymi wektorami w terapii genowej są wirusy, ponieważ:
naturalnie wprowadzają swój materiał genetyczny do komórki gospodarza
samodzielnie replikują z wykorzystaniem aparatu metabolicznego gospodarza
infekują kolejne komórki
54

Wykład 14
28
Wykorzystanie wirusów w medycynie
Dostarczenie genu do wybranych komórek umożliwiają dwie metody:
ukierunkowanie transdukcyjne - takie przekształcenie wirusów, aby
infekowały tylko komórki nowotworowe, np. poprzez dołączenie cząsteczek
rozpoznających komórki chorobowo zmienione do białkowej osłonki wirusa
ukierunkowanie transkrypcyjne - takie przekształcenie wirusów, aby
transkrypcja genu zachodziła tylko w komórkach nowotworowych; polega na
zastosowaniu promotorów aktywowanych białkami, wytwarzanymi przez chore
komórki, tak aby geny niesione na wektorze ulegały ekspresji wyłącznie
wewnątrz takich komórek
55
Wykorzystanie wirusów w medycynie
Najczęściej wykorzystywane są genomy pochodne :
Adenowirusów
Herpeswirusów
Parwowirusów
Retrowirusów
Modyfikacje tych wirusów obejmują usunięcie genów odpowiedzialnych za wirulencję,
rekombinację i replikację
Należy jednak pamiętać, że DNA wirusowe może połączyć się z DNA ludzkim w innym
miejscu, niż oczekiwane, co może mieć poważne niepożądane skutki. Również istnieje
ryzyko wystąpienia silnej odpowiedzi immunologicznej, przez co wektory te nie są w
pełni bezpieczne.
56
Wykład 14
29
Prezentacja białek:
Technika prezentacji białek na powierzchni fagów (phage display) jest wydajną
metodą przesiewową stosowaną w badaniach nad oddziaływaniem pomiędzy
białkami
Po raz pierwszy zastosowana w 1985 roku do ekspresji antygenów w fagu M13
Znajduje ona szerokie zastosowanie w poszukiwaniu i identyfikacji różnych białek –
począwszy od krótkich peptydów, aż po fragmenty przeciwciał, czy hormony
Umiejscowienie białka na zewnątrz kapsydu umożliwia również wykrycie i
charakterystykę ligandów, które oddziałują z badanym białkiem
Wykorzystanie bakteriofagów w medycynie
57
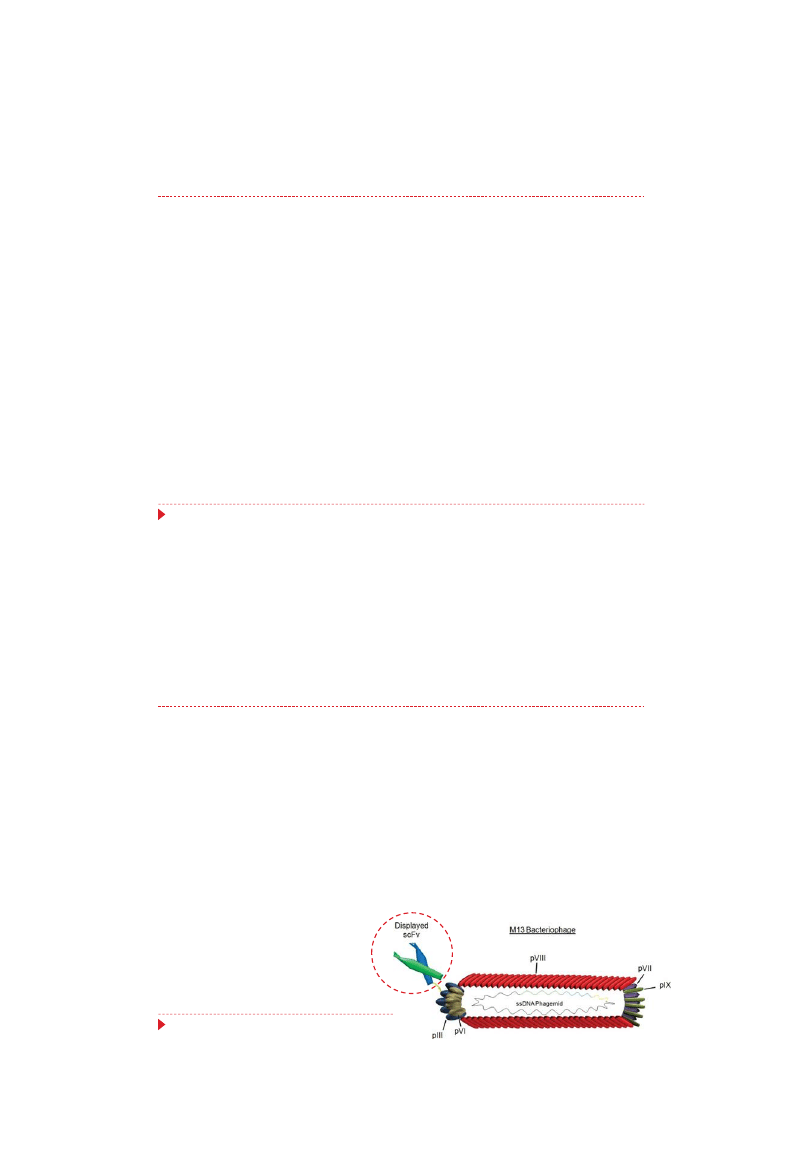
Prezentacja białek:
Obecnie najczęściej używanym fagiem jest fag M13 infekujący bakterie E. coli
Fag typu filamentowego z genomem (6407 nt) w postaci kolistego, jednoniciowego DNA o
dodatniej polarności
Otoczony płaszczem białkowym
Najczęściej określone sekwencje nukleotydowe klonuje się w obrębie genów kodujących
drugorzędowe białko płaszcza (gpIII) lub genu głównego białka płaszcza (gp VIII)
Wykorzystanie bakteriofagów w medycynie
58

Wykład 14
30
Wykorzystanie bakteriofagów w medycynie
Terapia fagowa
Pionierskimi placówkami naukowymi o ogromnym wkładzie w terapię fagową były
ośrodki w Gruzji i w Polsce. Kraje te nie zaprzestały badań nad terapeutycznym
wykorzystaniem fagów po odkryciu i wprowadzeniu antybiotyków do powszechnego
leczenia.
W Polsce pierwsza publikacja na temat terapii fagami „O bakteriofagji” Jerzego
Jasieńskiego ukazała się w „Chirurgii klinicznej” w 1927 roku,
59
Wykorzystanie bakteriofagów w medycynie
Terapia fagowa
W Polsce pierwszy udokumentowany przypadek wyleczenia chorego z
wykorzystaniem fagów odnotowano w roku 1942. Pacjentką była Maria Dąbrowska
(pisarka), którą wyleczono z ropnego zapalenia miedniczek nerkowych,
spowodowanego infekcją bakteriami Escherichia coli.
60

Wykład 14
31
Wykorzystanie bakteriofagów w medycynie
Terapia fagowa
Bakteriofagi (wirusy bakterii) są bardzo specyficzne wobec gatunków i konkretnych
szczepów bakterii, a jednocześnie łagodne dla makroorganizmu, w którym rozwija
się infekcja
W przypadku ich użycia muszą być spełnione dwa warunki:
Konieczna jest dobra i szybka diagnostyka dla zidentyfikowania szczepu
gospodarza
Bakteriofag musi być natychmiast dostępny dla tego szczepu
61
Wykorzystanie bakteriofagów w medycynie
Zalety stosowania terapii fagowej:
Są specyficzne dla konkretnych gatunków, a nawet szczepów bakterii
Efekty uboczne są minimalne, ponieważ bakteriofag nie atakuje komórek
makroorganizmu
Bakteriofag ulega fagocytozie (usuwanie przez pochłonięcie i zniszczenie przez
białe ciałka krwi), tak więc usunięcie ich z organizmu jest szybkie
Alternatywa dla antybiotykoterapii, zwłaszcza w walce z bakteriami
antybiotykoopornymi
62

Wykład 14
32
Wykorzystanie bakteriofagów w medycynie
Wady stosowania terapii fagowej:
Wąskie spektrum działania – łatwiej i szybciej można zastosować antybiotyki o
szerokim spektrum działania
Konieczność wcześniejszego przygotowania odpowiednich preparatów
skierowanych na konkretny gatunek lub szczep bakterii
Może pojawić się odpowiedź immunologiczna ze strony makroorganizmu, u
którego już wcześniej został zastosowany dany preparat bakteriofagowy, co
może być problematyczne przy powtórnym jego użyciu
63
Wykorzystanie bakteriofagów w medycynie
Terapia fagowa
Potencjalnym zagrożeniem przy zastosowaniu preparatów fagowych może być
wstrząs wywołany przez uwolnienie endotoksyn i egzotoksyn z bakterii, zlizowanych
przez fagi
in vivo (w organizmie poddanym terapii fagowej) – prowadzone są badania mające na celu
zminimalizowanie tego efektu; antybiotyki również mogą wywoływać taka reakcję
in vitro (przy produkcji preparatów fagowych) – preparaty są odpowiednio oczyszczane i
eliminowane są ewentualne toksyny
64

Wykład 14
33
Bakteriofagi i antybiotyki w terapii
BAKTERIOFAGI
ANTYBIOTYKI
Bezpieczne w stosowaniu, nie powodują poważnych
efektów ubocznych
Różne efekty uboczne, m.in. zaburzenia w
funkcjonowaniu układu pokarmowego, alergie, infekcje
wtórne
Replikują i koncentrują się w miejscu infekcji, tak długo,
jak długo obecne są wrażliwe na nie bakterie
Są metabolizowane i eliminowane z organizmu, nie
koncentrują się w miejscu infekcji
Wysoko specyficzne i bardzo efektywne w niszczeniu
docelowych komórek bakterii patogennych, pozwalają na
uniknięcie infekcji wtórnej; nie niszczą naturalnej
mikroflory bakteryjnej
Mogą być używane bez znajomości szczepu bakterii
wywołującej chorobę
Niszczą zarówno bakterie patogenne, jak i mikroflorę
naturalną, co może prowadzić do poważnych infekcji
wtórnych
Bakterie oporne na jeden typ faga pozostają wrażliwe na
inne fagi
Stosowanie antybiotyków może wywołać
wyselekcjonowanie bakterii lekoopornych, zarówno
będących celem ich działania, jak i innych
Wyselekcjonowanie nowych fagów jest procesem krótkim,
trwa kilka dni – tygodni, i stosunkowo niedrogim
Wytworzenie nowego antybiotyku jest procesem
długotrwałym, trwa kilka lat i jest bardzo kosztowne
65
Wykorzystanie bakteriofagów w medycynie
Innym podejściem w terapii fagowej jest zastosowanie jedynie enzymu pochodzenia
fagowego, skierowanego przeciw konkretnym bakteriom
Vincent Fischetti (Uniwersytet Rockefellera, USA) zastosował enzym fagowy lizynę
z faga C1, skierowany przeciwko bakteriom z rodzaju Streptococcus z grup A, C i E,
powodujących zapalenie gardła. Wyniki badań wskazały na bardzo dużą
skuteczność takiej terapii.
Naukowcy z tego Uniwersytetu również posłużyli
się fagową lizyną PlyG, skierowaną przeciwko
Bacillus anthracis w celu wykrywania tej bakterii
oraz przy leczeniu wąglika
66
Wyszukiwarka
Podobne podstrony:
MP 15 Zastosowanie mikroorganizmów w przemyśle chemicznym
MP 4 Pozyskiwanie szczepów mikroorganizmów o znaczeniu przemysłowym cz 2a
MP 3 Pozyskiwanie szczepów mikroorganizmów o znaczeniu przemysłowym cz 1a
MP 7 Metody przechowywania szczepów mikroorganizmów przemysłowych
Niektóre zastosowania węglowodorów w przemyśle i w życiu codziennym
Zastosowanie galwanizacji w przemyśle i w medycynie
14 Zastosowanie przepisow prawa Nieznany (2)
Zastosowanie mikroorganizmów w biohydrometalurii, Technologia żywności i żywienia człowieka
Charakterystyka i zastosowanie mikroorganizmów w procesach biodegradacji produktów
wykład 14 - 02.04.2009, FARMACJA, ROK 5, TPL 3, Zachomikowane
Zastosowanie drobnoustrojów w przemyśle, Technologia żywności i żywienia człowieka, Gastronomia
Zastosowanie enzymów w przemysle gumowym i fotograficznym
bakterie mlekowe zastosowanie lab w przemysle mleczarskim
Zastosowanie kofeiny w przemyśle spożywczym i kosmetycznym
Zastosowanie nanotechnologii w medycynie i farmacji
więcej podobnych podstron