
STAN GAZOWY, CIECZE,
CIAŁA STAŁE I ZMIANY
STANU

STAN GAZOWY
• Gaz nie ma własnej objętości w odróżnieniu od cieczy i
kształtu w odróżnieniu od ciał stałych
• Łatwa ściśliwość,
• szybka dyfuzja,
• duża rozszerzalność cieplna
Objętość
• W przypadku cieczy i ciał stałych objętość nie zmienia się
znacznie ze zmianą ciśnienia i temperatury. Cisnienie które
zmniejsza objętość gazów o 50% wywołuje zmniejszenie
objętości wody o 0,005%.
• Aby ustalić liczbę moli w danej próbce gazu, konieczna jest
znajomość jego ciśnienia, temperatury i objętości

• Gazy i ciecze są płynami: nie mają określonego
kształtu, przyjmują kształt naczynia.
• Pod wpływem niewielkich sił ulegają
odkształceniom (łatwość transportu w
rurociągach, łatwiejsze prowadzenie przemian
fizykochemicznych ze względu na łatwość
mieszania i rozwijania powierzchni

W celu uproszczenia rozważań matematycznych
nad zachowaniem się gazu wprowadzono
wyidealizowany model gazu zwany gazem
doskonałym (nierzeczywisty stan materii)
• Właściwości gazów rzeczywistych zbliżają się do
doskonałego gdy mamy wysokie temperatury i
pod niskimi ciśnieniami, duże rozrzedzenia
Gazy doskonałe
• Nie mają objętości własnej
• Zderzenia między cząsteczkami gazu są
sprężyste

• 1 litr wodoru pod ciśnieniem 1 atm. w temp 0 st. C
– zawiera 0,446 mol
• 1 litr pod ciśnieniem 2 atm. w temp 25 st. C –
zawiera 0,0817 mol
• Jeżeli mieszamy dwa gazy to ich objętość końcowa
po zmieszaniu zależy przede wszystkim od
ciśnienia końcowego
• Jeżeli ciśnienie końcowe dostatecznie się zwiększy
to dwa lub więcej gazów może zajmować tę samą
objętość, którą poprzednio zajmował jeden z nich

• Wszystkie gazy można zmieszać w
dowolnych stosunkach- są one
mieszalne
• Ciśnienie – określa kierunek
przepływu masy

• Stan gazu określają 3 parametry:
temperatura, ciśnienie i objętość
• Zależności między tymi parametrami
ujęte są w kilku prawach

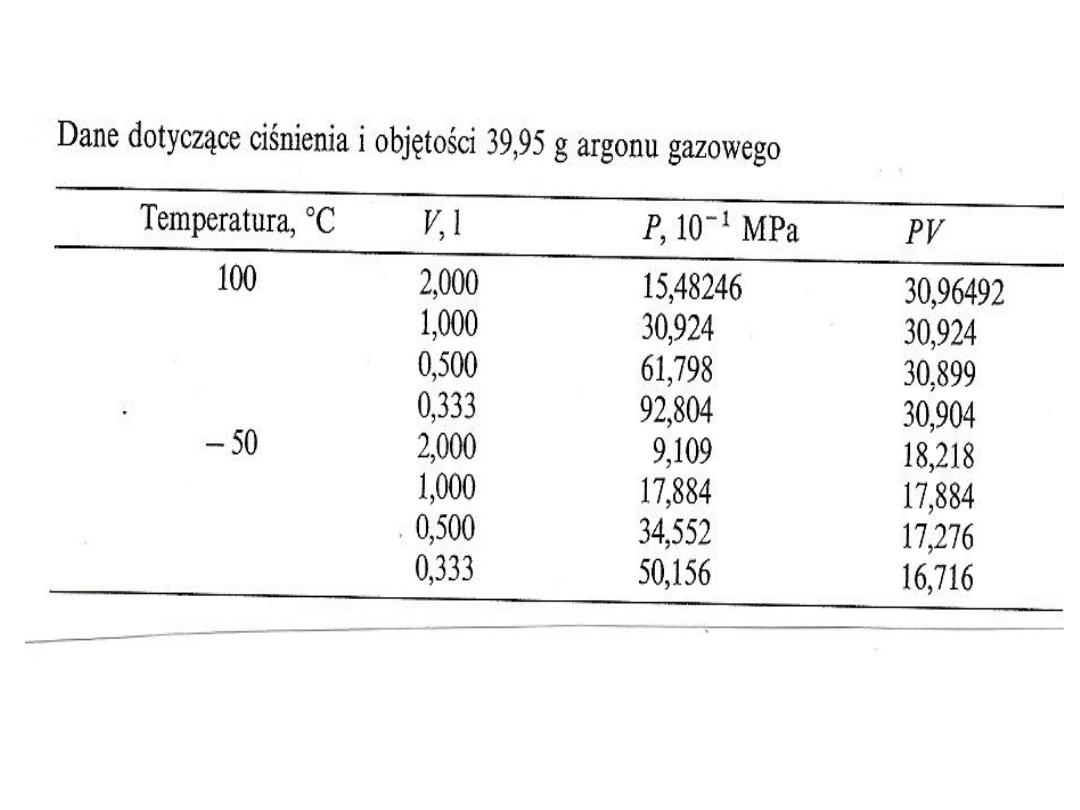
Zależność P/V
prawo Boyl’a – Mariotte’a
PV = const. dla T = const.
W stałej temperaturze T iloczyn ciśnienia p i
objętości V jest wielkością stałą
W danej temperaturze określona masa gazu
zajmuje objętość odwrotnie proporcjonalną do
ciśnienia pod jakim się znajduje
Dla większości gazów prawo to spełnione jest pod
niewielkimi ciśnieniami i w wysokich
temperaturach
Gdy ciśnienie wzrasta lub temperatura spada mogą
pojawiać się odchylenia

Zależność V/T prawo Gay- Lussaca
• Gazy zwiększają objętość ze wzrostem
temperatury
Pod stałym ciśnieniem objętość zajęta przez
określoną masę gazu jest wprost proporcjonalna
do temperatury bezwzględnej

Prawo Charlesa
• Dotyczy zależności między ciśnieniem
gazu a jego temperaturą przy stałej
objętości
p = p
o
(1+ βt) gdy V = const.
a β = 1/273 K –współczynnik
ciśnieniowy
p
o
= ciśnienie gazu w temp. 273 K

Równanie stanu gazu doskonałego
(równanie Clapeyrona)
• pV/ T =const.
• Wartość const. zależy od ilości gazu;
• jeżeli mamy 1 mol gazu to const.
nazywamy stałą gazową R = 8,3143 J/
(mol K)

• Zależność między objętością, ciśnieniem,
temperaturą i liczbą moli w próbce gazu
PV = nRT

Prawo Daltona
• Zachowanie się dwu lub więcej gazów
znajdujących się w tym samym pojemniku jest
uogólnione w prawie ciśnień cząstkowych Daltona
(1801).
• Ciśnienie całkowite mieszaniny gazów jest równe
sumie ciśnień cząstkowych skadników mieszaniny
• P całk = P1 + P2 +P3 +….

• Przykład
• Próbkę azotu wprowadzono do naczynia o
pojemności
• 1 l i stwierdzono, że jego ciśnienie wynosi 6586 Pa
• Próbkę tlenu wprowadzono do drugiego naczynia o
poj. 1l i stwierdzono, że jego ciśnienie wynosi
2736Pa
• Jeżeli obie próbki przeniesiemy do trzeciego
naczynia o poj. 1l to zmierzone ciśnienie wyniesie
9322 Pa

• Przykład
40,0 l azotu zebrano nad wodą w temp.
22 st. C pod ciśnieniem atmosferycznym
96968 Pa. Jaka będzie objętość suchego
azotu w temperaturze normalnej i pod
ciśnieniem normalnym, jeżeli założymy,
że azot zachowuje się jak gaz doskonały

• Ciśnieniem początkowym azotu gazowego
jest ciśnienie atmosferyczne zmniejszone o
ciśnienie pary wodnej w tej temperaturze
• 96968 – 2644 = 94324 Pa
• temp początkowa 273 + 22 =295 K
• temp normalna 273 K
• ciśnienie normalne 101 325 Pa (1 atm)

• Jaki jest wpływ zmiany ciśnienia i temperatury
na objętość?
• Zmiana ciśnienia 101325/94324
• Objętość zmienia się odwrotnie
94324/101325
• Zmiana temperatury 273/295 K
• Objętość zmienia się wprost proporcjonalnie
• V konc = 40 l x (94324/101325) x (273/295) =
• = 34,4 l

DYFUZJA
• Gaz rozprzestrzenia się tak, że zajmuje każdą
dostępną przestrzeń
• Samorzutne rozprzestrzenianie się cząsteczek
przez daną fazę nazywa się dyfuzją
• Gaz o mniejszej masie cząsteczkowej dyfunduje
szybciej
W tych samych warunkach szybkości dyfuzji
gazów są odwrotnie proporcjonalne do
pierwiastka kwadratowego ich mas
cząsteczkowych (prawo Grahama)

• Oznacza to, że czas wypływu gazu ze
zbiornika jest wprost proporcjonalny do
pierwiastka kwadratowego z masy
molowej
• Zależność ta wykorzystana jest do
rozdzielania gazów

TEORIA KINETYCZNA
• Cząsteczki materii znajdują się w ciągłym ruchu
(ruchy Browna)
• Założenia teorii kinetycznej:
1. Gazy składają się z mikroskopijnych cząsteczek,
przy czym średnia odległość między nimi jest
taka, że rzeczywista objętość cząsteczek jest
nieznaczna w porównaniu z pustą przestrzenią
między nimi

2. W gazie doskonałym nie oddziałują siły
przyciągania międzycząsteczkowego. Cząsteczki
są całkowicie niezależne od siebie
3. Cząsteczki gazu znajdują się w szybkim,
przypadkowym i prostoliniowym ruchu, zderzając
się ze sobą i ze ścianami pojemnika. Zakłada się,
że w zderzeniach nie następuje utrata energii
kinetycznej, może natomiast zachodzić wymiana
energii między uczestnikami zderzeń

4. W pewnej chwili w każdym zbiorze cząsteczek
gazu
różne cząsteczki mają różne prędkości i w wyniku
tego różną energię kinetyczną. Jednakże
przyjmuje się, że średnia energia kinetyczna
wszystkich cząsteczek jest wprost proporcjonalna
do temperatury bezwzględnej.
Średnia prędkość cząsteczek podniesiona do
kwadratu jest proporcjonalna do
temperatury

TEMPERATURA SKRAPLANIA
• Pomiędzy cząsteczkami gazu pojawiają się siły
przyciągania , działające w przypadku bardzo
małych odległości np. w przypadku zderzeń. W
niektórych przypadkach są to siły związane z
biegunowością cząsteczek np. wody, w innych są
to siły van der Waalsa.
• Siły van der Waalsa maleją wraz ze wzrostem
temperatury.
• W niskich temperaturach siły przyciągania mimo,
że słabe przeważają i cząsteczki skupiają się
tworząc ciecz. Temperaturę, w której cząsteczki
skupiają się tworząc ciecz nazywa się
temperaturą skraplania.

• Im wyższe jest ciśnienie , tym łatwiej zachodzi
skroplenie gazu i tym słabiej należy go ochłodzić,
aby go skroplić.

TEMPERATURA KRYTYCZNA
• Dla każdego gazu istnieje temperatura, powyżej
której siły przyciągania są zbyt słabe, aby wywołać
skroplenie niezależnie od ciśnienia pod jakim
znajduje się gaz.
• Jest to temperatura krytyczna powyżej której
substancja może istnieć tylko jako gaz
• Powyżej temperatury krytycznej ruch cząsteczek
jest tak energiczny, że bez względu na wielkość
ciśnienia cząsteczki w stanie gazu zajmują całą
przestrzeń, jaką mają do dyspozycji.
• Temperatura krytyczna zależy więc od wielkości sił
przyciągania między cząsteczkami.


CHłODZENIE PRZEZ ROZPRĘŻANIE
• Substancje o wysokich temperaturach
krytycznych można łatwo skraplać
• Substancje o niskich temperaturach
krytycznych jest trudno skroplić i wymagają
chłodzenia
• Np. tlen nie może być skroplony w
temperaturze pokojowej (temp. krytyczna
154 K)

• Gazy oziębiają się niekiedy same podczas
rozprężania
• Przykład
Gaz w cylindrze pod tłokiem wykonuje pracę na
skutek rozprężenia (porusza tłok)
• Jeśli energia potrzebna do wykonania tej pracy
pochodzi z energii kinetycznej cząsteczek gazu,
to spadek energii kinetycznej cząsteczek
przejawia się w postaci obniżenia temperatury


CIAłA STAłE CIECZE I ZMIANY STANU
• Jeżeli próbkę gazu oziębi się lub spręży ,
albo podda obu tym przemianom to gaz
ulega skropleniu.
• W procesie tym cząsteczki gazu poruszają
się ze stopniowo zmniejszajacą się
prędkością i zbliżają się do siebie na taką
odległość, przy której siły przyciągania
osiągają znaczną wartość.
• Pojedyńcze cząsteczki łączą się w zespoły i
osiadają na dnie zbiornika w postaci cieczy.

• Właściwości cieczy:
• Ciecze są praktycznie nieściśliwe
• Ciecze zachowują swoją objętość
• Ciecze nie mają określonego kształtu
• Ciecze dyfundują powoli
• Ciecze parują z otwartych pojemników

• Właściwościami charakteryzującymi ciecze
są lepkość i napięcie powierzchniowe. Dla
substancji chemicznie czystych w
określonej temp. i pod określonym
ciśnieniem wielkości te są stałe i służą do
identyfikacji substancji i do oznaczania
stopnia czystości.

Przemiany fazowe i równowagi fazowe
Pojęcie fazy, składnika, stopnia swobody.
Reguła faz
• Układ – zbiór substancji poddanych
obserwacji
• Faza – część układu jednolita pod względem
fizycznym i chemicznym
• Powierzchnia granicy faz- powierzchnia
oddzielająca dwie różne fazy
• Przykłady granicznych powierzchni
międzyfazowych: ciecz-gaz, ciecz -ciecz

• Mieszanina złożona z kilku różnych
gazów stanowi jedną fazę gazową – ze
względu na to, że gazy w sposób
nieograniczony wzajemnie się rozpuszczają.
• Substancje ciekłe jeśli nie rozpuszczają się
w sobie stanowią odrębne fazy np. woda –
benzen.
• Ciała stałe stanowią różne fazy gdy ich
składniki różnią się budowa krystaliczną lub
charakterem chemicznym

• Składnik – zbiór jednego rodzaju
indywiduów chemicznych np. ciekła woda
stanowi układ jednoskładnikowy
• Roztwór cukru w wodzie- układ
dwuskładnikowy
• Parametry intensywne opisujące
właściwości fazy: temperatura, ciśnienie,
gęstość (niezależne od ilości fazy

• Parametry ekstensywne: masa, objętość
(zależne od ilości fazy)
• Liczba stopni swobody układu (z)
• Liczba stopni swobody układu jest to liczba
parametrów intensywnych, które można
niezależnie zmieniać nie powodując
zmiany liczby faz układu

• Określa je reguła Gibbsa
z= s-f+2
z- liczba stopni swobody
s- liczba składników
f- liczba faz
• 2- liczba uwzględniająca dwa
parametry stanu: ciśnienie i
temperaturę

• Układ jednofazowy i jednoskładnikowy ma
2 stopnie swobody
• To znaczy że możemy zmieniać dwa
parametry intensywne (temperaturę i
ciśnienie) bez naruszania równowagi.
• Gdy występują dwie fazy tego samego
składnika (woda- para wodna), liczba z
=1, można zmieniać jeden parametr:
ciśnienie albo temperaturę bez naruszania
równowagi fazowej.

Układy jednoskładnikowe, wielofazowe
Równowaga między fazą ciekłą i
gazową
• Stan, w którym zachodzą dwa
przeciwstawne sobie procesy z taką samą
prędkością określa się jako równowagę
dynamiczną
• Mimo, że układ ten nie jest w stanie
spoczynku, nie zachodzi w nim żadna
zmiana. Objętość cieczy w zlewce nie
zmienia się , stężenie cząsteczek w parze
ponad cieczą jest również stałe
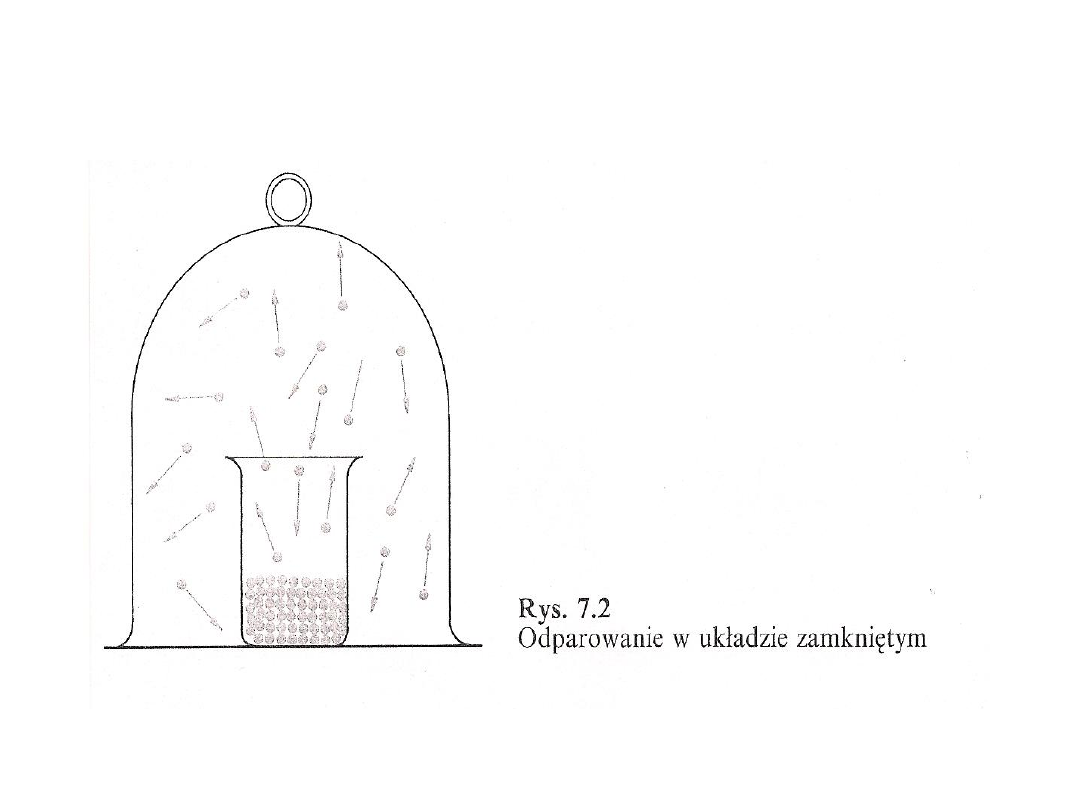

• Cząsteczki znajdujące się w fazie pary
wywierają ciśnienie
• W stanie równowagi ciśnienie to jest
charakterystyczne dla danej cieczy i
określa się je jako ciśnienie pary
nasyconej
• Jest to ciśnienie wywierane przez parę
znajdującą się w stanie równowagi z cieczą

• Wielkość ciśnienia pary nasyconej zależy
od:
• rodzaju cieczy
• jej temperatury

• Rodzaj cieczy ma znaczenie, ponieważ
każda ciecz odznacza się
charakterystyczną wielkością sił
przyciągania między cząsteczkami.
• Cząsteczki odznaczające się dużymi siłami
przyciągania np. H
2
O charakteryzują się
małą zdolnością do przechodzenia w stan
pary. Ciśnienie pary nasyconej takich
cieczy jest małe.

• Ciecze złożone z cząsteczek o małych siłach
wzajemnego przyciągania np. CCl
4
, łatwo
przechodzą w stan pary i dlatego cechuje je
wysokie ciśnienie pary nasyconej.
• W miarę wzrostu temperatury cieczy średnia
energia kinetyczna cząsteczek wzrasta.
Liczba cząsteczek o dużej energii, zdolnych
do ucieczki staje się również większa,
dlatego ciśnienie pary nasyconej wzrasta
.
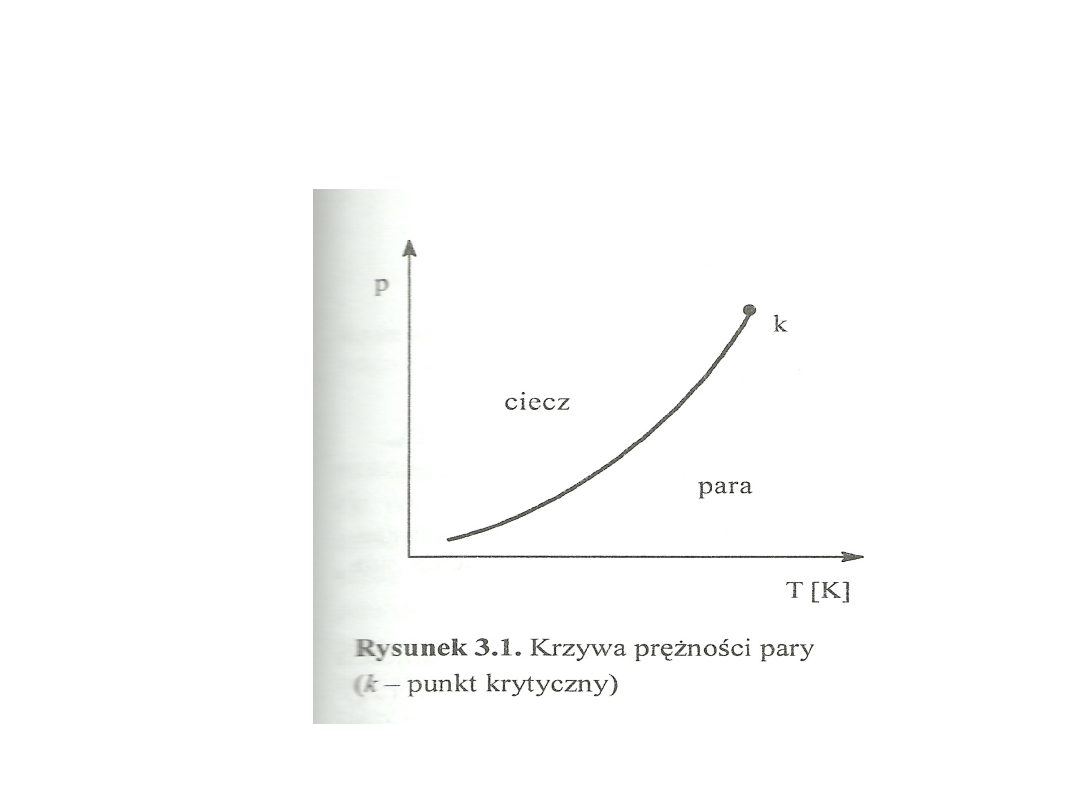

• Podczas ogrzewania cieczy prężność pary
nasyconej wzrasta i w temperaturze
wrzenia osiąga wartość równą ciśnieniu
zewnętrznemu.
• Wykres prężności pary:
• Punkty na krzywej oznaczają warunki w
których ciecz współistnieje ze swoją parą
nasyconą.
• Wraz ze wzrostem temperatury wzrasta
gęstość pary nasyconej a maleje cieczy.

• W punkcie k (krytyczny) gęstość pary i
cieczy się wyrównuje. Powyżej
temperatury krytycznej substancja może
już tylko występować w jednolitej fazie
gazowej.

CIAŁA STAŁE
• Ciała stałe są praktycznie nieściśliwe
• Ciała stałe dyfundują wolno
• Ciała stałe tworzą kryształy lub są
amorficzne (bezpostaciowe)

KRZYWE OGRZEWANIA
• Podczas ogrzewania ciała stałego następuje
wzrost temperatury do chwili osiągnięcia
temperatury topnienia. Dalsze ogrzewanie
nie powoduje już wzrostu temperatury.
• Podobne zjawisko zachodzi po osiągnięciu
temperatury wrzenia cieczy.
Doprowadzenia ciepła do wrzącej wody nie
podnosi jej temperatury ,lecz jest
zużytkowane na przemianę cieczy w gaz.
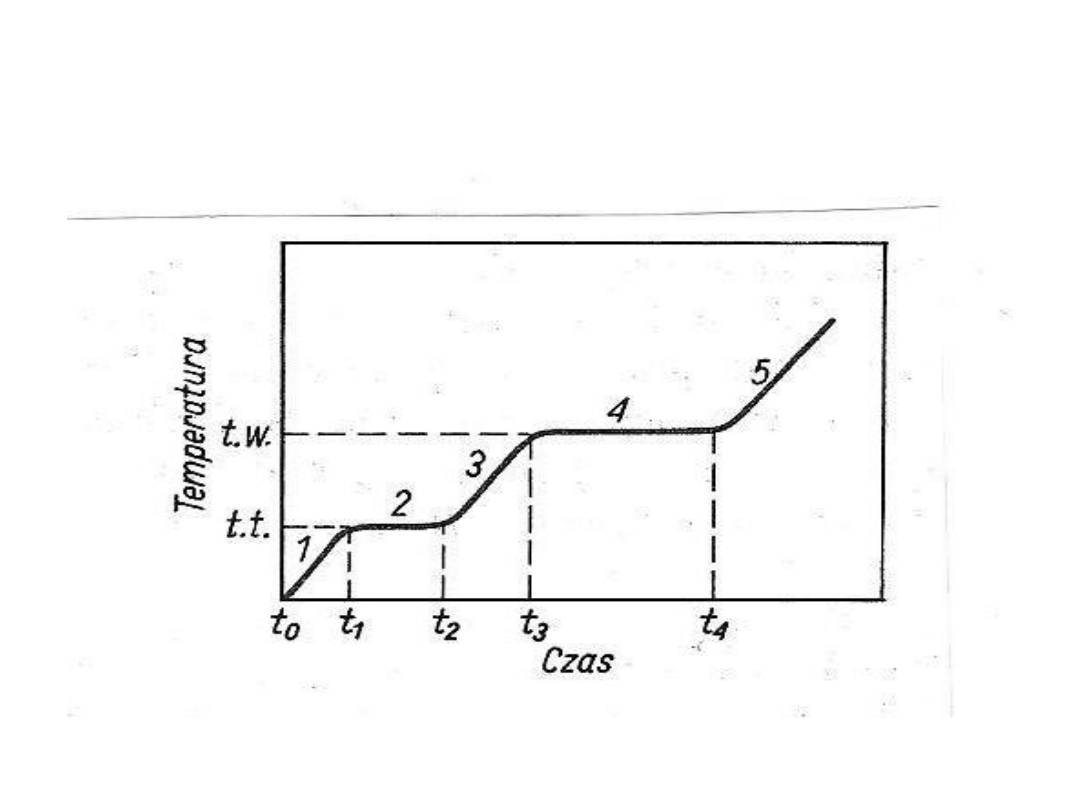
Zmiany temperatury towarzyszące zmianom stanu

• Temperaturę w której ciało stałe i
ciecz są w stanie równowagi, określa
się jako temperaturę topnienia
substancji

RÓWNOWAGA CIAłO STAłE GAZ
• Podobnie jak ciecz również ciała stałe mogą
przechodzić do fazy gazowej, co daje w wyniku
pewne ciśnienie pary.
• Cząstki , które w danej chwili mają energię większą
od średniej i znajdują się blisko powierzchni, mogą
przezwyciężyć siły przyciągania sąsiednich
cząsteczek i przejść do fazy gazowej.
• Może ustalić się równowaga dynamiczna, której
odpowiada równowagowe ciśnienie pary nasyconej
charakterystyczne dla danego ciała stałego.

• Ciśnienie pary nasyconej jest różne dla różnych
substancji i zależne od sił międzycząsteczkowych
w rozpatrywanym ciele stałym
• Stały wodór (kryształ cząsteczkowy) - małe siły
przyciągania – zdolność przechodzenia w stan
pary duża i ciśnienie pary nasyconej duże.
• NaCl (kryształ jonowy) – siły wiążące duże –
ciśnienie pary nasyconej małe
• Im wyższa temperatura tym większa energia
cząsteczek i tym łatwiej mogą opuścić fazę stałą

• Wykres
• Zmiany ciśnienia pary nasyconej w zależności od
temperatury
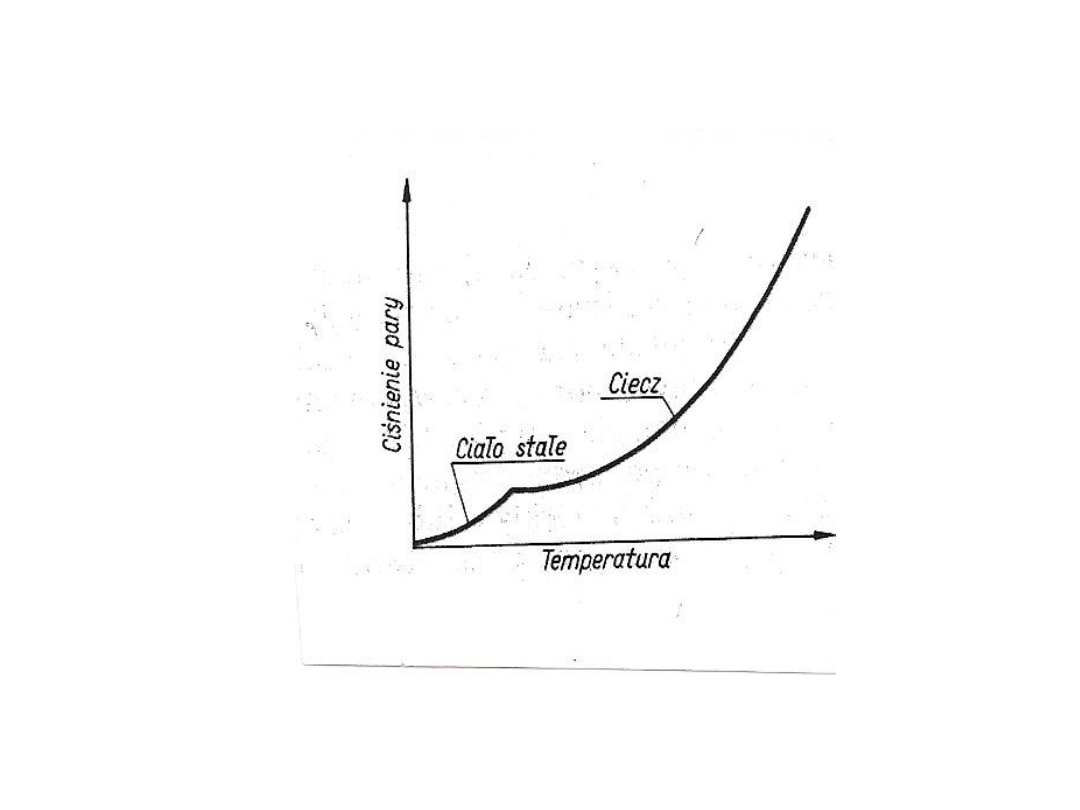

• Ciśnienie pary osiąga rzadko dużą wartość
zanim ciało stałe zostanie stopione.
Powyżej temperatury topnienia krzywa
ciśnienia pary jest taka sama jak dla cieczy
• Każdy punkt krzywej odpowiada
równowadze miedzy ciałem stałym a parą

• Zachowanie się układu w równowadze gdy
jest on poddany działaniu sił zewnętrznych
podlega zasadzie Le Chateliera
• Gdy jakiś bodziec działa na układ będący w
stanie równowagi, wówczas układ ,jeśli to
możliwe przystosowuje się tak, aby
zmniejszyć działanie tego bodźca

• Np. wzrost temperatury układu ciało stałe-
para będącego w równowadze, jest
wywołany działaniem na układ bodźca w
postaci ciepła. Działanie dodanego ciepła
może być skompensowane przemianą
części ciała stałego w gaz.
• W końcu ustala się równowaga w nowej
temperaturze gdy ciśnienie pary wzrosło

• W punkcie, w którym krzywa ciśnienia pary cieczy
przecina odpowiednią krzywą dla ciała stałego
( gdy ciśnienie pary ciała stałego równa się
ciśnieniu pary cieczy), zachodzi równocześnie
równowaga między ciałem stałym a gazem,
cieczą a gazem, ciałem stałym a cieczą.
• Jest to punkt potrójny.
• Zależy on od rodzaju sił przyciągania między
cząstkami w różnych fazach i jest
charakterystyczny dla każdej substancji

WYKRESY FAZOWE
• Zależność pomiędzy stanem stałym, ciekłym i
gazowym danej substancji od temperatury i
ciśnienia może być przedstawiona w postaci
jednego wykresu zwanego wykresem fazowym.
• Wykresy fazowe można uzyskać na podstawie
pomiarów wykonanych w różnych temperaturach i
pod różnymi ciśnieniami
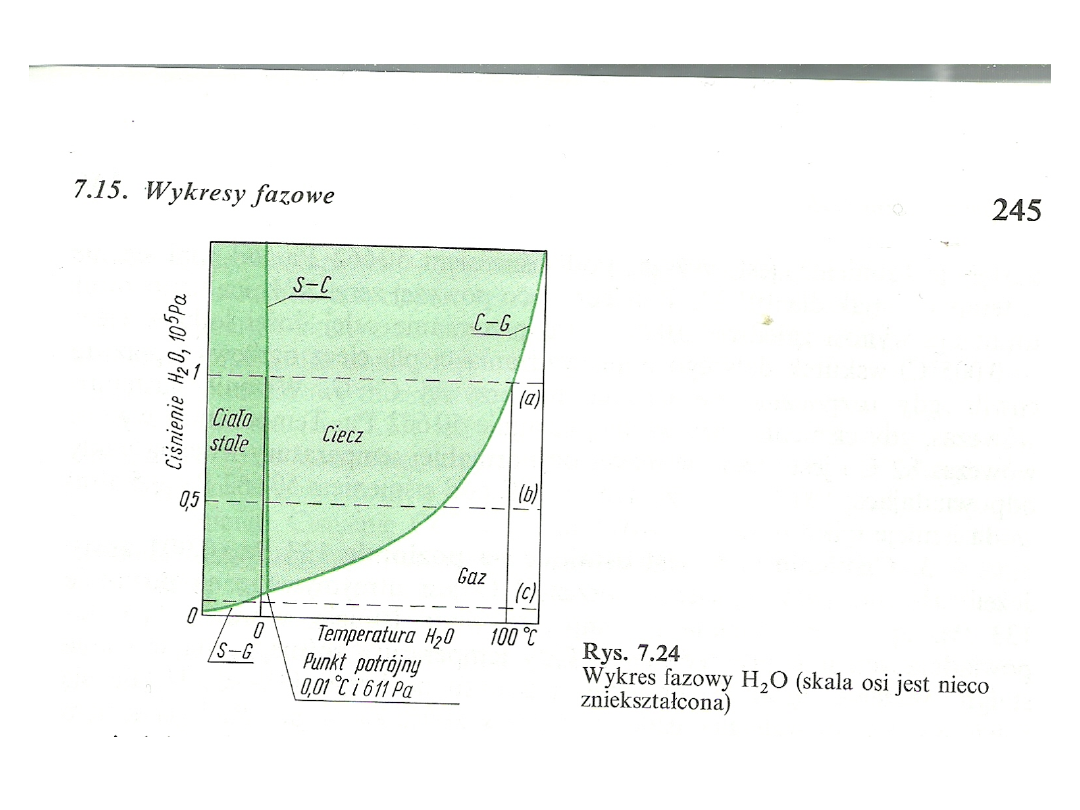
Wykres fazowy wody
• Na wykresie tym współrzędne stanowią ciśnienie i
temperatura. Trzy różne obszary odpowiadają
układom jednofazowym.

• Dla dowolnych wartości ciśnienia i temperatury,
odpowiadających obszarowi układu
jednofazowego, substancja występuje tylko w
podanym stanie skupienia. Krzywe rozdzielające
jeden obszar od drugiego odpowiadają krzywym
równowagi między dwiema fazami.
• Przecięciu trzech krzywych odpowiada punkt
potrójny.

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
Wyszukiwarka
Podobne podstrony:
Stan gazowy charakteryzuje się tym
2008 1 Stan Gazowy, inżynieria ochrony środowiska kalisz
Stan gazowy
Szkol Stan spawacz gazowy
Tematyka egzaminu dla stan DOZORU w zakresie gazowym
regul praw stan wyjątk 05
Stan zapalny
aparaty cyfrowe praktyczny przewodnik r 14 trudne zdjecia stan sitwe helion 56GBUFHXJXG6NRFSKVYCN
F 2 Złącze p n stan równowagi
monter instalacji gazowych 713[07] z2 03 u
7 Stan sinusoidalny 3
Kodeks drogowy stan prawny na styczeń 2011
STAN WYŻSZEJ KONIECZNOŚCI, prawo karne
Stan rozwoju mowy dzieci - charakterystyka, logopedia
Tab-wart stan, SWPS, Systemy motywacyjne w firmie
Seminarium dyplomowe Stan zaawansowania pracy inżynierskiej
Slavoj Žižek, Permanentny stan wyjątkowy
więcej podobnych podstron