
Własności koligatywne
Są
to
własności
roztworów
rozcieńczonych, których wartość zależy
tylko od ilości (liczby moli, liczby
cząsteczek) substancji rozpuszczonej
przypadającej
na
określoną
ilość
rozpuszczalnika lub roztworu.
Własności koligatywne
Obniżenie prężności pary
rozpuszczalnika nad roztworem
substancji nielotnej
Podwyższenie temperatury wrzenia
roztworu substancji nielotnej w
stosunku do czystego rozpuszczalnika
Obniżenie temperatury krzepnięcia
roztworu, w którym rozpuszczalnik i
substancja rozpuszczona tworzą układ
eutektyczny, w stosunku do czystego
rozpuszczalnika
Ciśnienie osmotyczne

Sposoby wyrażania stężeń
Ułamek molowy
Ułamek wagowy (zwykle wyrażany w
procentach)
Stężenie wagowe (masowe)
Stężenie molowe
Stężenie molarne
2
1
2
2
n
n
n
x
%
100
m
m
m
w
%
2
1
2
2
3
roztworu
2
2
w
dm
V
m
c
3
roztworu
2
2
dm
V
n
c
kg
m
n
c
1
2
2
m
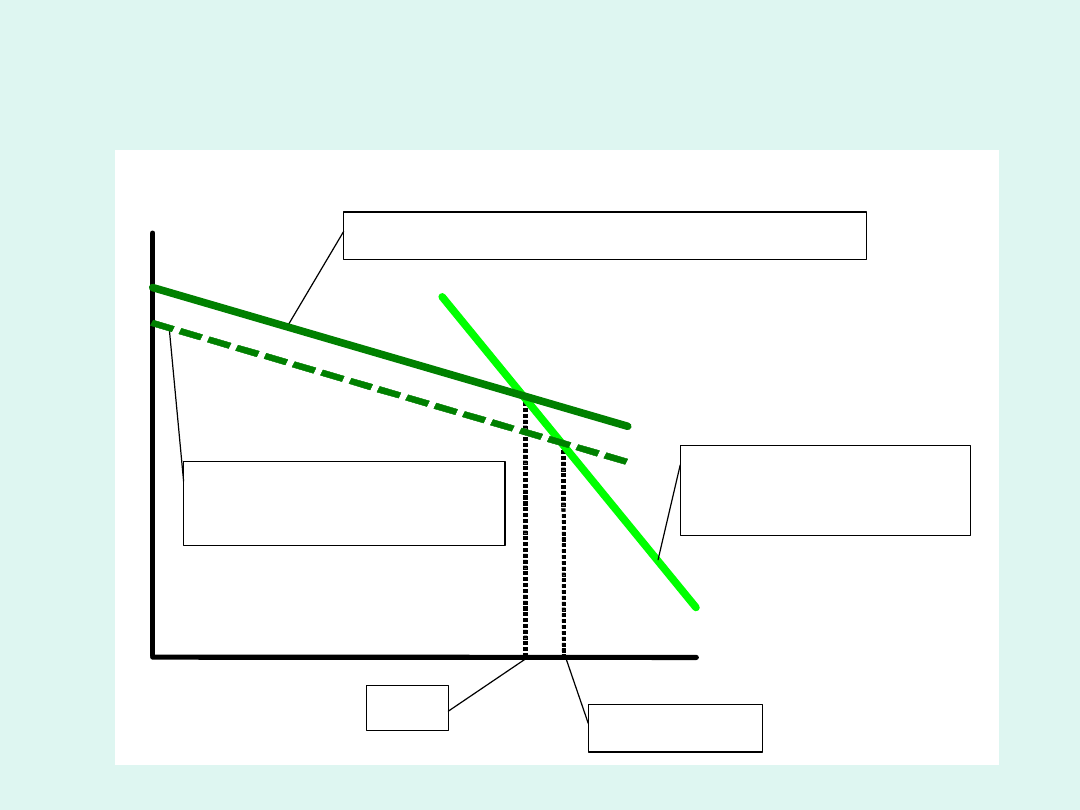
T
czysty ciekły rozpuszczalnik
rozpuszczalnik w
roztworze
pary
rozpuszczalnika
T
w (roztwór)
T
w
*
p = const
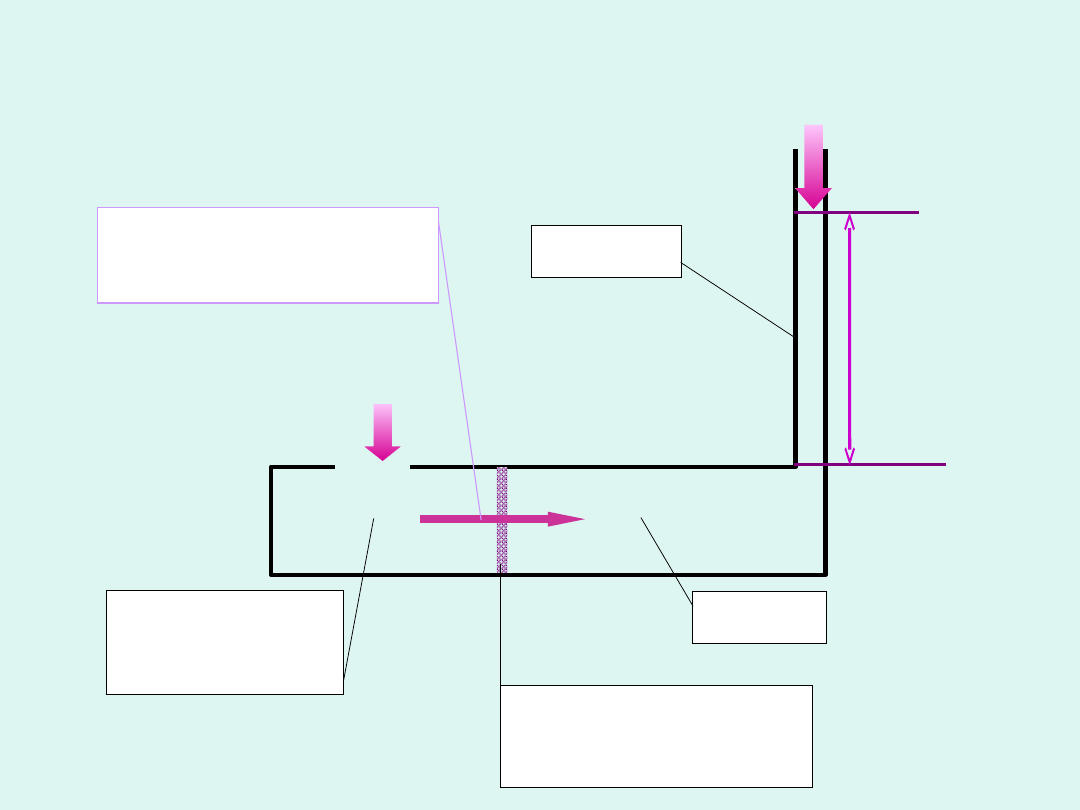
Podwyższenie temperatury wrzenia
roztworu substancji nielotnej
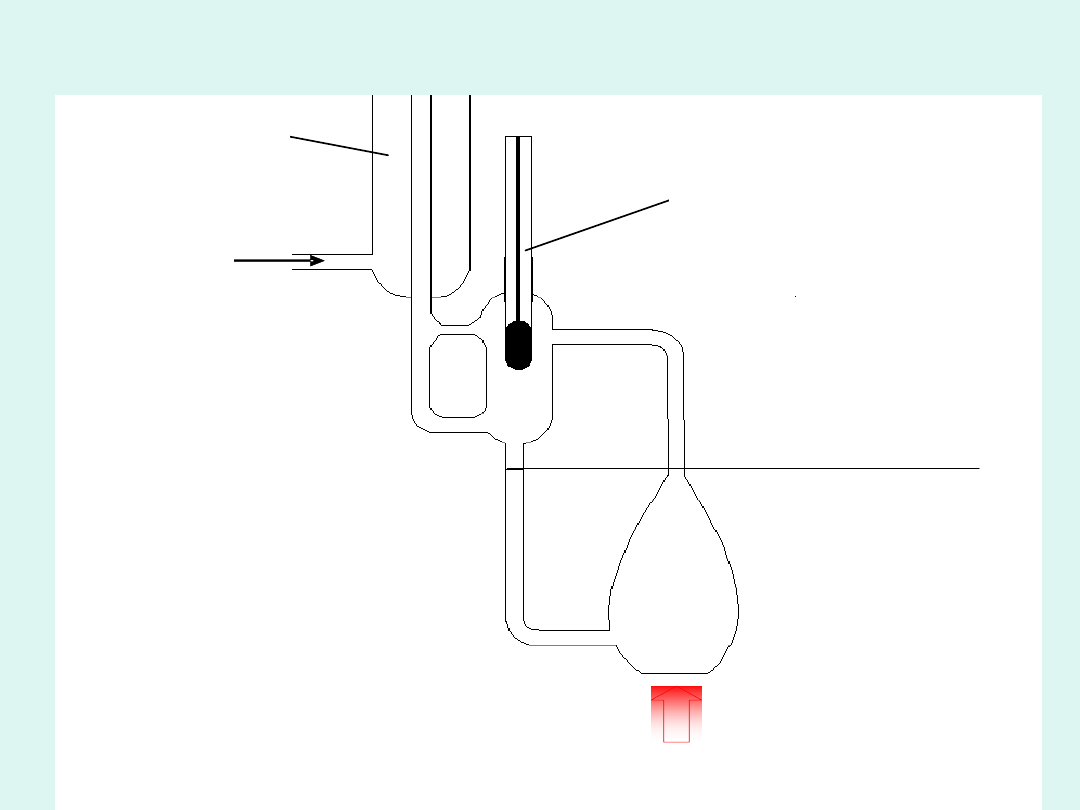
poziom roztworu
termometr Beckmana
wlot wody
chłodzącej
chłodnica
mikropalnik
Ebuliometr Świętosławskiego
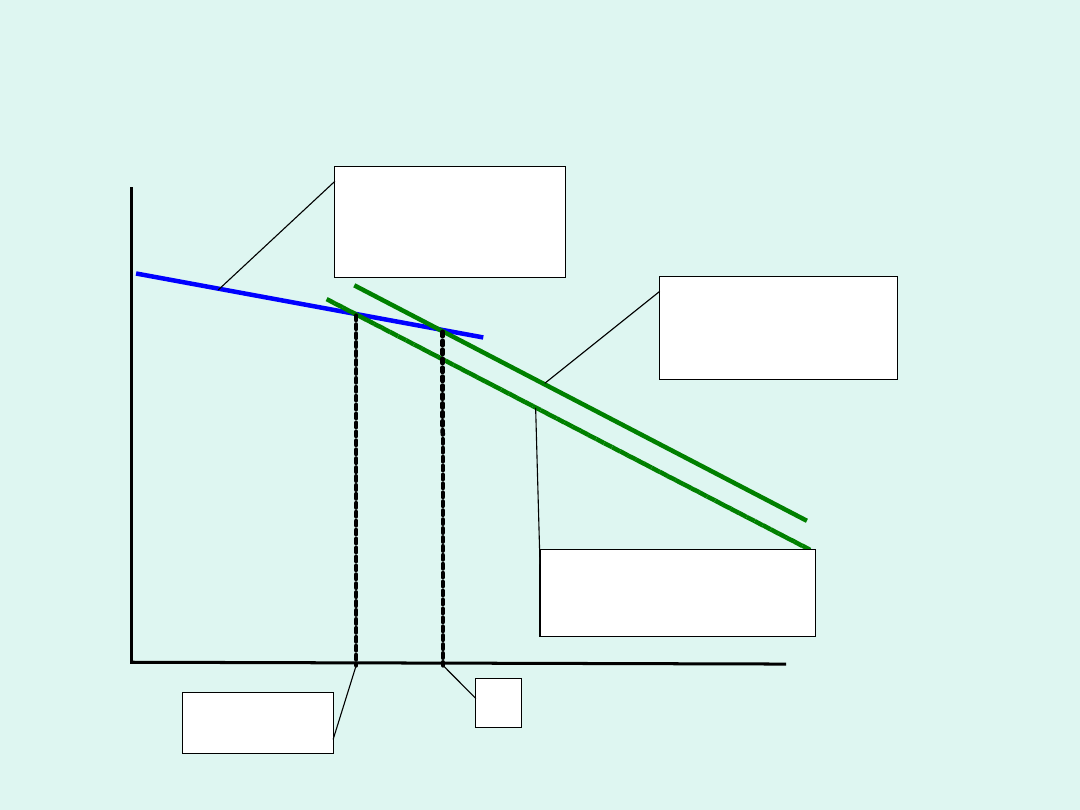
T
p =
const
czysty ciekły
rozpuszczal
nik
rozpuszczalnik
w roztworze
czysty stały
rozpuszczal
nik
T
t
*
T
t (roztwór)
Obniżenie temperatury krzepnięcia roztworu
substancji, która z rozpuszczalnikiem tworzy
układ eutektyczny
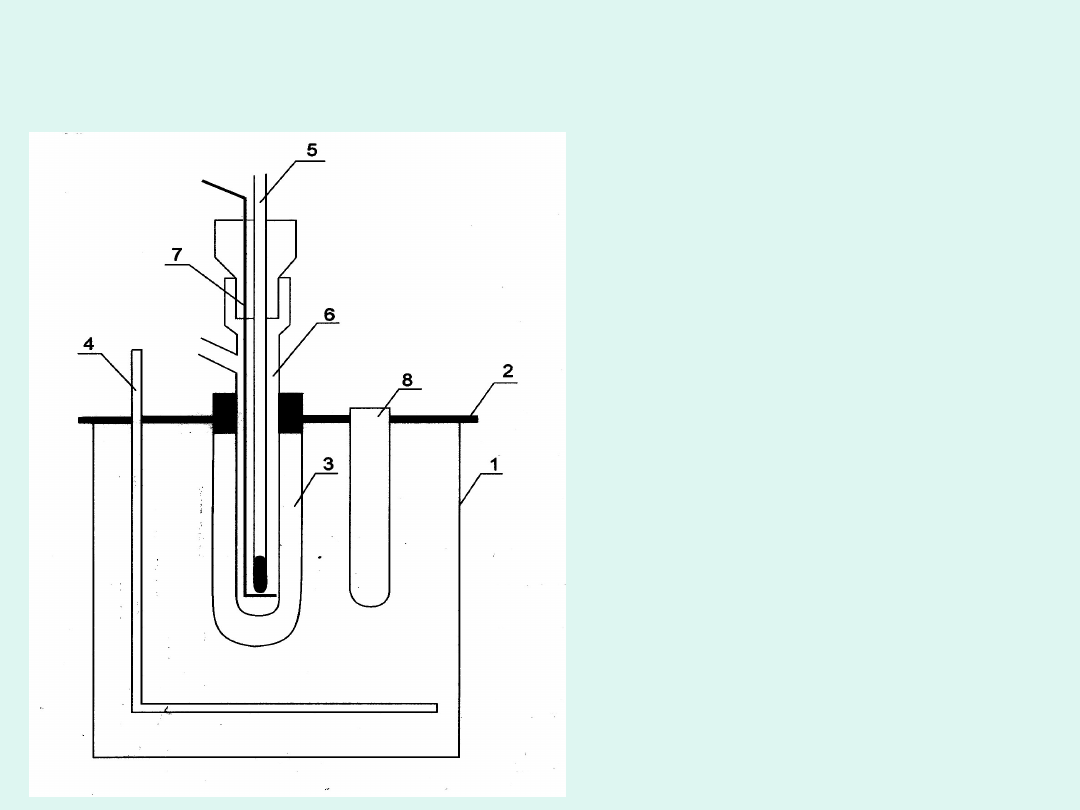
Kriometr Beckmana
1 - pojemnik z
mieszaniną
chłodzącą (NaCl +
lód)
2 - pokrywa
3 - probówka
ochronna
4 - mieszadło
5 - termometr
Beckmana
6 - naczyńko
kriometryczne
7 - mieszadło
8 - probówka
czysty
rozpuszczal
nik
roztwó
r
membrana
półprzepuszczal
na
kapilar
a
h
T = const
kierunek
migracji
rozpuszczalnika
p
o
p
=p-
p
o
Zjawisko osmozy i schemat
osmometru
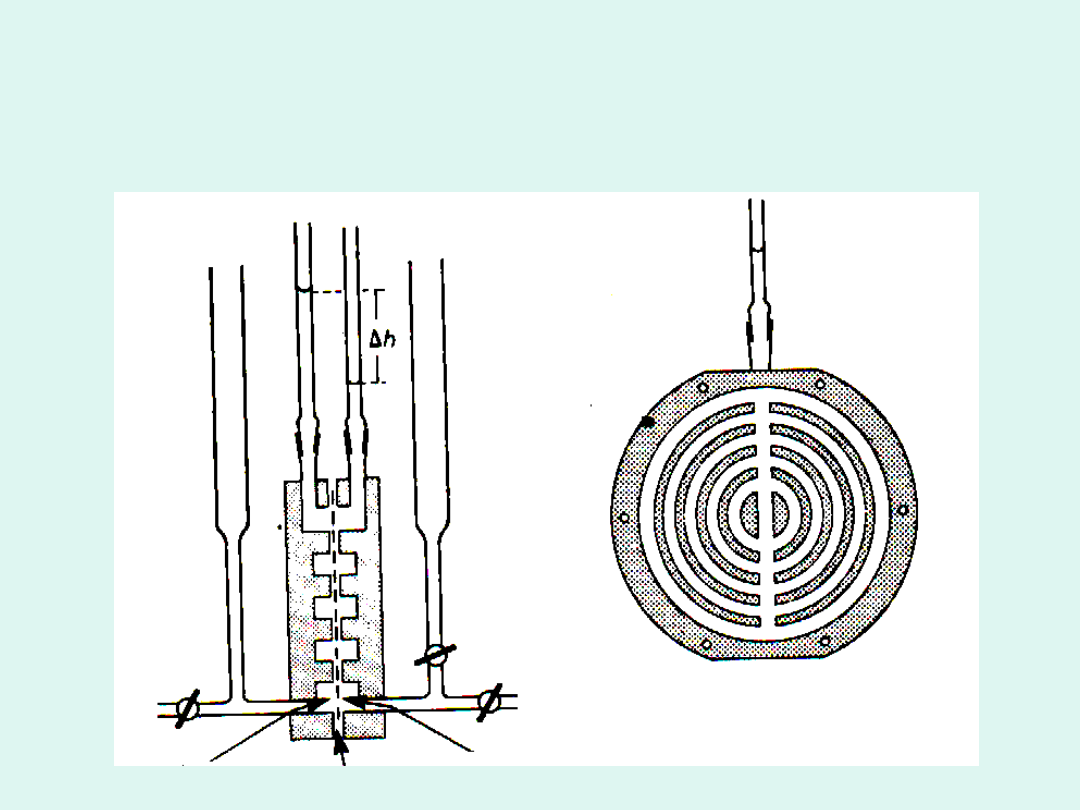
a)
b)
Schemat osmometru Fuossa-Meada
a) przekrój poprzeczny
b) wewnętrzna powierzchnia każdej polówki
osmometru

Przykład
: 2 g polimeru o masie cząsteczkowej
200 000 g/mol rozpuszczono w 100 ml CCl
4
. Obliczyć
obniżenie temperatury krzepnięcia roztworu oraz
ciśnienie osmotyczne w temperaturze 25°C. Stała
krioskopowa 30 kg·K/mol, gęstość 1,63 g/cm
3
.
Stężenie molarne polimeru
Obniżenie temperatury krzepnięcia
Najlepsza dokładność termometrów
± 0,002 K
Ciśnienie osmotyczne
Po przeliczeniu na wysokość słupa cieczy
kg
mol
5
m
kg
3
3
4
mol
g
2
2
1
2
2
2
m
10
135
,
6
10
63
,
1
m
10
200000
g
2
V
M
m
m
M
m
c
3
K
00184
,
0
10
135
,
6
30
c
K
T
kg
mol
5
mol
K
kg
2
m
k
k
Pa
9
,
247
m
10
200000
g
2
K
298
134
,
8
V
M
m
RT
RTc
3
4
mol
g
K
mol
J
2
2
2
mm
15,5
h
g
h
0
0
2
w
c
2
w
c
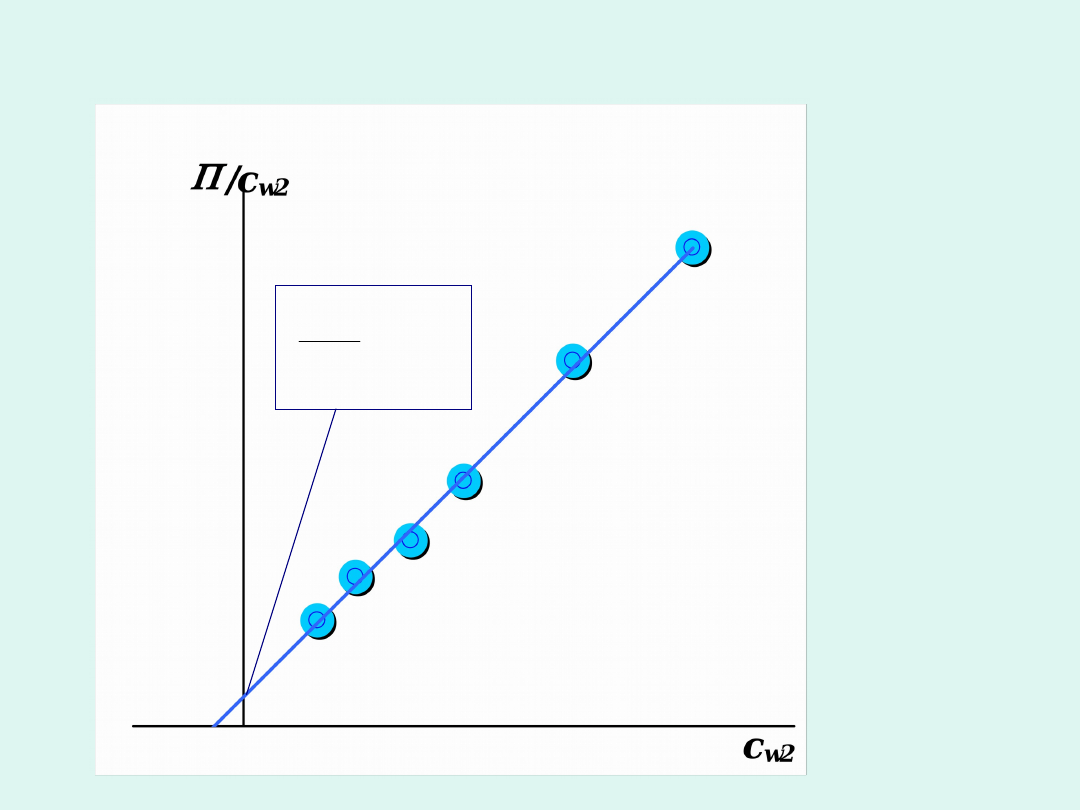
Wyznaczanie masy cząsteczkowej
polimeru na podstawie pomiarów
ciśnienia osmotycznego roztworów o
różnym stężeniu
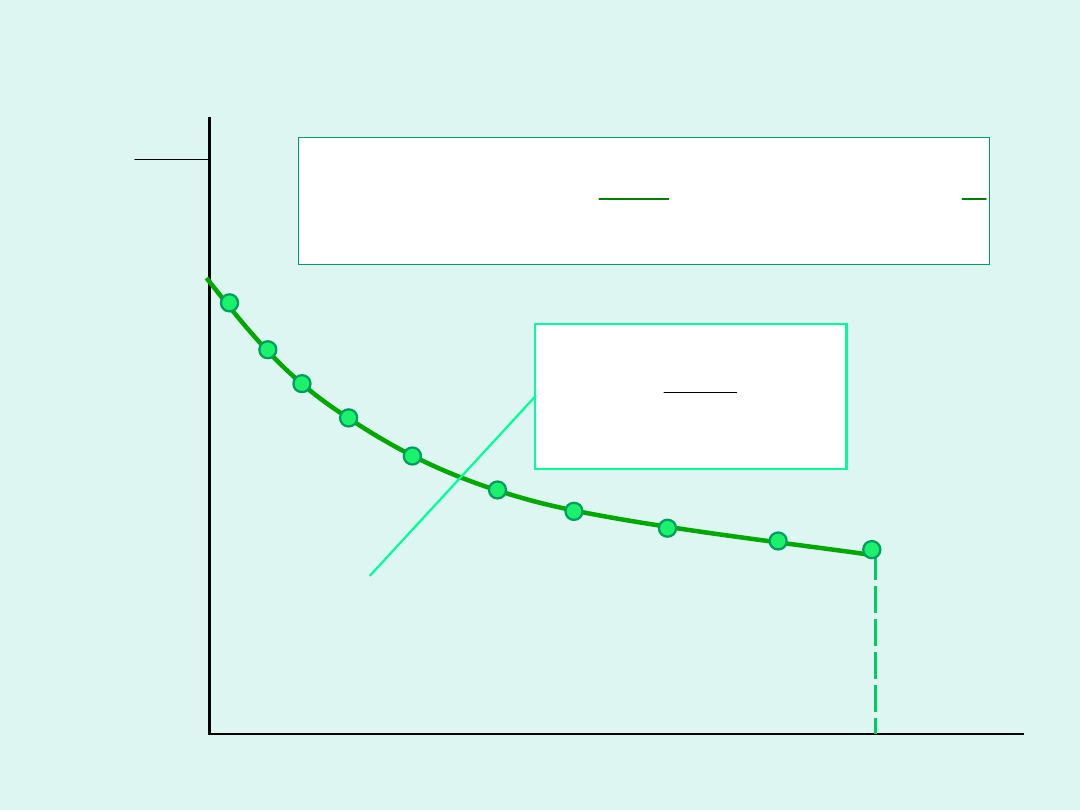
c
m2
0
2
m
2
m
c
0
c
2
m
2
m
dc
c
1
g
2
m
c
1
g
Wyznaczanie współczynnika aktywności
substancji rozpuszczonej w oparciu o
wielkości koligatywne
m2
m2
c
2
m2
m2
c
0
g 1
i
ln
g 1
dc gdzie g
c
�
-
g = - +
=
n
�
Document Outline
Wyszukiwarka
Podobne podstrony:
10 Wykład Ch F wielkości koligatywne
10 Wykład Ch F wielkości koligatywneid 11188 ppt
10 Wykład Ch F wielkości koligatywne 2id 11189 ppt
Wykład Ch F konduktometria
Wykład Ch F I zasada
Wykład Ch F potencjometria
5 Wykład Ch F II zasada1
Wykład Ch F gazy
więcej podobnych podstron