
Reakcje
red
ox
Układ redox to utleniacz i reduktor.
Jedno równanie reakcji redoks można rozłożyć na 2 równania cząstkowe.
Liczba elektronów oddawanych w jednym układzie musi być równa
liczbie elektronów pobranych w drugim układzie.
Utlenieniu
zawsze towarzyszy utrata (oddanie) elektronów i wzrost
stopnia utlenienia.
Redukcji
towarzyszy przyłączanie (pobranie) elektronów i zmniejszenie
stopnia utlenienia.
Utleniacz – substancja lub drobina, która ma zdolność przyłączania elektronów.
Utleniacz zmniejsza swój stopień utlenienia i jednocześnie podwyższa stopień
utlenienia innej drobiny lub substancji czyli utlenia.
Reduktor redukuje czyli obniża stopień utlenienia innej substancji lub drobiny
a tym samym podwyższa swój stopień utlenienia.

Każdemu procesowi utleniania zawsze towarzyszy proces redukcji.
Zasady oznaczanie stopnia utlenienia:
1. Stopień utlenienia atomów lub cząsteczek w stanie wolnym jest równy zeru.
0 0 0
Mg, Cl
2
, (MgCl
2
)
2.
Tlen
w połączeniach ma stopień utlenienia –II
II -II I -II I
MgO, H-O-H
Wyjątek
: w nadtlenkach stopień utlenienia tlenu wynosi –I.
I -I -I I
Np. nadtlenek wodoru H-O-O-H
3.
Wodór
w cząsteczkach związków i jonach złożonych ma stopień utlenienia I.
Wyjątek
: wodorki metali LiH, CaH
2
, BH
3
, AlH
3
stopień utlenienia wodoru –I.
4. Stopień utlenienia
fluoru
zawsze wynosi –I. Stopień utlenienia chloru, bromu
i jodu zależy od połączeń chemicznych.
5. Ładunek jonu jest równy sumie wszystkich stopni utlenienia atomów
wchodzących w jego skład.
I -I I I -II I III –II I V -II I VII –II I IV -II I -I III -II I
HCl, HClO, HClO
2
, HClO
3
, HClO
4
, Na
2
SO
3
, NaH, Fe(OH)
3

Czynności jakie należy wykonać przy pisaniu równań redoks:
1. Zapisać wszystkie substraty i produkty w równaniu reakcji.
2. Określić stopnie utlenienia wszystkich atomów.
3. Znaleźć atomy, w których zmieniają się stopnie utlenienia i określić
utleniacze i reduktory.
4. Dla utleniaczy i reduktorów zapisać równania połówkowe.
5. Wybrać możliwe najniższe wspólne mnożniki tych reakcji tak, aby liczba
elektronów dla jednego i drugiego równania połówkowego była równa.
6. Uzupełnić równanie reakcji w brakujące współczynniki.

SnCl
2
+ FeCl
3
SnCl
4
+ FeCl
2
II -I III
-I IV -I II -I
SnCl
2
+ FeCl
3
SnCl
4
+ FeCl
–
2
Równania połówkowe cząsteczkowo:
II -I IV -I
SnCl
2
SnCl
4
+ 2e | •1
III -I II -I
FeCl
3
+ e FeCl
2
| •2
II -I III -I IV -I II -I
Σ SnCl
2
+ 2 FeCl
3
+ 2e SnCl
4
+ FeCl
2
+ 2e
SnCl
2
+ 2 FeCl
3
SnCl
4
+ 2 FeCl
2
Równania połówkowe jonowo:
II IV
Sn Sn
+ 2e |• 1
III II
Fe + e Fe |• 2
II III IV II
Σ Sn + 2Fe + 2e Sn + 2 Fe
+ 2e
SnCl
2
+ 2 FeCl
3
SnCl
4
+ 2 FeCl
2
Jon Sn
2+
uległ
utlenieniu
(podwyższył swój stopień utlenienia), jest więc reduktorem.
Jon Fe
3+
uległ
redukcji
(obniżył swój stopień utlenienia), jest więc utleniaczem.

Mangan występuje w związkach
chemicznych w stopniu
utlenienia od +II do +VII.
konfiguracja elektronowa manganu:
25
Mn: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
5
Mangan ma 7 elektronów walencyjnych.
Reakcje redox z użyciem związków manganu
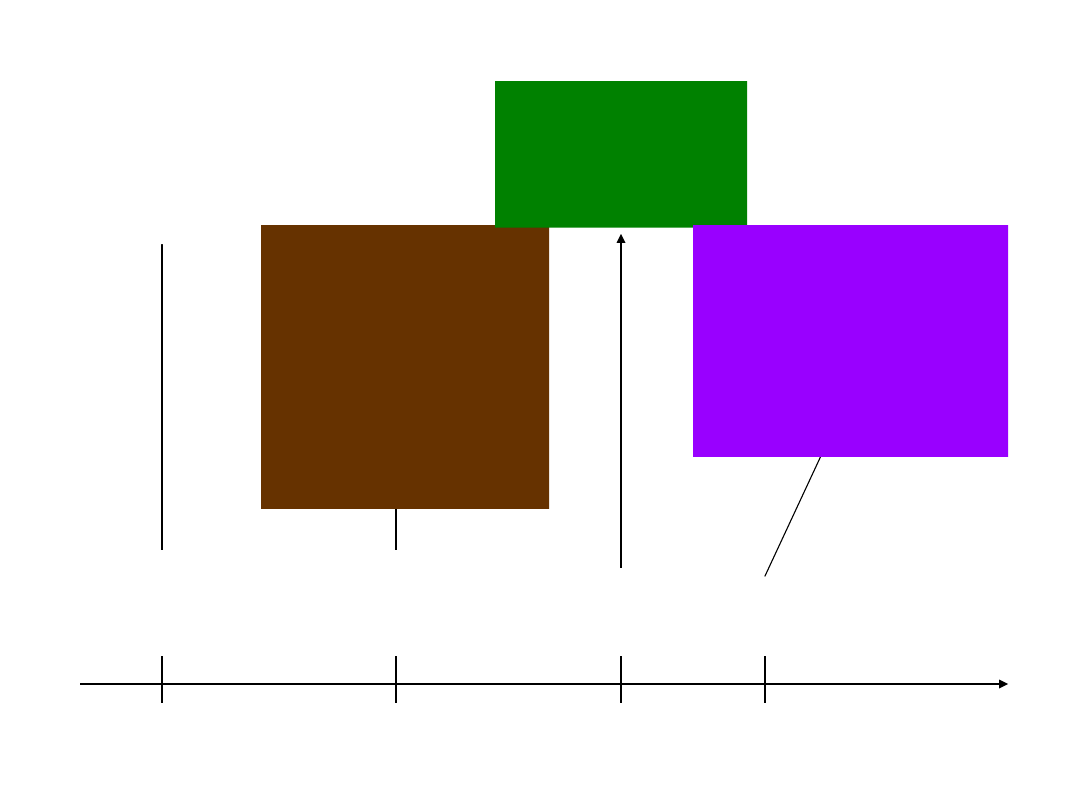
stopień
utlenienia
+II
+IV
+VI
+VII
bezbarwne
kationy
Mn
2+
brunatny
tlenek
manganu (IV)
MnO
2
zielone
aniony
MnO
4
2-
intensywnie
fioletowe
aniony
MnO
4
-

MnO
4
-
reduktor,
środowisk
o kwaśne
Mn
2+
reduktor,
środowisk
o
obojętne
MnO
2
reduktor,
środowisko
zasadowe
MnO
4
2-
równanie reakcji w środowisku kwaśnym
KMnO
4
+ K
2
SO
3
+ H
2
SO
4
-> MnSO
4
SO
4
+ K
2
SO
4
+
H
2
O
bilans elektronowy:
Mn(+VII) + 5e
-
->
Mn(+II)
S(+IV) -> S(+VI) + 2e
-
x2
x5
2
KMnO
4
+ 5 K
2
SO
3
+ 3 H
2
SO
4
-> 2 MnSO
4
+ 6 K
2
SO
4
+ 3
H
2
O
VII
II
Mn jest utleniaczem i redukuje się do jonu Mn w środowisku kwaśnym
IV
VI
S jest reduktorem i utlenia się do S

równanie reakcji redukcji KMnO
4
w
środowisku obojętnym:
2
KMnO
4
+ 3 K
2
SO
3
+ H
2
O -> 2
MnO
2
+ 3 K
2
SO
4
+ 2
KOH
lub jonowo:
2
MnO
4
-
+ 3 SO
3
2-
+ H
2
O -> 2
MnO
2
+ 3 SO
4
2-
+ 2 OH
-

równanie reakcji redukcji KMnO
4
w
środowisku zasadowym:
2
KMnO
4
+ K
2
SO
3
+ 2 KOH -> 2
K
2
MnO
4
+ K
2
SO
4
+
H
2
O
lub
jonowo
:
2
MnO
4
-
+ SO
3
2-
+ 2 OH
-
-> 2
MnO
4
2-
+ SO
4
2-
+
H
2
O

Anion manganianowy (VII)
najmocniejszym utleniaczem jest w
środowisku kwaśnym (redukuje się
o pięć stopni utlenienia), a
najsłabszym w środowisku
zasadowym.
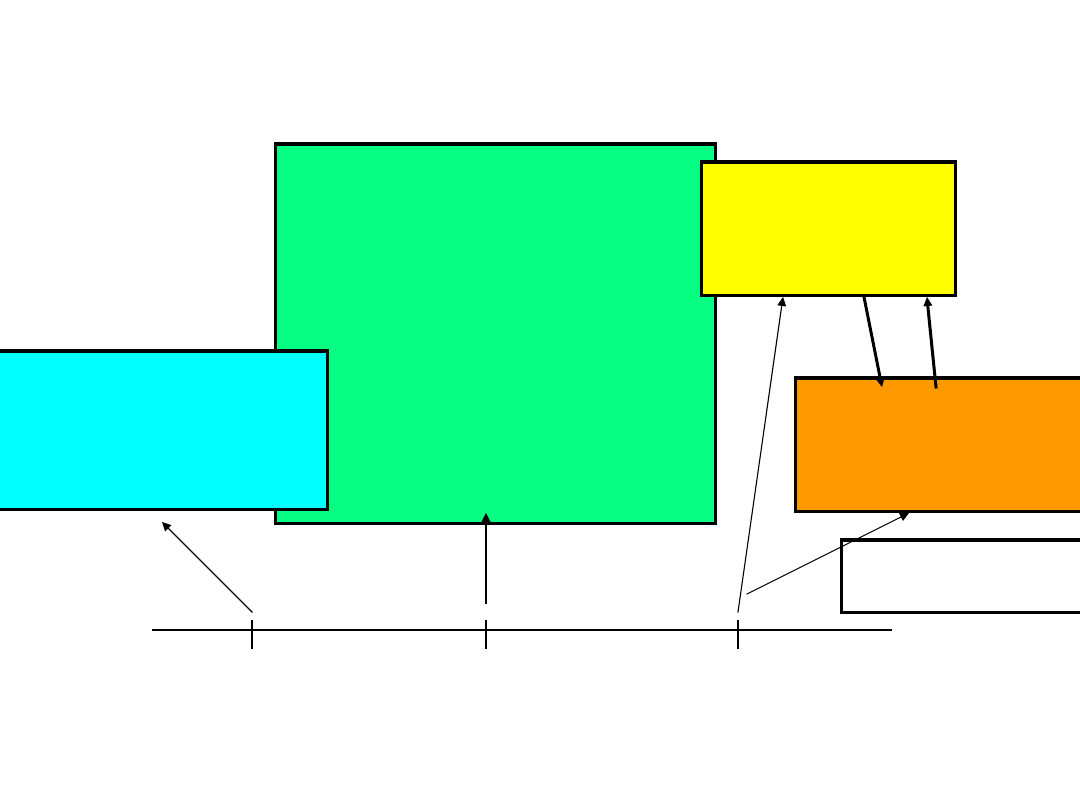
najczęściej używane reduktory
nieorganiczne i produkty ich
utlenienia
reduktor
produkt utlenienia
reduktora
aniony siarczanowe (IV)
SO
3
2-
aniony siarczanowe (VI)
SO
4
2-
aniony azotanowe (III)
NO
2
-
aniony azotanowe (V)
NO
3
-
kationy żelaza (II)
Fe
2+
kationy żelaza (II) Fe
3+
kationy cyny (II)
Sn
2+
kationy cyny (IV) Sn
4+
Chrom – stopnie utlenienia
Cr
II
Silny
reduktor
Cr
III
Reduktor
i utleniacz
Cr
VI
Silny
utleniacz
Amfoteryczny wodorotlenek
chromu(III) Cr(OH)
3
Cr(OH)
3
+ 3 H
+
Cr
3+
+ 3 H
2
O
Cr(OH)
3
+ 3 OH
-
Cr(OH)
6
3-
Sole Cr
3+
np. Cr
2
(SO
4
)
3
Siarczan(VI) chromu(III)
(zielony)
Oraz chromiany(III) Cr(OH)
6
3-
Np. K
3
Cr(OH)
6
Chromian(III) potasu (zielony)
Chromiany CrO
4
2-
Np. Na
2
CrO
4
Chromian sodu
żółty
Dichromiany Cr
2
O
7
2-
Np. K
2
Cr
2
O
7
Dichromian potasu
pomarańczowy
kwas
zasada
Kwasowy tlenek
chromu CrO
3
Zasadowy tlenek
chromu(II) CrO
Cr + 2 HCl CrCl
2
+ H
2
(bez tlenu)

Reakcje redoks z użyciem związków chromu
Dichromiany VI to sole nietrwałego kwasu dichromowegoVI
H
2
Cr
2
O
7
(pomarańczowy kolor).
Najbardziej znana sól dichromianVI potasu K
2
Cr
2
O
7
.
W środowisku alkalicznym dichromianyVI przechodzą w chromianyVI (żółty kolor).
K
2
Cr
2
O
7
+ 2 KOH 2 K
2
CrO
4
+ H
2
O
to nie jest reakcja redox
pomarańczowy
żółty
W środowisku kwaśnym chromianyVI przechodzą z powrotem w dichromianyVI
2 K
2
CrO
4
+ H
2
SO
4
K
2
Cr
2
O
7
+ K
2
SO
4
+ H
2
O
to nie jest reakcja redox
żółty
pomarańczowy

Reakcje redoks z użyciem związków chromu
Dichromiany i chromiany to bardzo silne utleniacze.
W środowisku kwaśnym w obecności reduktora jony dichromianowe (
pomaran)
i jony chromianowe (
żólte
) redukują się do
zielonych
jonów Cr
3+.
K
2
Cr
2
O
7
+ K
2
SO
3
+ H
2
SO
4
Cr
2
(SO
4
)
3
+ K
2
SO
4
+ H
2
O
VI III
Cr
2
O
7
2-
+ 6e 2 Cr
3+
| • 1
IV VI
SO
3
2-
SO
4
2-
+ 2e | • 3
Cr
2
O
7
2-
+ 3 SO
3
2-
+ 6e 2 Cr
3+
+ 3 SO
4
2-
+ 6e
K
2
Cr
2
O
7
+ 3 K
2
SO
3
+ H
2
SO
4
Cr
2
(SO
4
)
3
+ K
2
SO
4
+ H
2
O
Liczymy atomy K, S, H. Po lewej: 8K, uzupełniamy po prawej wstawiając
4 K
2
SO
4
. Wtedy po prawej jest 7S. Wstawiamy po lewej 3H
2
SO
4
. Po lewej jest 6H,
wstawiamy po prawej 3H
2
O. Zostały do policzenia atomy O. Po lewej 31O,
po prawej 31O. Równanie zbilansowano poprawnie.
Ostateczna postać równania:
K
2
Cr
2
O
7
+ 4 K
2
SO
3
+ 3 H
2
SO
4
Cr
2
(SO
4
)
3
+ 4 K
2
SO
4
+ 3H
2
O

Zadania:
1. Które z reakcji są reakcjami redoks, a które nie są? Dobrać współczynniki
reakcji i napisać nazwy substratów i produktów.
P
4
+ HNO
3
+ H
2
O H
3
PO
4
+ NO
K
2
SO
3
+ I
2
+ KOH K
2
SO
4
+ KI + H
2
O
HNO
3
+ CuO Cu(NO
3
)
2
+ H
2
O
CuS + HNO
3
Cu(NO
3
)
2
+ NO + S + H
2
O
Cr
2
O
3
+ KOH K
3
CrO
3
+ H
2
O
MnO
2
+ HCl MnCl
2
+ Cl
2
+ H
2
O
K
2
Cr
2
O
7
+ KOH K
2
CrO
4
+ H
2
O
P
2
O
5
+ H
2
O H
3
PO
4

2. Zbilansuj reakcje redoks:
KMnO
4
+ K
2
SO
3
+ H
2
O MnO
2
+ K
2
SO
4
+ KOH
KMnO
4
+ K
2
SO
3
+ KOH K
2
MnO
4
+ K
2
SO
4
+ H
2
O
P
4
+ HNO
3
+ H
2
O H
3
PO
4
+ NO
MnO
2
+ HCl MnCl
2
+ Cl
2
+ H
2
O
K
2
SO
3
+ I
2
+ KOH K
2
SO
4
+ KI + H
2
O
HI + H
2
SO
4
I
2
+ H
2
S + H
2
O
SnCl
2
+ FeCl
3
SnCl
4
+ FeCl
2
Au + HNO
3
+ HCl HAuCl
4
+ NO
2
+ H
2
O
Roztwory
Roztwór – powstaje w wyniku fizycznego zmieszania kilku faz lub kilku składników
jednofazowych lub w wyniku roztwarzania i jest układem homogenicznym.
Składniki roztworu – rozpuszczalnik i substancje rozpuszczone
Rozpuszczalność –maksymalna ilość substancji jaka rozpuszcza się
w 100 g rozpuszczalnika w danej temperaturze.
Rozpuszczalność zależy od rodzaju substancji rozpuszczonej, rozpuszczalnika
i temperatury.
Rodzaje roztworów:
•Nasycone – maksymalne stężenie substancji rozpuszczonej w danej
temperaturze w obecności fazy stałej.
•Nienasycone – stężenie jest mniejsze niż w roztworach nasyconych.
•Przesycone – stężenie większe od rozpuszczalności w danej temperaturze
(układ metastabilny).
Stężenia roztworów:
•Procentowe wagowe
•Molowe - ilość moli związku w 1 dm
3
roztworu

Stała równowagi reakcji
Stała równowagi reakcji chemicznych opisuje stan równowagi odwracalnych
reakcji chemicznych.
Reakcja jest w stanie równowagi wtedy gdy szybkość reakcji w stronę od substratów
do produktów jest taka sama jak w stronę od produktów do substratów.
mA + nB
pC + qD
Stała równowagi tej reakcji:
[C]
p
[D]
q
K =
___________________
[A]
m
[B]
n
Nawiasy kwadratowe oznaczają stężenia molowe w przypadku roztworów
lub molowe ciśnienia cząstkowe w przypadku gazów.
Przykład: prosta reakcja syntezy
Dane doświadczalne:
Użyto 1 mol związku A i 1 mol związku B
Objętość po reakcji 1dm
3
Równowaga ustala się po przereagowaniu 30%
substratów.
[A] = 0,7 mola/dm
3
, [B] = 0,7 mola/dm
3
,
[AB] = 0,3 mola/dm
3
AB
[AB]
1
K
=
______________
[A]
1
[B]
1
[0,3mol/dm
3
]
1
K
=
___________________________________
= 0,61mol
–1
dm
3
[0,7mol/dm
3
]
1
[0,7mol/dm
3
]
1
A + B
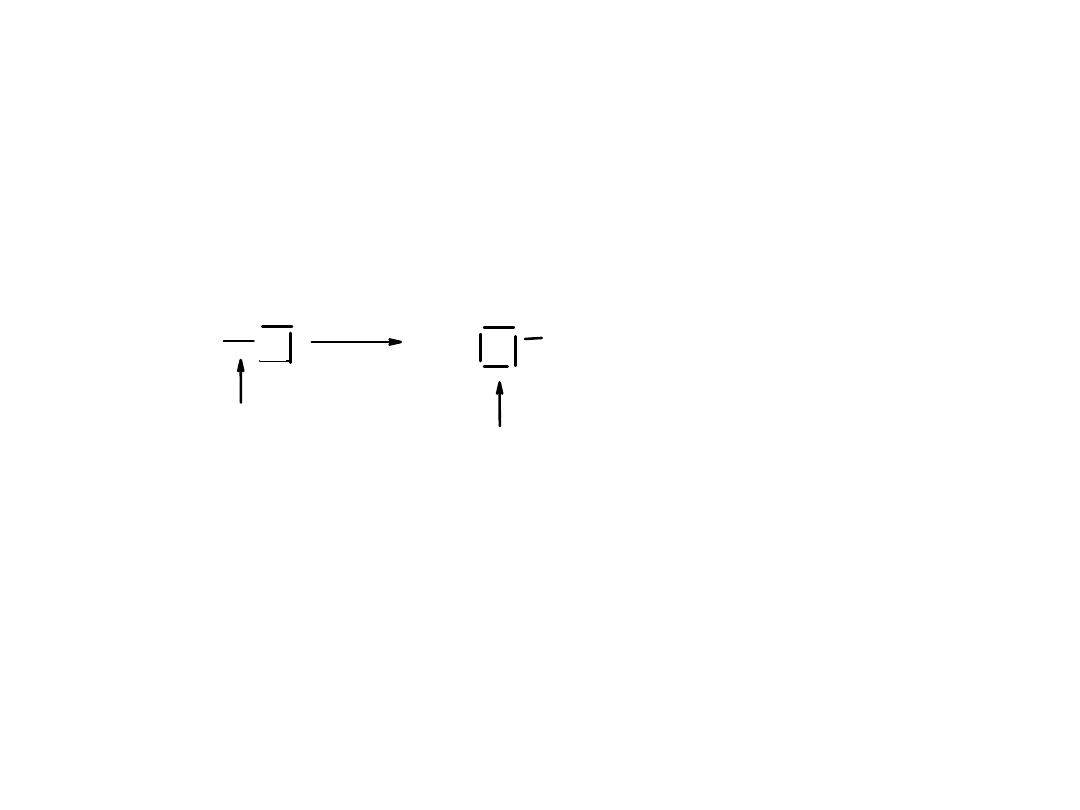
Reakcje w roztworach
Dysocjacja jonowa. Roztwory elektrolitów
Dysocjacja chlorku sodu: NaCl Na
+
+ Cl
-
Polarne cząsteczki wody ustawiają się dodatnimi biegunami w kierunku jonów Cl
-
i biegunami ujemnymi w kierunku jonów Na
+
.
Rozpuszczanie gazowego chlorowodoru w wodzie (tworzenie kwasu solnego):
H
Cl
Cl
H
+
+
Spolaryzowane wiązanie
tworzone przez uwspólnioną
parę elektronów
Na skutek przeniesienia
pary elektronów do atomu
chloru przekształca się on
w jednoujemny jon chlorkowy
Dysocjacja jonowa to rozpad kryształów jonowych lub cząsteczek polarnych
na jony pod wpływem wody.

Elektrolity – substancje, których wodne roztwory przewodzą prąd elektryczny
(sole, kwasy, zasady)
Nieelektrolity - substancje, których wodne roztwory nie przewodzą prądu
Elektrycznego (czysta destylowana woda, cukier)
liczba cząsteczek zdysocjowanych na jony
Stopień dysocjacji elektrolitu α
=
_______________________________________________________________
liczba wszystkich cząsteczek
0 < α < 1 0% < α < 100%
Elektrolity mocne – elektrolity silnie zdysocjowane, α – ok. 1
Elektrolity słabe – elektrolity zdysocjowane na jony częściowo,
α rzędu kilku procent
α zależy od stężenia elektrolitu, dysocjacja wzrasta gdy maleje stężenie roztworu.
W roztworach bardzo rozcieńczonych α osiąga wartość ok. 100%
dla każdego elektrolitu.
Słabe elektrolity dysocjują wg równania. Jest to proces odwracalny.
AB
A
+
+ B
—
Stała dysocjacji elektrolitycznej K
c
ma sens tylko dla słabych elektrolitów
c(A
+
)c(B
–
)
K
c
=
_______________
c(AB)
c(A
+
) i c(B
–
) stężenia molowe kationu i anionu
c(AB) stężenie molowe części niezdysocjowanej elektrolitu

Oznaczmy przez
c
całkowite stężenie molowe substancji rozpuszczonej w wodzie,
wówczas
c(A
+
) = c(B
–
) = αc oraz c(AB) = (1-α)c
Podstawiając te dane do równania na K
c
(poprzedni slajd) otrzymujemy
α
2
c
K
c
=
_______
Dla małych wartości α, 1 – α ~ 1,
1 – α
Wtedy
K
c
=
α
2
c
Dysocjacja kwasów i zasad
Wg teorii Arrheniusa
kwasy to związki, które dysocjując w roztworze,
odszczepiają jony wodorowe H
+
(protony)
zasady to związki, które odszczepiają jony wodorotlenowe OH
–
HA H
+
+ A
–
MOH M
+
+ OH
–
Wg teorii Brönsteda
kwasy to substancje, które mogą oddawać proton,
zasady to substancje zdolne do pobrania protonu
Proton nie może istnieć w stanie wolnym w roztworze i łączy się z cząsteczką wody
tworząc jon hydroksoniowy H
+
+ H
2
O H
3
O
+
Dysocjacja kwasu lub zasady w roztworze wodnym polega na reakcji
z cząsteczkami wody
.

Dysocjacja kwasu HA przebiega wg równania:
HA + H
2
O
H
3
O
+
+ A
–
Stąd wzór na stałą równowagi:
c(H
3
O
+
)c(A
–
)
K
c
=
________________________
c(HA)c(H
2
O)
W roztworach rozcieńczonych stężenie wody c(H
2
O) jest bardzo duże,
zachowuje więc wartość stałą niezależnie od zmiany stężeń pozostałych
składników roztworu.
C
H2O
= ilość moli wody w 1dm
3
= 1000g : 18g/mol = 55,6 mola H
2
O
Łącząc stałą K
c
i c(H
2
O) otrzymamy wzór na stałą dysocjacji kwasu:
c(H
3
O
+
)c(A
–
)
K
c(HA)
=
____________________
c(HA)
Podobnie można wyprowadzić wzór na stałą dysocjacji zasady B:
B + H
2
O
BH
+
+ OH
–
c(BH
+
)c(OH
–
)
K
c
=
__________________________
c(B)c(H
2
O)
c(BH
+
)c(OH
–
)
K
c(B)
=
__________________________
c(B)

Dysocjacja kwasów
•Kwasy jednoprotonowe:
HNO
3
H
+
+ NO
3
–
anion
azotowy
c(H
+
)c(NO
3
–
)
K =
__________________
c(HNO
3
)
•Kwasy wieloprotonowe
H
3
PO
4
H
+
+ H
2
PO
4
–
anion
diwodorofosforanowy(V)
c(H
+
)c(H
2
PO
4
)
–
K
1
=
_____________________
c(H
3
PO
4
)
K
1
H
2
PO
4
–
K
2
H
+
+ HPO
4
2–
anion
wodorofosforanowy(V)
c(H
+
)c(HPO
4
)
2–
K
2
=
_____________________
c(H
2
PO
4
)
–
HPO
4
2–
K
3
H
+
+ PO
4
3–
anion
fosforanowy(V)
c(H
+
)c(PO
4
)
3–
K
3
=
_____________________
c(HPO
4
)
2–
K
1
K
2
K
3

Elektrolity mocne i słabe
Im więcej jonów znajduje się w roztworze elektrolitu, tym większe będzie
natężenie prądu płynącego przez roztwór.
Elektrolity mocne:
•Część soli
•Wodorotlenki litowców i berylowców z wyjątkiem Be(OH)
2
•Kwasy: solny HCl, siarkowy(VI) H
2
SO
4
, azotowy(V) HNO
3
, chlorowy(VII)
Pozostałe kwasy: chlorowy(I), chlorowy(III), chlorowy(V), siarkowy(IV),
siarkowodorowy, cyjanowy HCN, borowy H
3
BO
3
, węglowy H
2
CO
3
są słabymi kwasami i słabymi elektrolitami
H
3
PO
4
kwas ortofosforowy jest średniej mocy kwasem.

Zadania:
1. Obliczyć stopień dysocjacji α pewnego słabego kwasu 1-protonowego,
jeżeli stała dysocjacji kwasu wynosi K = 1,70·10
-5
a stężenie 0,1 mol/dm
3
.
2. Napisać równania wieloetapowej dysocjacji kwasu siarkowego(VI) i wzory
na stałe równowagi każdego etapu. Stała równowagi którego etapu jest
największa?
3. Napisać równania wieloetapowej dysocjacji wodorotlenku magnezu i wzory
na stałe równowagi każdego etapu. Stała równowagi którego etapu jest
największa?
4. Obliczyć stałą hydrolizy K
β
pewnej soli, jeżeli stopień hydrolizy β wynosi
0,5% a stężenie 0,2 mol/dm
3
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
Plan wykładu 3 ogarnijtemat com
Plan wykładu 4 ogarnijtemat com
Plan wykładu 5 ogarnijtemat com
wyklad 8 ogarnijtemat com
Wykład 4 OgarnijTemat com
wykład 5 OgarnijTemat com
Analiza Wykład 6 (16 11 10) ogarnijtemat com
Plan wykładu 3aaaa ogarnijtemat.com, Chemia
więcej podobnych podstron