
Oznaczanie aktywności
wieloenzymowego układu
fotosyntetycznego

Chloroplasty
• Eukariotyczne organellum
komórkowe otoczone podwójną błoną
białkowo-lipidową,
• rodzaj plastydów,
• zawierają zielony barwnik – chlorofil-
zlokalizowany w granach,
• w ich wnętrzu przebiegają reakcje
składające się na proces fotosyntezy.

Fotosynteza
• proces anaboliczny,
• zależna od światła asymilacja
dwutlenku węgla i wody z
utworzeniem węglowodanów i tlenu
cząsteczkowego,
• zachodzą dwa rodzaje reakcji
świetlnych wynikające z aktywności
dwóch fotosystemów.

Fotosystem
• jest kompleksem barwnikowo-lipidowo-
białkowym absorbującym kwanty światła
• chlorofil występujący w centrum reakcji
PSI wykazuje maksimum absorbancji
światła przy 700nm, a chlorofil z
centrum reakcji PSII ma maksimum
absorbancji przy 680nm,
• te dwa fotosystemy łączy łańcuch
transportu elektronów.
• proces rozpoczyna się od fotosystemu II.

Pomiar aktywności
fotosystemów
• Aktywność obydwu układów mierzy
się stosując sztuczne donory i
akceptory elektronów,
• odpowiednio dostarczając dzięki
temu lub pobierając elektrony w
różnych miejscach łańcucha
fotosyntetycznego.

Pomiar aktywności PS II
• Produkt reakcji zachodzącej w PS II –
tlen,
• Aktywność = szybkość wydzielania
tlenu przez chloroplasty,
• Do pomiarów używamy elektrody
tlenowej Clarka.

Pomiar aktywności PS I
• Aktywność można oznaczać również
za pomocą elektrody Clarka stosując
sztuczne donory i akceptory
elektronów,
(zredukowana forma drugiego
akceptora elektronów ulegając
samoutlenieniu wytwarza rodnik
ponadtlenowy, co wymaga obecności
tlenu => jest to reakcja Mehlera)

Elektroda tlenowa Clarka
• Jest dość czuła, potrafi zmierzyć stężenie
tlenu, wynoszące nawet:0,1 mmol/l.
• Składa się z:
Katody– polaryzująca się, pomiarowa,
Anody – niepolaryzująca, elektroda
odniesienia.
• Obie elektrody zanurzone są w roztworze
elektrolitu (nasycony roztwór KCl) i
oddzielone od badanej zawiesiny błoną
teflonową.

• Prąd pomiędzy nimi płynie jedynie przez płyn
elektrodowy, a tlen dyfunduje przez błonę do
elektrolitu.
• Sygnałem wyjściowym elektrody jest natężenie
prądu, które jest proporcjonalne do ciśnienia
parcjalnego tlenu lub stężenia w elektrolicie.
• W chwili doprowadzenia napięcia do elektrod w
roztworze następuje elektrolityczna redukcja
tlenu, początkowo do nadtlenku wodoru, a
następnie do jonu hydroksylowego. Źródłem
elektronów redukujących tlen jest utleniająca
się anoda.

Charakteryzacja układu
fotosyntetycznego
• Dzięki zastosowaniu szeregu
inhibitorów, np. DBMIB, kwas
tłuszczowy, hydroksyloamina
• Kontrola fotosyntetyczna = stosunek
szybkości transportu elektronów przed
dodaniem ADP i fosforanu do szybkości
transportu elektronów po ich dodaniu
• Jony amonowe rozprzęgają specyficznie
fosforylację fotosyntetyczną.

Wykonanie pomiarów
• Przyjmujemy następujące wartości
dotyczące nasycenia mieszanin tlenem:
100% - napowietrzona w temp.25 stopni
mieszanina rekacyjna
0% - mieszanina reakcyjna nasycona
azotem w temp. 25 stopni
Pomiary wykonujemy wyłączając źródło
światła po dodaniu zawiesiny
chloroplastów.

Pomiary wydzielania tlenu –
PS II
• Mieszanina nasycona azotem +
chloroplasty => otrzymać przebieg
prostoliniowy wydzielania tlenu
• Dodajemy DCMU – dalsze oznaczenia
• Dodajemy kwas linolenowy – dalsze
oznaczenia.
• Związki te działają jako inhibitory
fotosyntezy.

Pomiary pobierania tlenu
• Wykonujemy w celu oznaczenia
aktywności całego łańcucha
fotosyntetycznego.
• Natlenowana mieszanina reakcyjna +
chloroplasty:
• + metyloamina – przeprowadzić
oznaczenia
• + DBMIB – przeprowadzić oznaczenia
• -związki te są inhibitorami systemu.

Oznaczanie aktywności PS I
• Mieszanina reakcyjna (zawierająca
Tris, askorbinian sodu, TMPD, MV) +
DCMU + chloroplasty.
• Reakcję przeprowadzać aż do
wyczerpania się tlenu.
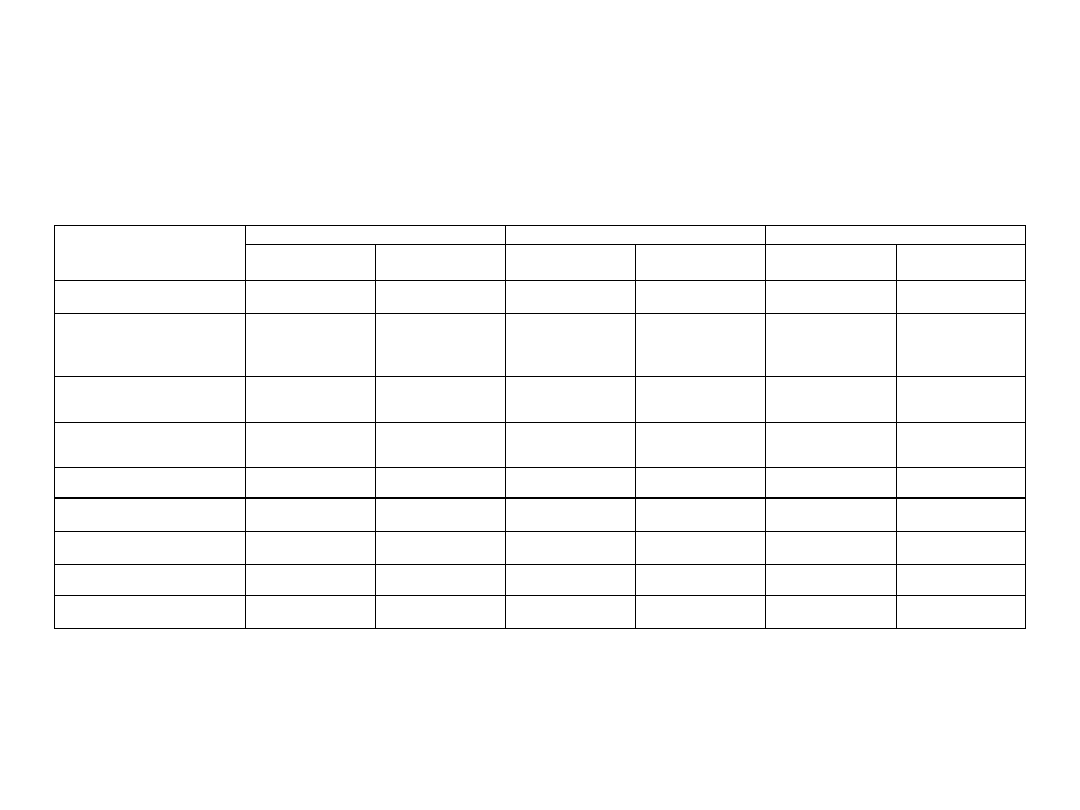
WYNIKI
1.
2.
3.
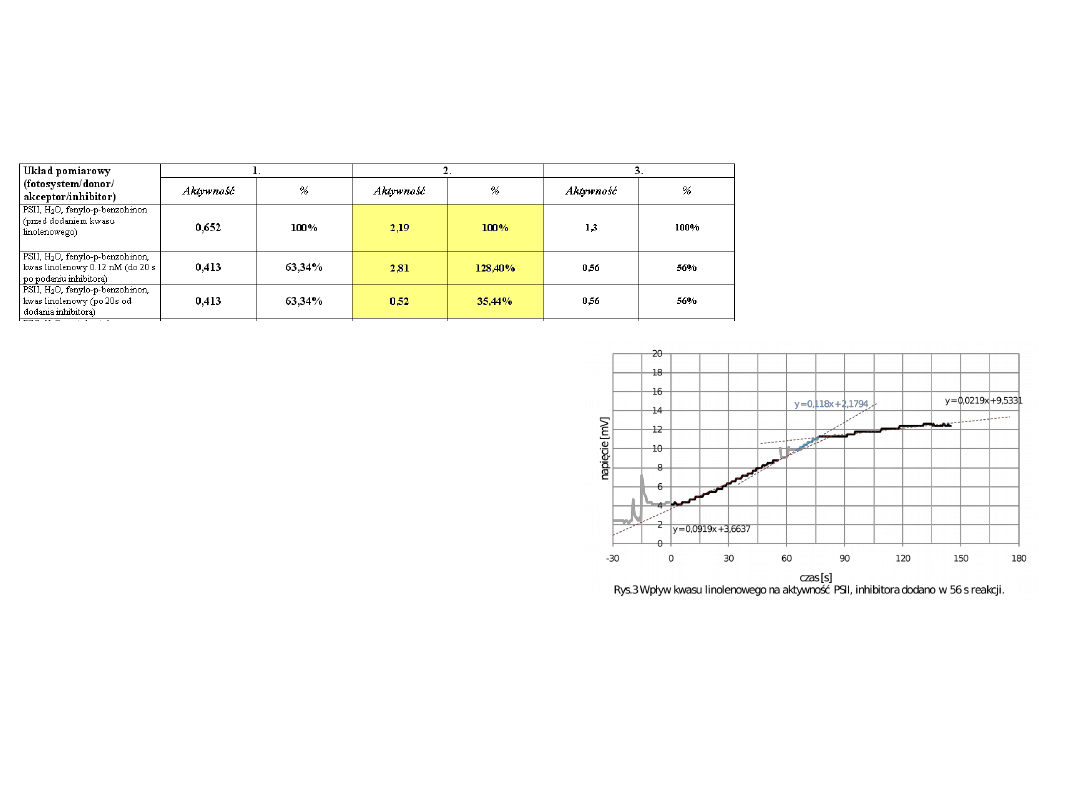
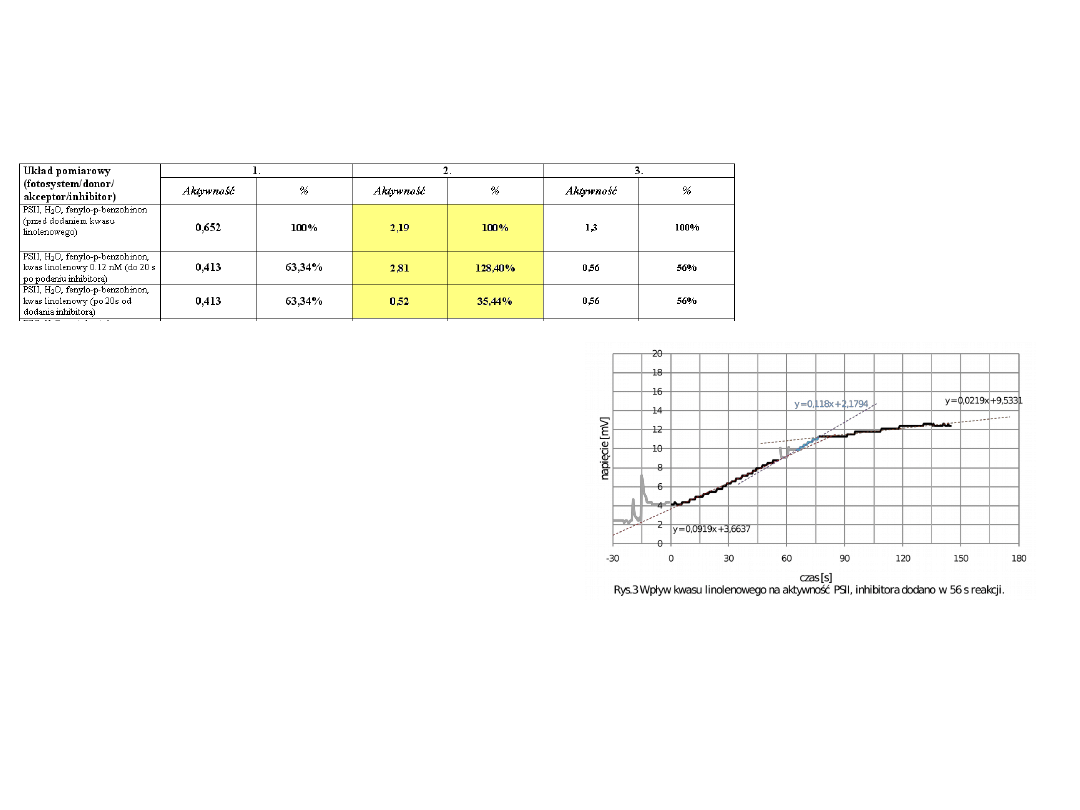
Układ pomiarowy
(fotosystem/donor/
akceptor/inhibitor)
Aktywność
%
Aktywność
%
Aktywność
%
PSII, H
2
O, fenylo-p-benzohinon
0,995
100%
2,82
100%
1,3
100%
PSII, H
2
O, fenylo-p-benzohinon
(przed dodaniem kwasu
linolenowego)
0,652
100%
2,19
100%
1,3
100%
PSII, H
2
O, fenylo-p-benzohinon,
kwas linolenowy 0.12 nM (do 20 s
po podaniu inhibitora)
0,413
63,34%
2,81
128,40%
0,56
56%
PSII, H
2
O, fenylo-p-benzohinon,
kwas linolenowy (po 20s od
dodania inhibitora)
0,413
63,34%
0,52
35,44%
0,56
56%
PSII, H
2
O, fenylo-p-benzohinon
DCMU
0,444
44,62%
Nie
wyszło
Nie
wyszło
0,51
61%
PSC, H
2
O, metylowiologen
0,297
100%
0,56
100%
-
-
PSC, H
2
O, metylowiologen,
metyloamina 3 mM
0,681
229,3%
2,02
362,28%
0,8
160%
PSC, H
2
O, metylowiologen,
DBMIB 8,3 µM
0,166
64,84%
0
0%
-
-
PSI, TMPD, metylowiologen
1,102
100%
4,13
100%
1,26
100%
Wyniki wykonywanych pomiarów przez 3 niezależne zespoły:
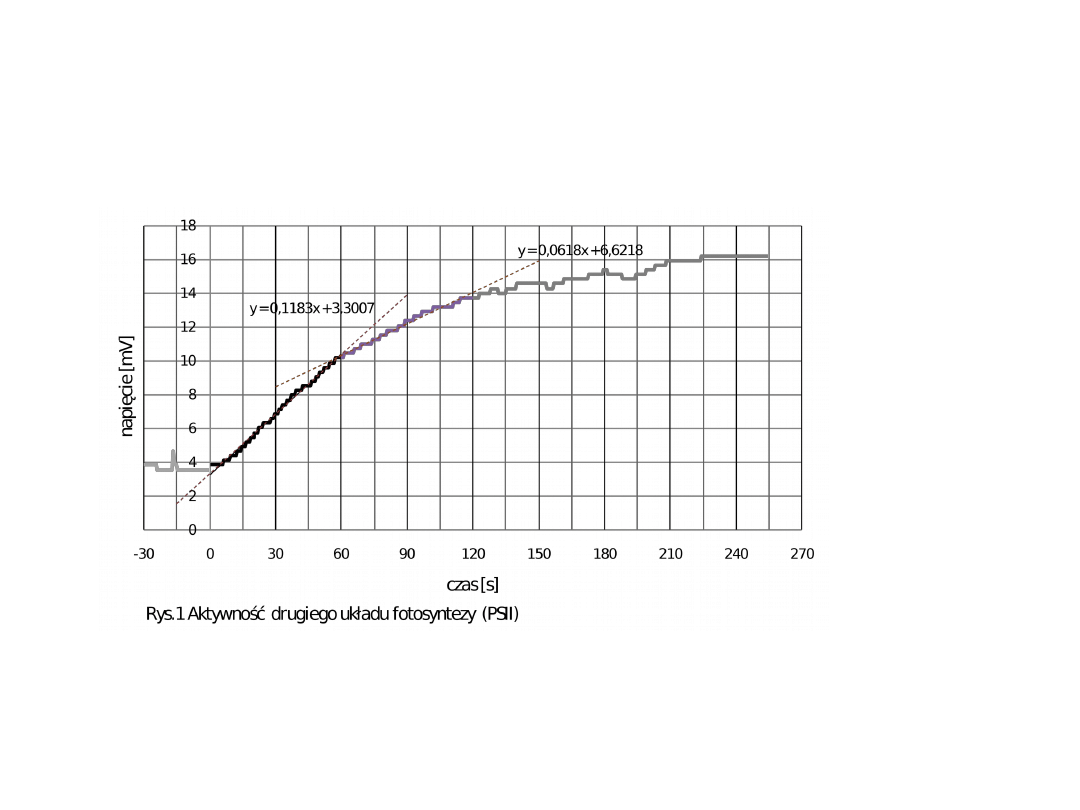
Oznaczanie aktywności PSII- pomiar
wydzielania tlenu
Fenylo-p-benzochinon – akceptor
elektronów
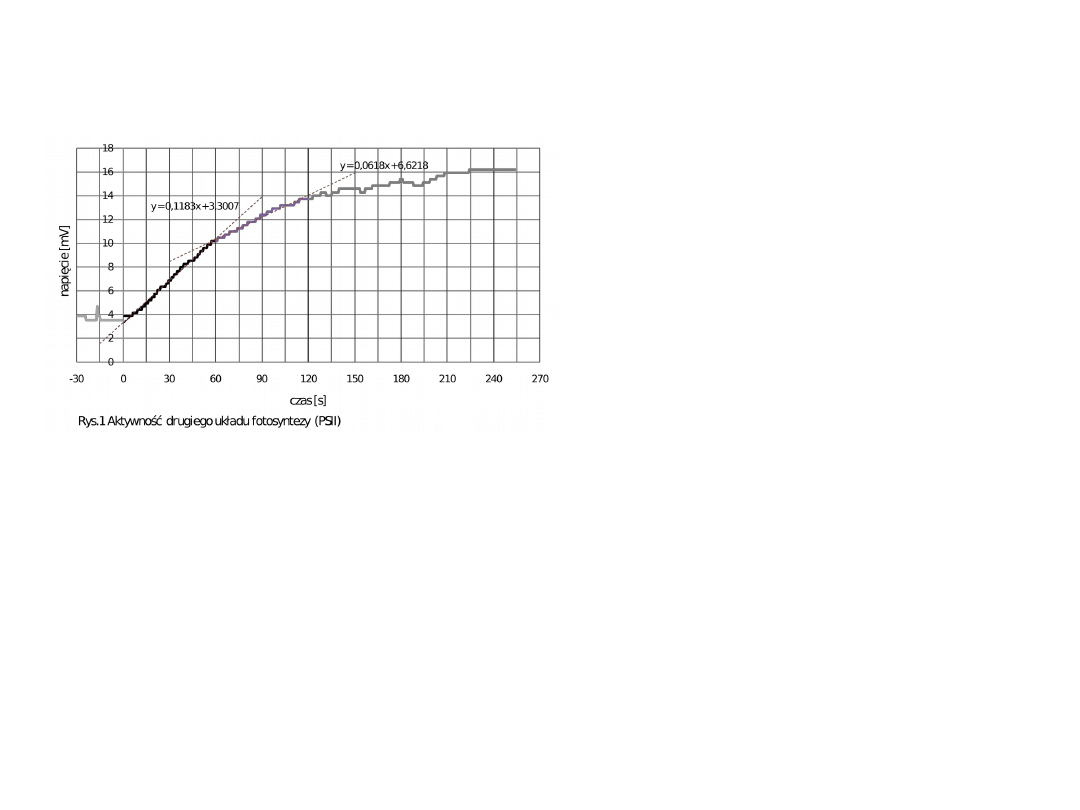
Oznaczanie aktywności PSII- pomiar
wydzielania tlenu
Na wykresie wyróżnić możemy dwa odcinki prostoliniowe –
reakcja w zależności od ilości donora elektronów przebiega z
różną szybkością.
Pierwszy odcinek prostoliniowy- początek reakcji- szybkość
reakcji wysoka ( 0.1183 mV/s)-dostępny donor.
Drugi odcinek prostoliniowy- szybkość reakcji (0.068 mV/s) –
szybkość reakcji niższa ponieważ mniejsza jest ilość donora
elektronów.
O
H
2
Donor
elektronów
Fenylo-p-benzochinon – akceptor elektronów
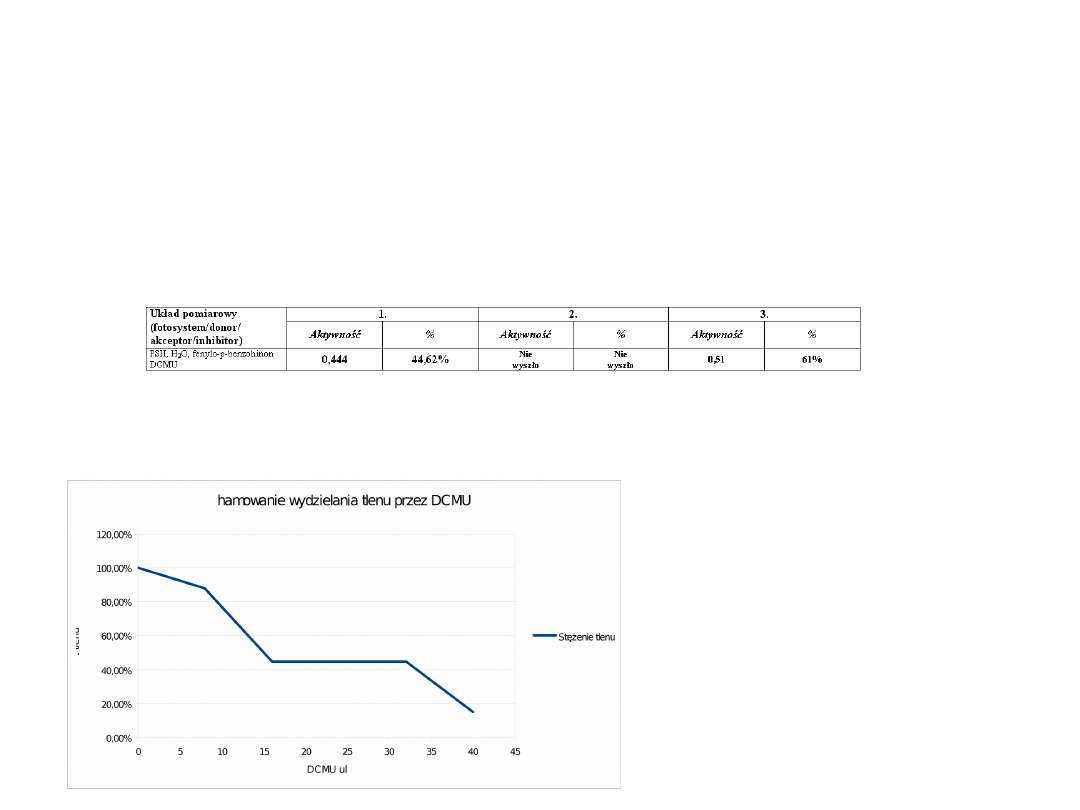
Oznaczanie aktywności PSII- pomiar
wydzielania tlenu w obecności DCMU (0.025
mM)
DCMU jest inhibitorem fotosystemu PSII. Wiąże się z plastochinonem
uniemożliwiając przepływ elektronów i przerywając ich transport w
łańcuchu fotosyntetycznym.
DCMU powoduje zwolnienie tempa wydzielania tlenu, a wraz ze wzrostem
stężenia tego inhibitora w mieszaninie reakcyjnej obserwujemy spadek
aktywności fotosystemu PSII.
Przy stężeniu DCMU ok. 0.1
mM
a
stężenie wydzielanego tlenu
wynosi 50 %.
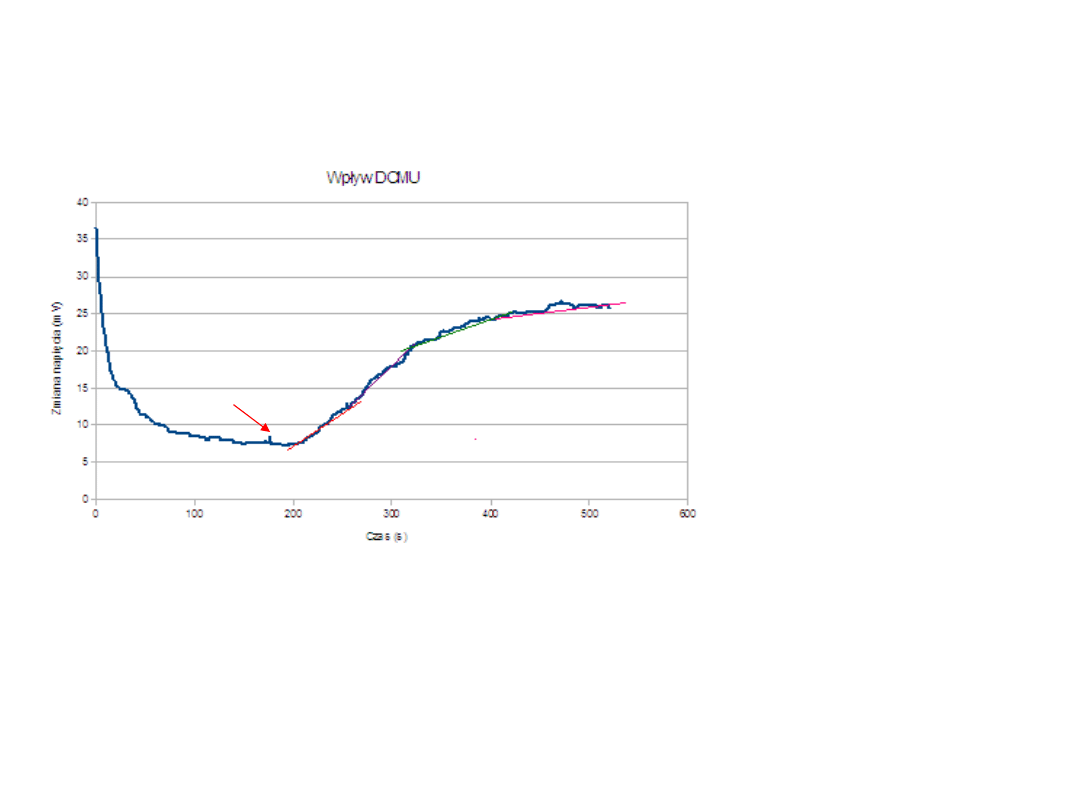
Oznaczanie aktywności PSII- pomiar
wydzielania tlenu w obecności DCMU
Dodanie
chloroplastów
Na wykresie zobrazowano zmianę napięcia [mV] w czasie [s].
Wyróżnić można 4 odcinki prostoliniowe – 4 etapy reakcji.
• I etap – reakcja bez dodania DCMU- szybkość reakcji wysoka. Aktywność – 100%
•Etap II, III, IV – po kolejnych dawkach inhibitora- szybkość reakcji każdego z etapów
jest niższa od szybkości w etapie poprzedzającym – towarzyszy temu spadek
aktywności fotosystemu.
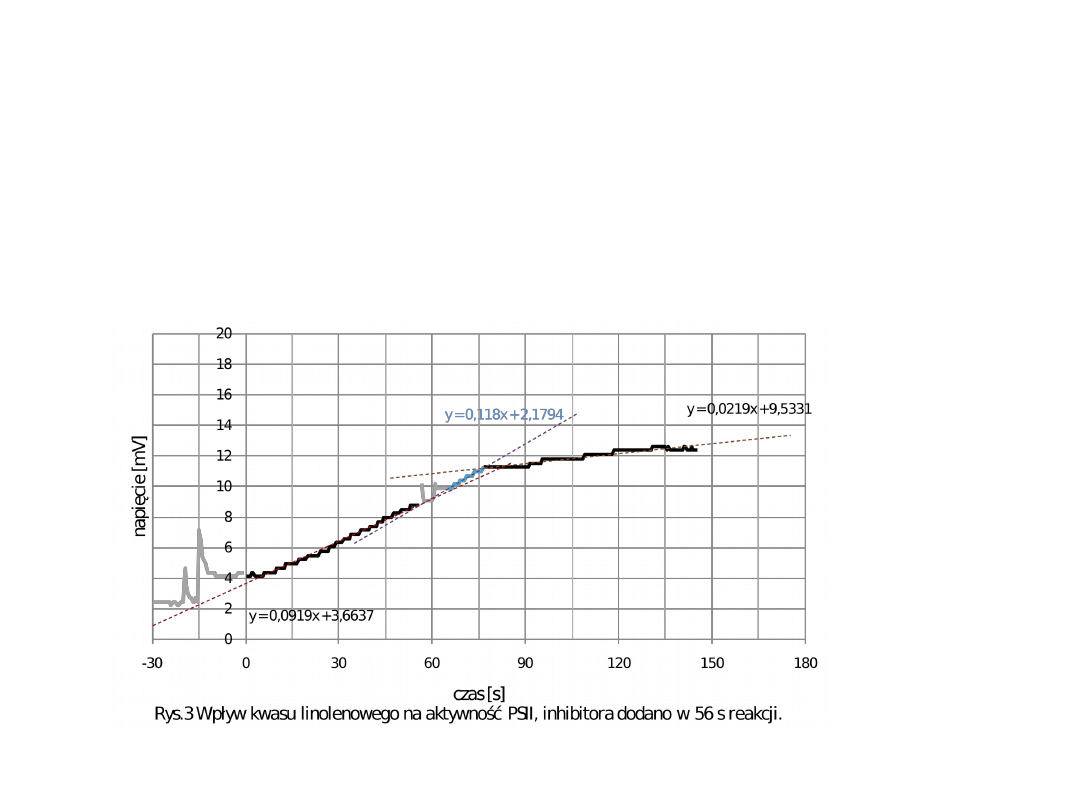
Oznaczanie aktywności PSII- pomiar
wydzielania tlenu w obecności kwasu
linolenowego (10mg/ml)
Kwas linolenowy rozprzęga transport protonów ( wnikając do
błon tylakoidów zaburza ich strukturę ).
Oznaczanie aktywności PSII- pomiar
wydzielania tlenu w obecności kwasu
linolenowego (10mg/ml)
•Na podstawie wykresu i wyników zespołu
drugiego możemy zauważyć, że w
pierwszych 20 sekundach po dodaniu kwasu
linolenowego szybkość reakcji jest wyższa
niż szybkość reakcji bez tego inhibitora
[ poczatkowo0.0919, po dodaniu kwasu –
0.118 mV/s].
• Taki wynik jest spowodowany faktem, że
tuż po podaniu kwasu linolenowego jeden z
enzymów kompleksu enzymatycznego
fotosystemu PSII zwiększa swoją aktywność
(by przeciwdziałać rozprzęganiu transportu
elektronów).
*Wyniki pozostałych zespołów mogą nie uwzględniać tego etapu, gdyż mógł być on
bardzo krótki i praktycznie nie zauważalny,
Oznaczanie aktywności PSII- pomiar
wydzielania tlenu w obecności kwasu
linolenowego (10mg/ml)
•
Po 20 sekundach od dodania do
mieszaniny kwasu linolenowego
obserwowany jest znaczny spadek
szybkości reakcji (do 0.02119 mV/s).
Aktywność fotosystemu spada, w
przypadku zespołu 2, do 35%. W
przypadku pozostałych zespołów spadek
ten nie jest tak znaczny, ale również
zauważalny (ok. 60%).
• Dłuższe działanie kwasu linolenowego /
większe stężenie, powoduje znaczące
uszkodzenie tylakoidów.

Oznaczanie aktywności PSII- pomiar
wydzielania tlenu w obecności kwasu
linolenowego (10mg/ml)
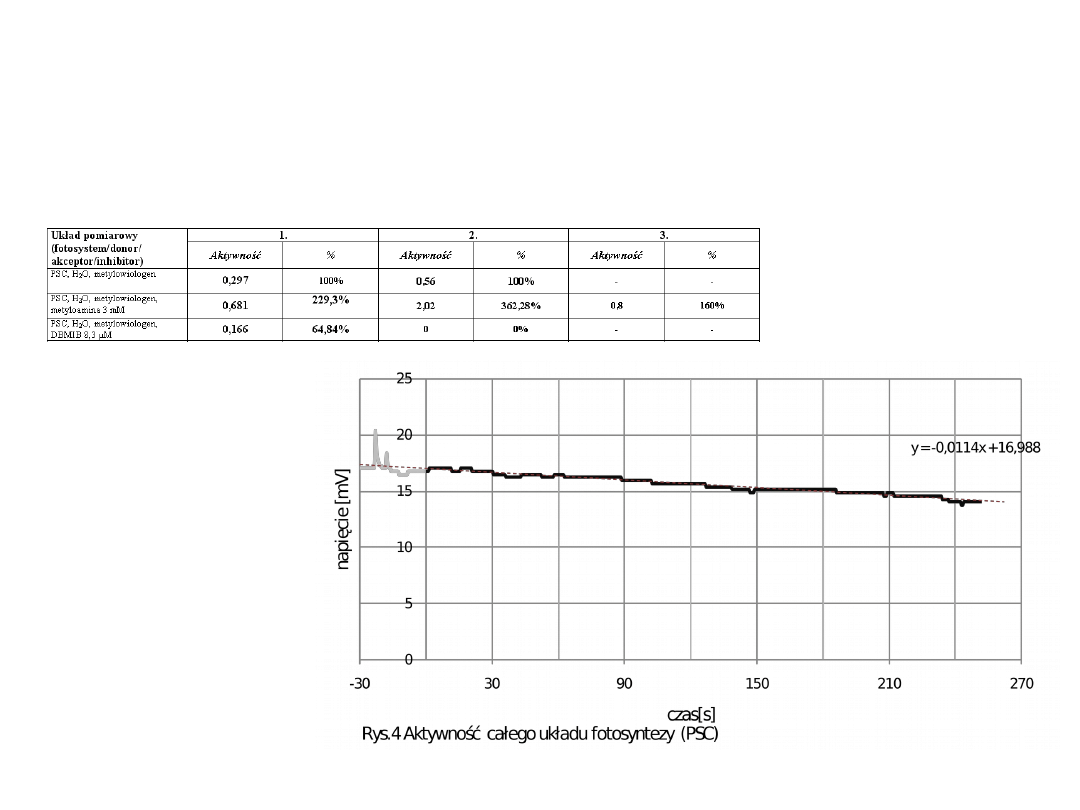
Oznaczanie aktywności całego łańcucha
fotosyntetycznego – pomiar pobierania tlenu
Metylowiologen- akceptor elektronów
Szybkość
pobierania tlenu
0.014 mV/s
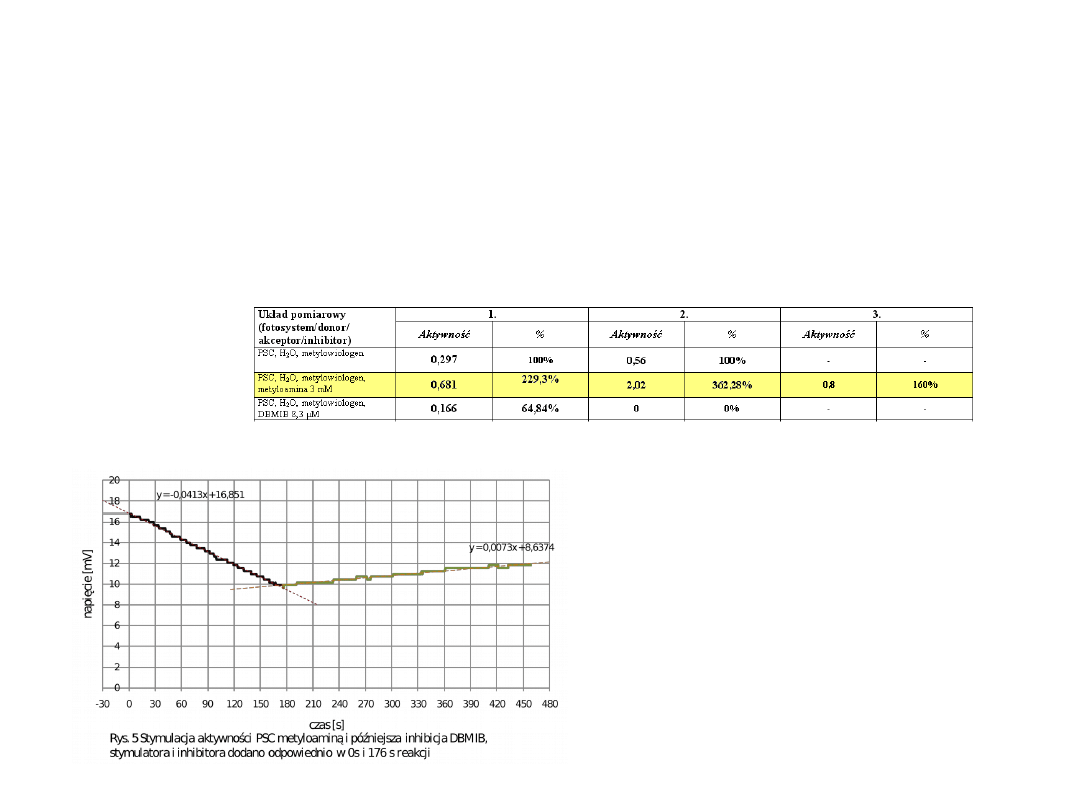
Oznaczanie aktywności całego łańcucha
fotosyntetycznego – pomiar pobierania tlenu
w obecności metyloaminy ( 3mM)
Metyloamina jest stymulatorem- znosi gradient protonowy w
chloroplastach – jej dodanie powoduje wzrost szybkości
pobierania tlenu
•Dodanie metyloaminy do
mieszaniny reakcyjnej powoduje
ponad dwukrotny wzrost
aktywności łańcucha
fotosyntetycznego (229,3 ;
362,28%) i czterokrotny wzrost
szybkości pobierania tlenu ( z
0.014 do 0.0413 mV/s)
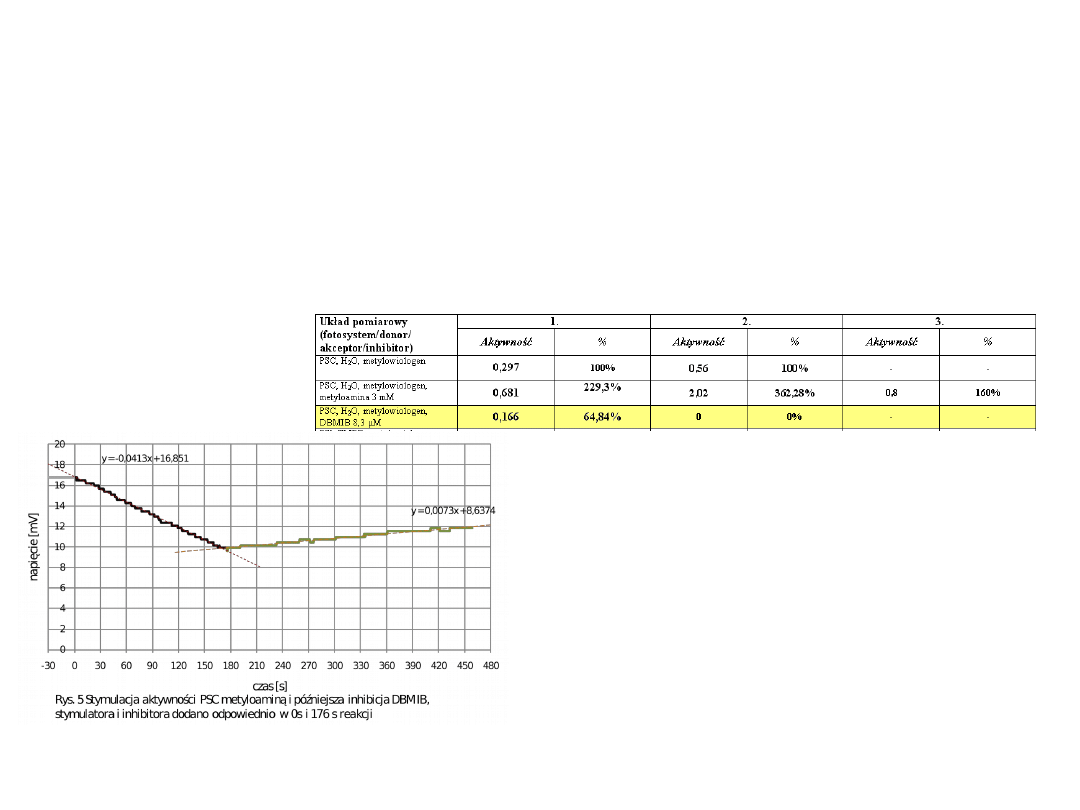
Oznaczanie aktywności całego łańcucha
fotosyntetycznego – pomiar pobierania tlenu
w obecności DBMIB (5mM)
DBMIB - inhibitor kompleksu cytochromów cyt.b
6
f
[ odpowiedzialnego za przenoszenie elektronów z PSII na PSII.
•Dodanie inhibitora powoduje znaczny
spadek aktywności całego łańcucha
fotosyntetycznego i spadek szybkości
pobierania tlenu ( z 0.014 do 0.0073
mV/s)

Oznaczanie aktywności PSI z DCMU
• Oznaczanie aktywności – do
momentu wyczerpania tlenu w
mieszaninie reakcyjnej.
•Wyznaczenie szybkości
pobierania tlenu przez układ w
obecności DCMU- inhibitora
fotosystemu PSII
Aktywność fotosystemu PSI jest wyższa od aktywności fotosystemu PSII.
Szybkość pobierania tlenu wynosi 0.0843, w przypadku całego łańcucha
fotosyntetycznego szybkość ta była wielokrotnie niższa- 0.014 mV/s.
TMPD- donor elektronów; metylowiologen- akceptor elektronów

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
Prezentacja 20 10
Prezentacja 20
Prezentacja1 20
Prezentacja 20 11 2006
Prezentacja 20 04
Prezentacja 20 10
Prezentacja 20
Prezentacja1 20
RAMKA(20), Prezenty
Prezentacja ODLEW (krótka) 20 09 2006
Konspekt prezentacji Św. Jan Maria Vianney, prezentacje, WSZYSTKIE PREZENTACJE, OAZA, Prezentacje cd
Prawo cywilne - prezentacja z dnia 20.03, Materiały - studia, I stopień, Prawo cywilne
wieszcz (prezentacja wykład 20 11 2011)
Istota prezentacji multimedialnej, wrzut na chomika listopad, Informatyka -all, INFORMATYKA-all, Inf
20 odp, UE IiE ISIZ, Prezentacje - Sroka, Sroczka, sizm i simeb materiały exam
RAMKA(20), Prezenty
UOKiK prezentacja stan na 20 11 2011
prezentacja finanse ludnosci
prezentacja mikro Kubska 2
więcej podobnych podstron