
1
Terminologia genetyczna
Gen – odcinek DNA o określonej sekwencji nukleotydowej odpowiedzialny za wytworzenie danego
polipeptydu; zajmuje określone miejsce „ locus” w chromosomie
i jest najmniejszą jednostką dziedziczności.
Allel – alternatywna forma danego genu zajmująca to samo „locus” w chromosomie
homologicznym. Allele danej pary wzajemnie wykluczają się w gametach (zgodnie z I prawem
Mendla.
Allele wielokrotne – alternatywne formy danego genu zajmujące to samo „locus” w chromosomie,
wzajemnie wykluczające się w gametach iwystępujące w danej populacji w liczbie wiekszej niż 2
(np. geny wyznaczające antygeny układu grupowego krwi AB0).
Geny nie alleliczne – geny zajmujące różne miejsca – „locii” w chromosomie
Homozygota – osobnik, u którego dana cecha wyznaczona jest parą idetycznych alleli
(aa lub AA).
Heterozygota – osobnik, u którego dana cecha wyznaczona jest parą różnych alleli (Aa).
Hemizygota – osobnik, u którego dana cecha wyznaczona jest tylko jednym allelem (dotyczy
wszystkich genów zlokalizowanych na chromosomach płciowych X lub Y w układzie XY).
Fenotyp – zespół cech ujawniających się na zewnątrz (np. kolor oczu, kształt nosa itp.)
Genotyp – zespół genów określający dane cechy (np. Aa, Bb).
Geny letalne – geny które w układzie homozygotycznym wywołują Śmierć układu, a w układzie
hemizygotycznym ograniczają jego żywotność (efekt subletalny ) Przykładem takiego genu jest gen
hemofilii, który w układzie homozygoty recesywnej wywołuje śmierć zarodka.
Plejotropia – dany gen warunkuje więcej niż jedną cechę np. gen L determinuje dwa układy
grupowe krwi MN i Ss.

2
Poligenia – dana cecha warunkowana jest kilkoma parami genów nieallelicznych np. cechy
ilościowe organizmu takie jak wzrost, kolor skóry, inteligencja, u zwierząt nośność kur, dojność
krów.
Proband – osoba obarczona chorobą genetyczną

3
Genom człowieka
Budowa chromosomów
Genom człowieka - nić DNA o długości w przybliżeniu 3 mld par zasad zawarta w jednym
haploidalnym zestawie 23 chromosomów.
Liczba diploidalna chromosomów człowieka w każdej prawidłowej, somatycznej komórce wynosi 46.
Nić DNA zorganizowana jest na kilku poziomach upakowania począwszy od chromatyny aż do
chromosomu metafazowego, który wykazuje 10 000 większą kondensację DNA niż chromatyna jądra
interfazowego.
W chromosomach DNA jest połączony z białkami, które pośredniczą w procesach transkrypcji, replikacji
lub są białkami strukturalnymi.
Kompleks DNA-białko nazywany jest chromatyną.
Wśród białek - histony oraz białka niehistonowe.
W porównaniu z innymi białkami histony zawierają zwiększoną liczbę aminokwasów zasadowych /lizyna,
arginina/, co ułatwia im wiązanie się z DNA.
Pięć histonów H1, H2A, H2B, H3 i H4 to elementy nukleosomu podstawowej jednostki upakowania
chromatyny.
Struktura nukleosomowa włókna chromatynowego o szerokości 30
µ
m buduje chromatynę w jądrze
interfazowym.
Chromatyna wykazuje zróżnicowany stopień kondensacji.
Silnie skondensowana - heterochromatyna,
mniej skondensowana - euchromatyna.
W dalszym etapie organizacji chromatyny włókno 30
µ
m ulega pofałdowaniu i skróceniu przyjmując
postać solenoidu. Pęt1e solenoidu zawierają 2 000-100 000 pz i powstają dzięki białkom niehistonowym
wiążącym się w miejscach specyficznych włókna chromatynowego.
Kolejne poziomy organizacji wyższego rzędu prowadzą do uwidocznienia chromosomów jako
indywidualnych struktur podczas podziału komórkowego.
Chromosom metafazowy - najbardziej skondensowana postać chromatyny
Chromosomy metafazowe zbudowane są z dwóch identycznych siostrzanych chromatyd. Szerokość
pojedynczej chromatydy wynosi około 700
µ
m.
Połączenia chromatyd to centromer (przewężenie pierwotne), który dzieli chromosom na dwa ramiona:
krótkie „p” i długie „q”.

4
telomery - regiony na obu końcach ramion
Centromer - miejsce przyłączenia włókien wrzeciona podziałowego, zapewnia właściwą segregację
chromosomów w czasie mitozy i mejozy.
Telomery uniemożliwiają zlepianie się chromosomów i zapewniają określoną lokalizację wewnątrz
jądra. Zbudowane są z powtarzającej się sekwencji /TTAGGG/.
W momencie urodzenia człowieka długość poszczególnych telomerów wynosi 6 000-10 000 nukleotydów.
Z wiekiem ulegają zmniejszeniu podczas kolejnych podziałów komórek somatycznych.
Zjawisko skracania się telomerów jest wyznacznikiem procesu starzenia się, może prowadzić do śmierci
komórki.
Długość telomerów w komórkach rozrodczych i zarodkowych utrzymywana jest przez enzym telomerazę.
Prawa Mendla
Grzegorz Mendel sformułował dwa prawa, które w współczesnej wersji są następujące:
I prawo czystości gamet :
Geny wyznaczające daną cechę w gametach , czyli allele tej samej pary wzajemnie się wykluczają i
występują zawsze pojedynczo
Aa
A a
II prawo niezależnej segregacji czyli niezależnego dziedziczenia cech
cechy należące do jednej pary alleli dziedziczone są niezależnie od cech innej pary.
- prawo niezależnego dziedziczenia cech.
wiele cech dziedziczy się zgodnie z prawem Mendla.
istnieją odstępstwa od tych praw np. dziedziczenie sprzężone (różne pary genów nieallelicznych na tej
samej parze chromosomów dziedziczą się razem)
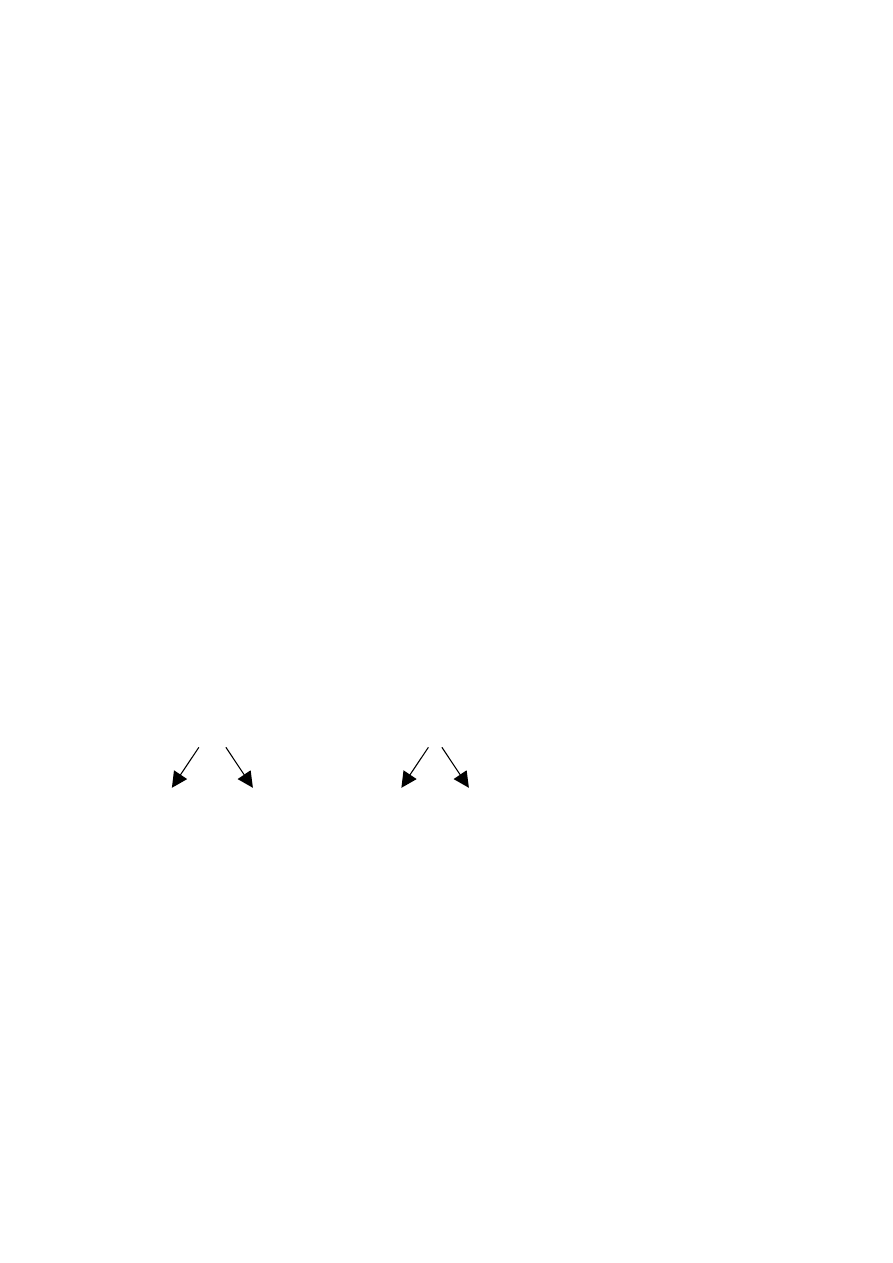
5
III prawo Mendla jest prawem dominacji: w parze czynników determinujących (określających)
dziedziczoną cechę jeden czynnik zawsze jest dominujący, a drugi recesywny.
Mendelizm to ogół teorii, hipotez i praw opartych na wynikach badań G.J. Mendla oraz
chromosomowej teorii dziedziczenia T. Morgana. Mendelizm wpływa na kierunki rozwoju
wszystkich dziedzin biologii oraz filozofii biologii.
Dziedziczenie monogenowe
Dziedziczenie alternatywne (nierównocenne)
Dziedziczenie alternatywne to dziedziczenie, w którym w heterozygocie (Aa) jeden z alleli dominuje nad
drugim i ujawnia się fenotypowo (A). Drugi allel recesywny (a) może ujawnić fenotypowo tylko w
homozygocie recesywnej (aa).
Przykład :Kolor czerwony (A) jest dominujący w stosunku do białego (a) w kwiatach groszku pachnącego.
Skrzyżowano dwie homozygotyczne odmiany groszku o kwiatach białych i czerwonych. Jest to pierwsze
pokolenie rodzicielskie (P)
P: AA x aa zgodnie z I prawem Mendla
G: A A a a
F1: Aa, Aa, Aa, Aa,

6
Wszystkie osobniki pokolenia F1 są jednorodne fenotypowo i genotypowo – wszystkie są czerwone,
heterozygotyczne. Krzyżujemy osobniki pokolenia F1 między sobą.
F1: Aa x Aa zgodnie z I prawem Mendla
G: A a A a
F2: AA, Aa, Aa, aa,
1 : 2 : 1 Stosunek genotypowy
3 : 1 Stosunek fenotypowy
W pokoleniu F2 nastąpiło rozszczepienie cechy w stosunku genotypowym w stosunku 1:2:1 `1a(jedna
homozygota dominująca, dwie heterozygoty, jedna homozygota recesywna). Fenotypowo trzy osobniki o
fenotypie dominującym czerwonym, jeden o fenotypie recesywnym biały.
Krzyżowanie testowe
W dziedziczeniu alternatywnym fenotyp dominujący determinowany jest dwoma genotypami: homozygotą
dominującą (AA) i heterozygotą (Aa). W celu określenia genotypu osobnika o fenotypie dominującym
przeprowadza się tzw. krzyżowanie testowe. Badanego osobnika o fenotypie dominującym krzyżuje się z
homozygotą recesywną. W przypadku roślin i zwierząt krzyżówkę taką przeprowadza się doświadczalnie.
Możliwe są dwa warianty
I wariant: zakładamy, że badany osobnik jest homozygotą dominującą. Krzyżując go z homozygotą
recesywną otrzymujemy następujący wynik krzyżówki:
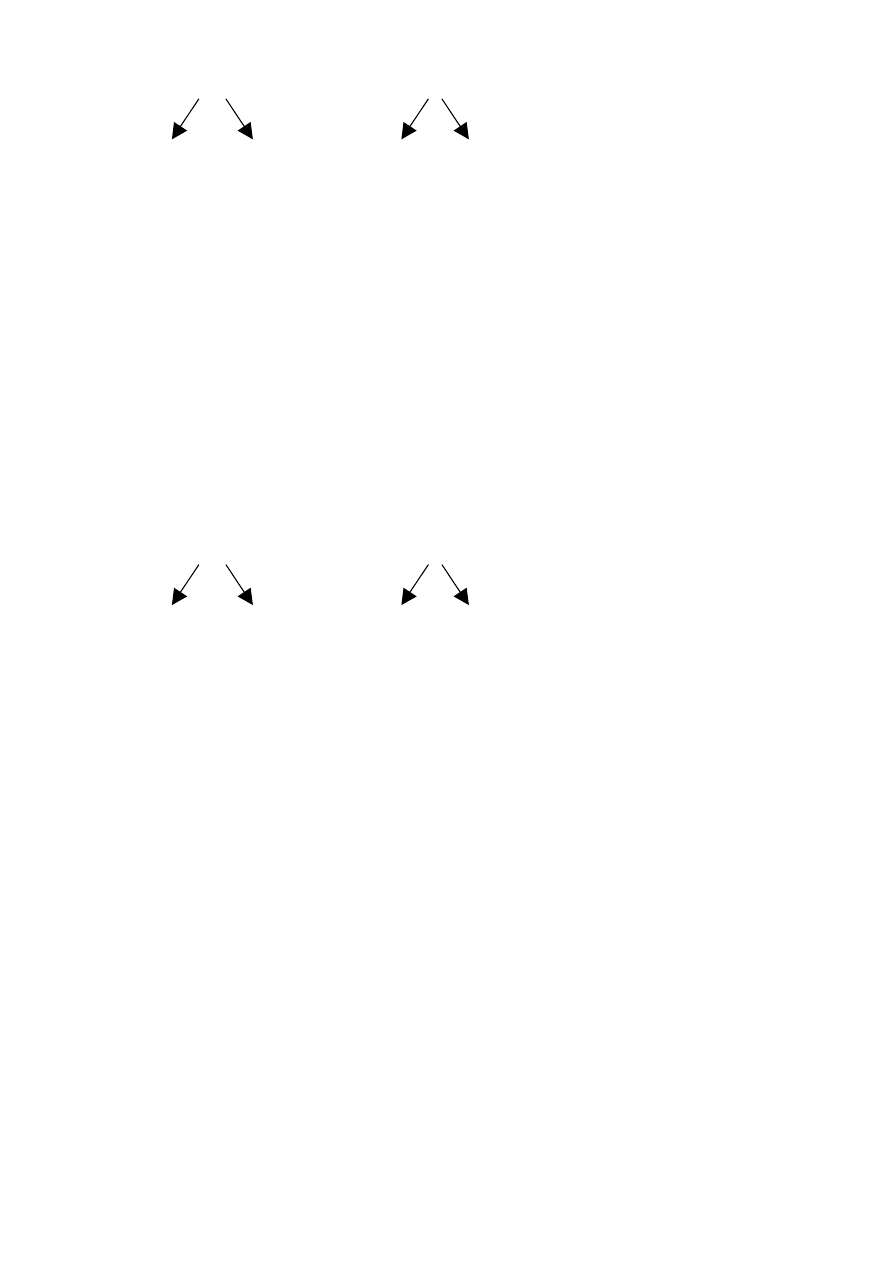
7
AA x aa
A A a a
Aa, Aa, Aa, Aa,
4 : 0
Wszystkie osobniki potomne mają fenotyp dominujący, brak osobników z fenotypem recesywnym.
II wariant: badany osobnik jest heterozygotą. Krzyżując go z homozygotą recesywną otrzymujemy:
Aa x aa
A a a a
Aa, Aa, aa, aa,
2 : 2
1 : 1
Połowa osobników potomnych ma fenotyp dominujący, połowa recesywny.
Przy rozpatrywaniu dziedziczenia cech u ludzi przeprowadzamy tzw. krzyżówkę wsteczną polegającą na
ustaleniu rodowodu danej cechy w rodzinie (jak dana cecha prezentowała się u rodziców i dziadków).
Dziedziczenie równocenne – kodominacja
Kodominacja to dziedziczenie, w którym w heterozygocie oba allele podlegają ekspresji fenotypowej
(ujawnieniu się)

8
Przykład:
W układzie grupowym MN gen na antygen M i gen na antygen N dziedziczą się równocennie. Osobnicy
heterozygotyczni mają zatem grupę krwi MN.
Fenotyp krwi M warunkowany jest genotypem L
M
L
M
, podobnie fenotyp N jest warunkowany
genotypem L
N
L
N
.
Krzyżując osobniki homozygotyczne w pokoleniu F1 otrzymujemy heterozygoty o fenotypie mieszanym
MN.
Krzyżując osobniki pokolenia F1 o fenotypie MN otrzymujemy w pokoleniu F2 rozszczepienie cechy w
stosunku fenotypowym i genotypowym 1:2:1.
W dziedziczeniu kodominacyjnym fenotyp jest jednoznaczny z genotypem i nie zachodzi potrzeba
wykonywania testowego.
Allele wielokrotne
W populacji dany gen może mieć więcej niż dwie odmiany alleliczne zwane allelami wielokrotnymi. Allele
te wzajemnie wykluczją się w gametach zgodnie z I prawem Mendla.
U danego osobnika występują tylko dwa spośród dowolnej liczby alleli. Przykładem alleli wielokrotnych
są geny warunkujące antygeny grupowe krwi w układzie AB0. Wyróżniamy trzy podstawowe odmiany
alleliczne genu I:
I
A
- allel warunkujący antygen A
I
B
-
allel warunkujący antygen B
i - allel warunkujący antygen 0
Allele I
A
oraz I
B
są względem siebie równocenne ( kodominacja ) i są dominujące w stosunku do allelu na
antygen 0 – i .

9
Fenotypy i genotypy grup krwi w układzie AB0. Są następujące
A - I
A
I
A
lub I
A
i
B - I
B
I
B
lub I
B
i
AB - I
A
I
B
0 - i i
Przykład:
Jakich grup krwi można oczekiwać u potomstwa rodziców z grupami krwi:
matka grupa krwi A, ojciec B
Fenotyp A lub B może być warunkowany dwoma genotypami: homozygotycznym lub heterozygotycznym.
W celu uzyskania wszystkich możliwości fenotypowych u potomstwa zakłada się, że fenotyp dominujący
jest heterozygotyczny ( jeśli nie wynika inaczej z danych rodowodowych – krzyżówka wsteczna).
Pokolenie rodzicielskie traktujemy jako F1 ponieważ jest heterozygotyczne.
Dziedziczenie innych układów grupowych krwi
Układ Rh
Układ Rh składa się z 13 antygenów, z których najsilniejszy jest antygen D. Jego obecność określana jest
jako Rh(+) a jego brak jako Rh(-) (jest to uproszczenie).
Fenotyp Rh(+) jest dominujący i warunkowany jest dwoma genotypami: homozygotycznym (RR) lub
heterozygotycznym (Rr)
Fenotyp Rh(-) jest recesywny i determinowany homozygotą recesywną (rr)
Układ MN

10
Układ grupowy MN został opisany jako przykład dziedziczenia kodominacyjnego
Układ Ss
Gen L warunkujący układ grupowy MN jest genem plejotropowym i oprócz antygenów MN determinuje
antygeny układu Ss, które dziedziczą się alternatywnie.
Uwzględniając działanie plejotropowe tego genu fenotypy i genotypy tych układów grupowych są
następujące:
MS - L
MS
L
MS
lub L
MS
L
Ms
NS - L
NS
L
NS
lub L
NS
L
Ns
MNS - L
MS
L
NS
lub L
MS
L
Ns
lub L
Ms
L
NS
Ms - L
Ms
L
Ms
Ns - L
Ns
L
Ns
MNs - L
Ms
L
Ns
Dziedziczenie kilku cech
Wyróżniamy dwie możliwości dziedziczenia kilku cech:
–
Dziedziczenie niezależne zgodne z II prawem Mendla
–
Dziedziczenie sprzężone – odstępstwa od II prawa Mendla
Dziedziczenie niezależne
Dziedziczenie niezależne kilku cech występuje wówczas gdy geny na dane cechy zlokalizowane są w
różnych parach chromosomów homologicznych
Przykład:

11
Kolor włosów człowieka uwarunkowany jest przez dwie pary genów dziedziczących się niezależnie. Jedna
para determinuje włosy ciemne lub jasne, druga para, rude lub nie rude
A - gen na barwę ciemną włosów
a – gen na barwę jasną
B – gen na włosy nie rude
b – gen na włosy rude
Jakich potomków mogą oczekiwać rodzice o ciemnych nie rudych włosach?
W zapisie krzyżówkowym dominujące cechy rodziców uznajemy za heterozygotyczne w celu
uzyskania wszystkich możliwych fenotypów w potomstwie.
Zapis krzyżówkowy prowadzimy od pokolenia F1, które jest pokoleniem heterozygotycznym
F
1
: Aa Bb x Aa Bb
Zgodnie z I prawem Mendla do każdej gamety dostaje się jeden allel z każdej pary. Ilość możliwych typów
gamet o różnym składzie genetycznym obliczamy ze wzoru 2
n
, gdzie n oznacza liczbę cech w układzie
heterozygotycznym. W podanym przykładzie występują dwie cechy w układzie heterozygotycznym (Aa
Bb), a zatem ilość możliwych typów gamet wynosi
2
2
= 4. Dla ułatwienia zapisu krzyżówkowego wyznaczamy tzw. kwadrat Punneta
F
2
: 9 : 3 : 3 : 1
▲ – włosy ciemne nie rude 9
∆ - włosy ciemne, rude 3
■ - włosy jasne, nie rude 3
□ - włosy jasne, rude 1
AB
Ab
aB
ab
AB
AABB ▲
AABb ▲
AaBB ▲
AaBb ▲
Ab
AABb ▲
Aabb ∆
AaBb ▲
Aabb ∆
aB
AaBB ▲
AaBb ▲
aaBB ■
aaBb ■
ab
AaBb ▲
Aabb ∆
AaBb ■
aabb □
12
Dziedziczenie sprzężone
Dziedziczenie sprzężone występuje wówczas, gdy geny na dane cechy zlokalizowane są w tej samej parze
chromosomów homologicznej. Wszystkie geny danej pary chromosomów tworzą tzw. układ sprzężeń i
dziedziczą się razem. Liczba układów sprzężeń danego gatunku jest równa jego liczbie haploidalnej (n). U
człowieka występują 23 układy sprzężeń.
Przykład:
Skrzyżowano dwie odmiany roślin o owocach czerwonych, okrągłych i o owocach zielonych,
wydłużonych. Barwa czerwona i kształt okrągły są dominujące i geny na te cechy zlokalizowane są na tym
samym chromosomie.
A – gen na barwę czerwoną
A B
a - gen na barwę zieloną
B – gen na kształt okrągły
b - gen na kształt wydłużony a b

13
Krzyżujemy rośliny o owocach czerwonych okrągłych uwzględniając tylko genotypy heterozygotyczne
(dla uzyskania maksymalnej ilości fenotypów w potomstwie).
F
1
: Aa Bb x Aa Bb
W czasie mejozy następuje segregacja chromosomów wraz z genami ( po jednym chromosomie z jednej
pary i do każdej gamety), stąd gamety będą miały następujący skład:
A B, a b
W pokoleniu F
2
po rekombinacji gamet uzyskujemy następujące genotypy i fenotypy
F
2 :
AA BB, Aa Bb, Aa Bb, aa bb
1 : 2 : 1 stosunek genotypowy
3 : 1 stosunek fenotypowy
Stosunek genotypowy 1:2:1 i fenotypowy 3:1 jest taki sam jak w dziedziczeniu alternatywnym jednej
cechy. Bez względu na liczbę rozpatrywanych cech stosunek ten pozostanie taki sam w dziedziczeniu
sprzężonym.
Układy sprzężeń mogą ulec rozprzęgnięciu w wyniku zajścia zjawiska crossing-over. Powstają wówczas
nowe układy sprzężeń.
Fenotypowo nie występują zmiany aż do momentu gdy osobniki o nowych układach sprzężeń nie dadzą
potomstwa. Krzyżujemy osobniki o owocach czerwonych i okrągłych z zielonymi z wydłużonymi
(poprzedni przykład) ale o nowym układzie sprzężeń genów (Ab, aB).
Pojawiły się nowe, dotąd nie spotykane fenotypy o owocach czerwonych, wydłużonych i zielonych,
okrągłych. Zwykle w danej populacji procent nowych fenotypów jest stosunkowo niski ale zaburza
dotychczasowy stosunek 3:1.
Dziedziczenie sprzężone z płcią

14
Geny znajdujące się na chromosomach płciowych X i Y tworzą układ sprzężeń dziedziczony z danym
chromosomem płciowym. Chromosom Y zawiera niewielką ilość genów z których najważniejszy jest gen
odpowiedzialny za wykształcenie jąder. Na chromosomie X zlokalizowane są geny determinujące różne
choroby takie jak: hemofilia, daltonizm czy dystrofia mięśniowa Duchenne'a. Geny na te schorzenia są
recesywne i sprzężone z chromosomem X. Gen warunkujący hemofilię jest genem letalnym i w układzie
homozygoty recesywnej powoduje obumarcie zarodka żeńskiego we wczesnym okresie rozwoju.
Hemofilia ujawnia się tylko w układzie hemizygotyczym (tylko jeden allel na daną cechę) u mężczyzn. W
układzie heterozygotycznym tego genu powoduje wystąpienie zjawiska nosicielstwa – kobiety nosicielki są
fenotypowo zdrowe ale przenoszą gen hemofilii na swoje potomstwo. Geny sprzężone z płcią zapisujemy
w indeksie górnym lub dolnym chromosomu X.
Przykład :
X
H
X
H
- kobieta zdrowa fenotypowo i genotypowo
X
H
X
h
- kobieta nosicielka zdrowa fenotypowo
X
h
X
h
- układ letalny
X
H
Y - mężczyzna zdrowy
X
h
Y - mężczyzna chory na hemofilię
Jakich potomków mogą oczekiwać kobieta nosicielka hemofilii i mężczyzna chory na hemofilię?
X
H
X
h
x X
h
Y
X
H
X
h
, X
h
X
h
, X
H
Y , X
h
Y ,
Połowa dziewczynek będzie nosicielkami, połowa układ letalny, połowa chłopców zdrowych, połowa
chłopców chorych.
Podobnie zapisuje się dziedziczenie daltonizmu i dystrofii mięśniowej Duchenne'a, uwzględniając, że
homozygota recesywna nie jest letalna. Jeśli dana cecha sprzężona z płcią występuje częściej u mężczyzn
niż u kobiet oznacza, że gen warunkujący tą cechę dziedziczy się recesywnie. Jeżeli dana cecha częściej
występuje u kobiet niż u mężczyzn oznacza, że gen sprzężony z płcią jest dominujący.
Dziedziczenie zależne od płci

15
Od płci zależą nie tylko cechy warunkowane genami zlokalizowanymi na chromosomach płciowych ale
także niektóre cechy których geny znajdują się w chromosomach somatycznych (autosomach). Do takich
cech zaliczamy łysienie u człowieka i obecność poroża u bydła. Ekspresja fenotypowa tych cech zależy od
płci danego osobnika i zależy od poziomu hormonów męskich. Obecność dwóch genów na łysienie
( homozygota ) powoduje łysienie u mężczyzny już po 20-stym roku życia, a u kobiety znaczne
przerzedzenie włosów. Układ heterozygotyczny tych genów powoduje łysienie u mężczyzn po 40-tym
roku życia, a u kobiet łysienie nie występuje ze względu na niski poziom androgenów. Zapis genotypu
musi być podawany łącznie z chromosomami płciowymi.
Przykład:
ŁŁXX kobieta łysiejąca
Łł XX kobieta nie łysiejąca
łłXX kobieta nie łysiejąca
ŁŁXY mężczyzna łysiejący
ŁłXY mężczyzna łysiejący
łłXY mężczyzna nie łysiejący
Dziedziczenie niealleliczne
Wiele cech warunkowanych jest nie jedną ale kilkoma parami genów zlokalizowanych w różnych parach
chromosomów. Cechy takie nazywamy poligenicznymi. Geny niealleliczne warunkujące te cechy
współdziałają ze sobą w różny sposób. Najbardziej znane formy współdziałania tych genów to:
1. epistaza
2. komplementacja
3. kumulacja
Epistaza
Jest taką formą współdziałania genów nieallelicznych w której jeden z genów tzw. epistatyczny decyduje o
ekspresji fenotypowej pozostałych genów tzw. hipostatycznych.
Przykład:
Barwa sierści u gryzoni warunkowana jest kilkoma parami genów odpowiedzialnych za ilość barwnika,
jego rozmieszczenie i natężenie. Genem epistatycznym jest gen warunkujący wytwarzanie melaniny.
Pozostałe geny hipostatyczne odpowiadają za jej ilość i rozmieszczenie. Brak genu epistatycznego
powoduje, że zwierze jest albinosem mimo posiadania innych genów umaszczenia.

16
A gen epistatyczny na wytwarzanie melaniny
a brak melaniny
B barwa czarna
b barwa brązowa
Skrzyżowano heterozygotyczne osobniki czarne:
F
1
: Aa Bb x Aa Bb
Ilość typów gamet 2
2
= 4
Wynik krzyżówki przedstawiamy w kwadracie Punneta
AB
Ab
aB
ab
AB
■
■
■
■
Ab
■
□
■
□
aB
■
■
○
○
ab
■
□
○
○
F
2
: 9 : 4 : 3
Osobnik czarny ■ 9
Osobnik brązowy □ 3
Albinos ○ 4
Komplementacja
Komplementacja jest to takie współdziałanie genów nieallelicznych w którym geny jednej pary dopełniają
w działaniu geny drugiej pary.
Przykład
Barwa czerwona kwiatów groszku pachnącego warunkowana jest obecnością barwnika antocyjanu, który
powstaje w wyniku utleniania chromogenu przy udziale oksydazy. Chromogen i oksydaza są warunkowane
przez dwie pary genów.
A wytwarzanie chromogenu
a brak chromogenu
B wytwarzanie oksydazy
b brak wytwarzania
Jeżeli nie wytwarzany jest chromogen lub oksydaza reakcja utleniania nie zachodzi i kwiaty są białe.
Skrzyżowano dwie odmiany homozygotyczne o barwie białej groszku pachnącego. Jedna odmiana nie
wytwarza oksydazy druga chromogenu.
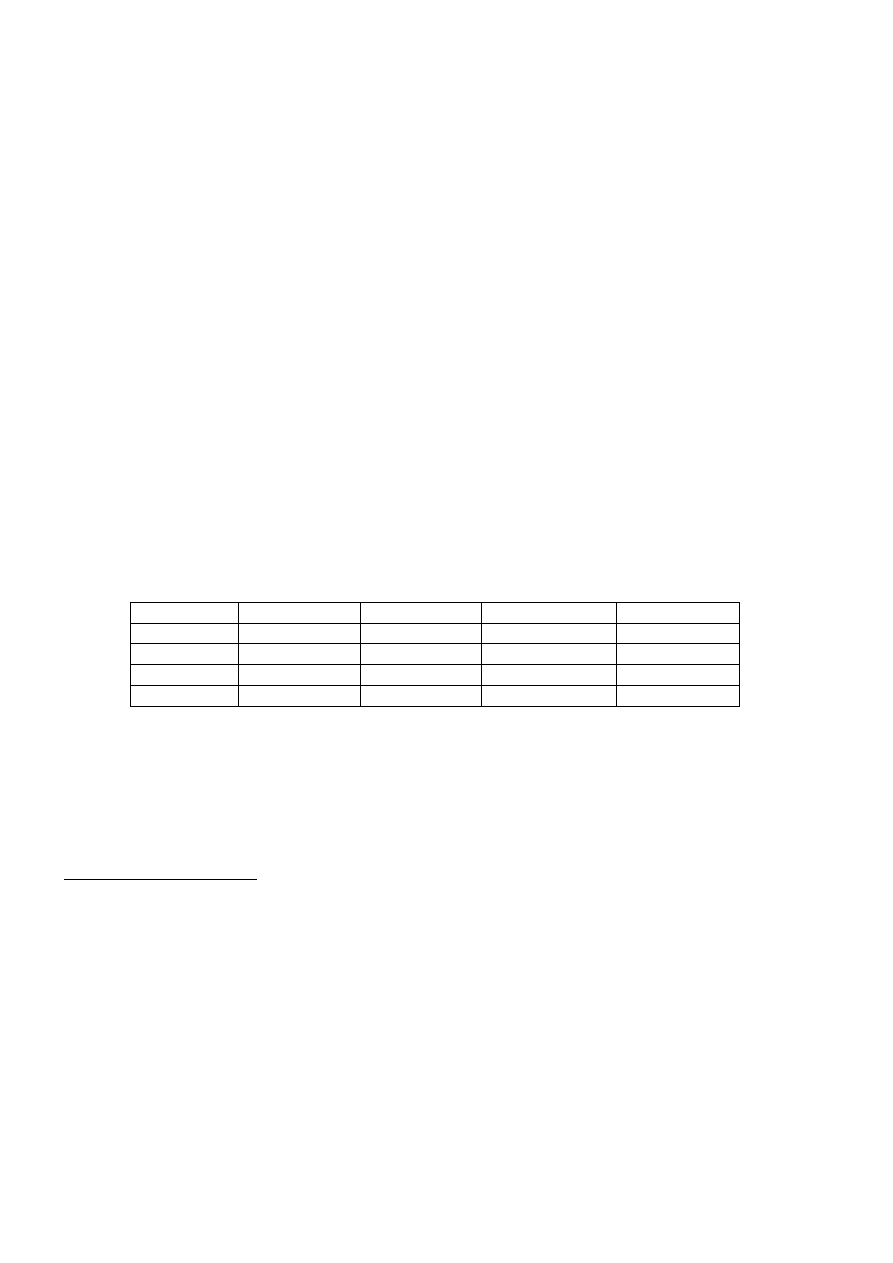
17
P: AA bb x aa BB
G: Ab Ab aB aB
F
1
: Aa Bb, Aa Bb, Aa Bb, Aa Bb
W pokoleniu F
1
wszystkie rośliny są o kwiatach czerwonych ponieważ posiadają obydwa geny potrzebne
do wytworzenia antocyjanu. Krzyżujemy osobniki pokolenia F
1
.
F
1
: Aa Bb x Aa Bb
Ilość typów gamet 2
2
= 4
AB
Ab
aB
ab
AB
■
■
■
■
Ab
■
□
■
□
aB
■
■
□
□
ab
■
□
□
□
F
2
9 : 7
Osobniki czerwone ■ 9
Osobniki białe □ 7
Kumulacja (sumowanie)
Kumulacja jest to takie współdziałanie nieallelicznych w którym ekspresja fenotypowa jest efektem
sumowania się działań poszczególnych genów. W ten sposób dziedziczy się wiele cech ilościowych takich
jak wzrost, inteligencja, kolor skóry czy u zwierząt mleczność krów, nośność kur.
Przykład
Kolor skóry u człowieka warunkowane jest czterema parami genów. W celach dydaktycznych
rozpatrujemy tylko dwie pary genów odpowiedzialne za rasę białą i czarną. Zakładamy, że każdy z genów
dominujących powoduje 25% natężenia melaniny. Geny recesywne 0 %.
A 25 % natężenia barwnika
18
a 0 %
B 25 %
b 0%
Jakich potomków mogą oczekiwać mulaci o 50 % natężenia barwnika (pod uwagę bierzemy podwójne
heterozygoty dla uzyskania maksymalnej liczby fenotypów u potomstwa.
F
1
: Aa Bb x Aa Bb
Ilość typów gamet 2
2
= 4
AB
Ab
aB
ab
AB
1oo%
75%
75%
50%
Ab
75%
50%
50%
25%
aB
75%
50%
50%
25%
ab
50%
25%
25%
0%
F
2
1 : 4 : 6 : 4 : 1
100 % -1 75 % - 4 0 % - 1
50 % - 6 25 % - 4
W podanym przykładzie pojawiają się skrajne fenotypy. 100 % czarny i 0 % biały. Zjawisko takie nosi
nazwę transgresji czyli skrajnego przekroczenia fenotypów rodzicielskich. W dziedziczeniu cech
ilościowych fenotyp w danej populacji ma rozkład cechy normalnej zgodnej z tzw. Quatelletta.
Dziedziczenie mendlowskie chorób genetycznych człowieka
Według definicji choroba genetyczna jest upośledzającym sprawność zyciową odchyleniem od stanu
prawidlowego, które przekazywane jest przez rodzicow potomstwu lub powstaje de novo na wskutek
mutacji w procesie gametogenezy. Wyróżnia się 3 zasadnicze grupy chorób genetycznych:
1. choroby monogenowe (jednogenowe) spowodowane mutacjami pojedynczego genu
2. choroby chromosomowe spowodowane aberracjami chromosomowymi

19
3. choroby wielogenowe i wieloczynnikowe uwarunkowane zarówno czynnikami genetycznymi jak i
środowiskowymi
Tylko 1-sza grupa chorób genetycznych dziedziczy się zgodnie z prawami Mendla podobnie jak wiele cech
monogenowych charakteryzujacych organizm człowieka.
Choroby monogenowe dotyczą 1-2% żywo urodzonych dzieci.
Choroby monogenowe dziedziczą się w sposób:
autosomalny dominujacy,
kodominujący,
recesywny
i w sprzężeniu z chromosomem X.
Rodzina, w ktorej występuje proband (osoba/osoby obarczona chorobą genetyczną) okreslana jest jako
rodzina zwiększonego ryzyka genetycznego. Opiekę nad takimi rodzinami sprawuje poradnia genetyczna
zatrudniajaca lekarzy genetyków, którzy informują o chorobie, sposobie jej dziedziczenia oraz okreslają
prawdopodobieństwo powtórnego wystąpienia choroby u potomstwa danej pary.
W przypadku choroby autosomalnej dominującej, jeśli jedno z rodziców dotknięte jest chorobą to ryzyko
wystąpienia tego schorzenia dla każdego kolejnego dziecka wynosi 50%.
Przykładem niech będzie neurologiczna choroba Huntingtona spowodowana mutacjami w obrebie genu
kodujacego białko huntingtynę.
aa osobnik zdrowy Aa osobnik chory (proband) AA układ zwykle letalny
P: Aa x aa
G: A, a a a
F1: Aa, aa (50% prawdopodobieństwa wystąpienia choroby Huntingtona
bez względu na płeć)
W przypadku, gdy obydwoje rodzice są chorzy ryzyko dla potomstwa wynosi 75%
P: Aa x Aa
G: A, a A, a
F1: AA, Aa, Aa, aa (75% prawdopodobieństwa wystąpienia choroby bez względu

20
na płeć)
W rodzinie, w której urodziło się dziecko z choroba rozpoznaną jako autosomalna dominująca, a obydwoje
rodzice są zdrowi, należy wnioskować, że przyczyną choroby była mutacja świeża (de novo).
Prawdopodobieństwo powtórzenia się tego schorzenia u kolejnych dzieci jest równe częstości
populacyjnej.
Choroba autosomalna recesywna ujawnia się natomiast w układzie homozygotycznym aa ale przenoszona
jest w rodzinie przez osoby zdrowe będące heteropzygotami (nosicielami) Aa. W przypadku, gdy jeden z
rodzicow jest chory to ryzyko wystapienia choroby dla każdego dziecka bez względu na płeć jest równe
0%
Przykład dotyczy fenyloketonurii uwarunkowanej mutacjami w obrębie genu kodującego hydroksylazę
fenyloalaninową (PAH)
P: aa x AA
G: a A
F1: Aa (0% prawdopodobieństwa wystąpienia fenyloketonurii)
Gdy jeden z rodziców jest chory a drugi zdrowy, ale ma układ heterozygotyczny to ryzyko wystąpienia
schorzenia dla każdego dziecka wynosi 50%.
P: aa x Aa
G: a a A, a
F1: Aa, aa (50% prawdopodobieństwa fenyloketonurii bez względu na płeć)
Jeśli natomiast obje rodzice są zdrowymi heterozygotami, nosicielami zmutowanego genu, to ryzyko
wystąpienia choroby u dziecka wynosi 25%.
P: Aa x Aa
G: A, a A, a
F1: AA, Aa, Aa, aa (25% prawdopodobieństwa fenyloketonurii dla obu płci)
W przypadku chorób recesywnych sprzężonych z płcią , jeżeli nie jest to mutacja de novo, zdrowe matki
nosicielki heterozygotyczne rodzą chorych synów. Ryzyko choroby dla synów wynosi 50%, zaś dla córek
istnieje 50% ryzyka nosicielstwa defektywnego genu.

21
We wszystkich wymienionych typach dziedziczenia chorób monogenowych ryzyko jest stałe dla każdej
ciąży i nie zależy od liczby dzieci zdrowych lub chorych.
Mutacje genowe (punktowe) i polimorfizmy DNA
Mutacje
utrwalone zmiany w sekwencji DNA genu, - mogą powstać spontanicznie najczęściej z powodów błędów
podczas replikacji DNA lub w wyniku działania różnych czynników mutagennych.
częstość mutacji samorzutnych niewielka, jedna na 10
5
do 10
7
komórek.
Częstość mutacji może być wielokrotnie podniesiona przez działanie czynników uszkadzających DNA,
takich jak: promieniowanie jonizujące, UV, niektóre związki chemiczne.
Główną przyczyną mutacji są czynniki mutagenne, które zwykle działają losowo.
Dziedziczenie mutacji
Mutacje w komórkach somatycznych nie są przekazywane z pokolenia na pokolenie, dotyczą wyłącznie
osobnika u którego powstały.
Dziedziczne są mutacje w komórkach rozrodczych; mogą zostać przekazane potomstwu, które
staje się jej nosicielem i może przenieść tę mutację na następne pokolenie.
Mutacje waunkują procesy rekombinacji DNA oraz zmienność fenotypową organizmów.
Zmienność mutacyjna jest podstawą procesów ewolucyjnych.
Niektóre mutacje mogą być przyczyną chorób genetycznych;
-zmieniają informację genetyczną prowadząc do zaburzeń ekspresji genów, procesów transkrypcji
oraz translacji.

22
Różne typy mutacji w genomie ludzkim:
-mutacje genowe (punktowe)
-rearanżacje genowe
-duże mutacje chromosomowe
Mutacje punktowe spowodowane zmianą pojedynczych nukleotydów w regionie kodującym genu, co
powoduje zmianę sensu informacji genetycznej i prowadzi do powstania nowych form alleli.
Zazwyczaj konsekwencją mutacji genowej jest:
- utrata prawidłowej funkcji białka (częściej)
- powstanie białka o zmienionej funkcji biologicznej (rzadziej).
Mutacje w sekwencjach regulatorowych genu mają wpływ na ekspresję genu i mogą powodować
podwyższenie lub obniżenie ilości powstającego białka
Rodzaje mutacji punktowych:
1. substytucja - (podstawienia pojedynczego nukleotydu) w regionie kodującym
- tranzycja - zamiana puryny na inną purynę lub pirymidyny na inną purynę
- transwersja - zamiana puryny na pirymidynę lub odwrotnie
Efekt substytucji:
-zmiana sensu (mutacja „missense” )
powstaje nowy kodon, powodujący wbudowanie innego aminokwasu w łańcuch białkowy. Przykład:
zmiana kodonu GAG na GTG. Rezultat - anemia sierpowatokrwinkowa.
Np.: w genie globiny zamiana w kodonie 6 adeniny (A) na tyminę (T) powoduje
-zmiana nonsensowna (mutacja „nonsens”).
może powstać przedwczesny kodon „stop”, a przez to krótszy łańcuch białkowy, zwykle mniej stabilny,
który szybciej ulega degradacji.
Przykład: jedna z form ciężkiej hemofilii
Substytucja może nie zmieniać sekwencji aminokwasowej w kodowanym białku i nie powodować żadnych
konsekwencji - mutacje nieme (ciche)
2.
delecja - (
ubytek
) jednego lub kilku nukleotydów w regionie kodującym
insercja – (wstawienie) jednego lub kilku nukleotydów w regionie kodującym
delecje oraz insercje mogą prowadzić do zmiany tripletów kodu we wszystkich kodonach występujących
po tej zmianie. W rezultacie dochodzi do całkowitej zmiany sekwencji aminokwasów w kodowanym
białku. Mutacje te określane są jako „frameshift” – zmiany ramki odczytu. Często poniżej miejsca insercji

23
lub delecji pojawiają się kodony „stop”. Przesunięcie ramki odczytu powoduje na ogół utratę aktywności
kodowanego białka.
3.
inwersja
- zmiany pozycji kilku sekwencji DNA w obrębie genu lub poza nim. Przykład: mutacja
odwrócona, w której fragment sekwencji DNA jest wycinany, a następnie wbudowany to samo
miejsce ale w odwrotnym kierunku. Dochodzi do zmian w kodowanym białku.
4.
mutacje w obrębie promotora genu
– mogą zmieniać (obniżać) wytwarzanie mRNA i w
rezultacie zmniejszać syntezę białka.
5.
mutacje dynamiczne
- polegają na zwielokrotnieniu liczby trójnukleotydu w sekwencji genu.
po raz pierwszy opisana w genie FMR1, jako odpowiedzialną za wystąpienie zespołu łamliwego
chromosomu X związanego z upośledzeniem umysłowym.
U osób zdrowych liczba kopii trójki CGG nie przekracza 54, u bezobjawowych nosicieli zespołu
liczba dochodzi do 200, u osób chorych może przekroczyć nawet 1000 powtórzeń.
6.
mutacje miejsc cięcia na granicy intron-ekson genu
- zaburzają prawidłowe wycinanie
intronów w czasie formowania dojrzałego mRNA.
Mogą prowadzić do nieprawidłowego składania mRNA, prowadzącego do powstania
niestabilnego, niefunkcjonalnego białka. Mutacje te są również nazywane mutacjami RNA.
7.
insercja transpozonów (elementów ruchomych genomu
)
– może powodować mutacje typu
zmiany ramki odczytu tworzące nowe sekwencje tripletów. Niekiedy może wystąpić uaktywnienie
funkcjonalnego genu np. onkogenu, jeśli wbudowanie nastąpi w okolicy jego promotora. Insercja
taka wywołuje u człowieka pojedyncze przypadki neurofibromatozy typu I, rodzinnych
nowotworów gruczołu piersiowego oraz rodzinnej polipowatości jelit.
Polimorfizmy DNA
Polimorfizm - zróżnicowanie genetyczne warunkujące zmienność wewnątrz gatunku
–
na poziomie całego osobnika (różnice fenotypowe),
–
na poziomie biochemicznym (np. różne formy antygenów powierzchniowych komórki, grup krwi,
enzymów ),

24
–
na poziomie chromosomowym (różnice cech morfologicznych chromosomów np. rozmiar
heterochromatyny przycentromerowej)
–
na poziomie DNA
Allele mogą różnić się pojedynczym podstawieniem nukleotydu w sekwencji DNA lub też liczbą
powtórzeń określonego motywu w sekwencjach DNA.
Polimorfizm DNA występuje z częstością większą niż ogólna częstość mutacji - kryterium
odróżniające zmianę polimorficzną od mutacji.
Jeżeli w populacji zmiana sekwencji nukleotydów występuje częściej niż 1 % - to jest to
polimorfizm.
Większość polimorfizmów nie wpływa na cechy kliniczne fenotypu i nie prowadzi (poza
wyjątkami) do objawów chorobowych.
Sekwencje polimorficzne mogą występować w sekwencjach kodujących, ale głównie obecne są w nie
kodujących regionach DNA.
Mogą być wykorzystane jako markery genetyczne, które dziedziczone są w sposób mendlowski,
jako proste cechy kodominujace ze zmianą fenotypową np.określoną cechą czy objawami choroby.
Mogą być użyte do śledzenia sposobu dziedziczenia się choroby w rodzinie, która sprzężona jest z
określonym markerem genetycznym. Wykorzystuje się je więc do mapowania genów. W
sądownictwie i kryminalistyce - do identyfikacji osobniczej oraz ustalania pokrewieństwa, (metody
wykrywania polimorfizmu mikro- i minisatelitarnego ; DNA-fingerprints), jak również do określania
genetycznej zgodności krwi, nasienia czy tkanki.
Mutacje chromosomowe człowieka
25
Mutacje chromosomowe /aberracje/ - duże nieprawidłowości chromosomów, które widoczne są w
mikroskopie świetlnym w preparatach cytogenetycznych.
Aberracje chromosomowe powstają w komórkach somatycznych albo w gametach de novo lub mogą być
dziedziczone od rodziców.
W rezultacie powstają zespoły objawów klinicznych, na które składa się zwykle: upośledzenie umysłowe,
upośledzenie rozwoju somatycznego w okresie zarodkowym i postnatalnym, dysmorfie (cechy zewnętrzne
odbiegające od normy np. wielopalczastość, zrosłopalczastość, nieprawidłowe bruzdy na dłoni, stopie,
nieprawidłowe ustawienie szpar powiekowych, kształt małżowiny usznej itp.) oraz współistnienie wielu
wad rozwojowych. W przypadku aberracji chromosomowych zawsze występuje zespół wad rozwojowych,
nigdy izolowana wada.
Zespoły cech stanowią podstawę rozpoznania aberracji chromosomowej, ale rozpoznanie kliniczne należy
uzupełnić oceną kariotypu.
Częstość występowania wad rozwojowych na tle aberracji chromosomowych w populacji wynosi około
0,6%, w ponad 50% są przyczyną poronień samoistnych.
Aberracje chromosomowe dzielą się na: liczbowe i strukturalne. Mogą dotyczyć wszystkich
chromosomów człowieka, zarówno autosomalnych jak i chromosomów płci.
Nieprawidłowością chromosomową jest również mozaicyzm (mozaikowatość) czyli obecność w jednym
organizmie linii komórkowych prawidłowych i z aberracjami. Mozaicyzm powstaje w wyniku
nieprawidłowego rozdzielenia się chromosomów w czasie bruzdkowania i wyraża się często
łagodniejszymi objawami klinicznymi.
Aberracje liczbowe
Wśród nieprawidłowości liczbowych chromosomów wyróżnia się poliploidię i aneuploidię.
Poliploidia powstaje w wyniku zwielokrotnienia haploidalnej liczby (czyli 23) chromosomów. Jest to
zwykle cecha letalna. Najczęściej spotykana jest triploidia, która powstaje na skutek zapłodnienia komórki
jajowej dwoma plemnikami (69,XXY) lub przez połączenie dwóch gamet, w tym jednej nieprawidłowej –
diploidalnej /69,XXY lub 69XXX/ Triploidia występują w 20% poronień samoistnych z aberracjami
chromosomowymi, natomiast żywo urodzone noworodki z wieloma wadami rozwojowymi giną szybko po
urodzeniu.
Tetraploidia /92,XXXX lub 92,XXYY/ powstaje w wyniku braku pierwszego podziału zygoty i to jest
przyczyną podwojenia liczby chromosomów bezpośrednio po zapłodnieniu. Większość tetraploidów jest
eliminowana w pierwszym trymestrze ciąży. Tetraploidia stwierdzane jest u 6% poronień z aberracjami
chromosomowymi.

26
Aneuploidia polega na dodaniu lub utracie jednego chromosomu do diploidalnego garnituru
chromosomowego.
Najczęstszą aneuploidią jest trisomia / obecność trzech zamiast dwóch kopii danego chromosomu/. Wśród
chromosomów autosomalnych najczęściej występują trisomie 21, 13, 18, a wśród chromosomów płci
XXY, XXX, XYY.
Monosomia /brak jednego chromosomu w diploidalnym zestawie/ jest zwykle cechą letalną za wyjątkiem
obecności jednego chromosomu X , warunkującego zespół Turnera /45,X/.
Jeśli nondysjunkcja zachodzi podczas podziału mitotycznego to jej efektem może być powstanie linii
komórkowych o różnej, prawidłowej i nieprawidłowej liczbie chromosomów. Prowadzi to do powstania
mozaikowości /np.45,X/47XXX/
Aberracje strukturalne
Aberracje strukturalne powstają w wyniku złamania jednego lub kilku chromosomów i nieprawidłowego
połączenia się „lepkich końców”, co może prowadzić do przegrupowania fragmentów chromosomów.
Wśród aberracji strukturalnych wyróżnia się:
translokacje,
insercje,
inwersje,
izochromosomy,
delecje,
duplikacje,
chromosomy pierścieniowe,
chromosomy dicentryczne.
Biorąc pod uwagę efekt fenotypowy aberracje strukturalne można podzielić na:
zrównoważone
i niezrównoważone.
Do zrównoważonych zaliczane są te aberracje, które nie prowadzą do ubytku lub zwiększenia ilości
materiału chromosomowego, a więc nie mają wpływu na cechy fenotypowe ich nosiciela. Są natomiast
przyczyną powstawania w czasie gametogenezy nieprawidłowych gamet, których efektem może być

27
wystąpienie patologicznego fenotypu u potomstwa. Aberracje niezrównoważone są konsekwencją ubytku
lub nadmiaru fragmentów chromosomu, powstają w wyniku mejotycznej segregacji aberracji
zrównoważonych lub mogą powstać spontanicznie.
U około 4-6% par małżeńskich z niepowodzeniami rozrodu stwierdza się obecność aberracji
chromosomowej (najczęściej translokacji zrównoważonej) lub rzadziej (inwersji) u jednego zrodziców.
Translokacje – powstają w wyniku złamania jednego chromosomu i przyłączenia się złamanego
fragmentu do terminalnej części innego chromosomu lub równoczesnego złamania się dwóch
chromosomów różnych par i wzajemnej zamiany fragmentów pomiędzy tymi chromosomami. Są to tzw.
translokacje wzajemne (zrównoważone). W obu przypadkach nosiciele translokacji zrównoważonych
najczęściej nie wykazują zmian fenotypowych, ale ponoszą wyższe ryzyko wystąpienia
niezrównoważonego kariotypu (konsekwencją są zawsze wady wrodzone) u potomstwa, ponieważ
podczas mejozy wytwarzają różne gamety z zestawami chromosomów, zawierającymi chromosomy
prawidłowe, translokacje zrównoważone lub gamety z niezrównoważonymi produktami translokacji –
częściową duplikacją lub delecją fragmentu chromosomu.
Może też występować złamanie w rejonie centromerów chromosomów akrocentrycznych i wzajemne
połączenie się dwóch chromosomów.
Niekiedy translokacje mogą stymulować proces nowotworowy. Tak jest w przypadku przewlekłej białaczki
szpikowej (CML)
W wyniku tej translokacji chromosom 22 jest morfologicznie znacznie mniejszy i dobrze rozpoznawany w
badaniu cytogenetycznym Nazwano go chromosomem filadelfijskim (ang, Philadelphia chromosome) a
translokację Ph
1
. Około 90 % pacjentów posiada chromosom filadelfijski, tak więc rozpoznanie Ph
1
ma
znaczenie w diagnostyce różnicowej białaczek.
Insercje
- powstają w wyniku trzech złamań w dwóch chromosomach i przeniesienia fragmentu
chromosomu powstałego pomiędzy dwoma złamaniami do drugiego chromosomu w miejsce złamania.
Inwersje - polegają na odwróceniu fragmentu chromosomu pomiędzy dwoma punktami złamań w
chromosomie.
Izochromosomy – powstają w wyniku duplikacji jednego i utraty drugiego ramienia chromosomu. Są to
więc chromosomy składające się z dwóch identycznych ramion /długich lub krótkich/. Do ich powstania
dochodzi w wyniku nieprawidłowego, poprzecznego podziału chromosomu w obrębie centromeru.
Delecje
– polegają na utracie fragmentu chromosomu w wyniku jednego złamania /terminalna/ lub dwóch
złamań /interstycjalna/ chromosomu.
28
Duplikacja – oznacza obecność dwóch kopii danego fragmentu chromosomu powstających najczęściej w
wyniku translokacji, inwersji lub powstania izochromosomu.
Chromosomy pierścieniowe – powstają w wyniku połączenia dwóch złamanych końców jednego lub
kilku chromosomów. Efektem jest delecja fragmentu chromosomu.
Chromosomy dicentryczne – zawierają dwa centromery , mogą powstajwać w wyniku translokacji.
Chromosomy markerowe - występują jako chromosomy dodatkowe, często bezcentromerowe, zwykle są
bardzo małe o zróżnicowanej morfologii. Mechanizm powstawania nie jest znany. Terminem tym określa
się również chromosomy pochodne, zmienione np. w wyniku translokacji.
Miejsca łamliwe - są to miejsca chromosomów, w których wykazano zwiększoną częstość złamań ,które
można obserwować w określonych warunkach hodowli komórkowej lub po indukcji pewnymi związkami
chemicznymi.
Opisano ponad 100 miejsc łamliwych, wśród których wyróżnia się tzw. pospolite /ang. common/ i rzadko
występujące /ang. rare/. Wśród rzadko występujących łamliwych miejsc najbardziej znane jest miejsce na
chromosomie X, określane jako fra X, związane z dziedzicznym niedorozwojem umysłowym /zespół
łamliwego chromosomu X.
Zespoły chorobowe będące wynikiem najczęściej występujących aberracji liczbowych chromosomów
autosomalnych i chromosomów płci
Trisomia chromosomu 21 /zespół Downa/ - jest to najczęściej występująca aberracją chromosomowa
rozpoznawana u 1 na 650-700 noworodków żywo urodzonych. Częstość jej występowania jest wyższa
wśród potomstwa kobiet rodzących po 35 roku życia.
Aberracja ta może powodować również wczesne poronienia samoistne.
W ponad 90% jest skutkiem prostej trisomii 21 jako efektu nondysjunkcji mejotycznej. Dodatkowy
chromosom pochodzi w 80% od matki. Przynajmniej 1% pacjentów ma mozaikowatość linii komórkowych
normalnych i z trisomią 21 . W około 4% dziecko otrzymuje dodatkowy chromosom 21 od jednego z
rodziców, nosiciela translokacji zrównoważonej (np.chromosomu 21 na chromosom14) lub ma
translokację de novo.
Objawy kliniczne w zespole Downa są charakterystyczne: u niemowląt występuje
płaska nasada nosa,
duży język,
zmarszczki nakątne ,

29
skośne szpary powiekowe,
małe uszy,
płaska potylica,
krótkie szerokie dłonie ,
bruzdy poprzeczne.
Obserwuje się również zmniejszone napięcie mięśniowe /hipotonia mięśniowa/.
Wszystkie dzieci z zespołem Downa wykazują różnego stopnia opóźnienie rozwoju umysłowego.
Do innych cech należą niski wzrost, nieprawidłowości układu odpornościowego i niedosłuch.
Do najczęściej współistniejących wad rozwojowych należą wady wrodzone serca /w 40% przypadków/,
wady przewodu pokarmowego /niedrożność odbytu, zarośnięcie dwunastnicy/ oraz wady układu
moczowego i kostnego.
Mężczyźni są bezpłodni, natomiast kobiety mogą zajść w ciążę ponosząc 50% ryzyko urodzenia dziecka z
trisomią 21.
Trisomia 13 /zespół Pataua
/
- częstość występowania wynosi 1 na 5000 wśród żywo urodzonych i
wykazuje związek z wiekiem matki.
Ponad połowa dzieci z tym zespołem umiera w pierwszym miesiącu życia, a blisko 90% chorych ginie
przed ukończeniem pierwszego roku życia.
Typowe cechy kliniczne obserwowane u noworodka to:
małogłowie,
rozszczep wargi i/lub podniebienia,
małoocze,
nisko osadzone małżowiny uszne,
głuchota.
W około 80% współistnieją wady serca, występują też wady układu nerwowego, przewodu pokarmowego i
kręgosłupa.
U dzieci, które przeżyją, opóźnienie umysłowe jest głębokie.
Trisomia 18 /zespół Edwardsa/ - występuje u około 1 na 3000 żywo urodzonych noworodków, częściej
u potomstwa kobiet po 35 roku życia.
Większość dzieci /ponad 90%/ umiera w pierwszym miesiącu życia, a te , które przeżywają pierwszy rok
życia wykazują głębokie upośledzenie rozwoju.

30
Noworodek z trisomią 18 ma:
małą twarz,
małe uszy,
niedorozwój żuchwy,
charakterystyczne są zachodzące na siebie palce dłoni.
Niemal zawsze współistnieją wady serca, często wady przewodu pokarmowego, układu moczowego i
układu nerwowego.
Zespół Klinefeltera /47,XXY/ - zespół ten występuje z częstością 1 na 800 noworodków płci męskiej. Jest
bardzo rzadko rozpoznawany w wieku dziecięcym, ze względu na brak cech fenotypowych w tym okresie.
Do rozpoznania dochodzi u dorosłych mężczyzn w związku z bezpłodnością i niedorozwojem gonad
/hipogonadyzmem/. Mężczyźni są wysocy o wydłużonych kończynach od dzieciństwa, słabo umięśnieni ,
z małym owłosieniem na twarzy. Są z reguły bezpłodni. Większość mężczyzn wykazuje normalny poziom
inteligencji.
Zespół 47,XYY – występuje z częstością 1 na 800 mężczyzn i nie powoduje zmian fenotypowych.
Rozpoznanie tej trisomii jest zwykle przypadkowe. Mężczyźni są płodni.
Zespół 47,XXX - częstość występowania wynosi 1 na 800 noworodków płci żeńskiej. Większość
przypadków pozostaje nie rozpoznana, ponieważ większość kobiet nie ma żadnych objawów klinicznych.
Kobiety są płodne i zwykle rodzą zdrowe potomstwo.
Monosomia chromosomu X, zespół Turnera /45,X/ - częstość występowania tego zespołu wynosi 1
na 2500 kobiet. Aberracja ta jest też częstą przyczyną poronień samoistnych.
Niemowlęta z zespołem Turnera mogą nie mieć objawów zespołu lub wykazywać:
płetwowatość szyi,
puklerzowatą klatkę piersiową
obrzęki dłoni i stóp.
U dorosłych cechami charakterystycznymi są; niski wzrost, brak cech dojrzewania płciowego, pierwotny
brak miesiączki i bezpłodność. Są to kobiety z krótką, płetwiastą szyją i niedorozwojem żuchwy.
Zewnętrzne narządy płciowe wykazują niedorozwój. W 20% przypadków współistnieje wada serca, a w
40-60% przypadków – wady nerek. Inteligencja nie odbiega od normy.

31
Mężczyźni XX i kobiety XY jako przykład czystej dysgenezji gonad z odwróceniem płci (sex
reversal)Chromosom Y odgrywa kluczową rolę w determinacji płci u człowieka. Zarodek dziedziczący
chromosom Y rozwija się zawsze jako męski, zarodek bez chromosomu Y jako żeński, ale dwa
chromosomy X są konieczne dla utrzymania istnienia jajników. Inicjacja rozwoju jąder z niezróżnicowanej
gonady zarodka odbywa się pod wpływem aktywności genu SRY (ang. Sex-determining region Y)
zlokalizowanego w krótkim ramieniu chromosomu Y. W procesie różnicowania jąder biorą udział również
inne geny sprzężone z chromosomami autosomalnymi i chromosomem X.
U około 1/20 000 mężczyzn występują objawy przypominające zespół Klinefeltera, ale analiza
chromosomów wykazuje kariotyp żeński (46,XX). Mężczyźni ci mają jeden chromosom X zawierający
gen SRY. Można to wyjaśnić błędnym procesem crossing over pomiędzy chromosomem X i Y w czasie
trwania mejozy u mężczyzny, w wyniku którego gen SRY zostaje przeniesiony na chromosom X. Potomek
dziedziczący taki chromosom od ojca wykazuje fenotyp męski..
I przeciwnie, potomek dziedziczący chromosom Y pozbawiony genu SRY będzie kobietą z kariotypem
46,XY. Kobiety te mają prawidłową sylwetkę żeńską, mogą mieć cechy zespołu Turnera (puklerzowata
klatka piersiowa, płetwiasta szyja). Jajniki, ze względu na pojedynczy chromosom X, są pasmowate i mają
tendencję do rozwoju nowotworów. Zalecane jest zwykle wykonanie gonadektomii (usunięcie gonad).
Przykłady zespołów chorobowych będących wynikiem aberracji strukturalnych chromosomów
autosomalnych.
Zespół Cri du chat /kociego krzyku/ 46,5p-
Zespół ten występuje rzadko /około 1 na 50 000 urodzeń/. Niemowlęta charakteryzują się płaczem
przypominającym miauczenie kota. Inne cechy to małogłowie, zmarszczki nakątne, nisko osadzone,
zniekształcone małżowiny uszne, niedorozwój żuchwy. Zwykle występują wady serca, zniekształcenia
kręgosłupa oraz upośledzenie rozwoju umysłowego.
U większości przypadków delecja ta powstaje de novo i obejmuje różnej wielkości fragment krótkiego
ramienia chromosomu 5. Może być niekiedy odziedziczona po jednym z rodziców, nosicielu translokacji
zrównoważonej.
Zespół Wolfa-Hirschhorna, 46,4p-
Zespół ten występuje rzadko 1 na 50 000 wśród żywo urodzonych. Charakterystyczne cechy fenotypowe
to: upośledzenie rozwoju somatycznego występujące już w okresie prenatalnym oraz postnatalnym,
małogłowie, twarz o kształcie „hełmu greckiego wojownika”, wypukłe czoło, szeroka nasada nosa,
rozszczep podniebienia, niedorozwój żuchwy. Często występują wady serca, napady padaczkowe oraz
głębokie upośledzenie umysłowe.
Podsumowanie

32
1. Aberracje chromosomowe zarówno liczbowe jak i strukturalne mogą dotyczyć każdego
chromosomu, różne są jednak konsekwencje fenotypowe (poronienia, różnorakie wady rozwojowe,
brak zmian)
2. Dodatkowy materiał chromosomowy /np. trisomia, duplikacja/ zaburza rozwój dziecka, lecz nie w
tak ciężkim stopniu jak to ma miejsce w przypadku utraty chromosomu lub jego fragmentu
/monosomia, delecja/, co w konsekwencji prowadzi do samoistnych poronień.
3. Nadmiar chromosomu /lub jego części/ autosomalnego objawia się poważniejszymi skutkami
fenotypowymi niż w przypadku chromosomów płciowych.
4. Utrata całego chromosomu autosomalnego jest cechą letalną.
5. Utrata jednego z chromosomów płci też jest zazwyczaj cechą letalną, za wyjątkiem zespołu Turnera
/45,X/. Większość zarodków 45,X ulega obumarciu, tylko niewielki procent rodzi się żywo
wykazując cechy zespołu Turnera.
6. Wśród żywo urodzonych nigdy nie stwierdzono przypadku, w którym przy obecności chromosomu
Y brakowało chromosomu X.
Ana1iza i klasyfikacja chromosomów - badanie cytogenetyczne
polega na określeniu liczby i struktury chromosomów w komórkach badanej osoby.
Analiza może być przeprowadzona na chromosomach metafazowych lub prometafazowych
otrzymanych z hodowli in vitro dzielących się komórek somatycznych lub bezpośrednio z tkanek o
wysokiej aktywności mitotycznej (np. z komórek guzów nowotworowych i z komórek szpiku kostnego).
Metody analizy chromosomów
Opracowanie w latach 70-tych technik prążkowych barwienia chromosomów umożliwiło dokładną
identyfikację każdej z 23 par chromosomów człowieka. Tym samym stało się możliwe rozpoznanie
aberracji /nieprawidłowości/ chromosomowych. Techniki prążkowe prowadzą do uzyskania specyficznego
układu prążków na chromosomach. Każdy chromosom ma charakterystyczny dla siebie wzór prążkowy
czyli układ poprzecznych prążków różniących się wielkością i intensywnością zabarwienia.
przy użyciu wyżej wymienionych klasycznych metod cytogenetycznych stwierdza się wprawdzie
obecność aberracji chromosomowych, ale rozpoznanie cytogenetyczne jest mało precyzyjne i
niewystarczające dla właściwej diagnozy. W takich przypadkach są wskazania do zastosowania bardziej
precyzyjnych metod cytogenetyki molekularnej.

33
Opracowane w latach 80-tych metody cytogenetyki molekularnej oparte są na osiągnięciach biologii
molekularnej i cytogenetyki klasycznej. Główną zaletą tych metod jest możliwość lokalizacji DNA lub
RNA bezpośrednio w materiale biologicznym /bez izolowania DNA/ w preparatach chromosomowych,
komórkach interfazowych, w skrawkach utrwalonych tkanek, w rozmazach komórkowych - na wszystkich
etapach kondensacji chromosomu.
Podstawową metodą cytogenetyki molekularnej jest technika FISH /ang. fluorescence in situ
hybridization/. W badaniu tą metodą sonda molekularna, którą jest specyficzny fragment DNA, wiąże się z
komplementarnym do niej DNA chromosomowym na preparacie. Fluorochrom znakujący sondę pod
wpływem promieniowania UV emituje światło widzialne, które po przejściu przez filtry daje obraz jasno
świecącego regionu obserwowanego w mikroskopie fluorescencyjnym.
Inną metodą badania chromosomów jest analiza cytometryczna w cytometrze przepływowym, która
polega na ocenie zawartości DNA lub stosunku par zasad AT/GC w poszczególnych chromosomach.
umożliwia sortowanie i identyfikację poszczeg6lnych chromosomów. Stosowana jest jako metoda
uzupełniająca konwencjonalną analizę prążkową, do wykrywania aberracji liczbowych i strukturalnych.
Zasady analizy kariotypu
Zestaw chromosomów przedstawiany jest parami /jeden chromosom z każdej pary pochodzi od matki
drugi od ojca/ i nazywa się kariogramem. Zestaw chromosomów został podzielony na 7 łatwych do
odróżnienia grup.
Pary chromosomów od 1 -22 to tzw. autosomy, ostatnią parę stanowią chromosomy płci: XX u kobiety i
XY u mężczyzny.
Przyjęty międzynarodowy system nazewnictwa cytogenetycznego oraz ujednolicony opis obrazu
prążkowego chromosomów umoż1iwiają jednoznaczne określenie kariotypu. Opis kariotypu uwzględnia
zawsze liczbę chromosomów, chromosomy płci oraz określenie stwierdzonej aberracji chromosomowej.
Prawidłowy kariotyp żeński to 46,XX, prawidłowy kariotyp męski to 46,XY . Zapis liczbowej aberracji
polega na umieszczeniu znaku /+/ gdy występuje dodatkowy chromosom lub znaku /-/ gdy brak
chromosomu.
Polimorfizm chromosomów
Polimorfizm chromosomów to występowanie różnic w ich budowie u różnych osób w populacji, które są
dziedziczne i nie powodują zmian fenotypowych. Dla ich uwidocznienia wymagane jest stosowanie
niekiedy specjalnych technik cytogenetycznych.
Analiza polimorfizmu może być przydatna w rozróżnianiu chromosomów pochodzenia matczynego lub
ojcowskiego.

34
Document Outline
- Genom człowieka
- Aa
- P: AA x aa zgodnie z I prawem Mendla
- F1: Aa x Aa zgodnie z I prawem Mendla
- AA x aa
- Aa x aa
- Mutacje genowe (punktowe) i polimorfizmy DNA
- Różne typy mutacji w genomie ludzkim:
- -mutacje genowe (punktowe)
- -rearanżacje genowe
- -duże mutacje chromosomowe
- Mutacje punktowe spowodowane zmianą pojedynczych nukleotydów w regionie kodującym genu, co powoduje zmianę sensu informacji genetycznej i prowadzi do powstania nowych form alleli.
- Zazwyczaj konsekwencją mutacji genowej jest:
- - utrata prawidłowej funkcji białka (częściej)
- - powstanie białka o zmienionej funkcji biologicznej (rzadziej).
- Mutacje w sekwencjach regulatorowych genu mają wpływ na ekspresję genu i mogą powodować podwyższenie lub obniżenie ilości powstającego białka
- Rodzaje mutacji punktowych:
- - transwersja - zamiana puryny na pirymidynę lub odwrotnie
- Efekt substytucji:
- -zmiana sensu (mutacja „missense” )
- powstaje nowy kodon, powodujący wbudowanie innego aminokwasu w łańcuch białkowy. Przykład: zmiana kodonu GAG na GTG. Rezultat - anemia sierpowatokrwinkowa.
- Np.: w genie globiny zamiana w kodonie 6 adeniny (A) na tyminę (T) powoduje
- -zmiana nonsensowna (mutacja „nonsens”).
- Polimorfizmy DNA
- Mutacje chromosomowe /aberracje/ - duże nieprawidłowości chromosomów, które widoczne są w mikroskopie świetlnym w preparatach cytogenetycznych.
- Aberracje chromosomowe powstają w komórkach somatycznych albo w gametach de novo lub mogą być dziedziczone od rodziców.
- W rezultacie powstają zespoły objawów klinicznych, na które składa się zwykle: upośledzenie umysłowe, upośledzenie rozwoju somatycznego w okresie zarodkowym i postnatalnym, dysmorfie (cechy zewnętrzne odbiegające od normy np. wielopalczastość, zrosłopalczastość, nieprawidłowe bruzdy na dłoni, stopie, nieprawidłowe ustawienie szpar powiekowych, kształt małżowiny usznej itp.) oraz współistnienie wielu wad rozwojowych. W przypadku aberracji chromosomowych zawsze występuje zespół wad rozwojowych, nigdy izolowana wada.
- Zespoły cech stanowią podstawę rozpoznania aberracji chromosomowej, ale rozpoznanie kliniczne należy uzupełnić oceną kariotypu.
- Częstość występowania wad rozwojowych na tle aberracji chromosomowych w populacji wynosi około 0,6%, w ponad 50% są przyczyną poronień samoistnych.
- Mężczyźni XX i kobiety XY jako przykład czystej dysgenezji gonad z odwróceniem płci (sex reversal)Chromosom Y odgrywa kluczową rolę w determinacji płci u człowieka. Zarodek dziedziczący chromosom Y rozwija się zawsze jako męski, zarodek bez chromosomu Y jako żeński, ale dwa chromosomy X są konieczne dla utrzymania istnienia jajników. Inicjacja rozwoju jąder z niezróżnicowanej gonady zarodka odbywa się pod wpływem aktywności genu SRY (ang. Sex-determining region Y) zlokalizowanego w krótkim ramieniu chromosomu Y. W procesie różnicowania jąder biorą udział również inne geny sprzężone z chromosomami autosomalnymi i chromosomem X.
- Metody analizy chromosomów
Wyszukiwarka
Podobne podstrony:
pytania z genetyki, Materiały =), Genetyka
GENETYKA, Szkoła, Biologia, genetyka, gen prezentacje, Najnowsze odkrycia w dziedzinie genetykiFigur
Genetyczka, ★ materiały rok I wety, Genetyka, gena
Dziedziczenie cechy dominujacej i recesywnej-zadanie, Genetyka, materiały
Genetyka-typy dziedziczenia, Genetyka, materiały
1 kolo genetyka, materiały, genetyka
Cecha genetyka, materiały, genetyka
Dziedziczenie cechy posredniej-zadanie, Genetyka, materiały
Inzynieria genetyczna Materialy SUM
pytania z genetyki, Materiały =), Genetyka
Materiał genetyczny, mutacje, systemy naprawy DNA, test Amesa
MIX, Materiały =), Genetyka
GENETYKA W PSYCHIATRII, studia, 4 rok, psychiatria, materiały, genetyka
Obliczenia cw 2, studia, materiały od roku wyżej, Inżynieria genetyczna, inżynieria
Pirosekwencjonowanie, materiały medycyna SUM, GENETYKA
egzamin z genetyki 2003, Materiały =), Genetyka
genetyka7, referaty i materiały, biologia
wyklady10 13, Materiały =), Genetyka
więcej podobnych podstron