
127
W
OJCIECH
Z
EŃCZAK
1
MODEL MATEMATYCZNY OGNIWA PALIWOWEGO W STANACH
USTALONYCH
Streszczenie
W oparciu o podstawowe równania opisujące właściwości termodynamiczne
i
elektrochemiczne zbudowano prosty model matematyczny ogniwa paliwowego
wodorowo tlenowego zaimplementowany w środowisku programu Mathcad. Za pomocą
programu można uzyskać przebiegi charakterystyki prądowo-napięciowej, a także
krzywej sprawności ogniwa. Możliwe jest także badanie wpływu ciśnienia i temperatury
substratów i produktów biorących udział w reakcji zachodzącej w ogniwie a także
koncentracji tlenu w powietrzu na wartość siły elektromotorycznej ogniwa. W referacie
przedstawiono również przykład obliczeniowy.
1. WPROWADZENIE
Zainteresowanie ogniwami paliwowymi do różnych zastosowań, w tym także
w okrętowych systemach energetycznych, rośnie w miarę wyczerpywania się zasobów paliw
kopalnych i wzrostu ich cen. Stosowanie nowych technologii energetycznych, do których zalicza
się ogniwa paliwowe, wymuszane jest także coraz bardziej przez przepisy ochrony środowiska
np. zawarte w aneksie VI do konwencji MARPOL 73/78 obowiązujące na całym świecie, czy też
przepisy regionalne obowiązujące w krajach Unii Europejskiej, Japonii czy USA [1]. Warto
wspomnieć także o wielu zaletach ogniw paliwowych w stosunku do silników cieplnych jak np.
osiąganie większych sprawności, pomijalnie niska emisja związków toksycznych, niskie koszty
eksploatacji, cicha praca i brak zanieczyszczeń ropopochodnych, które także są przyczyną dużego
nimi zainteresowania. Upowszechnieniu ogniw w okrętownictwie szczególnie sprzyja także
rozwijana i upowszechniana koncepcja statku w pełni zelektryfikowanego (all electric ships).
Możliwe zastosowania ogniw paliwowych w okrętownictwie przedstawiono m. in. w [2]. Tam też
zaprezentowano wybrane wyniki badań eksperymentalnych ogniw paliwowych w aspekcie
zastosowań morskich, które przeprowadzono w laboratorium Fachhochschule Stralsund w
Niemczech. Do badań eksperymentalnych jednak niezbędne są posiadanie ogniwa i dostęp do
odpowiedniej infrastruktury laboratoryjnej. Stąd też wiele badań ogniw paliwowych wykonuje się
przy użyciu modeli matematycznych i programów komputerowych. Programy do badania ogniw
paliwowych są dostępne także w Polsce jednakże są one bardzo drogie i niewiele ośrodków
badawczych w Polsce stać na ich zakup. Dla wielu analiz, w tym także dla celów dydaktycznych,
wystarczą jednak znacznie mniej złożone modele, które w zadawalający sposób pozwalają na
przedstawienie istotnych charakterystyk ogniw paliwowych. Stąd też podjęto próbę opracowania
modelu matematycznego zerowymiarowego „0D” ogniwa paliwowego wodorowo tlenowego,
który w połączeniu ze środowiskiem programu Mathcad tworzy narzędzie umożliwiające
1
Dr inż., Politechnika Szczecińska

128
uzyskanie typowych dla ogniw charakterystyk jak: napięciowo –prądowa, krzywa sprawności,
czy przebiegu siły elektromotorycznej w zależności od parametrów substratów oraz produktów
biorących udział w reakcji zachodzącej w ogniwie.
2. SIŁA ELEKTROMOTORYCZNA I SPRAWNOŚĆ IDEALNEGO OGNIWA
WODOROWO TLENOWEGO
W ogniwie paliwowym zachodzi bezpośrednia zamiana energii chemicznej paliwa w
energię elektryczną. Ponieważ są różne rodzaje elektrolitów w ogniwach to także różne są
procesy elektrochemiczne na elektrodach. W rozważanym modelu wzięto pod uwagę ogniwo
wodorowo tlenowe. W celu wyznaczenia energii elektrycznej możliwej do uzyskania z
ogniwa określa się energię chemiczną produktów wejściowych (tlen i wodór) i wyjściowych
(woda) dla reakcji zachodzącej w ogniwie, identycznej z reakcją spalania wodoru tj.
H
2
+ 1/2 O
2
→
H
2
O.
(1)
Wykorzystuje się w tym celu pojęcie entalpii swobodnej, zwanej też potencjałem
termodynamicznym, którą można zapisać [3]
Ts
h
g
−
=
(2)
gdzie: h – entalpia , T – temperatura, s – entropia.
Zmiana entalpii swobodnej dla rozważanej reakcji jest różnicą entalpii swobodnej produktów
(wody) i substratów (wodoru i tlenu) reakcji. Dla jednego mola powstałej wody jest więc:
( )
( )
( )
2
2
2
O
H
O
H
g
2
1
g
g
g
−
−
=
Δ
(3)
W przypadku układów odwracalnych (bez strat) praca prądu elektrycznego jest równa
zmianie entalpii swobodnej Δg czyli
(
)
FE
2
V
V
F
2
s
T
h
g
A
K
−
=
−
−
=
Δ
−
Δ
=
Δ
.
(4)
gdzie: F – stała Faraday’a, V
A
i V
K
– potencjał anody i katody, E – siła elektromotoryczna [4].
Z równania tego wyznacza się w opisywanym modelu siłę elektromotoryczną (SEM) E
0
idealnego ogniwa wodorowo tlenowego w stanie jałowym dla dowolnej temperatury przy
ciśnieniu standardowym (0,1 MPa).
⎟
⎠
⎞
⎜
⎝
⎛
Δ
−
Δ
−
=
F
2
s
T
h
E
0
(5)
W modelu obliczana jest także sprawność η jaką może osiągnąć ogniwo wodorowo tlenowe
przy braku strat. Zamiast pracy prądu elektrycznego, zgodnie z zależnością 4, odnosi się
równoważną jej zmianę entalpii swobodnej Δg do entalpii tworzenia czyli wartości opałowej
wodoru tj.
h
g
ideal
Δ
Δ
=
η
.
(6)
3. WPŁYW CIŚNIENIA NA SIŁĘ ELEKTROMOTORYCZNĄ IDEALNEGO
OGNIWA WODOROWO TLENOWEGO
Ogniwo paliwowe może pracować przy różnych ciśnieniach począwszy od ciśnienia
atmosferycznego do ok. 0,8 MPa, w przypadku ogniw polimerowych (PEMFC), do nawet ok.
1,5 MPa w przypadku ogniw ze stałymi tlenkami metali (SOFC). Generalnie wzrost ciśnienia

129
substratów wpływa na zwiększenie SEM ogniwa [5]. Zależność SEM ogniwa (zwanej też
idealnym potencjałem Nernsta) od ciśnienia ujmuje równanie Nernsta [4,5,6], które ma
następująca postać:
⎟
⎟
⎟
⎠
⎞
⎜
⎜
⎜
⎝
⎛
⋅
+
=
O
H
2
1
O
H
0
2
2
2
p
p
p
ln
F
2
RT
E
E
(7)
gdzie: E
0
– SEM ogniwa przy ciśnieniu standardowym według równania 5.
Ciśnienia w nawiasie we wzorze 7 są ciśnieniami cząstkowymi poszczególnych składników.
A więc jeśli np. ogniwo będzie zasilane z reformera to wodór będzie w mieszaninie
z dwutlenkiem węgla i parą wodną. Podobnie tlen najczęściej dostarczany jest do ogniwa w
powietrzu, którego jest składnikiem. Ciśnienie cząstkowe danego gazu jest proporcjonalne do
jego udziału w mieszaninie. Widać więc z równania 7, że zastąpienie czystego tlenu
powietrzem powodować będzie spadek siły elektromotorycznej ogniwa.
4. SPADEK SEM W OGNIWIE PALIWOWYM
Obciążenie ogniwa przez podłączenie do układu z odbiornikiem prądu oraz
nieodwracalność procesów są źródłem spadku różnicy potencjałów i w efekcie zmniejszenia
siły elektromotorycznej co też w literaturze nazywa się stratą potencjału ogniwa [4,5,7]. Aby
uniknąć nieporozumień wynikających z różnic w nazewnictwie, trzeba nadmienić, że w
elektrotechnice teoretycznej pojęcie strat napięcia dotyczy jedynie prądu przemiennego. W
teorii ogniw paliwowych natomiast za starty powszechnie uważa się spadki napięcia
wywołujące zmniejszenie SEM ogniwa podczas przepływu prądu stałego. Wyróżnia się trzy
grupy strat: straty biegu jałowego
V
0
, straty związane ze spadkiem napięcia wywołane
rezystancją V
Ω
oraz straty elektrokinetyczne V
E
. SEM ogniwa będzie więc równa:
E
o
V
V
V
E
E
−
−
−
=
Ω
0
.
(8)
Dla różnych rodzajów ogniw udział poszczególnych rodzajów strat jest zróżnicowany.
Straty biegu jałowego są spowodowane przez nieprecyzyjne wykonanie elektrod,
zanieczyszczenia paliwa oraz występowanie reakcji odwrotnej do głównych procesów
zachodzących w ogniwie [7]. Straty biegu jałowego są niezależne od natężenia prądu i dla
typowych ogniw wodorowo-tlenowych ich wielkość jest równa 0,15–0,25V.
Spadek napięcia wywołany rezystancją przewodzenia wyznacza się na podstawie
prawa Ohma:
r
i
V
⋅
=
Ω
(9)
gdzie: i
– gęstość prądu przepływającego przez ogniwo, r – całkowita powierzchniowa rezy-
stancja właściwa ogniwa.
Na rezystancję ogniwa składają się rezystancja elektrolitu R
EL
oraz rezystancja elektrod R
E
.
Decydujący wpływ na wartość spadku napięcia mają straty wywołane rezystancją elektrolitu.
Dlatego też w modelu przyjęto stałą wartość rezystancji elektrod, której wielkość zależna jest
od rodzaju zastosowanego materiału. W wielu przypadkach jak np. dla elektrod grafitowych
jej wartość się pomija [5]. Rezystancję elektrolitu opisuje natomiast zależność:
q
S
l
R
EL
⋅
=
(10)

130
gdzie: l – odległość między elektrodami , S – powierzchnia elektrody, q – konduktancja
właściwa elektrolitu.
Ponieważ w teorii ogniw powszechnie stosuje się gęstość prądu i to wówczas rezystancje R
EL
oraz R
E
należy odnieść do jednostki powierzchni ogniwa i dla odróżnienia oznaczane są w
modelu jako r
EL
i r
E
.
Do grupy strat elektrokinetycznych zalicza się straty powstałe wskutek procesów
elektrodowych takich jak: adsorpcja– desorpcja substratów i produktów, straty przejścia
ładunku i polaryzacja.
V
E
=ΔV
p
+ΔV
D
(11)
gdzie: ΔV
p
– spadek napięcia wskutek strat aktywacji, ΔV
D
– spadek napięcia wskutek start
masowych transportu lub koncentracji
Na granicy pomiędzy elektrodą i elektrolitem powstaje warstwa elektryczna o podwójnym
ładunku, który jest ujemny na powierzchni elektrody i dodatni od strony elektrolitu. W celu
pokonania tego progu przez ładunek elektryczny potrzebna jest odpowiednia energia
aktywacji. Stąd też często mówi się o stracie aktywacji. Najbardziej charakterystycznymi
etapami procesów elektrodowych są: dyfuzja, przejścia ładunków oraz reakcja chemiczna na
powierzchni elektrody lub w warstwie elektrolitu graniczącej bezpośrednio z nią. Przejście
ładunku oznacza wymianę elektronów między cząsteczkami znajdującymi się w elektrolicie, a
elektrodą i tworzenie jonów lub ich neutralizację. Etap przejścia ładunku jest hamowany
przez polaryzację przejścia.
Zależność pomiędzy polaryzacją przejścia a gęstością prądu opisuje wzór Tafela [4,5]:
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
⋅
=
Δ
0
P
i
i
ln
A
V
(12)
gdzie: A – współczynnik Tafela, i – gęstość prądu, i
0
– gęstość prądu wymiany.
Wzór 12 obowiązuje jedynie, gdy zachodzi zależność i > i
0
, natomiast współczynnik Tafela
określa się z równania
F
2
RT
A
α
=
(13)
gdzie:
α – współczynnik transferu ładunku [4].
Straty masowe transportu lub koncentracji powstają w wyniku transportu reagentów
przy wyższych prądach gdzie decydującym czynnikiem jest przepływ gazu przez porowate
elektrody do katalizatora i elektrolitu. Straty koncentracji pojawiają się gdy gaz w kontakcie z
katalizatorem i elektrodą zużywa się szybciej niż może do niej dotrzeć. Straty te oblicza się ze
wzoru:
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
−
⋅
−
=
Δ
l
D
i
i
1
ln
B
V
(14)
gdzie: B – współczynnik zależny od rodzaju ogniwa i reagenta, i
l
– graniczna gęstość prądu,
która jest miarą maksymalnej szybkości reakcji jaka może być uzyskiwana na elektrodzie.
Współczynnik B dla wodoru jest równy
F
2
RT
natomiast dla tlenu
F
4
RT
. Po uwzględnieniu
wszystkich strat SEM ogniwa będzie równa:
(
)
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
−
⋅
+
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
⋅
−
+
⋅
−
−
=
l
0
E
EL
0
0
i
i
1
ln
B
i
i
ln
A
r
r
i
V
E
E
.
(15)
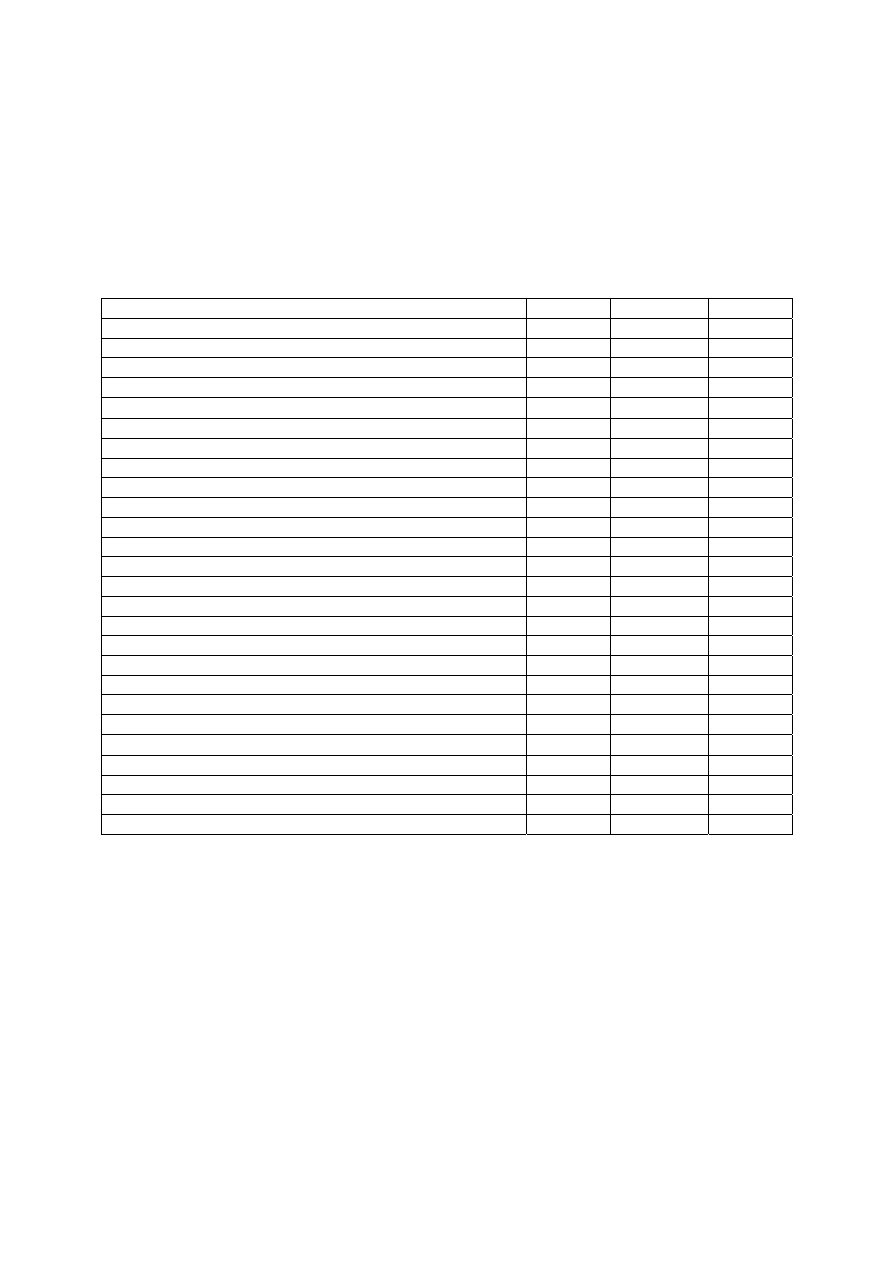
131
4. PRZYKŁAD OBLICZENIOWY
Po wprowadzeniu poszczególnych wzorów do programu Mathcad przeprowadzono
przykładowe obliczenia ogniwa wodorowo tlenowego jak również określono jego
charakterystyki. Jako punkt odniesienia do obliczeń entalpii i entropii przyjęto warunki
standardowe dla ogniw tj. 298,15K oraz 0,1MPa. W tabeli 1 zebrano najważniejsze dane
wejściowe i wyniki obliczeń ogniwa w temperaturze pracy 80
º
C.
Tabela 1. Dane wejściowe i wyniki obliczeń ogniwa paliwowego wodorowo tlenowego
Parametr Symbol
Jednostka
Wartość
Temperatura pracy ogniwa
T
2
K 353
Ciśnienie wodoru
p
1
MPa 0,1
Ciśnienie tlenu
p
2
MPa 0,1
Ciśnienie wody
p
3
MPa 0,1
Udział tlenu w przypadku zasilania ogniwa powietrzem
σ
– 0,21
Gęstość prądu
i
mA/cm
2
100
Odległość między elektrodami
l
cm 0,2
Powierzchnia elektrody
S
cm
2
10
Konduktancja właściwa elektrolitu
q
Ω
-1
cm
-1
0,55
Entropia wody w temperaturze T
2
s
H2O
kJ/(mol K)
0,0756
Entropia wodoru w temperaturze T
2
s
H2
kJ/(mol K)
0,1354
Entropia tlenu w temperaturze T
2
s
O2
kJ/(mol K)
0,2103
Różnica entropii produktów i substratów
Δs
kJ/(mol K)
-0,1650
Entalpia tworzenia wody w temperaturze T
2
Δh
kJ/mol -286,45
Potencjał termodynamiczny ogniwa w temperaturze T
2
Δg
kJ/mol -228,19
SEM idealnego ogniwa w stanie jałowym w temp T
2 .
E
0
V 1,183
Sprawność idealnego ogniwa temp T
2
η
ideal
- 79,66
SEM ogniwa przy zastąpieniu tlenu powietrzem
E
V 1,171
Straty biegu jałowego
V
0
V 0,25
Powierzchniowa rezystancja właściwa elektrod
r
E
Ω cm
2
0,02
Powierzchniowa rezystancja właściwa elektrolitu
r
EL
Ω cm
2
0,36
Straty oporu przewodzenia
V
Ω
V 0,038
Straty aktywacji
ΔV
p
V 0,137
Starty masowe transportu lub koncentracji
ΔV
D
V 0,0016
Rzeczywista SEM ogniwa zasilanego tlenem
E
V 0,756
Rzeczywista SEM ogniwa zasilanego powietrzem
E
V 0,744
Zastosowanie programu Mathcad pozwala na zmianę dowolnej wartości w dowolnym
miejscu. Można zatem szybko sprawdzić jaki efekt daje zmiana na końcowy wynik. W
środowisku Mathcad wzory wprowadzone jako funkcje jednej lub wielu zmiennych można
przedstawić na wykresie. Przykładowo równanie 15 stanowi charakterystykę napięciowo
prądową ogniwa, która może być przedstawiona jako funkcja temperatury, ciśnienia, gęstości
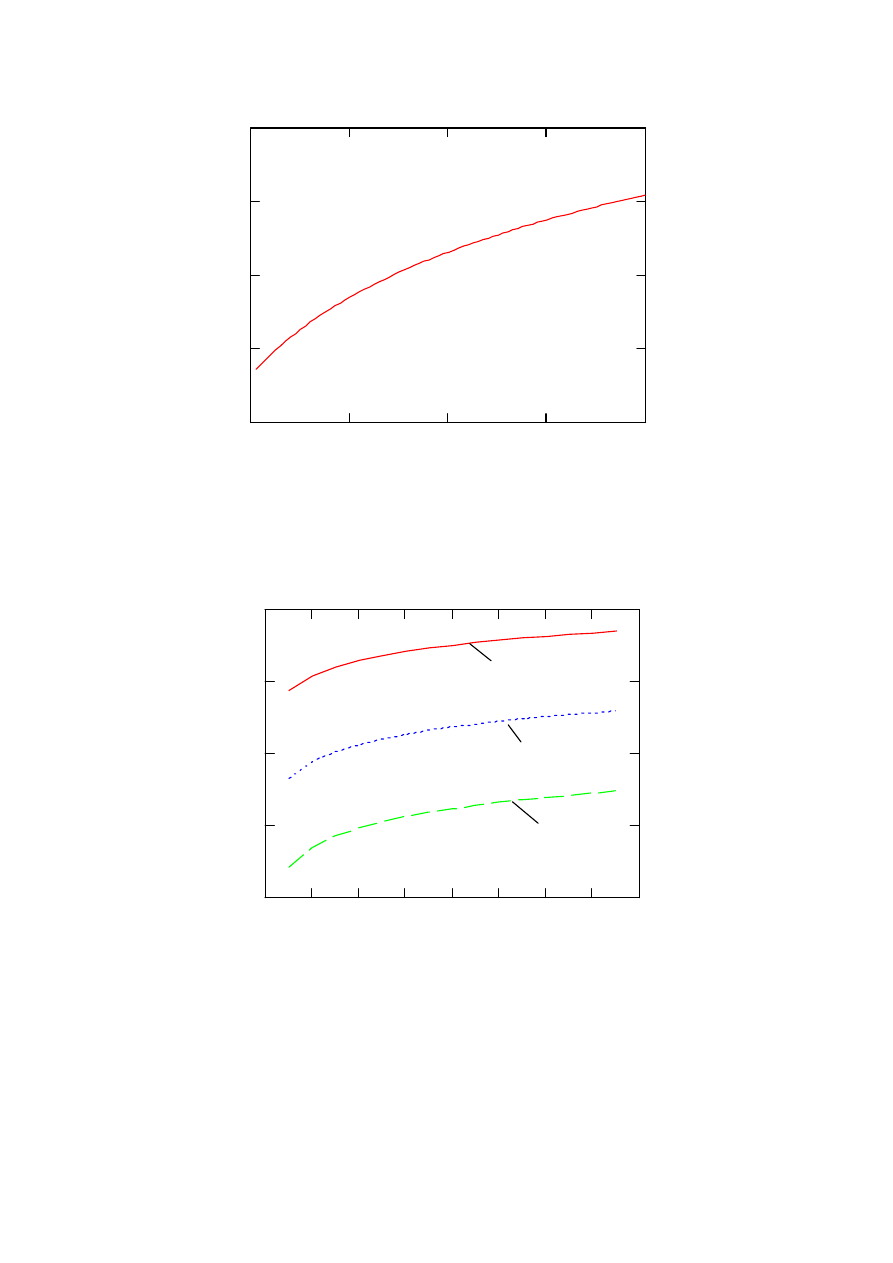
prądu i stężenia tlenu. Przebieg tej charakterystyki dla temperatur 353, 403 i 453 K, pokazano
na rys. 1. Jej przebieg odpowiada przebiegom przedstawianym w literaturze [5]. Na rysunku 2
przedstawiono natomiast przebieg sprawności idealnego ogniwa w funkcji temperatury
uzyskany na podstawie zależności 6 także zgodny z teorią.

132
0
200
400
600
800
1000
0
0.2
0.4
0.6
0.8
1
)
i [mA/cm
2
]
Rys.1. Charakterystyka napięciowo prądowa ogniwa dla różnych temperatur
260
280
300
320
340
360
380
400
420
440
74
76
78
80
82
84
86
T
2
[K]
Rys.2. Sprawność ogniwa idealnego w funkcji temperatury
Na rysunku 3 przedstawiono natomiast zależność SEM ogniwa paliwowego od stężenia tlenu
σ w mieszaninie gazów począwszy od 0,21 tj. wartości odpowiadającej stężeniu tlenu w
powietrzu do wartości 1, kiedy ogniwo zasilane jest czystym tlenem.
353 K
403K
453K
E [V]
η
453K
133
0.2
0.4
0.6
0.8
0.74
0.745
0.75
0.755
0.76
)
σ
Rys. 3. Zależność siły elektromotorycznej ogniwa od stężenia tlenu w mieszaninie gazów
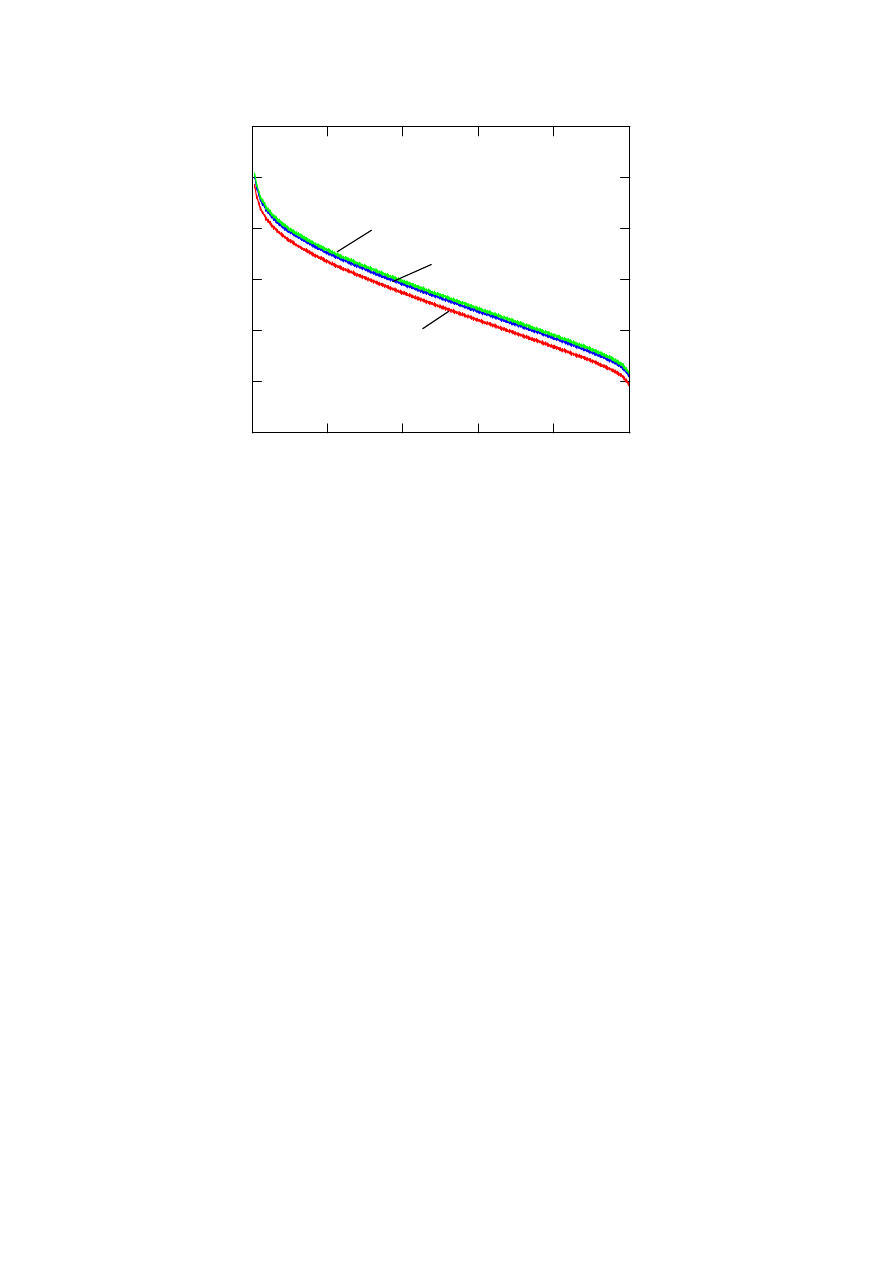
Rysunek 4 przedstawia zależność SEM ogniwa od ciśnienia wodoru dla temperatur 353, 403
i 453 K przy stałej gęstości prądu równej 100 mA/cm
2
zaś na rysunku 5 pokazano wpływ
ciśnienia wodoru na charakterystykę napięciowo prądową w temperaturze 353K.
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
0.6
0.65
0.7
0.75
0.8
)
p [MPa]
Rys.4. Zależność siły elektromotorycznej ogniwa od ciśnienia wodoru
E [V]
E [V]
353 K
403K
453K
134
0
200
400
600
800
1000
0
0.2
0.4
0.6
0.8
1
1.2
i [mA/cm
2
]
Rys. 5. Wpływ ciśnienia wodoru na charakterystykę napięciowo prądową ogniwa
5. PODSUMOWANIE
Przedstawiony model obliczeniowy ogniwa paliwowego oparty na podstawowych
zależnościach termodynamicznych i elektrochemicznych zrealizowany w środowisku
Mathcad pozwala na bardzo szybkie analizy wpływu istotnych parametrów pracy ogniwa na
jego charakterystyki. Łatwa zmiana danych wejściowych, bądź dowolnych stałych
stosowanych do obliczeń pozwala na szybkie uzyskanie wyników w postaci liczbowej lub w
formie graficznej. Model ten może być przydatny w badaniach eksperymentalnych do
wstępnej weryfikacji wyników a także jako proste narzędzie projektowe. Duża przydatność
modelu potwierdza się także na polu dydaktycznym.
LITERATURA
[1] Zeńczak W.: Koncepcja rozwiązania systemu energetycznego statku typu rzeka-morze z
ogniwem paliwowym, VIII Konferencja Okrętownictwo i Oceanotechnika, Perspektywy
rozwoju systemów transportowych, Międzyzdroje, czerwiec 2006.
[2] Zeńczak W.: Rozwój okrętowych systemów energetycznych opartych na ogniwach
paliwowych, Zeszyty Naukowe AMW, XXVI Sympozjum Siłowni Okrętowych SYMSO
2005, Gdynia 2005
[3] Bielski
S.,
Zeńczak W.: Selected Technical Problems Connected with Perspective
Applications of fuel Cells in Marine Power Plants, WSM Zeszyty Naukowe nr 71, XXIV
Międzynarodowe Sympozjum Siłowni Okrętowych, Świnoujście 2003
[4]
Larminie J., Dicks A.: Fuel Cell Systems Explained, John Wiley & Sons LTD, 2003
[5]
Barbir F.: PEM Fuel Cells: Theory and Practice, ELSEVIER Academic Press, London 2005
[6]
Massardo A.F., Lubelli F.: Internal Reforming Solid Oxide Fuel Cell –Gas Turbine Combined
Cycles: Part A- Cell Modell and Cycle thermodynamic Analysis, Journal of Engineering for
Gas Turbines and Power, ASME January 2000 vol.122/7
[7]
Chmielniak T.J.: Technologie energetyczne, Wydawnictwo Politechniki Śląskiej, Gliwice
2004
E [V]
2 MPa
1 MPa
0.1 MPa
T=353K
Wyszukiwarka
Podobne podstrony:
MODEL MATEMATYCZNY TURBINY
matematyka podstawowe wzory i Nieznany
Matematyka zaawansowana rroznic Nieznany
matematyka 1(4) id 284045 Nieznany
Matematyka dyskretna opracowani Nieznany
Matematyka 4 id 283195 Nieznany
Matematyka 5 id 283204 Nieznany
M Mrowiec Model matematyczny zbiornika re
Modele matematyczne ukladow reg Nieznany
ns polski pp model 2011 id 3248 Nieznany
Edukacja matematyczna 4 id 1503 Nieznany
AM, Liniowe zadanie decyzyjne, Model matematyczny zadania programowania liniowego
Model rodziny wpolczesnej i jej Nieznany
1 Model klient serwerid 9461 Nieznany (2)
Model ekonometryczny 5 id 30479 Nieznany
więcej podobnych podstron